Biophysics
Vol.03 No.01(2015), Article ID:15162,22
pages
10.12677/BIPHY.2015.31004
Structures, Antioxidation Mechanism, and Antioxidation Test of the Common Natural Antioxidants in Plants
Huijuan He, Na Huang, Ruijun Cao, Lingjie Meng*
Department of Chemistry, School of Science, Xi’an Jiaotong University, Xi’an Shannxi
*通讯作者。
Email: *menglingjie@mail.xjtu.edu.cn
Received: Apr. 8th, 2015; accepted: Apr. 23rd, 2015; published: Apr. 30th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Excess reactive oxygen species (ROS) caused by mitochondrial dysfunction and adverse external stimulus would damage the liposomes, proteins, even DNA in cells, which is one of the lead causes for cancer, cardiovascular disease, rheumatoid arthritis and a variety of neurological diseases. The most important natural antioxidants are the vitamins, carotenes and polyphenol compounds in daily consumption and medicinal plants. These antioxidants can eliminate the ROS effectively and have become a research hotspot recently. This article reviews the structures and antioxidation mechanisms of these important natural antioxidants from a chemical perspective, and focuses on the available test methods of the toxicity and antioxidant properties at three levels, i.e. chemical test, cell experiments and animal experiments, respectively. We believe that this article may help the readers to understand correctly the chemical nature of the antioxidants’ antioxidation, and guide researches to choose proper test methodologies to obtain reliable evaluation results. Finally, some future opportunities and challenges in the antioxidant field are discussed to our understanding.
Keywords:Natural Antioxidants, Reactive Oxygen Species (ROS), Reaction Mechanism, Detection Methods, Structure-Activity Relationship

植物中主要抗氧化剂的结构、抗氧化机理和抗氧化性能检测
何慧娟,黄娜,曹瑞军,孟令杰*
西安交通大学理学院化学系,陕西 西安
Email: *menglingjie@mail.xjtu.edu.cn
收稿日期:2015年4月8日;录用日期:2015年4月23日;发布日期:2015年4月30日

摘 要
线粒体功能异常和外界刺激引起细胞内活性氧(reactive oxygen species,ROS)含量的长期增高会对脂质体、蛋白和DNA造成损伤,可能诱发癌症、心血管疾病、风湿性关节炎和各种神经性疾病等。日常食用和药用的植物中含有的维生素、胡萝卜素和多酚类化合物等种类众多的抗氧化剂能帮助清除过量ROS,是近年来食品化学、药学和生命科学等领域的一个研究热点。本文主要从化学角度介绍常见天然抗氧化剂的结构和抗氧化机理,重点是从化学检测实验、细胞实验和动物实验三个层面综述抗氧化性能的检测方法和化学反应机理。试图帮助读者正确理解抗氧化反应的化学本质,有助于合理组合使用抗氧化检测方法获得可靠的评价结果。最后对天然抗氧化剂研究中存在的主要问题以及未来的热点方向进行了分析和展望。
关键词 :天然抗氧化剂,活性氧,反应机理,检测方法,构效关系

1. 引言
Denham Harman在1956提出活性氧自由基致病假说:在一定条件下体内过量活性氧(reactive oxygen species,ROS)的长时间存在,可能造成蛋白质、脂质体甚至DNA的氧化损伤和变异,从而引发癌症、心血管疾病、糖尿病、白内障、风湿性关节炎和各种神经性疾病(阿尔茨海默氏症和帕金森综合症)等各种严重疾病 [1] [2] 。
ROS主要包括超氧阴离子(O2·−)、过氧化氢(H2O2)、单线态氧(1O2)、氢过氧自由基(HO2·−)、羟基自由基(OH.)、脂质氢过氧化物(ROOH)、脂质过氧自由基(ROO·)和脂质烷氧自由基(RO·)等。生物体内的活性氧主要有四个来源[3] [4] :1) 线粒体是提供生物体能量的场所,动物和植物细胞在呼吸和生成三磷酸腺苷的过程中均会有大量活性氧作为副产物出现;2) 嗜中性细胞、嗜酸性细胞和巨噬细胞等吞噬细胞在氧爆过程中会释放活性氧;3) 过氧化物酶在生理条件下生成H2O2等;4) 细胞色素P450酶在氧化不饱和脂肪酸时产生O2·−和H2O2等活性氧。
ROS是生理过程中的必然代谢产物,同时对细胞信息传导和细胞功能调节也发挥着重要作用[5] [6] 。但过量ROS的存在会对细胞膜上的脂质体、蛋白甚至细胞核内的DNA分子造成持续的伤害,因此维持体内ROS的平衡对保持人类的健康具有至关重要的作用和意义。正常情况下,生物体内的抗氧化剂如过氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽酶(GPX)等能直接分解和清除各类ROS [7] 。另外,人类在饮食中获得的维生素C、维生素E、胡萝卜素和各种多酚类化合物,也能够清除一部分ROS。但是,这些天然抗氧化剂大都存在含量低、体内代谢快和生物利用度低等缺点。另外,随着人类生存环境的恶化,大量人群的生活环境受到辐射和有毒物质的污染,而且经常面临压力和紧张情绪,都可能产生过量的ROS [8] 。在人体自身系统不能完全清除这些ROS的时候,如何适量引入更高效的抗氧化剂有效清除过量的ROS,是预防癌症和心血管疾病等重大疾病的关键所在。基于人类对保持和改善健康的渴求和巨大的市场潜力,大量科研人员从事抗氧化剂的提取、制备和抗氧化特性研究,从2004~2014年以抗氧化剂为主题词的论文超过556,000篇,而且逐年呈快速增长趋势(如图1所示),充分反映了抗氧化剂的研究热度。
由于研究人员背景不同,使用的实验方法和手段众多,经常导致不一致甚至相互矛盾的研究结论[9] 。如何正确评价这些天然抗氧化剂的抗氧化性能仍是一项很有挑战性的工作。对抗氧化剂性能的测试通常可以分为分子化学检测、细胞实验和活体实验三个层次:1) 通常先用化学检测来初步评价抗氧化剂的抗氧化能力,包括对特定自由基的清除能力,对脂质体、蛋白和DNA等生物分子过氧化的抑制能力,以及对被氧化生物分子的还原能力。但是,这些化学测定方法无法模拟真实的生理环境,没有涉及到抗氧化剂跨膜进入细胞的能力,在细胞内的分布以及与细胞器或酶的相互作用等。2) 通过细胞实验可以获得更多的信息,例如通过细胞毒性实验可以确定抗氧化剂的合理使用浓度范围,还能研究抗氧化剂的分布和代谢,特别是对细胞内抗氧化活性酶的调控性能等。3) 活体实验结果能更客观或接近反映真实的抗氧化效果。通过口服、静脉注射和经皮给药等不同给药方式,抗氧化剂进入人体后的循环途径有很大不同。而且进入血液的抗氧化剂可能通过肝肾被直接代谢掉,也可能在运输途中自身被氧化损失,因此还要考虑其生物活性和生物利用度。通过检测抗氧化剂对动物代谢毒性和血液中抗氧化活性酶或抗氧化产物的研究,能获得更真实的综合抗氧化性能以及生物利用度信息。但动物实验周期长,受动物个体差异和给药方式影响很大,可重复性相对较差。因此,根据天然抗氧化剂的分子结构和抗氧化反应特性以及各种抗氧化检测过程的化学反应机理对合理组合使用抗氧化检测方法获得可靠的评价结果具有重要意义。
关于天然抗氧化剂的种类、结构和抗氧化性能的综述已经很多[10] -[15] ,本文主要从化学角度介绍植物中常见的抗氧化剂的结构和抗氧化机理,重点是从化学检测、细胞实验和动物实验三个层面综述抗氧化性能的检测方法和化学反应机理。期望能帮助读者正确理解抗氧化反应的化学本质,有助于合理组合使用抗氧化检测方法获得可靠的评价结果。这对于正确研究天然抗氧化剂的构效关系,指导开发高效、廉价和低毒的天然抗氧化剂均具有重要指导意义。最后对天然抗氧化剂研究中存在的主要问题以及未来的热点方向进行了分析和展望。

Figure 1. Number of published papers containing the search term “antioxidants” by year from 2004- 2014 (Web of Science database)
图1. Web of Science数据库中以“antioxidants”为主题词从2004~2014年逐年发表的论文数量
2. 植物中重要抗氧化剂的种类和结构
植物中的抗氧化剂种类众多,根据其化学结构特点主要分为维生素类、类胡萝卜素和多酚类物质等几大类。
2.1. 维生素
维生素是维持人体生命活动必须的一类有机物质,对保持人体健康具有重要作用,在体内的含量虽少但不可或缺。维生素是个庞大的家族,现阶段所知的维生素就有几十种,大致可分为脂溶性和水溶性两大类。其中,水溶性维生素C和脂溶性维生素E是代表性的两种化合物,广泛分布在新鲜植物和植物油中。
2.1.1. 维生素C
维生素C又称抗坏血酸,主要有三种结构形式(如图2所示),在植物中主要以还原形式(Vitamin C和AscH−)存在。还原形式的抗坏血酸与各种活性氧反应可形成相对稳定的抗坏血酸自由基(半脱氢抗坏血酸,Asc.−),这是其清除ROS的化学基础。
由于参与葡萄糖合成维生素C的一个重要的酶—古洛糖酸内酯氧化酶的基因编码的失活突变,人类自身不能合成维生素C,只能从食用的水果和蔬菜中获得补充。富含维生素C的水果有哈密瓜,葡萄柚,蜜露甜瓜,猕猴桃,芒果,木瓜和草莓等。众多的新鲜蔬菜如西兰花,甘蓝,卷心菜,花椰菜,甘蓝,红椒或青椒等也含有丰富的维生素C。维生素C缺乏会造成坏血病,因此日常饮食需摄入适量的维生素C,而且已有研究证实每天摄入量不超过2 g是安全无副作用的[16] 。目前,维生素C是市场上销售的常用抗氧化剂补充剂,可直接与自由基反应,清除自由基,同时也是各种酶的必要辅助因子。流行病学研究表明,维生素C在足够的浓度下可以抑制和预防心脏疾病和癌症。
由于维生素C能够清除·OH,H2O2,ROO·和1O2等ROS,许多研究小组致力于该化合物在预防和治疗癌症的潜在价值,但研究结果尚存在一定的争议。例如Elisa V. Bandera在1997年的早期研究中发现,增高膳食中维生素C的摄取量可以显著降低患肺癌的可能性[17] 。Dachs G U的研究也表明[18] ,高剂量静脉注射补充维生素C(10 g/天,共10天),再口服同样剂量的维生素C10天,能提高晚期癌症患者生存率。但是,随后两个随机、高剂量口服维生素C的对照研究表明,该化合物对于晚期癌症患者并没有显著的有益效果。Padayatty [19] 等发现用药方式的不同可能是导致矛盾结论的主要原因,同剂量的静脉注射使血浆中维生素C浓度比口服要高30至70倍。而且,静脉给药的维生素C只用于抗肿瘤活性,而口服给药的维生素C需要经历肠道吸收,组织运输和肾脏重吸收等过程。
2.1.2. 维生素E
维生素E又叫生育酚,天然存在的八个化合物分别称为α-,β-,γ-,δ-生育酚,和α-,β-,γ-,δ-生育三烯酚。他们都包含极性吡喃环和C-2位点类异戊二烯侧链(如图3所示),只是侧链的饱和度不同。
生育酚的主要来源是坚果和植物油。而生育三烯酚大量存在于谷物、小麦、水稻、大麦和一些植物油如棕榈油或糠油中。在所有维生素E中,α-生育酚为营养补充剂的主要形式,优先被肝生育酚转移蛋白识别(α-TTP)并输送到血浆,并进而输送到组织中[20] 。
高度断链亲脂性的维生素E是ROS的重要清除剂[21] ,容易与氧化物质发生反应,从而保护细胞免受因不饱和脂肪酸氧化产生的有害过氧化物质的伤害。α-生育酚是存在于人脂蛋白中的主要抗氧化剂,可清除RCOO·进而抑制低密度脂蛋白的氧化[22] [23] 。冠状动脉粥样硬化的患者,补充维生素E后,能降低心血管死亡和非致死性心肌梗死的发病率,而且对心血管疾病也有预防作用 [24] 。维生素E还可以保护肝、肾和睾丸不受叠氮化钠(活性氮)的毒害,提高雄性小鼠的免疫力[25] 。但是也有一些相反和不利的研究结
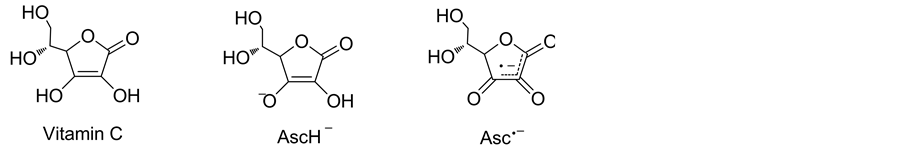
Figure 2. Structures of Vitamin C, ascorbate monoanion, ascorbyl radical
图2. 维生素C、抗坏血酸单价阴离子、抗坏血酸自由基的结构式
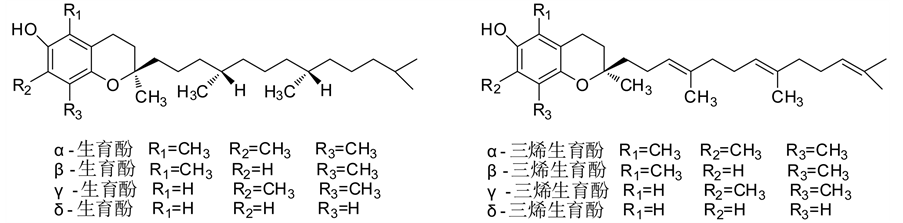
Figure 3. Structures of tocopherols, tocotrienols
图3. 生育酚、生育三烯酚的结构式
果报道,例如Scott M等的实验结果表明维生素E对于健康男性的前列腺癌预防没有明显作用[26] ;Eric A等[27] 认为连续7年服用维生素E (400 IU/天)的健康男性,反而导致患前列腺癌的风险显著增加(增加17%)。因此,对于维生素E的合理利用(适用人群,给药方式、给药剂量等)仍需进一步深入研究。
2.2. 类胡萝卜素
类胡萝卜素(Carotenoids)是一类C40萜类化合物及其衍生物的统称,包括600多种脂溶性植物色素[28] 。类胡萝卜素广泛存在于水果和蔬菜中,可以分为四个亚族:1) 胡萝卜素,如α-,β-,γ-胡萝卜素、番茄红素;2) 胡萝卜醇,如叶黄素、玉米黄质;3) 胡萝卜醇的脂类;4) 胡萝卜酸,如臧红素。常见类胡萝卜素的结构如图4所示。其中α-胡萝卜素,主要存在于胡萝卜、羽衣甘蓝、南瓜、玉米、黄椒、黄莓中;β-胡萝卜素,主要存在于胡萝卜、杏、芒果、红辣椒、羽衣甘蓝、菠菜、西兰花中;番茄红素,存在于番茄、西瓜、葡萄柚、木瓜、番石榴、玫瑰果中;β-隐黄素,存在于牛油果、橘子、木瓜、百香果、花椒、柿子中;而叶黄素和隐黄素,广泛存在于甘蓝、菠菜、西兰花、豌豆、甘蓝、生菜和玉米中。
类胡萝卜素对人类实现各种生理功能具有重要作用。例如它是维生素A原,能预防夜盲症。人体自身不能合成维生素A,但可以将β-胡萝卜素降解成两分子的维生素A,所以类胡萝卜素尤其β-胡萝卜素是人体维生素A的丰富来源。类胡萝卜素是一种生理抗氧化剂[29] ,其高活性、富电子的长多烯碳链使它具有良好的清除活性氧自由基的作用,能阻碍类脂过氧化,从而保护卵泡和子宫的类固醇不被氧化。类胡萝卜素还具有着色功能,在蛋鸡饲料中添加类胡萝卜素,能增强蛋黄的颜色。
Azam Bolhassani等发现类胡萝卜素对癌症和中风等许多疾病有治疗作用[30] ,提高膳食中β-胡萝卜素的摄入量能显著降低老年人心肌梗死(MI)的风险。藏红花中的类胡萝卜素还具有抗肿瘤和抗致癌活性,并且对正常细胞没有毒性。Marcela Hernandez-Ortega发现从干辣椒中提取的胡萝卜素有抗氧化、镇痛、消炎的功效[31] 。PéterMolnár发现类胡萝卜素可以抑制幽门螺旋杆菌,从而预防胃病[32] 。George Wolf的研究表明类胡萝卜素能增强间隙联接细胞的交流和联接蛋白的合成,从而抑制致癌细胞的发展[29] 。Takuji Tanaka对比研究发现类胡萝卜素能降低不同组织癌症的风险,但是对于吸烟、酗酒的人群可能产生不利的影响[33] 。
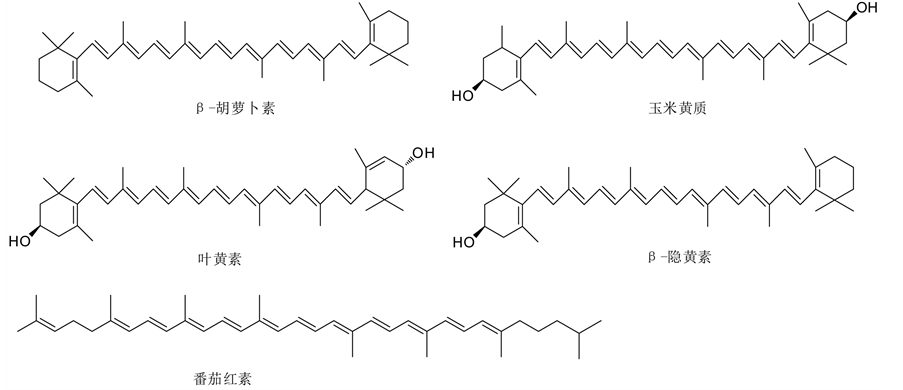
Figure 4. Structures of β-carotene, zeaxanthin, lutein, β-cryptoxanthin, lycopene
图4. β-胡萝卜素、玉米黄质、叶黄素、β-隐黄素、番茄红素的结构式
2.3. 多酚类化合物
天然多酚类抗氧化物是从植物中提取的一类高效抗氧化剂。目前从植物提取物中已经发现和报道的多酚或酚类化合物及其衍生物多达6500种以上,他们都是植物代谢过程中的次生副产物,存在于几乎所有的水果、蔬菜和药用植物中,是人们每天从食物中摄取数量最多的抗氧化物质。基于多酚类抗氧化剂的化学结构,可以分为芪(二苯乙烯类)、鞣、酚酸类、羟基络醇类、黄酮类,花青素类等8类化合物(代表性结构如图5所示)。其中研究最充分的是茶多酚,而最近几年的研究热点还有白藜芦醇和羟基酪醇等[34] -[36] 。茶多酚是一类存在于茶叶中的多羟基酚类混合物,主要组分包括儿茶素类、黄酮及黄酮醇类、花色素类和酚酸类等多酚化合物,其中儿茶素类约占总量80% [37] 。
这些天然多酚类化合物具有良好的抗氧化功能,还有强化血管壁、促进肠胃消化、降血脂、增强人体免疫力、防动脉硬化和血栓形成,以及利尿、降血压、抑制细菌与癌细胞增殖等作用[10] 。大量抗肿瘤药和抗炎药的主要成分含有多酚类化合物,它们已经成为保证和维持健康的重要物质[38] 。Li Wu [2] 等发现从高粱麸皮提取的原花青素对物的肿瘤有抑制效应。Khushwant S等发现蔓虎刺浆果多酚有明显的抗氧化性和细胞保护活性[39] 。Vitaly Roginsky的研究表明茶多酚能影响分子信号的调制、转导通路,还能影响细胞的防御系统和细胞凋亡基因的表达,可作为抗炎性和抗癌药物[40] 。
3. 抗氧化的反应机理
抗氧化防御系统,主要包括抗氧化酶系统和非酶小分子抗氧化剂。抗氧化酶主要包括超氧化物歧化酶(SOD)、愈创木酚过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)。非酶抗氧化剂主要有抗坏血酸(AsA)、谷胱甘肽(GSH)、类胡萝卜素(Car)和多酚类等天然抗氧化剂。
3.1. 抗氧化酶的抗氧化反应机理
抗氧化酶是人体自身的防御系统,能高效的利用氧化还原作用将过氧化物转换为毒害较低或无害的物质。例如,超氧化物歧化酶(SOD)能将超氧化物阴离子转化为过氧化氢和O2,该反应速度是超氧化物阴离子自发歧化的104倍。在还原过渡金属的存在下,如Fe2+或Cu+,H2O2发生Fenton反应,生成OH· (如图6所示),这可能引发不饱和脂肪酸(PUFA)的自由基链反应和DNA损伤[4] 。过氧化氢酶(CAT)可进一步把细胞代谢产生的过氧化氢还原为水(如图7所示),以消除其对细胞的毒性作用。

Figure 5. Structures of resveratrol, tannin, Danshensu, caffeic acid, quercetin, and anthocyanidin
图5. 白藜芦醇、鞣、丹参素、咖啡酸、槲皮素、花青素的结构式

Figure 6. Antioxidation mechanisms of SOD [41]
图6. SOD的抗氧化反应机理[41]

Figure 7. Antioxidation mechanisms of CAT [41]
图7. CAT的抗氧化反应机理[41]
3.2. 非酶抗氧化剂的抗氧化反应机理
在还原性谷胱甘肽(GSH)的存在下,GPx作为电子给体能清除过氧化氢,得到氧化的谷胱甘肽(GSSG)和水[4] (如图8所示)。GSH和抗氧化酶都属于细胞的防御系统,用于保护细胞免受ROS的破坏。
维生素C的还原态和氧化态见图2所示。而多酚类抗氧化剂的抗氧化性能尤其突出,反应机制也比较复杂,主要有图9所示的三种途径[42] [43] :1) 多酚类化合物主要通过酚羟基上氢原子的转移机制将高活性的自由基转变为反应能力很低的酚基自由基[44] ;2) 少数多酚类化合物也可能直接从高活性自由基上获得一个电子,将高活性自由基变成低反应活性的阴离子;3) 多酚类化合物还能和铁、铜等金属离子发生络合生成稳定的络合物,从而有效阻止金属离子参与下的Fenton反应(将过氧化氢变为高活性的O2·–和·OH) [45] 。
4. 抗氧化性能的化学检测方法
目前多种试剂和方法被广泛用于抗氧化能力的检测,有些试剂还被开发成商业化的标准试剂盒。然而,由于抗氧化剂种类众多、结构各异,使用的环境也不尽相同,每种抗氧化检测方法都有一定的优点和局限性。基于反应机理,抗氧化能力测定法可分为两大类:基于单电子转移(SET)反应[46] [47] 和基于氢转移(HAT)的反应的抗氧化能力测定方法。其实,有些测试方法可能同时涉及HAT和SET反应。
按照反应机理,抗氧化能力检测法大致可以分为以下几类[46] :Folin-Ciocalteu (Folin-C)总酚测定法,DPPH自由基清除法,Trolox equivalent antioxidant capacity (TEAC)总抗氧化能力测定法,抗氧化剂还原

Figure 8. Antioxidant mechanism of Glutathione
图8. 谷胱甘肽的抗氧化机制
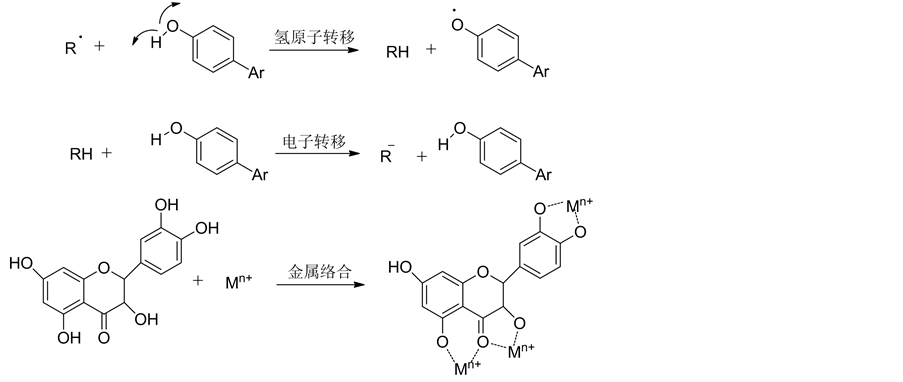
Figure 9. Antioxidant mechanism of Polyphenolic antioxidants
图9. 多酚类抗氧化剂的抗氧化机制
三价铁离子的能力(Ferric-reducing antioxidant power,FRAP)测定法和氧自由基吸收能力(Oxygen Radical Absorbance Capacity,ORAC)测定法,β-胡萝卜素/亚油酸模型测定法和抑制磷脂过氧化反应测定法等。
4.1. 基于电子转移(SET)的测定法
4.1.1. DPPH法
1,1-Diphenyl-2-picrylhydrazyl(DPPH)自由基法是最常用的评价植物样品抗氧化活性的方法之一。DPPH在有机溶剂中是一种稳定的自由基,其甲醇溶液呈紫色(最大吸收波长517 nm),能接受一个电子或氢离子。有自由基清除剂存在时,DPPH的单电子被捕捉而使其颜色变浅,在517 nm处的吸光值下降,且下降程度呈线性关系[47] [48] ,其原理如图10所示。使用紫外-可见分光光度计测量DPPH自由基的吸光度,可以定量检测抗氧化剂的抗氧化性能[49] 。抗氧化剂清除自由基的活性(RSA)可以用下面的公式计算:
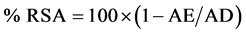 式中:AE为样品的吸光度,AD为空白试剂的吸光度。DPPH法具有简单和快速的优势,适用于快速筛选和评价多种样品清除自由基的活性,在筛选天然抗氧化剂(植物提取物)和评价抗氧化活性方面具有广泛应用。但是,DPPH是一个稳定的氮自由基,存在的时间较长,而脂质氧化生成的自由基活性高、存在时间短暂(瞬间存在),由于空间阻碍作用,许多能与脂质自由基快速反应的抗氧化剂与DPPH的反应却很慢,或对DPPH无活性。一些小分子的抗氧化剂更容易
式中:AE为样品的吸光度,AD为空白试剂的吸光度。DPPH法具有简单和快速的优势,适用于快速筛选和评价多种样品清除自由基的活性,在筛选天然抗氧化剂(植物提取物)和评价抗氧化活性方面具有广泛应用。但是,DPPH是一个稳定的氮自由基,存在的时间较长,而脂质氧化生成的自由基活性高、存在时间短暂(瞬间存在),由于空间阻碍作用,许多能与脂质自由基快速反应的抗氧化剂与DPPH的反应却很慢,或对DPPH无活性。一些小分子的抗氧化剂更容易

Figure 10. The reaction mechanism of DPPH assay
图10. DPPH测定法的反应原理
接近自由基,因此该法测得的小分子物质的抗氧化活性会比较高[50] 。使用DPPH法时,生色团的存在也会干扰测定结果,如类胡萝卜素在515 nm附近有吸收,会对测定结果产生影响。此外,单羟基酚类物质(如酪氨酸)、单糖(如葡萄糖)、嘌呤和嘧啶等不能与DPPH反应,蛋白质遇DPPH容易生成沉淀,所以该法不适合测定这些物质的抗氧化性。低价无机离子也会干扰测定结果,测量时必须将这些干扰除去。
4.1.2. Folin-Ciocalteu法
Folin-Ciocalteu试剂即磷钨酸和磷钼酸混合试剂,在碱性条件下极不稳定,易被酚类化合物还原生成蓝色的钨兰和钨兰混合物[51] ,其原理如图11所示。生成的蓝色混合物在765 nm处有最大吸收峰,且吸光度与总酚的含量在一定浓度范围内呈线性关系。使用没食子酸作为标准,以吸光度为纵坐标,没食子酸溶液质量浓度为横坐标可绘制标准曲线。样品与Folin-Ciocalteu试剂在适宜的温度下,反应特定时间,显色后在765 nm处测其吸光度,通过标准曲线并按下列公式可计算出多酚的含量:

式中W为多酚含量(pg/mL);C为没食子酸质量浓度(g/mL);V为提取液体积(mL);N为稀释倍数;M为取样量(mL)。
Folin-Ciocalteu比色法是植物多酚类化合物含量的常用测定法,具有成本低廉、操作简便、准确度和精密度高等优点[52] 。但Folin-Ciocalteu试剂和形成的蓝色产物在碱性或高温下都易分解,而酚在碱性条件下才能反应,所以升高温度和碱性条件虽可以加速反应,提高检测效率,但会影响测定精度。植物中存在的非酚类化合物如抗坏血酸、糖、芳香胺、有机酸和蛋白,可能与Folin-Ciocalteu试剂反应[53] 。还有一些无机物如硫酸铁,亚硝酸钾,磷酸钠和硫酸锰也可能与酚试剂反应,都会导致酚类化合物浓度的测定值偏高。
4.1.3. TEAC法
TEAC法也叫ABTS assay,是用Trolox作为标准抗氧化剂,来测定其他抗氧化物质总抗氧化能力的一种测定方法[54] 。(2,2’-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS)与过硫酸钾反应可生成稳定的ABTS.+,而且呈现深蓝色[9] ,其原理如图12所示。有其他抗氧化物质存在的时候,ABTS.+的生成会受到抑制,待一定浓度的抗氧化剂与ABTS试剂作用一定时间后,测量734 nm的吸光度变化即可测定并计算出样品的总抗氧化能力。6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)是一种维生素E的类似物,和维生素E的抗氧化能力相近,其他物质的抗氧化能力可用其抗氧化能力与同浓度下Trolox相比的倍数来表示,得到的数据叫做TEAC值。
ABTS自由基既溶于水又溶于有机溶剂,不受离子强度影响,可以用来同时测量样品中亲水性和亲脂性化合物的抗氧化能力。另外,ABTS.+具有低的氧化还原电位(0.68 V) [55] ,适用于评估酚的抗氧化能力。但是,ABTS.+与抗氧化物质反应较慢,TEAC法高度依赖于保温时间、样品量与ABTS自由基浓度的比值。选取较长的反应时间能获得高的准确性和可重复性,但不能表征不同物质间抗氧化反应速度之间的差异。

Figure 11. The reaction mechanism of Folin-Ci- ocalteu assay [47]
图11. Folin-Ciocalteu总酚测定法的反应原理[47]
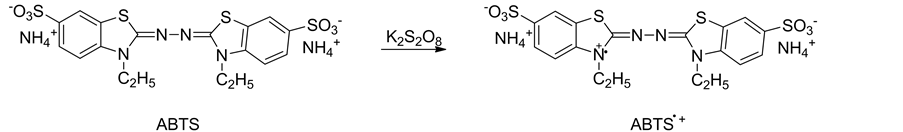
Figure 12. The reaction mechanism of TEAC assay
图12. TEAC法的反应机理
4.1.4. FRAP法
FRAP测定法是以铁氰化钾为氧化性试剂,与抗氧化物质反应后生成Fe2+,Fe2+进一步与三吡啶三吖嗪(TPTZ)结合生成蓝色络合物(如图13所示),在波长593 nm处有最大光吸收[47] [56] 。蓝色络合物的生成量与受试物的还原能力成一定比例,吸光度值越大,表明由抗氧化物质还原的Fe2+越多,即该物质的抗氧化活性越强。
FRAP法具有操作简单、测定速度快等优点,而且对定量测定亲水和亲脂性抗氧化剂都是有效的。FRAP法的氧化还原反应在大多数情况下都能迅速(4分钟内)完成,但有些酚类化合物反应较慢,就需要较长的反应时间。FRAP法的一个局限是铁(III)盐的氧化还原电位约为0.70 V,理论上氧化还原电位低于0.70 V的任意化合物都可以还原铁造成干扰[47] 。例如蛋白质与巯基抗氧化剂如谷胱甘肽就不能由FRAP法来测量。另外,FRAP法是在pH 3.6条件下进行的,与人体生理环境pH 7~7.4相差较大。
4.2. 基于氢转移(HAT)的测定法
4.2.1. ORAC法
ORAC测定法涉及一个相对复杂的反应体系和反应过程,反应体系主要包括自由基产生源、被自由基攻击起氧化反应的靶指示剂、抗氧化物质(标准品或被测样品)和反应介质几部分。反应的基本过程如图14所示,自由基产生剂如水溶性化合物2,2’-偶氮(2-甲基丙基脒)-二盐酸盐AAPH首先与氧反应,产生过氧自由基,后者攻击靶指示剂(荧光探针) [57] [58] 。随着靶指示剂被攻击,发生氧化反应,靶指示剂的指示信号(荧光)逐渐减弱。如果反应体系中加入抗氧化物质,由于其竞争性地与自由基作用,减弱、延缓了靶指示剂的氧化过程,对靶指示剂起到了保护作用,通过监测靶指示剂信号的变化,可记录这一过程[59] 。这一竞争性反应被认为是最可能接近体内抗氧化物质的作用形式。目前已成功应用于生物样品、植物或食品提取物以及纯化合物等多种样品的体内外抗氧化能力分析,也可检测化合物的氧自由基清除能力。
ORAC法检测过程中能提供稳定可控的自由基,这些自由基与生命现象中的自由基具有高度的一致性,而且作为靶指示剂的荧光分子与待测样品之间不发生相互作用,不会干扰样品的测定结果。因此,该方法与其他抗氧化活性分析方法相比,在灵敏度、精密度、准确度、重复性及应用范围等方面均有一定的优势。但ORAC法也存在一些不足,例如荧光分子的荧光强度对反应体系的pH值可能相对敏感,而且AAPH自发分解产生过氧自由基的速率主要取决于温度,因此ORAC方法需要在一定pH范围内恒温测定。
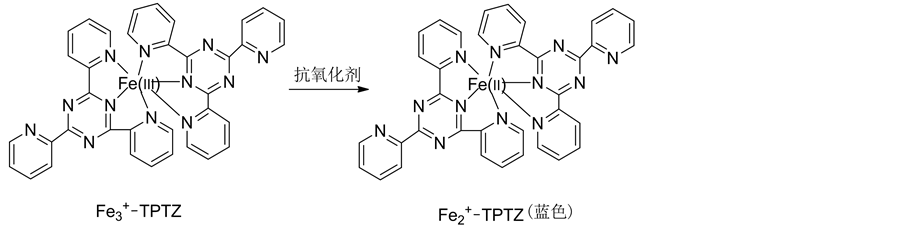
Figure 13. The reaction mechanism of FRAP assay
图13. FRAP测定法的反应机理
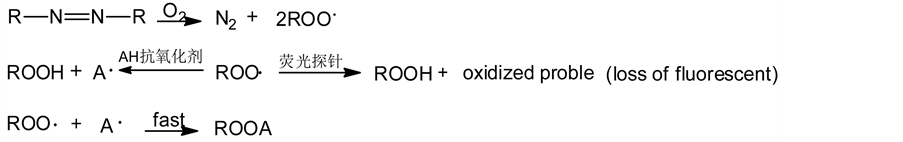
Figure 14. The reaction mechanism of ORAC assay [47]
图14. ORAC法的反应原理[47]
4.2.2. β胡萝卜素-亚油酸褪色测定法
β胡萝卜素-亚油酸氧化法是基于亚油酸在高温下分解产生的过氧化氢能使β-胡萝卜素褪色来进行的光谱分析方法[47] [60] ,如图15所示。
一个典型的测试过程如下[61] :将0.2 mg β胡萝卜素溶于0.2 mL氯仿中,然后加入20 mg亚油酸及200 mg吐温−40。混合均匀后置于40℃水浴中除去氯仿,再加入50 mL蒸馏水剧烈振荡并鼓入氧气2~3 min,即配成反应介质溶液。除不加β-胡萝卜素氯仿溶液外,其他步骤同前配成空白对比溶液。在具塞试管中逐一加入4.0 mL反应介质溶液,再分别加入0.2 mL样品液(浓度为100和200 mg/kg),同时设置空白调零管、对照管、2,6-二叔丁基-4-甲基苯酚(BHT)管和PG管。其中空白调零管中不含β-胡萝卜素与试样,对照管不含试样,以0.2 mL溶剂代替试样溶液。上述溶液混匀后,置于50℃水浴中恒温,在470 nm波长下测定t = 0时的吸光度,之后每间隔15 min测定吸光度,直至对照管中β胡萝卜素颜色消失(约120 min),平行测定3次。
β胡萝卜素-亚油酸法的优点是只使用少量的样品和试剂,重现性好,对脂溶性样品测定效果好。缺点是相对于Folin-Ciocalteu法操作繁琐、费时。该方法还有一个重要的限制是β胡萝卜素可通过多种途径在470 nm发生褪色,使得结果可能比较复杂。而藏红花素只能经过自由基氧化途径漂白,用藏红花素取代β胡萝卜素可提高测定的可靠性[62] 。
4.2.3. 抑制磷脂过氧化测定法
该方法是利用Cu催化脂质发生过氧化反应生成丙二醛(MDA),MDA在酸性加热条件下可与硫代巴比妥酸(TBA)反应生成粉红色(最大吸收峰在532 nm)的硫代巴比妥酸 (TBARS) [63] (如图16所示)。当体系中有抗氧化物质存在时,MDA生成量减少,终产物TBARS的产量也会减少,因此可通过吸光值的变化来评价脂质过氧化反应的程度。
巴比妥测试法是非专一性的检测,不仅能测量生成的MDA的含量,还容易受其他含氧化合物的干扰。另外,实验过程需要高温条件,对于某些脂质在检测过程中可能发生氧化甚至导致过氧化物的过度氧化。因此,相对于对于大多数其他检测方法,该检测方法的灵敏度相对较低[64] 。

Figure 15. The reaction mechanism of β carotene-linoleic acid bleaching assay
图15. β胡萝卜素-亚油酸褪色法的反应机理

Figure 16. The reaction mechanism of phospholipid peroxidation assay
图16. 抑制磷脂过氧化测定法的反应机理
4.3. 其他ROS清除能力测定
4.3.1. 氯化硝基四氮唑蓝(NBT)检测法
NBT法是利用氯化硝基四氮唑蓝(NBT)与超氧阴离子O2.−反应生成甲臜,后者为蓝色物质,在560 nm波长处有强吸收[65] (如图17所示)。当加入抗氧化物质后,可竞争性与超氧阴离子反应,抑制NBT的还原,从而导致甲臜含量降低和560 nm附近吸光度的减弱。茶多酚和维生素C都能有效清除O2.−,所以都可以用此法检测。抑制蓝色甲臜生成的量与抗氧化剂的用量在一定范围内呈正比关系[66] 。该方法可用于实验室抗氧化剂的筛选与研究,也可用于次黄嘌呤和黄嘌呤氧化酶生成超氧阴离子浓度的检测,但不适用于一些非酶抗氧化剂的定量检测。
4.3.2. DHE法
荧光探针二氢乙锭(DHE)检测法是利用DHE可自由透过活细胞膜进入细胞内,并与O2.−反应生成具有红色荧光的氧化乙啶的一种光谱检测方法[67] ,其原理如图18所示。氧化乙啶可插入染色体DNA中,并仍然产生红色荧光,荧光强度与体系中O2.−的量有关,根据活细胞中红色荧光的强度,可以判断细胞ROS含量和变化[65] 。
通过荧光显微镜可直接用DHE荧光检测法研究细胞内ROS的含量和分布。DHE法还具有高的DNA绑定特异性,能帮助理解血管重塑过程中的氧化还原[67] ,是一种快速简便的检测组织或培养活细胞中ROS的经典方法。该测试方法的缺点是DHE探针见光易分解,保存过程中应尽量避光,长时间测量也可能导致明显的光漂白现象。
5. 细胞毒性和抗氧化性能的细胞检测方法
当天然抗氧化剂被作为功能食品和药品使用之前,首先要对其进行细胞毒性评价,确定合理的浓度使用范围。此外,前面总结的化学测定方法大都忽略了生物体系的复杂性,不能模拟真实的生理环境,也没有涉及到抗氧化剂跨膜进入细胞的能力,在细胞内的分布以及与细胞器或酶的相互作用等过程,因此还有必要进行生物实验[68] 。体外细胞实验由于操作简便、可重复性好、成本低等优势,通常用于天然抗氧化剂的毒性初步评价、对细胞内抗氧化酶活性的调控评价以及对不良环境中抗氧化剂的保护作用评价等。已有文献中报道的体外细胞实验所用的模型细胞种类众多,选择合适的细胞模型和正确的培养测试方法,对实验结果的可靠性和可比性也具有重要意义。
5.1. 细胞毒性测试
判断细胞毒性大小最常用的方法之一就是细胞增殖实验。在细胞增殖实验中,四甲基偶氮唑盐法(MTT)是最早报道且应用最广泛的方法[69] ,但是由于MTT经活细胞线粒体脱氢酶转化生成的蓝紫色结晶物需要加入二甲基亚砜(DMSO)进行溶解,操作步骤繁琐,导致实验结果稳定性差。目前已经有一些改进
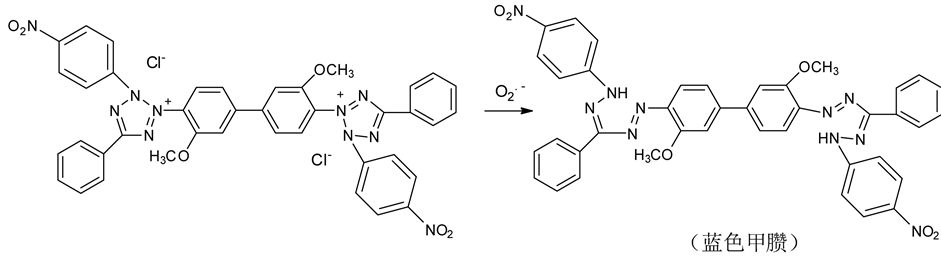
Figure 17. The reaction mechanism of NBT assay
图17. 氯化硝基四氮唑蓝(NBT)检测法的反应机理

Figure 18. The reaction mechanism of DHE assay
图18. DHE检测法的反应机理
型的试剂盒可用来检测细胞毒性,如甲胺四氮唑盐(MTS)法、水溶性四唑盐(WST-1)法、水溶性四氮唑-8(CCK-8)法和3,3’-[1-(苯氨酰基)-3,4-四氮唑]-二(4-甲氧基-6-硝基)苯磺酸钠(XTT)法等 [70] 。
5.1.1. MTT法
MTT法的原理如图19所示:活细胞的线粒体脱氢酶能将3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)还原成不溶于水的紫色甲臜(formazan)结晶,formazan的生成量与细胞释放出的酶活性成正比例,而酶活力与细胞数及细胞活力成比例[65] 。MTT法是最经济、适用范围也较广的细胞生长检测方法,但灵敏度不高,并且需添加DMSO以溶解甲臜,同时DMSO具有比较强烈的细胞毒性可导致蛋白质沉淀,从而致使背景可变,操作不当会给实验带来极大误差[69] 。
5.1.2. MTS法
MTS法的反应机理见图20。与MTT法类似,活细胞的线粒体脱氢酶能将3-(4,5-二甲基-2-基)-5-(3-羧基甲氧基)-2-(4-磺苯基)-2H-四唑鎓(MTS)还原成水溶性的黄色甲臜(formazan),formazan的生成量与细胞数及细胞活力成比例[71] 。MTS法的适用范围很广且灵敏度较高,但该法需要加入中间电子受体吩嗪甲硫酸盐PMS,且试剂的储存方法要求严格,储存时间也较短,比MTT的价格高很多倍[72] 。
5.1.3. WST-1法
WST-1法也是MTT的改进技术,反应机理如图21所示。活细胞的线粒体脱氢酶能将WST-1还原成水溶性的橘黄色甲臜(formazan),formazan的生成量与细胞数及细胞活力成比例。WST-1法是最快捷、最敏感的且实验结果稳定的检测方法,直接产生水溶性的甲臜,WST-1较稳定、重复性好,可作即用型试剂。例如,Puriya Ngamwongsatit分别用MTT和WST-1法测定5芽孢杆菌对中国仓鼠卵巢细胞CHO的毒性,发现MTT法需要44-52 h而WST-1法只需3 h [73] 。但是WST-1法的局限性在于WST-1不能被所有的细胞所代谢[74] 。

Figure 19. The reaction mechanism of MTT assay
图19. MTT法的反应机理
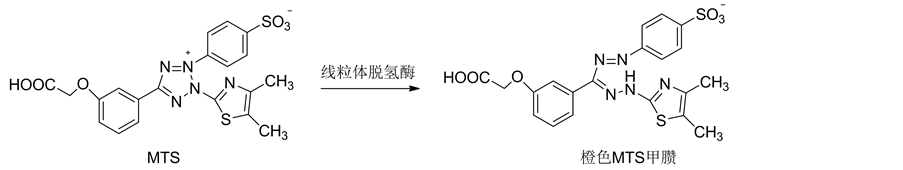
Figure 20. The reaction mechanism of MTS assay
图20. MTS法的反应机理
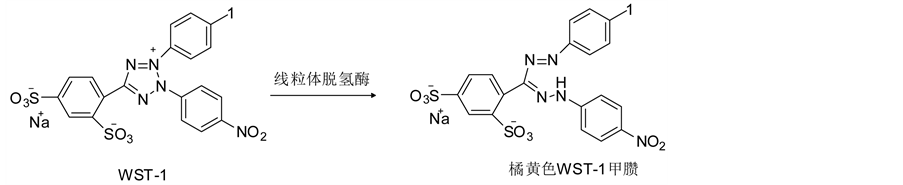
Figure 21. The reaction mechanism of WST-1assay
图21. WST-1法的反应机理
5.1.4. CCK-8法
CCK-8法也是近年商业化的一个细胞毒性检测盒,反应机理如图22所示。活细胞的线粒体脱氢酶能将2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐(CCK-8)还原成水溶性的黄色甲臜(formazan),formazan的生成量与细胞数及细胞活力成比例。CCK-8法也具有使用方便、检测快速、灵敏度高,甚至可以测定较低细胞密度、重复性优于MTT、对细胞增殖影响小、细胞毒性小。但是CCK-8试剂的颜色为淡红色,与含酚红的培养基颜色接近,不注意的话容易产生漏加或多加。
5.1.5. XTT法
XTT法也是MTT的改进方法[75] ,反应机理如图23所示。活细胞的线粒体脱氢酶能将3,3'-[1-(苯氨酰基)-3,4-四氮唑]-二(4-甲氧基-6-硝基)苯磺酸钠(XTT)还原成水溶性的橘黄色甲臜(formazan)。当XTT与电子偶合剂吩嗪二甲酯硫酸盐(PMS)联合应用时,其所产生的水溶性的甲臜产物的吸光度与活细胞的数量成正比。XTT测定法与MTT法相比,能减少样品处理、提高检测效率,消除增溶过程可能出现的错误,同时提供等效灵敏度。但是XTT法也需要加入中间电子受体PMS,而XTT/PMS混合试剂容易生成电荷转移复合物而不太稳定[72] ,可能影响检测结果。
5.2. 细胞内抗氧化酶的活性测试方法
天然抗氧化剂作为体内抗氧化酶的有益补充,能清除体内过量的ROS。但外源性抗氧化剂的引入,

Figure 22. The reaction mechanism of CCK-8 assay
图22. CCK-8法的反应机理

Figure 23. The reaction mechanism of XTT assay
图23. XTT法的反应机理
必然也会影响体内抗氧化酶的活性变化。除了前面所述部分化学检测法可以检测细胞内ROS的含量和分布外,还有一些商业化的试剂盒可以用来测试抗氧化剂存在下的细胞内抗氧化剂活性酶(SOD,CAT,GPx,GR,GST)的活性变化。
5.2.1. SOD活性检测
INT法是最常用的SOD活性检测方法,主要是利用碘硝基氯化四氮唑蓝(INT)与超氧自由基反应生成红色甲臜来进行光谱分析的一种办法,反应机理如图24所示。超氧化物歧化酶(SOD)也可以消耗超氧自由基,因此INT和SOD与超氧自由基的反应是竞争性反应,通过测定SOD对INT与超氧自由基反应的抑制程度可以评估SOD的活性。反应液红色愈深,说明INT的反应程度越大而SOD活性愈低,反之酶活性愈高[76] [77] 。INT法测SOD的活性具有精确、方便等优势,但应该综合考虑保存时间、保存温度及保存方式这些因素带来的影响。
除了使用最多的INT法,还可以用黄嘌呤氧化酶-细胞色素C法和氮蓝四唑(NBT)光还原法等检测SOD的活性。其中黄嘌呤氧化酶-细胞色素C法是利用细胞色素C与O2.−反应,将高铁细胞色素C还原为亚铁细胞色素C时在550 nm波长处有明显的吸光度(A)变化[78] 。氮蓝四唑(NBT)光还原法是利用NBT与超氧自由基反应生成蓝色甲臜来进行光学分析的方法[79] 。
5.2.2. CAT活性检测
CAT能催化过氧化氢分解成水和氧气,所以通过测定体系中剩余H2O2的量来评价CAT的活性大小。钼酸铵法是常用的一种检测方法,机理如图25所示。过氧化氢能氧化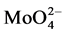 (VI)成
(VI)成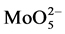 (VIII),而
(VIII),而 (VIII)接受氢氧根的电子成键并使分子间立即脱水缩合,分子内也形成众多-O-H-O-氢键,得到稳定的黄色复合物(H2MoO4·XH2O)n,在405 nm处有强烈吸收峰,其吸光值和过氧化氢浓度成线性关系。测定出体系剩余过氧化氢在405 nm的吸光值,可得到剩余过氧化氢的量,就得到了CAT的催化活性。钼酸铵法测定CAT活性,具有准确、高效的特点,重现性好,相对于滴定法可以减少误差,但钼酸铵法操作较复杂,提取的酶液浓度、显色反应的时间等也可能干扰结果。
(VIII)接受氢氧根的电子成键并使分子间立即脱水缩合,分子内也形成众多-O-H-O-氢键,得到稳定的黄色复合物(H2MoO4·XH2O)n,在405 nm处有强烈吸收峰,其吸光值和过氧化氢浓度成线性关系。测定出体系剩余过氧化氢在405 nm的吸光值,可得到剩余过氧化氢的量,就得到了CAT的催化活性。钼酸铵法测定CAT活性,具有准确、高效的特点,重现性好,相对于滴定法可以减少误差,但钼酸铵法操作较复杂,提取的酶液浓度、显色反应的时间等也可能干扰结果。

Figure 24. The reaction mechanism of INT assay for measuring the activity of SOD
图24. INT法测SOD活性的反应机理

Figure 25. The reaction mechanism of molybdate assay for measuring the activity of CAT
图25. 钼酸铵法测定CAT活性的反应机理
其他测定CAT活性的方法还有亚铁离子与硫氰酸盐分光光度法和流动相注射法(FIA)。亚铁离子与硫氰酸盐分光光度法测定过氧化氢酶的活性是通过孵育后残留的H2O2与Fe2+反应,生成Fe3+,Fe3+与硫氰酸盐反应生成红色Fe(SCN)3,酶标仪测吸光度从而计算出剩余H2O2的量 [80] 。流动相注射法(FIA)测定H2O2的活性是将过氧化氢酶固定,而待测基质被连续泵输送经过,过氧化氢酶分解H2O2产生O2,从而利用Clark型氧电极检测增加的溶解氧来评价过氧化氢酶的活性[81] 。
5.2.3. GPx活性检测
GPx能催化还原型谷胱甘肽(GSH)与过氧化物反应,所以GPx的活性测定是以催化GSH氧化的反应速度,即单位时间内GSH减少的量来表示的。DTNB法是最常用的GPx活性检测方法[82] [83] ,其反应机理如图26所示。GSH和DTNB在GPx催化下反应生成黄色的5-硫代-2-硝基苯甲酸阴离子,在412 nm附近有最大吸收峰,通过吸收强度的变化可计算出GSH减少的量并求得GPx的活性。由于GSH也能进行非酶反应氧化,所以最后计算酶活力时,必须减去非酶反应所引起的GSH减少量。
DTNB法不需特殊的设备,测定的精密度、灵敏度和稳定性基本符合要求,而且使用的DTNB试剂性能稳定,便于使用。DTNB法除了适于GPx活性的测定,也可以用于其他含巯基化合物的测定。但如果生物样品中含有其他巯基化合物可能会导致GPx活性的检测值偏高[82] 。
5.2.4. GR活性检测
谷胱甘肽还原酶(GR)能催化氧化型谷胱甘肽(GSSG)被还原型辅酶II (NADPH)还原为GSH(如图27所示)。NADPH在340 nm附近有特征吸收,通过测定吸光度在340 nm处的下降就能获得NADPH的减少量,即可测定GR的活性[84] 。NADPH法测定GR活性具有快速、灵敏度高,可同时测定多个样品等特点,但如果有其他NADPH-消耗酶的存在会使得GR活性的测定值偏高[85] 。
5.2.5. GST的活性测定
1-氯-2,4-二硝基苯(CDNB)法常用来检测谷胱甘肽转移酶(GST)的活性。CDNB与GSH在GST的催化下能生成复合物CDNB-SG,其最大吸收在340 nm,用酶标仪或分光光度计检测此波长吸光度的变化即可计算GST的活性[86] [87] ,反应机理如图28所示。CDNB法具有操作简便和灵敏度高的优势,但该反应对GST缺乏专一性,其它巯基物质的存在可能对检测结果造成干扰。
5.3. 极端条件下抗氧化剂的防护和修复性能检测
实验中通常选用紫外线(UVB)照射来模拟极端条件对细胞的伤害。波长短能量较高的UVB (290~320
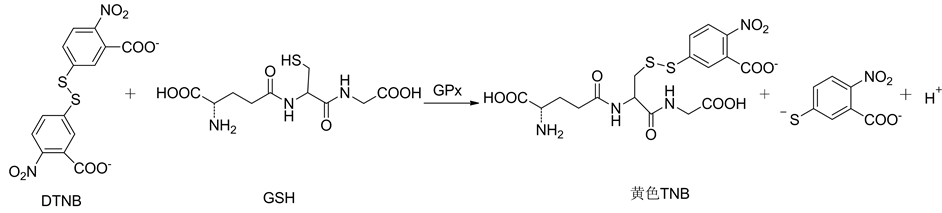
Figure 26. The reaction mechanism of DTNB assay for measuring the activity of GPx
图26. DTNB法测GPx活性的反应机理

Figure 27. The reaction mechanism of NADPH assay for measuring the activity of GR
图27. NADPH法测GR活性的反应机理

Figure 28. The reaction mechanism of CDNB assay for measuring the activity of GST
图28. CDNB法测GST活性的反应机理
nm)能诱导皮肤病变,包括红斑、水肿、增生、细胞晒伤、炎症等,甚至发生癌变[88] 。UVB可诱导细胞产生大量ROS,引起一系列的氧化性损伤,并释放多种介导炎症反应、调节免疫应答和诱导细胞凋亡等细胞因子,这些细胞因子以负反馈形式作用于细胞,进一步加剧细胞的损伤[89] 。紫外线照射而形成的活性氧(ROS)被推定为在导致细胞反应的传导中起重要作用的物质,而且氧自由基的升高导致炎症增加,从而对皮肤产生伤害。因此,在UVB照射条件下可以研究抗氧化剂对辐照损伤的预防和修复作用。细胞的损伤程度与UVB的照射剂量有关,照射剂量(J/cm2) = 照射强度(W/cm2) × 照射时间(s),照射强度通过紫外线辐照计来测量[89] 。
一个典型的实验方法如下[90] :将处于对数生长期的细胞接种于96孔板,待细胞单层贴壁后(24 h),弃培养液,每孔加入200 μL PBS,分为空白对照组(空白组用铝箔盖住)、抗氧化剂组、UVB照射组、UVB照射 + 抗氧化剂组,UVB照射剂量为30 mJ/cm2,照光完毕后弃去PBS覆盖液,加入DMEM维持液继续孵育24 h后,进行检测。用前面介绍的MTT、MTS、WST-1、CCK-8、XTT等方法可以检测细胞增殖活性,用比色法检测细胞丙二醛(MDA)含量、超氧化物歧化酶(SOS)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽转移酶(GST)及过氧化氢酶(CAT)的活性。
选择的细胞模型和抗氧化剂用量和使用方法也会对实验结果产生影响。Liu J等证实螺旋藻(节旋螺旋藻)的活性乳酸菌发酵产品具有抗氧化和UVB防护作用[90] 。Sara Salucci发现羟基络醇能够防护人类角化细胞暴露于紫外线下引起的细胞凋亡,从而防止皮肤损害[91] 。Mariane A通过大鼠模型实验证实芦荟皂质对UVB引起的爪晒伤具有抗炎及抗氧化作用[92] 。
6. 抗氧化性能的活体实验方法
对于天然提取物抗氧化性能的评价目前最成熟的方法就是前面综述的化学检测方法和细胞实验方法。但这些化学或体外的检测方法的检测条件与人体的实际生理环境相去甚远,前面的初步评估结果可能与实际的使用效果相差很多甚至相互矛盾。进一步通过活体实验能更客观或接近反映真实的抗氧化效果。但是活体实验的动物模型种类也很多,而且给药方式有口服、静脉注射和经皮给药等不同方式,可能导致抗氧化剂的利用度差异很大,另外模型动物个体状态的差异也会导致实验重复性较差。由于活体实验成本高、实验周期长,实验结果的可重复性较差,文献中报道的活体实验结果相对要少的多。但作为走向临床或市场的重要环节,活体实验又是必不可少的。这里根据文献和中华人民共和国食品药品监督管理局制定的《保健食品抗氧化功能评价方法》总结一些常用的检测内容和方法。
活体实验用到的动物模型主要是成本较低、饲养和实验都比较方便的大鼠、小鼠和兔子等小型动物,也可以选择猪、狗等大型动物,人体试食实验要尤其慎重。文献中多选取氧化损伤或老龄的大鼠[93] 或小鼠[94] [95] 作为模型,分组关在干净的笼子里,提供充足的可任意使用的水和食物(小麦豆粕)。氧化损伤动物模型的造模方法有D-半乳糖供给过量法和乙醇氧化损伤模型。抗氧化性能测试实验开始前,在受控的温度(24℃~26℃或18℃~22℃) [96] ,湿度(55%~60%),和控制光照(光照12 h和黑暗12 h)的环境中饲养一周[97] 。可以通过静脉注射或灌胃不同浓度梯度的天然抗氧化剂进行给药。定期称量体重,治疗一段时间后,取血进行生化分析,并将动物通过颈椎脱位处死,于4℃切下小鼠的肝、肾、脾和脑等需要检测的组织,用冰冷的盐水清洗,浸入液氮中,并立即储存在−80℃ [98] 。
用前面介绍的各种比色法检测血清中MDA含量以及抗氧化酶SOD、GPx、GST及CAT的活性[98] [99] 。还可以特别对有氧化损伤的器官或组织进行进一步研究,例如PSOTOVA J等检测新抗菌药物sanguiritrin对外周淋巴细胞和肝细胞的DNA断裂损伤进行评估[100] 。G. Diaz-Araya等评价了1,4-二氢吡啶和亚硝基芳基衍生物对Fe3+/抗坏血酸刺激大鼠脑片的脂质过氧化的抗氧化作用并测定了大鼠脑切片的氧消耗量[101] 。整体来讲,抗氧化能力测试的活体实验还缺乏规范的实验内容,更缺少统一的操作和检测标准,现有报道方法的可靠性和局限性还有待于进一步验证。
7. 结论和展望
由于癌症、心血管疾病、糖尿病和各种神经性疾病等重大疾病都可能和体内过量ROS的存在密切相关,所以近年来对天然抗氧化剂的研究风起云涌,仅每年的研究性论文就高达数万篇。本文主要从化学角度综述常见天然抗氧化剂的结构和抗氧化机理,重点从化学检测方法、细胞实验和动物实验三个层面总结了抗氧化性能的检测内容、检测方法和化学反应机理。期望能帮助读者正确理解抗氧化反应的化学本质,有助于合理组合使用抗氧化检测方法获得可靠的评价结果。
对于植物中天然抗氧化剂的研究虽然已经取得了很多研究成果,但仍有一些重要科学问题亟需解决,未来的一些研究热点可能包括:1) 建立一套由操作简便、结果可靠、能被大多数科研人员认可的测试方法构成的抗氧化性能测试评价标准。对于细胞和活体实验还需要考虑选择合适和通用的生物模型和给药方式,增强不同科研团队的结果可比性。2) 天然的抗氧化剂容易被肝肾直接代谢掉,生物利用率很低。如何提高抗氧化剂的吸收率,提高其在血液中的循环时间,增强其进入细胞甚至特定细胞器的能力,是提高抗氧化剂的生物利用率的关键。3) 深入研究抗氧化剂的结构与抗氧化性能、细胞毒性、生物利用度、靶向性能等的关系,通过这些构效关系研究对抗氧化剂的结构进行综合优化,必将促进抗氧化剂的商业化和实用化,对提高人类的健康和生活质量有重要意义。
致谢
感谢国家自然科学基金、教育部新世纪优秀人才计划等的资助。感谢曹老师、孟老师的悉心指导和殷切关怀,他们给了我独到的建议,曹老师、孟老师渊博的学术知识,严谨的治学态度,锐意开拓的创新精神以及平易近人的做人风范使我受益匪浅。
基金项目
国家自然科学基金(21174087,21474079),教育部新世纪优秀人才计划(NCET-13-0453),中国博士后基金(2013M540738,2014T70909),中央高校基本科研业务费(08142027,08143101)资助。
文章引用
何慧娟,黄 娜,曹瑞军,孟令杰, (2015) 植物中主要抗氧化剂的结构、抗氧化机理和抗氧化性能检测
Structures, Antioxidation Mechanism, and Antioxidation Test of the Common Natural Antioxidants in Plants. 生物物理学,01,25-47. doi: 10.12677/BIPHY.2015.31004
参考文献 (References)
- 1. Wojcik, M., Burzynska-Pedziwiatr, I. and Wozniak, L.A. (2010) A review of natural and synthetic antioxidants important for health and longevity. Current Medicinal Chemistry, 17, 3262-3288.
- 2. Wu, L., Huang, Z., Qin, P., Yao, Y., Meng, X.J., Zou, J.Q., et al. (2011) Chemical characterization of a procyanidin-rich extract from sorghum bran and its effect on oxidative stress and tumor inhibition in vivo. Journal of Agricultural and Food Chemistry, 59, 8609-8615.
- 3. Valko, M., Izakovic, M., Mazur, M., Rhodes, C.J. and Telser, J. (2004) Role of oxygen radicals in DNA damage and cancer incidence. Molecular and Cellular Biochemistry, 266, 37-56.
- 4. Bailly, C. (2004) Active oxygen species and antioxidants in seed biology. Seed Science Research, 14, 93-107.
- 5. Bhattacharjee, S. (2005) Reactive oxygen species and oxidative burst: Roles in stress, senescence and signal transduction in plants. Current Science, 89, 1113-1121.
- 6. Wojtovich, A.P. and Foster, T.H. (2014) Optogenetic control of ROS production. Redox Biology, 2, 368-376.
- 7. Saeidnia, S. and Abdollahi, M. (2013) Antioxidants: Friends or foe in prevention or treatment of cancer: The debate of the century. Toxicology and Applied Pharmacology, 271, 49-63.
- 8. Mostafalou, S. and Abdollahi, M. (2012) Current concerns on genotoxicity of pesticides. International Journal of Pharmacology, 8, 473-474.
- 9. Kou, X., Chen, Q., Li, X., Li, M.F., Kan, C., Chen, B.R., et al. (2015) Quantitative assessment of bioactive compounds and the antioxidant activity of 15 jujube cultivars. Food Chemistry, 173, 1037-1044.
- 10. Pandey, K.B. and Rizvi, S.L. (2009) Plant polyphenols as dietary antioxidants in human health and disease. Oxidative Medicine and Cellular Longevity, 2, 270-278.
- 11. Leopoldini, M., Russo, N. and Toscano, M. (2011) The molecular basis of working mechanism of natural polyphenolic antioxidants. Food Chemistry, 125, 288-306.
- 12. Namal Senanayake, S.P.J. (2013) Green tea extract: Chemistry, antioxidant properties and food applications—A review. Journal of Functional Foods, 5, 1529-1541.
- 13. Maqsood, S., Benjakul, S., Abushelaibi, A. and Alam, A. (2014) Phenolic compounds and plant phenolic extracts as natural antioxidants in prevention of lipid oxidation in seafood: A detailed review. Comprehensive Reviews in Food Science and Food Safety, 13, 1125-1140.
- 14. White, P., Oliveira, R., Oliveira, A., et al. (2014) Antioxidant activity and mechanisms of action of natural compounds isolated from lichens: A systematic review. Molecules, 19, 14496-14527.
- 15. Falowo, A.B., Fayemi, P.O. and Muchenje, V. (2014) Natural antioxidants against lipid-protein oxidative deterioration in meat and meat products: A review. Food Research International, 64, 171-181.
- 16. Rietjens, I.M.C.M., Koeman, J.H., Boersma, M.G., et al. (2002) The pro-oxidant chemistry of the natural antioxidants vitamin C, vitamin E, carotenoids and flavonoids. Environmental Toxicology and Pharmacology, 11, 321-333.
- 17. Bandera, E.V., Freudenheim, J.L., Marshall, J.R., Zielezny, M., Priore, R.L., Brasure, J., et al. (1997) Diet and alcohol consumption and lung cancer risk in the New York State Cohort (United States). Cancer Causes & Control, 8, 828- 840.
- 18. Dachs, G.U., Munn, D.G., Carr, A.C., Vissers, M.C. and Robinson, B.A. (2014) Consumption of vitamin C is below recommended daily intake in many cancer patients and healthy volunteers in Christchurch. The New Zealand Medical Journal, 127, 73-76.
- 19. Padayatty, S.J., Sun, H., Wang, Y., et al. (2004) Vitamin C pharmacokinetics: Implications for oral and intravenous use. Annals of Internal Medicine, 140, 533-537.
- 20. Paul, B.N., Sarkar, S. and Mohanty, S.N. (2004) Dietary vitamin E requirement of mrigal, Cirrhinus mrigala fry. Aquaculture, 242, 529-536.
- 21. Cuce, G., Çetinkaya, S., Koc, T., et al. (2015) Chemoprotective effect of vitamin E in cyclophosphamide-induced hepatotoxicity in rats. Chemico-Biological Interactions, 232, 7-11.
- 22. Tesoriere, L., D’Arpa, D., Maggio, A., Giaccone, V., Pedone, E. and Livrea, M.A. (1998) Oxidation resis-tance of LDL is correlated with vitamin E status in β-thalassemia intermedia. Atherosclerosis, 137, 429-435.
- 23. de Waart, F.G., Moser, U. and Kok, F.J. (1997) Vitamin E supplementation in elderly lowers the oxidation rate of linoleic acid in LDL. Atherosclerosis, 133, 255-263.
- 24. Saremi, A. and Arora, R. (2010) Vitamin E and cardiovascular disease. American Journal of Therapeutics, 17, e56- e65.
- 25. El-Shenawy, N.S., Al-Harbi, M.S. and Hamza, R.Z. (2015) Effect of vitamin E and selenium separately and in combination on biochemical, immunological and histological changes induced by sodium azide in male mice. Experimental and Toxicologic Pathology, 67, 65-76.
- 26. Lippman, S.M., Klein, E.A., Goodman, P.J., et al. (2009) Effect of selenium and vitamin E on risk of prostate cancer and other cancers the selenium and vitamin E cancer prevention trial (SELECT). JAMA—Journal of the American Medical Association, 301, 39-51.
- 27. Klein Jr., E.A., Thompson, I.M., Tangen, C.M., et al. (2011) Vitamin E and the risk of prostate cancer the selenium and vitamin E cancer prevention trial (SELECT). JAMA-Journal of the American Medical Association, 306, 1549-1556.
- 28. Choo, Y.M., Yap, S.C., Ooi, C.K., Ma, A.N., Goh, S.H. and Ong, A.S.H. (1996) Recovered oil from palm-pressed fiber: A good source of natural carotenoids, vitamin E, and sterols. Journal of the American Oil Chemists’ Society, 73, 599-602.
- 29. Wolf, G. (1992) Retinoids and carotenoids as inhibitors of carcinogenesis and induces of cell-cell communication. Nutrition Reviews, 50, 270-274.
- 30. Bolhassani, A., Khavari, A. and Bathaie, S.Z. (2014) Saffron and natural carotenoids: Biochemical activities and anti- tumor effects. Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 1845, 20-30.
- 31. Hernández-Ortega, M., Ortiz-Moreno, A., Hernández-Navarro, M.D., et al. (2012) Antioxidant, antinociceptive, and anti-inflammatory effects of carotenoids extracted from dried pepper (Capsicum annuum L.). Journal of Biomedicine and Biotechnology, 2012, Article ID: 524019.
- 32. Molnár, P., Deli, J., Tanaka, T., Kann, Y., Tani, S., Gyémánt, N., et al. (2009) Carotenoids with anti-Helicobacter pylori activity from Golden delicious apple. Phytotherapy Research, 24, 644-648.
- 33. Tanaka, T., Shnimizu, M. and Moriwaki, H. (2012) Cancer chemoprevention by carotenoids. Molecules, 17, 3202- 3242.
- 34. Cao, K., Zheng, A., Xu, J., Li, H., Liu, J., Peng, Y., et al. (2014) AMPK activation prevents prenatal stress-induced cognitive impairment: Modulation of mitochondrial content and oxidative stress. Free Radical Biology and Medicine, 75, 156-166.
- 35. Sun, L., Luo, C. and Liu, J. (2014) Hydroxytyrosol induces apoptosis in human colon cancer cells through ROS generation. Food & Function, 5, 1909-1914.
- 36. Wang, B., Sun, J., Ma, Y., Wu, G.R., Tian, Y.J., Shi, Y.H. and Le, G.W. (2014) Resveratrol preserves mitochondrial function, stimulates mitochondrial biogenesis, and attenuates oxidative stress in regulatory T cells of mice fed a high- fat diet. Journal of Food Science, 79, H1823-H1831.
- 37. Dreosti, I.E. (2000) Antioxidant polyphenols in tea, cocoa, and wine. Nutrition, 16, 692-694.
- 38. Shi, L., Liu, Y., Tan, D., Yan, T.C., Song, D.Q., Hou, M.X. and Meng, X.J. (2014) Blueberry anthocyanins ameliorate cyclophosphamide-induced liver damage in rats by reducing inflammation and apoptosis. Journal of Functional Foods, 11, 71-81.
- 39. Bhullar, K.S. and Rupasinghe, H.P.V. (2015) Antioxidant and cytoprotective properties of partridgeberry polyphenols. Food Chemistry, 168, 595-605.
- 40. Roginsky, V., Barsukova, T., Hsu, C.F. and Kilmartin, P.A. (2003) Chain-breaking antioxidant activity and cyclic voltammetry characterization of polyphenols in a range of green, oolong, and black teas. Journal of Agricultural and Food Chemistry, 51, 5798-5802.
- 41. Wu, Y.X. and Andreas, V.T. (2002) Impact of fungicides on active oxygen species and antioxidant enzymes in spring barley (Hordeum vulgare L.) exposed to ozone. Environmental Pollution, 116, 37-47.
- 42. Leopoldini, M., Marino, T., Russo, N. and Toscano, M. (2004) Density functional computations of the energetic and spectroscopic parameters of quercetin and its radicals in the gas phase and in solvent. Theoretical Chemistry Accounts: Theory, Computation, and Modeling, 111, 210-216.
- 43. Leopoldini, M., Russo, N., Chiodo, S. and Toscano, M. (2006) Iron chelation by the powerful antioxidant flavonoid quercetin. Journal of Agricultural and Food Chemistry, 54, 6343-6351.
- 44. Hotta, H., Sakamoto, H., Nagano, S., Osakai, T. and Tsujino, Y. (2001) Unusually large numbers of electrons for the oxidation of polyphenolic antioxidants. Biochimica et Biophysica Acta, 1526, 159-167.
- 45. Pastor, N., Weinstein, H., Jamison, E. and Brenowitz, M. (2000) A detailed interpretation of OH radical footprints in a TBP-DNA complex reveals the role of dynamics in the mechanism of sequence-specific binding. Journal of Molecular Biology, 304, 55-68.
- 46. Huang, D., Ou, B. and Prior, R.L. (2005) The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry, 53, 1841-1856.
- 47. Prior, R.L., Wu, X. and Schaich, K. (2005) Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry, 53, 4290-4302.
- 48. Amadou, I., Le, G., Amza, T., Sun, J. and Shi, Y.H. (2013) Purification and characterization of foxtail millet-derived peptides with antioxidant and antimicrobial activities. Food Research International, 51, 422-428.
- 49. Milella, L., Bader, A., De Tommasi, N., Russo, D. and Braca, A. (2014) Antioxidant and free radical-scavenging activity of constituents from two Scorzonera species. Food Chemistry, 160, 298-304.
- 50. Smolskaitė, L., Venskutonis, P.R. and Talou, T. (2015) Comprehensive evaluation of antioxidant and antimicrobial properties of different mushroom species. LWT-Food Science and Technology, 60, 462-471.
- 51. Ikawa, M., Schaper, T.D., Dollard, C.A. and Sasner, J.J. (2003) Utilization of Folin-Ciocalteu phenol reagent for the detection of certain nitrogen compounds. Journal of Agricultural and Food Chemistry, 51, 1811-1815.
- 52. Lee, E.J., Nomura, N., Patil, B.S. and Yoo, K.S. (2014) Measurement of total phenolic content in wine using an automatic Folin-Ciocalteu assay method. International Journal of Food Science & Technology, 49, 2364-2372.
- 53. Rover, M.R. and Brown, R.C. (2013) Quantification of total phenols in bio-oil using the Folin-Ciocalteu method. Journal of Analytical and Applied Pyrolysis, 104, 366-371.
- 54. Sun, L., Gao, W., Zhang, M., Li, C., Wang, A.G., Su, Y.L. and Ji, T.F. (2014) Composition and antioxidant activity of the anthocyanins of the fruit of Berberis heteropoda schrenk. Molecules, 19, 19078-19096.
- 55. Ilaiyaraja, N., Likhith, K.R., Sharath Babu, G.R. and Khanum, F. (2015) Optimisation of extraction of bioactive compounds from Feronia limonia (wood apple) fruit using response surface methodology (RSM). Food Chemistry, 173, 348-354.
- 56. Benzie, I.F.F. and Strain, J.J. (1996) The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay. Analytical Biochemistry, 239, 70-76.
- 57. Naguib, Y.M.A. (2000) A fluorometric method for measurement of oxygen radical-scavenging activity of water-soluble antioxidants. Analytical Biochemistry, 284, 93-98.
- 58. Ou, B., Hampsch-Woodill, M. and Prior, R.L. (2001) Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. Journal of Agricultural and Food Chemistry, 49, 4619-4626.
- 59. Atala, E., Aspée, A., Speisky, H., Lissi, E. and López-Alarcón, C. (2013) Antioxidant capacity of phenolic compounds in acidic medium: A pyrogallol red-based ORAC (oxygen radical absorbance capacity) assay. Journal of Food Composition and Analysis, 32, 116-125.
- 60. Roginsky, V. and Lissi, E. (2005) Review of methods to determine chain-breaking antioxidant activity in food. Food Chemistry, 92, 235-254.
- 61. Amarowicz, R., Pegg, R.B., Rahimi-Moghaddam, P., Barl, B. and Weil, J.A. (2004) Free-radical scavenging capacity and antioxidant activity of selected plant species from the Canadian prairies. Food Chemistry, 84, 551-562.
- 62. Di Majo, D., La Guardia, M., Giammanco, S., La Neve, L. and Giammanco, M. (2008) The antioxidant capacity of red wine in relationship with its polyphenolic constituents. Food Chemistry, 111, 45-49.
- 63. Seljeskog, E., Hervig, T. and Mansoor, M.A. (2006) A novel HPLC method for the measurement of thiobarbituric acid reactive substances (TBARS). A comparison with a commercially available kit. Clinical Biochemistry, 39, 947-954.
- 64. Rebolledo, A.E.D., Pastor, F.M., Santos, M.R.F., et al. (2009) Comparison of the TBARS assay and BODIPY C11 probes for assessing lipid peroxidation in red deer spermatozoa. Reproduction in Domestic Animinals, 45, 360-368.
- 65. Fernandes, A.S., Gaspar, J., Cabral, M.F., Caneiras, C., Guedes, R., Rueff, J., et al. (2007) Macrocyclic copper(II) complexes: Superoxide scavenging activity, structural studies and cytotoxicity evaluation. Journal of Inorganic Biochemistry, 101, 849-858.
- 66. Skandrani, I., Bouhlel, I., Limem, I., Boubaker, J., Bhouri, W., Neffati, A., et al. (2009) Moricandia arvensis extracts protect against DNA damage, mutagenesis in bacteria system and scavenge the superoxide anion. Toxicology in Vitro, 23, 166-175.
- 67. Fernandes, D.C., Wosniak, J., Pescatore, L.A., et al. (2006) Analysis of DHE-derived oxidation products by HPLC in the assessment of superoxide production and NADPH oxidase activity in vascular systems. American Journal of Physiology: Cell Physiology, 292, C413-C422.
- 68. Ackermann, K. and Angus, S.D. (2014) A resource efficient big data analysis method for the social sciences: The case of global IP activity. Procedia Computer Science, 29, 2360-2369.
- 69. Gieni, R.S., Li, Y. and Hayglass, K.T. (1995) Comparison of [3H]thymidine incorporation with MTT- and MTS-based bioassays for human and murine IL-2 and IL-4 analysis tetrazolium assays provide markedly enhanced sensitivity. Journal of Immunological Methods, 187, 85-93.
- 70. Fernandez-Sanchez, M., Del, C.A., Salido, G.M. and González, A. (2009) Ethanol exerts dual effects on calcium homeostasis in CCK-8-stimulated mouse pancreatic acinar cells. BMC Cell Biology, 10, 77.
- 71. Wang, L., Sun, J., Horvat, M., Koutalistras, N., Johnston, B. and Ross Sheil, A.G. (1996) Evaluation of MTS, XTT, MTT and 3HTdR incorporation for assessing hepatocyte density, viability and proliferation. Methods in Cell Science, 18, 249-255.
- 72. Goodwin, C.J., Holt, S.J., Downes, S. and Marshal, N.J. (1995) Microculture tetrazolium assays: A comparison between two new tetrazolium salts, XTT and MTS. Journal of Immunological Methods, 179, 95-103.
- 73. Ngamwongsatit, P., Banada, P.P., Panbangred, W., et al. (2008) WST-1-based cell cytotoxicity assay as a substitute for MTT-based assay for rapid detection of toxigenic Bacillus species using CHO cell line. Journal of Microbiological Methods, 73, 211-215.
- 74. Tan, A.S. and Berridge, M.V. (2000) Superoxide produced by activated neutrophils efficiently reduces the tetrazolium salt, WST-1 to produce a soluble formazan: A simple colorimetric assay for measuring respiratory burst activation and for screening anti-inflammatory agents. Journal of Immunological Methods, 238, 59-68.
- 75. Chaieb, K., Zmantar, T., Souiden, Y., Mahdouani, K. and Bakhrouf, A. (2011) XTT assay for evaluating the effect of alcohols, hydrogen peroxide and benzalkonium chloride on bio film formation of Staphylococcus epidermidis. Microbial Pathogenesis, 50, 1-5.
- 76. Arockiaraj, J., Palanisamy, R., Bhatt, P., et al. (2014) A novel murrel Channa striatus mitochondrial manganese superoxide dismutase: Gene silencing, SOD activity, superoxide anion production and expression. Fish Physiology and Biochemistry, 40, 1937-1955.
- 77. Mendoza-Núñez, V.M., Hernández-Monjaraz, B., Santiago-Osorio, E., et al. (2014) Tai Chi exercise increases SOD activity and total antioxidant status in saliva and is linked to an improvement of periodontal disease in the elderly. Oxidative Medicine and Cellular Longevity, 2014, Article ID: 603853.
- 78. Orbea, A., Ortiz-Zarragoitia, M., Sole, M., Porte, C. and Cajaraville, M.P. (2002) Antioxidant enzymes and peroxisome proliferation in relation to contaminant body burdens of PAHs and PCBs in bivalve molluscs, crabs and fish from the Urdaibai and Plentzia estuaries (Bay of Biscay). Aquatic Toxicology, 58, 75-98.
- 79. Janknegt, P.J., Rijstenbil, J.W., van de Poll, W.H., et al. (2007) A comparison of quantitative and qualitative superoxide dismutase assays for application to low temperature microalgae. Journal of Photochemistry and Photobiology B: Biology, 87, 218-226.
- 80. Cohen, G., Kim, M. and Ogwu, V. (1996) A modified catalase assay suitable for a plate reader and for the analysis of brain cell cultures. Journal of Neuroscience Methods, 67, 53-56.
- 81. Ukeda, H., Adachi, Y. and Sawamura, M. (2004) Flow-injection assay of catalase activity. Analytical Sciences, 20, 471-474.
- 82. Özyürek, M., Baki, S., Güngör, N., Esin Çelik, S., Güçlü, K. and Apak, R. (2012) Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta, 750, 173-181.
- 83. Yu, S., Yin, Y., Zhu, J., et al. (2010) A modulatory bifunctional artificial enzyme with both SOD and GPx activities based on a smart star-shaped pseudo-block copolymer. Soft Matter, 6, 5342-5350.
- 84. Foyer, C.H. and Halliwell, B. (1976) The Presence of glutathione and glutathione reductase in chloroplasts: A proposed role in ascorbic-acid metabolism. Planta, 133, 21-25.
- 85. Norman, H.A. and Pillai, P. (1996) High-performance liquid chromatographic resolution of NADP+ after induction of fluorescence and its application to assay for an NADPH-dependent enzyme: Application to the determination of glutathione reductase activity in plant leaf extracts. Analytical Biochemistry, 237, 30-36.
- 86. Sinaei, M. and Rahmanpour, S. (2013) Evaluation of glutathione S-transferase activity as a biomarker of PAH pollution in mudskipper, Boleophthalmus dussumieri, Persian Gulf. Bulletin of Environmental Contamination and Toxicology, 90, 369-374.
- 87. Zhang, Y.P., Song, D.N., Wu, H.H., et al. (2014) Effect of dietary cadmium on the activity of glutathione S-transferase and carboxylesterase in different developmental stages of the Oxya chinensis (Orthoptera: Acridoidea). Environmental Entomology, 43, 171-177.
- 88. Ivan, A.L.M., Campanini, M.Z., Martinez, R.M., et al. (2014) Pyrrolidine dithiocarbamate inhibits UVB-induced skin inflammation and oxidative stress in hairless mice and exhibits antioxidant activity in vitro. Journal of Photochemistry and Photobiology B: Biology, 138, 124-133.
- 89. Piao, M.J., Kang, K.A., Kim, K.C., et al. (2013) Diphlorethohydroxycarmalol attenuated cell damage against UVB radiation via enhancing antioxidant effects and absorbing UVB ray in human HaCaT keratinocytes. Environmental Toxicology and Pharmacology, 36, 680-688.
- 90. Liu, J., Hou, C., Lee, S., Chuang, Y. and Lin, C.C. (2011) Antioxidant effects and UVB protective activity of Spirulina (Arthrospira platensis) products fermented with lactic acid bacteria. Process Biochemistry, 46, 1405-1410.
- 91. Salucci, S., Burattini, S., Curzi, D., et al. (2014) Antioxidants in the prevention of UVB-induced keratynocyte apoptosis. Journal of Photochemistry and Photobiology B: Biology, 141, 1-9.
- 92. Silva, M.A., Trevisan, G., Hoffmeister, C., et al. (2014) Anti-inflammatory and antioxidant effects of Aloe saponaria Haw in a model of UVB-induced paw sunburn in rats. Journal of Photochemistry and Photobiology B: Biology, 133, 47-54.
- 93. Biasibetti, M., Rojas, D.B., Hentschke, V.S., et al. (2014) The influence of low-level laser therapy on parameters of oxidative stress and DNA damage on muscle and plasma in rats with heart failure. Lasers in Medical Science, 29, 1895-1906.
- 94. Sheweita, S.A., Abd, E.M. and Bastawy, M. (2001) Carbon tetrachloride-induced changes in the activity of phase II drug-metabolizing enzyme in the liver of male rats: Role of antioxidants. Toxicology, 165, 217-224.
- 95. Celik, I., Tuluce, Y. and Turker, M. (2006) Antioxidant and immune potential marker enzymes assessment in the various tissues of rats exposed to indoleacetic acid and kinetin: A drinking water study. Pesticide Biochemistry and Physiology, 86, 180-185.
- 96. Celik, I., Turker, M. and Tuluce, Y. (2007) Abcisic acid and gibberellic acid cause increased lipid peroxidation and fluctuated antioxidant defense systems of various tissues in rats. Journal of Hazardous Materials, 148, 623-629.
- 97. Kazeem, M.I., Akanji, M.A., Yakubu, M.T. and Tom Ashafa, A.O. (2013) Protective effect of free and bound polyphenol extracts from ginger (Zingiber officinale Roscoe) on the hepatic antioxidant and some carbohydrate metabolizing enzymes of streptozotocin-induced diabetic rats. Evidence-Based Complementary and Alternative Medicine, 2013, Article ID: 935486.
- 98. Shanmugam, K.R., Mallikarjuna, K., Nishanth, K., Kuo, C.H. and Reddy, K.S. (2011) Protective effect of dietary ginger on antioxidant enzymes and oxidative damage in experimental diabetic rat tissues. Food Chemistry, 124, 1436- 1442.
- 99. Li, Z.L., Mo, L., Le, G. and Shi, Y. (2014) Oxidized casein impairs antioxidant defense system and induces hepatic and renal injury in mice. Food and Chemical Toxicology, 64, 86-93.
- 100. Psotova, J., Vecera, R., Zdarilova, A., et al. (2006) Safety assessment of sanguiritrin, alkaloid fraction of Macleaya cordata, in rats. Veterinarni Medicina-Czech, 51, 145-155.
- 101. Diaz-Araya, G., Godoy, L., Naranjo, L., Squella, A., Letelier, M.E. and Núñez-Vergara, L.J. (1998) Antioxidant effects of 1, 4-dihydropyridine and nitroso aryl derivatives on the Fe3+/ascorbate-stimulated lipid peroxidation in rat brain slices. General Pharmacology, 31, 385-391.