Hans Journal of Medicinal Chemistry
Vol.
09
No.
04
(
2021
), Article ID:
46778
,
8
pages
10.12677/HJMCe.2021.94019
4-硫-5-氯尿苷的合成及最优条件探索
干苗苗1,张杨1,郭天宇1,梁露1,包颖1,张晓辉2,闫德峰1*
1新疆医科大学厚博学院,新疆 克拉玛依
2大连大学环境与化学工程学院,辽宁 大连
收稿日期:2021年11月1日;录用日期:2021年11月17日;发布日期:2021年11月29日

摘要
核苷类似物在抗肿瘤活性方面应用极大,为获得具有潜在抗肿瘤活性药物4-硫-5-氯尿苷,以尿苷为原料,经乙酰化、氯代、硫代、脱乙酰化等步骤首次合成4-硫-5-氯尿苷,并探索了反应过程中温度、剂量、时间对产品收率的影响,并使用1H-NMR及13C-NMR对所得产品的结构进行了表征。
关键词
4-硫-5-氯尿苷,抗肿瘤,有机合成,硫代反应

Synthesis and Optimum Conditions of 4-Thio-5-Chlorouridine
Miaomiao Gan1, Yang Zhang1, Tianyu Guo1, Lu Liang1, Ying Bao1, Xiaohui Zhang2, Defeng Yan1*
1Houbo College of Xinjiang Medical University, Karamay Xinjiang
2College of Environment and Chemical Engineering, Dalian University, Dalian Liaoning
Received: Nov. 1st, 2021; accepted: Nov. 17th, 2021; published: Nov. 29th, 2021

ABSTRACT
Nucleoside analogues are widely used in antitumor activity. In order to obtain 4-thio-5-chlorouridine with potential antitumor activity, 4-thio-5-chlorouridine was synthesized from Uridine by acetylation, chlorination, thiolation and deacetylation for the first time. The effect of temperature, dose and time on the yield of the product was explored, and the structure of the product was characterized by 1H-NMR and 13C-NMR.
Keywords:4-Thio-5-Chlorouridine, Antitumor, Organic Synthesis, Thio Reaction

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 研究背景
1.1. 核苷类似物在抗肿瘤方面的应用
在日常生活中,癌症让所有人胆战心惊。根据世界卫生组织国际癌症研究机构(IARC)统计,2020年,全世界新增癌症病例1929万例,死亡病例996万例。而我国的情况也不容乐观:2020年新增癌症病例457万例,死亡病例300万例,占全球发病率的23.7% [1]。恶性肿瘤已成为本世纪人类的第一杀手,对人类生存构成了严重的威胁,也对人类的生活造成了巨大的负担 [2]。
恶性肿瘤的预防和治疗是医学领域防治的主题。抗肿瘤药物最显著的特征是种类繁多,在作用机制及临床应用中具有很强的针对性和差异性。大多数抗肿瘤药的作用机制是阻止脱氧核糖核酸(DNA)、核糖核酸(RNA)或蛋白质的合成,或直接作用于大分子,从而抑制肿瘤细胞的分裂和增殖,使之死亡 [3]。随着科研人员对核苷类药物抗肿瘤作用机理研究的不断深入,其研究也取得了巨大进展 [4]。
核苷是一类特别重要的生物大分子,由于其结构和核酸构成相似,在抗癌新药的研究中显示出巨大的优势,特别是碱基的结构,对核苷酸类似物的生物活性起着决定性的作用,通过修饰嘧啶而得到的核苷酸类似物,其主要作用机制是通过特异性干扰DNA在肿瘤细胞中的合成、影响RNA的转录过程或者蛋白质合成,或作用于生物大分子,然后遏制肿瘤细胞的生长,使之死亡 [4] [5] [6]。
美国药理学家Gertrude Belle Elion合成了抗疱疹病毒药物–阿昔洛韦(Aciclovir),在1988年得到了诺贝尔生理学奖和医学奖。被很多知名的相关研究人员所关注,经过持续不断地深入研究,发现了十分多的修饰后的核苷类似药物。比如说,司他夫定(D4T)与恩曲他滨(NRTIs)等药物 [7]。
1.2. 5-取代核苷类似物的研究
在核苷衍生物的生物活性中,5-取代胸苷类似物已被广泛应用于临床作为抗肿瘤和抗病毒药物,例如5-碘脱氧尿苷(IdU)、5-溴脱氧尿苷(BrdU)和5-氟脱氧尿苷(FdU) [8]。研究表明,在尿嘧啶碱基5-位上引入吸电子基团、强极性基团或不饱和基团且这些基团与碱基杂环共轭时,所得衍生物往往具有较好的生物活性 [9]。5位可作为引入官能团的理想修饰位点,通过不同官能团取代后,可能具有抗肿瘤和抗病毒活性 [10] [11] [12]。
调查显示,在美国国家癌症中心所准许的抗癌先导化合物中,有五分之一的分子包含Cl、Br和I,通过对嘧啶环、嘌呤环和核糖的修饰,卤素使核酸衍生物表现出更强的抗病毒、抗代谢作用,抗菌等特性,这表明卤素在药物研发中起着重要的作用 [13]。
如5-碘-2'-脱氧尿苷(碘苷),从1962年开始就用于牛痘病毒、单纯疱疹病毒的治疗 [14]。还有一线抗癌药物5-氟尿嘧啶(Fluorouracil, 5-FU),已经作为抗肿瘤代谢药物广泛用于临床,常用于治疗肝癌,头颈部癌症、结肠癌等。
Federico等以NIS (N-碘代琥珀酰亚胺)为碘化试剂,在DMF (N,N-二甲基甲酰胺)中微波加热3分钟,完成对嘧啶环5位的碘代反应。Ganguly等采用NBS (N-溴代琥珀酰亚胺)作为溴代试剂,在n-Bu4NBr (TBAB,四丁基溴化铵)中微波加热4分钟,完成了对嘧啶环5位的溴代反应,产率达到90%以上 [15]。
1.3. 研究意义
当今世界,肿瘤是一种难以治疗的疾病。在抗癌药的市场中,核苷类药物占有不小的比重并且发挥着非常重要的作用,并且发展迅速。而由核苷类药物衍生出的类似物也被证实具有很大的抗肿瘤潜力。但近些年来,核苷类药物仍旧存有大量的问题,如不良反应多、代谢快等。因此,扩展研究核苷类似物具有重要意义。
基于硫代碱基的特点,徐耀忠与Peter Kann博士提出了“近紫外光/4-硫胸苷(UVA/Thiothymidine)光动力疗法” [16],可定向的杀死肿瘤细胞,对非肿瘤细胞的伤害轻微,缓解了肿瘤患者在治疗中的疼痛,为恶性肿瘤的治疗提供了一个新的方法 [17]。有研究显示:4-硫-5-碘脱氧尿苷345 nm处有最大吸收并且可以消灭口腔癌细胞;同样4-硫-5-溴脱氧尿苷在340 nm处有最大吸收并且可以消灭肺癌细胞。有研究成果显示在4位和5位都有取代的5-取代胸苷类似物,能够进入到细胞的DNA中,使细胞对近紫外光敏感然后死亡。此重大发现阐明了其余的双修饰核苷(如5-取代-4-硫胸苷类似物)可能会具有进入细胞的本领,让细胞更加容易受到近紫外光伤害致死 [18]。
本文探索4-硫-5-氯尿苷的合成方法,为此类化合物的合成提供了一种简便易行的方法。对于开发多功能新药具有一定的理论意义及潜在的研究价值,为抗肿瘤药物的研究奠定一定的理论基础。
2. 研究内容与方法
2.1. 实验仪器与试剂
Table 1. Experimental instruments
表1. 实验仪器
Table 2. Experimental reagents
表2. 实验试剂
2.2. 实验路线的设计
在设计合成4-硫-5-氯尿苷路线时,硫代步骤尤为重要,该步骤往往产率较低,反应条件较苛刻,也是整个反应的重点和难点,因此分别使用五硫化二磷和劳森试剂作为硫代试剂。探索劳森试剂的最优反应条件(反应温度,试剂使用量以及反应时间),并对比在其最优条件下的反应产率,设计路线如下图1所示。
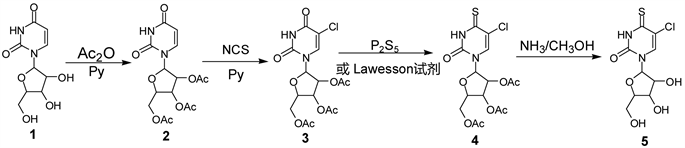
Figure 1. Synthesis route of 4-thio-5-chlorouridine
图1. 4-硫-5-氯尿苷的合成路线
2.3. 具体合成步骤
2.3.1. 2',3',5'-O-三乙酰基尿苷的合成
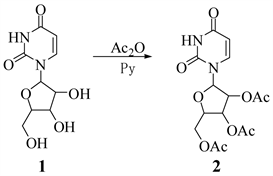
Figure 2. Synthesis of 2',3',5'-O-three acetyl uridine
图2. 2',3',5'-O-三乙酰基尿苷的合成
将尿苷(1) (2.00 g, 8.20 mmol),溶于30 mL的无水吡啶中,搅拌使其充分溶解,加入乙酸酐(6.0 mL, 64 mmol),0℃冰浴条件下持续搅拌,通过TLC监测反应情况。约5 h,原料点消失。证明反应完全,减压75℃条件下蒸出溶剂(可用甲苯共沸带出吡啶)。取出粘稠状液体,使用无水乙醇重结晶,放入冰箱过夜,有大量白色晶体析出,抽滤干燥后得到大量白色固体,即2',3',5'-O-三乙酰基尿苷(2) 2.79 g,收率为92% (路线如图2所示)。
m. p. 126℃~129℃. 1HNMR (500 MHz, DMSO-d6) δ 11.48 (s, 1H, -NH), 7.72 (d, J = 8.0 Hz, 1H, 6-H), 5.89 (d, J = 4.9 Hz, 1H, 1'-H), 5.73 (d, J = 7.9 Hz, 1H, 5-H), 5.45 (t, J = 5.5 Hz, 1H, 2'-H), 5.32 (t, J = 5.5 Hz, 1H, 3'-H), 4.25 (m, 3H, 4'-H, 5'-H), 2.07 (d, J = 12.7 Hz, 9H, 3 × -CH3).
2.3.2. 5-氯-2′,3′,5′-O-三乙酰基尿苷的合成
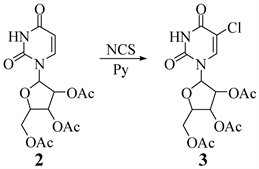
Figure 3. The synthesis of chlorine-2',3',5'-O-three acetyl uridine
图3. 5-氯-2',3',5'-O-三乙酰基尿苷的合成
将2',3',5'-O-三乙酰基尿苷(2) (1.00 g, 2.70 mmol),溶于40 mL的无水吡啶中,加热至85℃,搅拌使其充分溶解,随后加入NCS (0.55 g, 4.12 mmol),通过TLC监测反应情况。约2 h原料点消失,证明反应完全。减压75℃条件下蒸出溶剂(可用甲苯带出吡啶)。粗产品进行柱分离(PE:EA = 4:1; 3:1),再用无水乙醇和石油醚混合重结晶,抽滤干燥后得固体5-氯-2',3',5'-O-三乙酰基尿苷(3) 0.83 g,收率为76% (路线如图3所示)。
m. p. 50℃~52℃. 1HNMR (500 MHz, DMSO-d6) δ 12.02 (s, 1H, -NH), 8.16 (s, 1H, 6-H), 5.89 (d, J = 4.7 Hz, 1H, 1'-H), 5.48 (t, J = 5.4 Hz, 1H, 2'-H), 5.35 (d, J = 5.1 Hz, 1H, 3'-H), 4.35 (d, J = 8.8 Hz, 1H, 4'-H), 4.25 (m, 2H, 5'-H, 5'-H), 2.07 (d, J = 3.9 Hz, 9H, 3 × -CH3).
2.3.3. 4-硫-5-氯-2',3',5'-O-三乙酰基尿苷的合成
方法一:五硫化二磷法

Figure 4. The synthesis of 4-thio-5-chlorine-2',3',5'-O-three acetyl uridine (Route of P2S5)
图4. 4-硫-5-氯-2',3',5'-O-三乙酰基尿苷的合成(五硫化二磷法)
取5-氯-2',3',5'-O-三乙酰基尿苷(3) (1.05 g, 2.60 mmol)放入三口烧瓶中,加入无水1,4-二氧六环55 mL至全部溶解,加入五硫化二磷(1.13 g, 5.09 mmol),升温至105℃,通过TLC监测反应情况,6 h反应完全,冷却过滤蒸干溶剂,柱分离(PE:EA = 4:1; 3:1; 2:1)得到黄色固体4-硫-5-氯-2',3',5'-O-三乙酰基尿苷(4) 0.47 g,收率为43% (路线如图4所示)。
方法二:劳森试剂法
首先,筛选劳森试剂反应的最优条件,参考五硫化二磷反应条件再将其扩大范围,反应温度设计为85℃、90℃、95℃、100℃、105℃、110℃,反应底物与试剂用量的比值设计为1:0.5、1:1、1:1.5、1:2,反应时间设计为2 h、3 h、3.5 h、4 h、5 h、6 h。具体实验过程如下:
取5-氯-2',3',5'-O-三乙酰基尿苷(3) (1.05 g, 2.60 mmol)放入三口烧瓶中,加入无水1,4-二氧六环55 mL至全部溶解,加入劳森试剂(1.10 g, 2.73 mmol),升温至95℃,通过TLC监测反应情况,柱分离(PE:EA = 3:1)得到黄色固体4-硫-5-氯-2',3',5'-O-三乙酰基尿苷(4) (路线如图5所示)。

Figure 5. The synthesis of 4-thio-5-chlorine-2',3',5'-O-three acetyl Uridine (Route of Lawesson reagent)
图5. 4-硫-5-氯-2',3',5'-O-三乙酰基尿苷的合成(劳森试剂法)
m. p. 48℃~50℃. 1HNMR (500 MHz, DMSO-d6) δ 13.16 (s, 1H, NH), 8.28 (s, 1H, 6-H), 5.85 (d, 1H, J = 5.86 Hz, 1'-H), 5.48 (s, 1H, J = 5.53 Hz, 2'-H), 5.35 (t, 1H, 3'-H), 4.35 (m, 3H, 4'-H, 5'-H), 2.06 (m, 9H, 3 × -CH3).
2.4. 4-硫-5-氯尿苷的合成
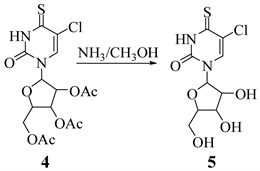
Figure 6. The synthesis of 4-thio-5-chlorine uridine
图6. 4-硫-5-氯尿苷的合成
取黄色固体4-硫-5-氯-2',3',5'-O-三乙酰基尿苷(4) (0.50 g, 1.19 mmol),用饱和氨气甲醇溶液100 mL,室温搅拌至完全溶解。通过TLC监测反应情况,约6 h停止反应。减压条件下除去溶剂,柱分离(CHCl2:CH3OH = 20:1),得到黄色固体4-硫-5-氯尿苷(5) 0.16 g,收率为46% (路线如图6所示)。
m. p.54℃~57℃。
1HNMR (500 MHz, DMSO-d6) δ 13.12 (s, 1H, -NH), 8.57 (s, 1H, 6-H), 5.68 (d, J = 3.2 Hz, 1H, 1'-H), 5.52 (d, J = 5.0 Hz, 1H, 2'-OH), 5.35 (t, J = 4.3 Hz, 1H, 3'-OH), 5.08 (d, J = 5.9 Hz, 1H, 5'-OH), 4.08 (m, 1H, 2'-H), 4.01 (d, J = 5.1 Hz, 1H, 3'-H), 3.89 (d, J = 2.8 Hz, 1H, 4'-H), 3.74 (m, 1H, 5'-H), 3.60 (m, 1H, 5'-H).
13CNMR (125 MHz, DMSO-d6) δ 185.36 (4-C), 147.07(2-C), 134.71 (6-C), 116.81 (5-C), 89.36 (1'-C), 84.57 (4'-C), 74.13 (2'-C), 68.72 (3'-C), 59.63 (5'-C).
3. 结果与讨论
通过两种不同的方法成功合成了4-硫-5-氯尿苷及3种最终硫代产物,并通过实验发现劳森试剂法的最优反应条件是:温度95℃,与底物的比值为1:1,反应时间3.5 h (具体数据见下表3~5)。与五硫化二磷法比较,其具有反应条件温和、时间更短,收率更高的特点。最终产物通过1HNMR和13CNMR进行了表征。这将有利于该类化合物作为药物的前期研究提供了方向和理论基础。
Table 3. The relation between the temperature and the reaction yield of Lawesson reagent in the synthesis of 4-thio-5-chlorine uridine
表3. 劳森试剂法在4-硫-5-氯尿苷的合成中反应温度与收率的关系
Table 4. The relation between the quantity and the reaction yield of Lawesson reagent in the synthesis of 4-thio-5-chlorine uridine
表4. 劳森试剂法在4-硫-5-氯尿苷的合成中试剂量与收率的关系
Table 5. The relation between the time and the reaction yield of Lawesson reagent in the synthesis of 4-thio-5-chlorine uridine
表5. 劳森试剂法在4-硫-5-氯尿苷的合成中反应时间与收率的关系
基金项目
克拉玛依市创新环境建设(创新人才)项目(2020CXRC0061)资助。
文章引用
干苗苗,张 杨,郭天宇,梁 露,包 颖,张晓辉,闫德峰. 4-硫-5-氯尿苷的合成及最优条件探索
Synthesis and Optimum Conditions of 4-Thio-5-Chlorouridine[J]. 药物化学, 2021, 09(04): 154-161. https://doi.org/10.12677/HJMCe.2021.94019
参考文献
- 1. 于千舒. 谈癌不色变透视我国抗肿瘤药物现状[N]. 中国医药报, 2021-05-12(002).
- 2. 刘宗超, 李哲轩, 张阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-14.
- 3. 刘洋, 李明花, 邢向红. 核苷类抗肿瘤药物研究进展[J]. 中国新药杂志, 2012, 21(21): 2493-2498.
- 4. 李伟, 秦汤, 温新民. 具有抗肿瘤活性核苷类似物研究进展[J]. 济宁医学院学报, 2016, 39(1): 53-57.
- 5. 蒋革, 罗锋, 徐耀忠, 等. 近紫外光辅助4-硫脱氧胸苷抗癌作用的研究[J]. 化学进展, 2016, 28(8): 1224-1237.
- 6. 张志广. 微波辅助核苷及其衍生物的快速绿色合成[D]: [硕士学位论文]. 新乡: 河南师范大学, 2007.
- 7. 葛晓斌, 张晓辉. 核苷类及5'位磷酸酯修饰药物的研究进展[J]. 大连大学学报, 2018, 39(6): 28-34.
- 8. 闫德峰, 赫玲爽, 马克东, 等. 4-硫胸苷的合成新方法[J]. 合成化学研究, 2016, 36(12): 2989-2996.
- 9. 张新迎, 王洋洋, 冯东, 等. 5-取代嘧啶核苷类似物的设计、合成及生物活性研究进展[J]. 有机化学, 2010, 30(6): 797-808.
- 10. Romeo, R., Giofrè, S.V., Iaria, D., et al. (2011) Syn-thesis of 5-Alkynyl Isoxazolidinyl Nucleosides. European Journal of Organic Chemistry, 2011, 5690-5695. https://doi.org/10.1002/ejoc.201100767
- 11. Agrofoglio, L.A., Gillaizeau, I. and Saito, Y. (2003) Palladi-um-Assisted Routes to Nucleosides. Chemical Reviews, 103, 1875-1916. https://doi.org/10.1021/cr010374q
- 12. Pawar, M., et al. (2013) Heavy Atom Containing Fluorescent Ribonucleo-side Analog Probe for the Fluorescence Detection of RNA-Ligand Binding. Bioconjugate Chemistry, 24, 1367-1377. https://doi.org/10.1021/bc400194g
- 13. 陈行, 刘春冬, 王建华. 卤素对核酸类药物的修饰与影响研究进展[J]. 应用化学, 2018, 35(5): 491-499.
- 14. 渠桂荣, 张志广, 夏然, 等. 微波辅助下5-碘尿嘧啶衍生物的绿色合成[J]. 河南师范大学学报(自然科学版), 2007, 35(2): 101-103.
- 15. 夏然. 微波辅助下碱基修饰合成核苷类化合物的研究[D]: [硕士学位论文]. 新乡: 河南师范大学, 2008.
- 16. Massey, A., Xu, Y.Z. and Karran, P. (2002) Ambiguous Coding Is Required for the Lethal Interaction between Methylated DNA Bases and DNA Mismatch Repair. DNA Repair, 12, 275-286. https://doi.org/10.1016/S1568-7864(02)00004-6
- 17. 句媛, 李德鹏. 5-(2-溴乙烯基)-4-硫代尿苷合成工艺的改进[J]. 大连大学学报, 2018, 39(6): 24-27+57.
- 18. 王健, 郑学仿, 曹洪玉, 等. 4-硫-5-碘尿苷的合成及其与人血清白蛋白间的相互作用[J]. 发光学报, 2013, 34(3): 361-368.
NOTES
*通讯作者。
