Studies in Synthetic Chemistry
Vol.03 No.02(2015), Article ID:15874,7 pages
10.12677/SSC.2015.32006
Study on the Process of Epoxidation of Liquid Propylene by Reaction-Controlled Phase Transfer Catalyst
Fangfang Huang1, Yonghong Qi1, Hanxi Shen1, Shuang Gao2, Ligang Shi1, Yanni Jing1
1Shaanxi Key Laboratory of Oil Fine Chemicals, Shaanxi Research Design Institute of Petroleum and Chemical Industry, Xi’an Shaanxi
2Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian Liaoning
Email: hff520703@126.com
Received: Jul. 27th, 2015; accepted: Aug. 11th, 2015; published: Aug. 17th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
When using aqueous hydrogen peroxide as oxidant, the process of the reaction of
the liquid propylene epoxidation by reaction-controlled phase transfer catalyst
was studied in the organic solvent including reaction-controlled phase transfer
catalyst and H2O2; the effects of reaction temperature, the
ratio of raw materials, reaction time and H2O2 concentration
on the epoxidation were investigated. Under the reaction condition, the stability
of H2O2 and the phase transformation of the catalyst were
also researched. On the basis, the reaction kinetics was explored preliminarily.
The results showed that the reaction rate increased with increasing temperature;
the optimal reaction temperature was 60˚C considering the factor of H2O2
decomposition; the reaction time can be controlled at about 100 min; the mole rate
of raw material (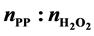 (mole))
was 3:1; the catalytic activity was closely related to its phase transition; when
the dosage of catalyst was 0.3%, the concentration of H2O 2
in 1.8 - 2.2 mmol/g was appropriate. The reaction rate equation was established
according to the reaction equilibrium. The order and the rate constant of reaction
of epoxy propane were calculated using the MATLAB program.
(mole))
was 3:1; the catalytic activity was closely related to its phase transition; when
the dosage of catalyst was 0.3%, the concentration of H2O 2
in 1.8 - 2.2 mmol/g was appropriate. The reaction rate equation was established
according to the reaction equilibrium. The order and the rate constant of reaction
of epoxy propane were calculated using the MATLAB program.
Keywords:Reaction-Controlled Phase-Transfer Catalysis, Propylene, Epoxidation, Propylene Oxide, Reaction Kinetics

反应控制相转移催化液相丙烯环氧化 工艺研究
黄方方1,齐永红1,沈寒晰1,高爽2,史李刚1,景艳妮1
1陕西省石油化工研究设计院,陕西省石油精细化学品重点实验室,陕西 西安
2中国科学院大连化学物理研究所,辽宁 大连
Email: hff520703@126.com
收稿日期:2015年7月27日;录用日期:2015年8月11日;发布日期:2015年8月17日

摘 要
在含有反应控制相转移催化剂及H2O2的均相有机体系中,以H2O2为氧源,研究反应控制相转移催化液体丙烯(PP)环氧化制备环氧丙烷(PO)的反应过程,考察了反应温度、反应时间、原料配比、H2O2浓度对反应的影响;并进行了反应条件下H2O2的稳定性考察及反应过程中催化剂相变规律的探讨,在此基础上初步进行反应动力学探索。结果表明:反应速率随温度的升高而增加,但综合考虑H2O2的分解因素,以60℃为最佳,反应时间控制在100
min左右为宜,最佳原料配比( (摩尔比))为3:1,催化剂的催化性能与其相变状况密切相关,催化剂加量为0.3%时,H2O2浓度以1.8~2.2 mmol/g为宜;根据反应平衡建立了反应动力学速率方程,并通过matlab编程,确定了丙烯环氧化反应的反应级数及速率常数。
(摩尔比))为3:1,催化剂的催化性能与其相变状况密切相关,催化剂加量为0.3%时,H2O2浓度以1.8~2.2 mmol/g为宜;根据反应平衡建立了反应动力学速率方程,并通过matlab编程,确定了丙烯环氧化反应的反应级数及速率常数。
关键词 :反应控制相转移催化,丙烯,环氧化,环氧丙烷,反应动力学

1. 引言
环氧丙烷(PO)是重要的大宗化学中间体之一,在丙烯衍生物中,环氧丙烷消费量仅次于聚丙烯和丙烯腈。近年来,以H2O2为氧源,进行烯烃环氧化绿色合成为一项新兴清洁生产技术,与传统的氯醇法、共氧化法工艺技术相比,过氧化氢直接氧化技术在经济、环境以及未来发展等方面具有独特的竞争优势,因此,该工艺在今后一段时期,将成为新建PO装置主要采用的生产工艺,该工艺具有代表性的催化剂主要有TS-1及磷钨杂多酸季铵盐反应控制相转移催化剂。
1983年,意大利的Taramasso等[1] 首次报道合成了钛硅分子筛(TS-1),TS-1催化H2O2一步氧化丙烯制环氧丙烷是其重要的反应。其优势在于过程简单、环境友好,反应可在较低的温度下进行,其选择性高,但该反应为一复杂反应过程,丙烯环氧化生成的环氧丙烷会进一步与溶剂甲醇反应生成副产物;奚祖威等[2] -[6] 将反应控制相转移催化剂与蒽醌法生产H2O2工艺相耦合催化氧化丙烯生产PO,为绿色生产PO提供了一种崭新的工艺技术和研究思路。
本文以磷钨杂多酸季铵盐为催化剂,液相丙烯为原料,在自行设计的可视环氧化装置上进行丙烯环氧化反应,考察催化剂的相变规律及其它影响反应的因素,并进行动力学研究,深入了解反应进程,可望在后期的连续化工业放大中有一定帮助。
2. 实验部分
2.1. 原料及仪器
催化剂由中国科学院大连化学物理研究所0806项目组提供。
丙烯环氧化实验在带有磁力搅拌的50 mL可视环氧化反应装置中进行,环氧化反应产物采用Agilent7890型气相色谱仪进行分析,HP-1 (30 m × 0.320 mm × 0.25 µm)毛细管柱,FID检测器,环庚烷作内标物;H2O2含量采用碘量法进行测定。
2.2. 实验方法
均相含H2O2及催化剂有机体系的制备:在一定量配比的复合有机溶剂中,加入0.3%的催化剂[7] 和一定量的50%双氧水,进行减压蒸馏,除去其中的水,由于催化剂载氧后可溶于体系中,使三相转变为一相。
环氧化实验:将上述制备好的有机体系加入反应釜,安装好反应釜开始加热,并打开搅拌,等反应釜中的温度达到设定值(40℃~70℃)时,采用计量泵将液体丙烯连续通人反应体系中(保持反应釜压力为4.2~4.6 MPa),开始记录反应时间,反应结束后取样分析。
2.3. 分析方法
反应前后双氧水浓度用间接碘量法测定;有机组分采用Agilent7890型气相色谱仪分析,进样口汽化室温度250℃;载气(高纯N2)流量0.8 ml/min,FID检测器温度为250℃,柱温采用程序升温:起始温度为40℃,保持5 min,然后以升温速率20℃/min升温至180℃,保持5 min,尾吹气(N2)流量20 mL/min,分流比100:1,进样量0.2 µL。
3. 结果与讨论
预试验产物经气相色谱(GC)分析后,发现产物中除了目标产物环氧丙烷(PO)以外,还有少量丙二醇生成,同时,在对试验数据进行物料衡算的过程中,发现H2O2的进入量大于生成的PO和丙二醇所需的H2O2量,H2O2除了生成目的产物PO及副产物丙二醇以外,还存在部分分解。
由上述分析可知,在丙烯环氧化过程中除主反应以外,还存在PO水解反应及H2O2分解反应,其反应为:

3.1. H2O2在有机体系中稳定性考察首先,将制备好的含H2O2及催化剂均相有机体系进行稳定性考察,即在不同温度水浴中放置,考察不同时间下H2O2的分解情况,初步确定环氧化反应的温度范围。如图1所示:通过实验,我们发现,本有机体系在40℃水浴中放置3 h时H2O2分解率只有0.32%,说明此H2O2有机体系稳定性较好;而升高
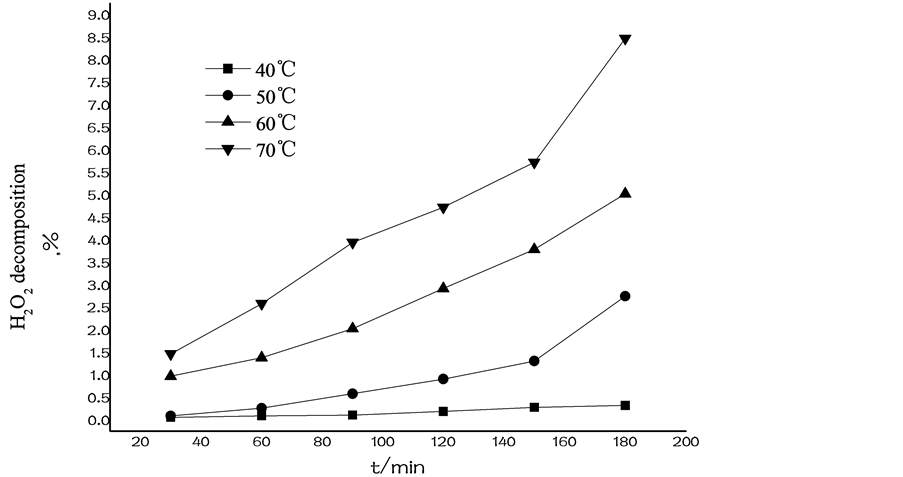
Figure 1. The stability of the homogeneous organic system with catalyst and H2O2 under different temperature
图1. 不同温度下含H2O2及催化剂均相有机体系的稳定性
温度后,分解率逐渐增大,70℃ 3 h时H2O2分解率高达8.47%,以反应时间2 h为例,反应温度应小于70℃为宜。
3.2. 反应温度及时间对主反应的影响
采用N2建压,控制反应釜压力在4.2~4.6 MPa (即保持丙烯为液态)下,在一定浓度的H2O2有机均相体系中,计量加入液体丙烯,分别在不同温度下,测得PO产率随时间变化的规律。具体结果如图2所示;由图可知:40℃~50℃,随着反应时间的增加,PO产率逐渐增大,4 h的最大产率为72.1%,而当温度升高至60℃~70℃时,反应速率加剧,90 min可达90%以上,考虑H2O2的分解因素,反应适宜温度为60℃。
3.3. 原料配比对反应的影响
在相同溶剂体系中,相同H2O2浓度及其他同等反应条件下,考察了不同原料配(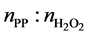 )对反应的影响,结果如图3和图4所示:随着原料配比的增加,PO的产率及选择性先增大后减小的趋势,这可能与含H2O2溶剂体系容纳丙烯的量有关,到一定程度为一极值,再增大对反应本身不利,且随着配比的增加,催化剂的析出时间变短,说明丙烯的增加会提高反应速率。
)对反应的影响,结果如图3和图4所示:随着原料配比的增加,PO的产率及选择性先增大后减小的趋势,这可能与含H2O2溶剂体系容纳丙烯的量有关,到一定程度为一极值,再增大对反应本身不利,且随着配比的增加,催化剂的析出时间变短,说明丙烯的增加会提高反应速率。
3.4. H2O2在有机体系中浓度对反应的影响
H2O2有机均相体系的制备也是重要的一个环节,因为脱水的过程其实也是催化剂载氧的过程,实验中发现,当H2O2小于1.6 mmol/g时,催化剂溶解不完全,而当H2O2浓度过大时,制备过程H2O2损失过大。所以我们考察了H2O2为1.4~3.0 mmol/g时环氧化实验情况。如图5所示,随着浓度的增加,PO的产率和选择性出现先增大后减小的趋势,说明:在同一催化剂含量的H2O2有机体系中,催化剂的量与H2O2的量也有对应关系,实验中还发现,H2O2浓度增大到一定程度导致催化剂无相变,而且严重影响产品的转化率,这可能与相平衡有关,也有可能催化剂的含量与H2O2浓度有一定的制约关系,具体原因在以后的工作中再深入分析;所以在0.3%催化剂含量情况下,H2O2浓度的适宜范围为1.8~2.2 mmol/g。

Figure 2. The influence of reaction temperature and time on the yield of PO
图2. 反应温度及时间对PO产率的影响

Figure 3. Effect of raw material ratio on the reaction
图3. 原料配比对反应的影响

Figure 4. Changes in catalyst precipitation time with raw material ratio
图4. 催化剂析出时间随原料配比的变化

Figure 5. Effect of H2O2 concentration on the reaction
图5. H2O2浓度对反应的影响
4. 反应动力学
在控制反应温度小于60℃时,时间1 h时的分解率小于2%,可保证PO产率在93%以上,所以对反应而言,在不考虑双氧水分解的情况下,且经气相分析可知副产物丙二醇的量很少,只有0.2%~0.4%,所以该条件下反应可近视认为只有一步环氧化反应:
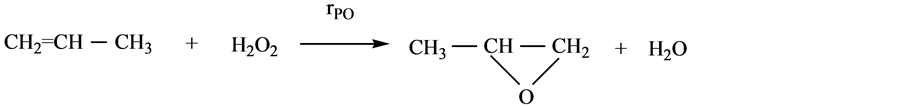
其反应动力学方程为:
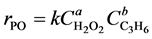
在反应过程中,丙烯保持液相,压力恒定4.6 MPa,且丙烯过量,因此,可近似认为丙烯在体系中的浓度相对恒定,动力学方程可简化为:
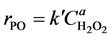
根据H2O2浓度随时间的变化规律(见图6),利用非线性差分的方法,得到各实验点的反应速率,最后用最小二乘法线性回归,本文调用Matlab中提供的内部功能函数,用微分法处理动力学数据确定反应级数和计算速率常数[8] 。
程序清单:
>> edit t.m
edit c.m
load t.m
load c.m
d=(max(t)-min(t))/10000
X=min(t):d:max(t);
Y=interp1(t,c,X,'pchip');
v=diff(Y)./diff(X);
log(-v);
m=length(Y)-1;
logc=log(Y(1:m));
nk=polyfit(logc,log(-v),1);
n=nk(1);
k=exp(nk(2));
n
k
经运行程序后计算结果如下:
d = 3.0000e−004
n = 1.4506
k = 0.3753
因而;针对该反应条件下,可认为环氧丙烷生成反应速率方程为:
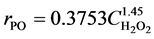
5. 结论
1) 以H2O2为氧源、反应控制相转移催化剂的有机均相体系中,采用液态丙烯为原料,在可视环氧化高压装置中制备环氧丙烷,催化剂加量0.3%时,对反应温度、反应时间、原料配比、H2O2浓度进行了考察;反应随温度的升高反应速率增加,但综合考虑H2O2的分解因素,可认为反应温度60℃为最佳,反应时间可控制在100
min左右为宜,最佳原料配比为: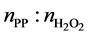 (摩尔比) = 3:1,H2O2浓度以1.8~2.2 mmol/g为宜;
(摩尔比) = 3:1,H2O2浓度以1.8~2.2 mmol/g为宜;
2) 在实验基础上进行了丙烯环氧化反应的动力学研究,利用matlab编程,确定出环氧丙烷生成反应的速率方程。

Figure 6. Change curve of H2O2 concentration on the time
图6. H2O2浓度随时间的变化曲线
基金项目
延长石油集团项目:科技计划类(批准号:ycsy2012ky-A-18)。
文章引用
黄方方,齐永红,沈寒晰,高 爽,史李刚,景艳妮, (2015) 反应控制相转移催化液相丙烯环氧化工艺研究
Study on the Process of Epoxidation of Liquid Propylene by Reaction-Controlled Phase
Transfer Catalyst. 合成化学研究,02,35-42. doi: 10.12677/SSC.2015.32006
参考文献 (References)
- 1. Taramasso, M., Perego, G. and Notari, B. (l983) Preparation of porous crystaiiine synthetic materiais comprised of siiicon and titanium oxides. USP: 44l050l.
- 2. Xi, Z.W., Zhou, N., Sun, Y. and Li, K.L. (2001) Reaction-controlled phase-transfer catalysis for propylene epoxidation to propylene oxide. Science, 292, 1139.
- 3. Sun, Y., Xi, Z.W. and Cao, G.Y. (2001) Epoxidation of olefins catalyzed by [π-C5H5NC16H33]3[PW4O16] with molecular oxygen and a recyclable reductant 2-ethylanthrahydroquinone. Journal of Molecular Catalysis A, 166, 219. http://dx.doi.org/10.1016/S1381-1169(00)00416-7
- 4. Zhou, N., Xi, Z.W., Cao, G.Y. and Gao, S. (2003) Epoxidation of propylene by using [π-C5H5NC16H33]3[PW4O16] as catalyst and with hydrogen peroxide generated by 2-ethylanthrahydroquinone and molecular oxygen. Applied Catalysis A, 250, 239. http://dx.doi.org/10.1016/S0926-860X(03)00310-7
- 5. Li, J., Gao, S., Li, M., Zhang, R.H. and Xi, Z.W. (2004) Influence of composition of heteropolyphosphatotungstate catalyst on epoxidation of propylene. Journal of Molecular Catalysis A, 218, 247. http://dx.doi.org/10.1016/j.molcata.2004.04.024
- 6. Gao, J.B., Chen, Y.Y., Han, B., Feng, Z.C., Li, C., Zhou, N., Gao, S. and Xi, Z.W. (2004) A spectroscopic study on the reaction-controlled phase transfer catalyst in the epoxidation of cyclohexene. Journal of Molecular Catalysis A, 210, 197.
- 7. 张恒耘, 吕迎, 李军, 高爽, 奚祖威 (2010) 反应控制相转移催化原位过氧化氢环氧化丙烯反应. 催化学报, 10, 1253-1256.
- 8. 曾建强, 董家新, 沈星灿, 闭献树 (2013) Matlab在微分法求反应级数和速率常数中的应用. 广州化工, 5, 24-25.