Studies in Synthetic Chemistry
Vol.
08
No.
01
(
2020
), Article ID:
34864
,
9
pages
10.12677/SSC.2020.81004
Phosphite Catalyzed Aza-Baylis-Hillman Reaction of Imines and Methyl Acrylates
Jun Jia1, Qibo Yao2, Jingchao Tao2, Xingwang Wang3*
1Analysis and Testing Center, Soochow University, Suzhou Jiangsu
2College of Chemistry, Zhengzhou University, Zhengzhou Henan
3College of Chemistry, Chemical Engineering and Materials Science, Soochow University, Suzhou Jiangsu

Received: Mar. 9th, 2020; accepted: Mar. 24th, 2020; published: Mar. 31st, 2020

ABSTRACT
The aza-Bayllis-Hillman reactions of imines and methyl acrylate catalyzed by achiral phosphite were studied. The reaction conditions, such as solvent, temperature, concentration, catalysts, and substrates were screened. The target products of α-methylene-b-sulfonamido acrylates were obtained with 25% - 78% yield.
Keywords:aza-Bayllis-Hillman Reaction, Phosphite, Imine, Methyl Acrylates, α-Methylene-b-Sulfonamido Acrylates

亚磷酸酯催化的亚胺与丙烯酸甲酯的氮杂Baylis-Hillman反应研究
贾 俊1,姚其波2,陶京朝2,王兴旺3*
1苏州大学,分析测试中心,江苏 苏州
2郑州大学,化学学院,河南 郑州
3苏州大学,材料与化学化工学部,江苏 苏州

收稿日期:2020年3月9日;录用日期:2020年3月24日;发布日期:2020年3月31日

摘 要
本文以一系列亚磷酸酯为催化剂,对催化芳香醛亚胺与丙烯酸甲酯的氮杂Baylis-Hillman反应进行了系统研究。经过对该反应的溶剂、反应温度、底物浓度、催化剂进行了筛选和优化,我们发现亚磷酸二乙酯和1,4-二氮杂二环[2.2.2]辛烷(DABCO)能有效催化该反应。最后对一系列底物进行测试,所有反应能以中等到良好的收率得到α-亚甲基β-磺酰胺基丙烯酸酯产物。
关键词 :氮杂Baylis-Hillman反应,亚磷酸酯,亚胺,丙烯酸甲酯,α-亚甲基β-磺酰胺基丙烯酸酯

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
尽管有机催化的概念诞生于一百多年前,但是直到本世纪初有机催化才焕发出勃勃生机,新理论、新方法、新试剂、新反应层出不穷。其中布朗斯特酸作为有机催化剂广泛应用于有机合成反应,并成为有机催化研究的热门研究领域 [1] [2] [3],所用到的布朗斯特酸包括有机膦酸 [4] [5] 、有机羧酸 [6] 、有机磺酸 [7] [8] 、有机硼酸 [9] [10] [11] 等。Brønsted酸能够催化多种有机反应,例如:加成反应、环化反应、Aldol反应、Mannich反应等等 [12] [13] [14]。
氮杂Baylis-Hillman合成反应是构建α,β-不饱和多官能团化合物的重要方法 [15] [16] [17]。氮杂Baylis-Hillman反应的产物还可以直接转化为各类β-氨基酸、β-氨基醇类化合物 [18] [19],也可以经过一步或多步反应转化为各类杂环类化合物,如内酰胺、吡咯、吡啶、喹啉、异喹啉、吲哚、嘧啶、尿嘧啶、嘧啶酮等各类具有生物活性的杂环化合物 [20] [21]。氮杂Baylis-Hillman反应具有下面几种优势:第一,反应高效,该反应具有原子经济特性,原料能实现100%利用率。第二,该反应可以将多种原料以“一锅煮”的方法进行,也可以分步式发生反应。第三,反应底物适用范围非常广泛,且底物价廉易得。第四,反应操作简单,反应条件温和。第五,所获得的产物容易进行官能团转化。第六,反应产物及其衍生物在社会各方面都有广泛的应用价值。因此,研究氮杂Baylis-Hillman反应不仅具有理论研究意义,而且具有非常好的应用前景。
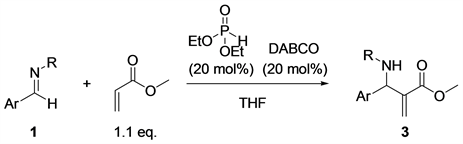
亚胺与α,β-不饱和羰基化合物的氮杂Baylis-Hillman反应,通常是在叔膦和叔胺催化剂作用下进行的,但是该类反应的反应活性不高。如果在该反应体系中加入一些路易斯酸,如:三氯化铝、四氯化钛、三氟磺酸铁及稀土金属路易斯酸,或者加入一些布朗斯特酸催化剂,反应活性均可以明显提高很多。由于亚磷酸酯廉价易得,取代基可以多种多样,我们的目标是通过加入催化量的亚磷酸酯来促进叔胺催化的芳香醛亚胺与丙烯酸甲酯的氮杂Baylis-Hillman反应。
2. 实验部分
2.1. 仪器与试剂
所有合成的化合物均经核磁共振氢谱和碳谱确定,CDCl3或者d6-DMSO为溶剂,所用核磁共振谱仪为美国Varian公司的UNITY INOVA 400型400 MHz核磁共振谱仪或者Varian公司的NMRststem型300 MHz核磁共振谱仪上测定;所合成化合物的质谱是使用美国Varian公司的Saturan2200型离子阱质量检测器LC-MS或者英国Micromass公司的TOF-MS型EI电离源高分辨质谱仪上测定。利用标准的Schlenk 技术完成对湿气敏感的实验,在氮气氛围中操作完成。液体试剂如TMEDA、二氯甲烷、丙酮、乙醚、N,N-二甲基甲酰胺、甲苯、四氢呋喃等经过标准纯化后使用。
2.2. 实验方法
在Schlenk管中依次加入亚胺(0.386 mmol)、丙烯酸甲酯2 (38.48 µl, 0.4246 mmol, 1.1 equiv)、亚磷酸二乙酯(10.66 mg, 0.0772 mmol, 20 mol%)溶解于2 mL THF中,在室温下搅拌20分钟后,加入DABCO (8.66 mg, 0.0772 mmol, 20 mol%), 然后在70℃加热48小时,经波板层析检测,直到完全反应。然后将反应液转移至单口烧瓶中,用乙酸乙酯洗涤反应瓶,合并有机相,减压下除去有机相,反应混合物用硅胶柱色谱提纯,流动相为石油醚比乙酸乙酯5:1,得最终产物为白色固体。
3. 结果与讨论
3.1. 反应条件的优化与筛选
3.1.1. 溶剂的筛选
我们首先合成了芳胺和对甲苯磺酰胺与芳香醛形成的醛亚胺,然后合成了一系列丙烯酸酯类化合物。然后将这些底物应用于氮杂Baylis-Hillman反应(图1),对一系列条件进行了筛选。
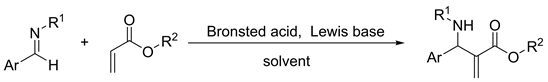
Figure 1. The aza-Bayllis-Hillman reaction
图1. 氮杂Baylis-Hillman反应
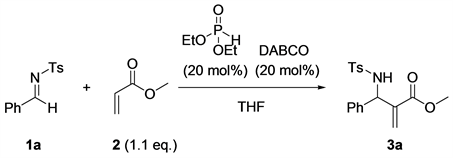
首先,我们对反应媒介进行了筛选,以乙醇为溶剂室温下进行反应,我们发现反应体系为非透明的。然后我们将该反应体系加热至50℃反应,我们发现反应体系变为均相体系。经过反应媒介的筛选,我们发现50℃反应条件下反应48小时,以乙醇、甲苯、二氯甲烷作为反应溶剂时,反应的产率都很不理想,产率都不超过10% (Entry 1~3,表1);当以乙二醇二甲醚和1,4-二氧六环作为反应溶剂时,反应产率分别为16%和22% (Entry 4和5,表1)。当以乙酸乙酯作为反应溶剂时,反应的产率为30% (Entry 6,表1)。总的来看,当反应以乙醚和四氢呋喃作为反应溶剂时,反应产率比较令人满意,当乙醚作为反应溶剂时,反应产率结果为50% (Entry 2,表1),而四氢呋喃作为反应溶剂时,分离产率能达到65% (Entry 8,表1),反应的产率最高,所以四氢呋喃作为该反应最好的溶剂进行下一步筛选。
3.1.2. 浓度和温度的选择
接下来以THF作为反应溶剂,对该反应的底物浓度和反应温度变化进行了筛选(表2)。考察该反应依次升高温度对反应的影响。当反应温度为20℃、40℃、60℃时,该模板反应的产率分别为19%、28%、47%。由此可见,随着反应温度的依次升高,反应的产率会逐渐递增(Entry 1~3,表2)。当反应的温度继续升高到70℃时,该反应的产率最高达到73% (Entry 4,表2)。然后我们考察了反应体系的浓度对反该应的影响,在反应温度为60℃的条件下,反应体系浓度为0.13 mol/L时,反应的产率为67% (Entry 5,表2)。当把反应体系的浓度增加为0.39 mol/L时,反应的分离产率仅有55% (Entry 6,表2)。因此,该反应体系的最佳反应条件为浓度0.2 mol/L,反应温度70℃,反应的产率最高为74% (Entry 4,表2)。
Table 1. Screening of different solvents on the reactiona
表1. 筛选不同溶剂对反应的影响a

a亚胺1a (0.386 mmol)、丙烯酸甲酯2 (0.4246 mmol, 1.1 equiv)、亚磷酸二乙酯(0.0772 mmol, 20 mol%)、DABCO (0.0772 mmol, 20 mol%),在2 mL溶剂中,50℃条件下反应48 h。b分离收率。
Table 2. Screening of different temperature and concentration on the reactiona
表2. 筛选不同的反应温度和浓度对反应的影响a
a反应条件:亚胺1a (0.386 mmol)、丙烯酸甲酯2 (0.4246 mmol, 1.1 equiv)、亚磷酸二乙酯(0.0772 mmol, 20 mol%)、DABCO (0.0772 mol, 20 mol%),在2 mL THF中反应48 h。b分离收率。c加入3 mL THF。d加入1 mL THF。
3.1.3. 催化剂的筛选
由于该反应的催化体系为布朗斯特酸和路易斯碱共催化剂体系,两种催化剂用量的比例将对反应有很大的影响,下面对它们的用量和比例分别进一步考察。
1) Brønsted酸的筛选
我们仍然以丙烯酸甲酯和对甲苯磺酰基保护的芳香醛亚胺进行的氮Baylis-Hillman反应为模板反应。我们固定20 mol%用量的1,4-二氮杂二环[2.2.2]辛烷(DABCO)作为路易斯碱催化剂,首先筛选了一些亚磷酸酯以及对甲苯磺酸对反应的影响。当不加入任何布朗斯特酸时,以四氢呋喃为溶剂,反应48小时,氮杂Baylis-Hillman反应的产物的收率仅有8% (Entry 1,表3)。当用20 mol%的亚磷酸二甲酯、亚磷酸二乙酯、亚磷酸二异丙酯、亚磷酸二苯酯催化相应的反应时,反应的产率分别为41%、74%、38%、46% (Entry 2~5,表3)。但是20 mol%的二苯基氧化膦和磷酸二苯酯被分别用作催化剂催化该反应时,反应产率分别为72%和69% (Entry 6~7,表3)。最后,我们尝试用对20 mol%的甲苯磺酸催化该反应时,仅为20%的产率被得到(Entry 8,表3)。综合考虑催化剂的成本和催化活性,亚磷酸二乙酯仍然是最佳的Brønsted酸催化剂。
Table 3. Screening of different Brønsted acids on the reactiona
表3. 筛选不同的布朗斯特酸对反应的影响a
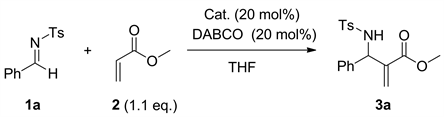
a反应条件:亚胺1a (0.386 mmol)、丙烯酸甲酯2 (0.4246 mmol, 1.1 equi.)、Brønsted酸(0.0772 mmol, 20 mol%)、DABCO (0.0772 mol, 20 mol%),在2 mL THF中70℃条件下反应48 h。b分离收率。
2) Lewis碱的筛选
然后我们固定20 mol%亚磷酸二乙酯作为布朗斯特酸催化剂,然后考察DBU、PPh3、NEt3几种常见的亲核性的路易斯碱对催化反应的影响。结果我们观察到,对于该反应,DBU、PPh3、NEt3均无催化效果(Entry 2~4,表4)。
Table 4. Screening of different Lewis bases on the reactiona
表4. 筛选不同的路易斯碱对反应的影响a

a反应条件:亚胺1a (0.386 mmol)、丙烯酸甲酯2 (0.4246 mmol, 1.1 equiv)、Lewis碱(0.0772 mmol, 20 mol %)、DABCO (0.0772 mmol, 20 mol%)、THF (2 mL) 70℃条件下反应48 h。b分离收率。
3) 酸和碱的比例
接下来我们对布朗斯特酸和路易斯碱的用量关系进行了考察,总体上来看,路易斯碱和布朗斯特酸催化剂的用量越大,反应产率逐渐升高。以四氢呋喃为媒介、反应温度为70℃条件下,仅加入1,4-二氮杂二环[2.2.2]辛烷(DABCO)催化剂或者亚磷酸二乙酯催化剂时,反应几乎不发生(Entry 1~2,表5)。当加入DABCO和亚磷酸二乙酯的用量的分别为10 mol%、 20% mol和30 mol%时,该反应的产率分别为30%、74%和73% (Entry 3~5,表5)。当固定亚磷酸二乙酯的量为20 mol%,DABCO的量从10 mol%增加到30 mol%时,产物的产率由40%增加到70% (Entry 6~7,表5);同样,当用量为30 mol%的亚磷酸二乙酯被固定,催化剂1,4-二氮杂二环[2.2.2]辛烷(DABCO)的用量从10 mol%增加到20 mol%时,产物的收率由45%增加到67% (Entry 8~9,表5)。最终我们确定布朗斯特酸和路易斯碱的用量比为1:1,两种催化剂用量均为20 mol%。
3.1.4. 底物的拓展
确定了最优化的反应条件后,我们开始拓展反应底物,研究底物的普适性。首先我们研究了亚胺1中芳香醛上的取代基对反应的影响,当亚胺1b和1c芳香醛部分的苯环的对位引入氟原子和溴原子时,反应的产率分别为78%和57% (Entry 2~3,表6)。当亚胺1d芳香醛部分的苯环对位为甲氧基取代基时,反应产率降低为47% (Entry 4,表6);当亚胺1e芳香醛部分为1-萘基时,产率降低至25% (Entry 5,表6);当我们使用亚胺1f和1g氮原子的取代基为苯基(Ph)和对甲氧基苯基(PMP)时,反应不发生(Entry 6~7,表6)。通过分析实验结果我们可以看到,当苯环上带有吸电子基团时有利于反应的进行。这是因为1,4-二氮杂二环[2.2.2]辛烷(DABCO)作为亲核试剂进攻丙烯酸甲酯,发生Michael加成反应,形成烯醇负离子,随后烯醇负离子对亚胺加成。因此,当亚胺芳香醛基部分带有吸电子基团时,提高了亚胺碳氮双键的正电性,有利于反应的发生。但是,当亚胺芳香醛基部分位阻太大时,就烯阻碍了醇负离子的进攻,产率也会下降。
Table 5. Screening the ratio of Brønsted acid and Lewis base on the reaction a
表5. 布朗斯特酸和路易斯碱比例的筛选a

a反应条件:亚胺1a (0.386 mmol)、丙烯酸甲酯2 (0.4246 mmol, 1.1 equiv)、亚磷酸二乙酯、DABCO、THF (2 ml),70℃条件下反应48 h。b分离收率。
Table 6. Substrate scopea
表6. 反应底物的筛选a
a反应条件:亚胺1a-1g (0.386 mmol)、丙烯酸甲酯2 (0.4246 mmol, 1.1 equiv)、亚磷酸二乙酯(0.0772 mmol, 20 mol%)、DABCO (0.0772 mmol, 20 mol%)、THF (2 ml),70℃条件下反应48 h。b分离收率。
4. 结论
我们报道了以芳香醛亚胺与丙烯酸甲酯为反应底物,以亚磷酸酯和1,4-二氮杂二环[2.2.2]辛烷(DABCO)为共催化剂体系的氮杂Baylis-Hillman反应。在优化的反应条件下,反应能以中等到良好的收率得到α-亚甲基β-磺酰胺基丙烯酸酯产物。该反应操作简便、反应条件温和,溶剂和反应过程都不需要严格的无水无氧。产物为多官能团烯烃化合物,是天然产物、药物和精细化工非常重要的中间体。另外,该亚磷酸酯/1,4-二氮杂二环[2.2.2]辛烷(DABCO)共催化剂体系为进一步设计手性亚磷酸酯催化的不对称氮杂Baylis-Hillman反应奠定了坚实的基础。
基金项目
国家自然科学基金资助项目(21572150)。
文章引用
贾 俊,姚其波,陶京朝,王兴旺. 亚磷酸酯催化的亚胺与丙烯酸甲酯的氮杂Baylis-Hillman反应研究
Phosphite Catalyzed Aza-Baylis-Hillman Reaction of Imines and Methyl Acrylates[J]. 合成化学研究, 2020, 08(01): 33-41. https://doi.org/10.12677/SSC.2020.81004
参考文献
- 1. Maguire, O.R. and O’donoghue, A.C. (2016) Homogeneous Acid Catalysis in Nonasymmetric Synthesis. RSC Green Chemistry Series (Sustainable Catalysis, Part 1), 40, 38-64. https://doi.org/10.1039/9781782622093-00038
- 2. Yamamoto, H. (2013) Acid Catalysis in Organic Synthesis. Topics in Organometallic Chemistry, 44, 315-334.https://doi.org/10.1007/3418_2012_51
- 3. Sereda, O., Tabassum, S. and Wilhelm, R. (2010) Lewis Acid Organocatalysts. Topics in Current Chemistry, Asymmetric Organocatalysis, 291, 349-393. https://doi.org/10.1007/128_2008_17
- 4. Sevrain, C.M., Berchel, M., Couthon, H. and Jaffres, P.-A. (2017) Phosphonic Acid: Preparation and Applications. Beilstein Journal of Organic Chemistry, 13, 2186-2213. https://doi.org/10.3762/bjoc.13.219
- 5. Novakov, I.A. and Rakhimov, A.I. (2016) Features of Homolytic Organophosphorus Synthesis and Its Application. Russian Journal of General Chemistry, 86, 508-511. https://doi.org/10.1134/S1070363216030026
- 6. Shirakawa, S. and Kobayashi, S. (2006) Carboxylic Acid Catalyzed Three-Component Aza-Friedel-Crafts Reactions in Water for the Synthesis of 3-Substituted Indoles. Organic Letters, 8, 4939-4942. https://doi.org/10.1021/ol062031q
- 7. Abedini, M., Shirini, F. and Shahriari, A. (2015) N-Sulfonic Acids: New, Efficient and Reusable Catalysts for the Acceleration of Organic Reactions. Current Organic Chemistry, 19, 2011-2039.https://doi.org/10.2174/1385272819666150629174946
- 8. Yamato, T. (1998) Recent Developments of Perfluorinated Resin Sulfonic Acid (Nafion-H) Catalysis in Organic Synthesis. Recent Research Developments in Pure & Applied Chemistry, 2, 297-310.
- 9. Ishihara, K. (2015) Boronic Acid-Catalyzed Reactions of Carboxylic Acids. Topics in Organometallic Chemistry (Synthesis and Application of Organoboron Compounds), 49, 243-270. https://doi.org/10.1007/978-3-319-13054-5_8
- 10. Zheng, H. and Hall, D.G. (2014) Boronic Acid Catalysis: An Atom-Economical Platform for Direct Activation and Functionalization of Carboxylic Acids and Alcohols. Aldrichimica Acta, 47, 41-51.
- 11. Wu, J., Fang, H. and Xu, W. (2009) Application Progress of Boronic Acid Catalyst in Organic Synthesis. Technische Informationsbibliothek, 29, 1175-1181.
- 12. Wabnitz, T.C. and Spencer, J.B. (2003) A General Brønsted Acid-Catalyzed Hetero-Michael Addition of Nitrogen, Oxygen, and Sulfur Nucleophiles. Organic Letters, 5, 2141-2144. https://doi.org/10.1021/ol034596h
- 13. Sun, J.W. and Kozmin, S.A. (2005) Brønsted Acid-Promoted Cyclizations of 1-Siloxy-1,5-Diynes. Journal of the American Chemical Society, 127, 13512-13513. https://doi.org/10.1021/ja055054t
- 14. Pan, S.C. and List, B. (2008) The Catalytic Acylcyanation of Imines. Chemistry-An Asian Journal, 3, 430-437.https://doi.org/10.1002/asia.200700327
- 15. Aggarwal, V.K., Castro, A.M.M., Mereu, A. and Adams, H. (2002) The Use of Enantiomerically Pure N-Sulfinimines in Asymmetric Baylis-Hillman Reactions. Tetrahedron Letters, 43, 1577-1581.https://doi.org/10.1016/S0040-4039(02)00021-7
- 16. Declerck, V., Martinez, J. and Lamaty, F. (2009) Aza-Baylis-Hillman Reaction, Chemical Reviews, 109, 1-48.https://doi.org/10.1021/cr068057c
- 17. Buskens, P., Klankermayer, J. and Leitner, W. (2005) Bifunctional Activation and Racemization in the Catalytic Asymmetric Aza-Baylis-Hillman Reaction. Journal of the American Chemical Society, 127, 16762-16763.https://doi.org/10.1021/ja0550024
- 18. Sergeeva, N., Golubev, A.S. and Burger, K. (2001) Synthesis of Partially Fluorinated -Amino Acids via Morita-Baylis-Hillman Reaction. Synthesis, 2, 281-285. https://doi.org/10.1055/s-2001-10816
- 19. Xu, Y.M. and Shi, M. (2004) Highly Efficient aza-Baylis-Hillman Reaction of N-Tosylated Imines with MVK, Acrolein, and Phenyl Acrylate or α-Naphthyl Acrylate: Lewis Base Effects and A Convenient Method to Synthesize α, β-Unsaturated β-Amino Carbonyl Compounds. The Journal of Organic Chemistry, 69, 417-425. https://doi.org/10.1021/jo035103p
- 20. Kim, M., Lee, K.Y., Lee, S. and Kim, J.N. (2004) Ring-Closing Metathesis toward the Synthesis of 2,5-Dihydrofuran and 2,5-Dihydropyrrole Skeletons from Baylis-Hillman Adducts. Tetrahedron Letters, 45, 2805-2808. https://doi.org/10.1016/j.tetlet.2004.02.047
- 21. Kim, J.N., Lee, H.J., Lee, K.Y. and Kim, H.S. (2001) Synthesis of 3-Quinolinecarboxylic Acid Esters from the Baylis-Hillman Adducts of 2-Halobenzaldehyde N-Tosylimines. Tetrahedron Letters, 42, 3737-3740. https://doi.org/10.1016/S0040-4039(01)00552-4
- 22. Basavaiah, D., Rao, P.D. and Hyma, R.S. (1996) The Baylis-Hillman Reaction: A Novel Carbon-Carbon Bond Forming Reaction. Tetrahedron, 52, 8001-8062. https://doi.org/10.1016/0040-4020(96)00154-8
NOTES
*通讯作者。
