Advances in Clinical Medicine
Vol.
11
No.
02
(
2021
), Article ID:
40712
,
16
pages
10.12677/ACM.2021.112101
宫颈阴道微生物群与HPV感染、宫颈上皮内瘤变及宫颈癌的关系:系统评价和网络荟萃分析
秦丽,朱莉,王瑞雅,任志帅,郭玉琪
郑州大学人民医院(河南省人民医院),河南 郑州
收稿日期:2021年1月23日;录用日期:2021年2月7日;发布日期:2021年2月26日

摘要
目的:系统评价宫颈阴道微生物群与人乳头瘤病毒(human papillomavirus, HPV)感染、宫颈上皮内瘤变(cervical intraepithelial neoplasias, CIN)和宫颈癌之间的关系。方法:用计算机检索PUBMED、EMBASE、COCHRANE LIBRARY等数据库2010年以来关于宫颈阴道微生物群与HPV感染、宫颈上皮内瘤变和宫颈癌之间的关系的研究,经过筛选后进行系统评价,采用Stata/MP 16.0软件对文献进行网络荟萃分析(network meta-analysis, NMA)。结果:经筛选后共纳入12个研究,共涉及1449例受试者。12项研究中最常见的阴道微生物群落状态类型(community state type, CST)为CST I:卷曲乳杆菌优势的CST、CST III:惰性乳杆菌优势的CST和CST IV:乳酸杆菌缺乏的CST。Meta分析结果证实,阴道菌群以非乳酸杆菌为优势的女性更可能与HPV感染、高危HPV感染、宫颈病变或宫颈癌相关,其中发生HPV感染的合并优势比(odds ratio, OR)为1.78,95%CI (1.29, 2.47),发生高危HPV感染OR = 1.36,95%CI (0.97, 1.88),发生任何宫颈病变或癌症:OR = 2.10,95%CI (1.03, 4.27);对于高危HPV感染的清除或CIN2的消退,非乳酸杆菌优势的CST优势比为0.39,95%CI (0.23, 0.66);而卷曲乳杆菌优势的CST优势比为2.36,95%CI (1.23, 4.52)。任何HPV阳性组、高危HPV阳性组中低乳酸杆菌CST所占加权合并比例均为最高,分别为52%,95%CI (46%, 59%)和49%,95%CI (38%, 60%)。结论:女性宫颈阴道微生物群与人乳头瘤病毒(HPV)感染、宫颈上皮内瘤变和宫颈癌的发生发展密切相关,缺乏乳酸杆菌的CST是HPV感染和宫颈疾病、癌症发生的危险因素,而卷曲乳杆菌优势的CST可能促进高危HPV感染的清除并有利于宫颈上皮内瘤变的自然消退。
关键词
阴道微生物,人乳头瘤病毒,宫颈癌
Associations of Cervical Vaginal Microflora with HPV Infection, Cervical Intraepithelial Neoplasia and Cancer: A Systematic Review and Network Meta-Analysis
Li Qi, Li Zhu, Ruiya Wang, Zhishuai Ren, Yuqi Guo
Zhengzhou University People’s Hospital (Henan Provincial People’s Hospital), Zhengzhou Henan

Received: Jan. 23rd, 2021; accepted: Feb. 7th, 2021; published: Feb. 26th, 2021

ABSTRACT
Objective: To systematically evaluate the associations of cervical vaginal microbiota with human papillomavirus (HPV) infection, cervical intraepithelial neoplasias (CIN), and cervical cancer (CC). Methods: Studies on the associations of cervical vaginal microbiota of HPV infection, cervical intraepithelial neoplasias and cervical cancer since 2010 were searched in PUBMED, EMBASE, COCRANE LIBRARY and other databases by computer. After screening, systematic evaluation was conducted. Stata/MP 16.0 software was used for network meta-analysis of literatures. Results: After screening, 12 studies were included, involving a total of 1449 subjects. The most common vaginal community State types (CSTs) in the 12 studies were CST I: L. crispatus-dominant CST, CST III: L. iners-dominant CST, and CST IV: non-Lactobacillus-dominated CST. Meta analysis results confirmed that the women with non-Lactobacillus-dominant CST are more likely to HPV infection, high-risk HPV infection, cervical lesion and cervical cancer, including the consolidation odds ratio of HPV infection, OR = 1.78, 95%CI (1.29, 2.47), odds ratio of high risk HPV infection, OR = 1.36, 95%CI (0.97, 1.88), odds ratio of any cervical intraepithelial lesion or cancer, OR = 2.10, 95%CI (1.03, 4.27); for the elimination of high-risk HPV infection and regression of CIN2, the non-lactobacilli-dominant CST shows odds ratio with OR = 0.39, 95%CI (0.23, 0.66). The L. crispatus-dominant CST shows odds ratio with OR = 2.36, 95%CI (1.23, 4.52). The weighted pooled proportion of LOW lactobacillus CST in any HPV-positive group and high-risk HPV-positive group was the highest, with 52%, 95%CI (46%, 59%) and 49%, 95%CI (38%, 60%), respectively. Conclusion: Cervical vaginal microbiota and human papilloma virus (HPV) infection, cervical intraepithelial neoplasia is closely related to the occurrence of cervical cancer development, low number of lactobacilli CST is HPV infection and cervical disease, cancer risk factors, and lactobacillus crispatus can promote high-risk HPV infection of the advantages of the removal and help the natural regression of cervical intraepithelial neoplasia.
Keywords:Vaginal Microbiota, Human Papillomavirus, Cervical Cancer

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
宫颈癌(cervical cancer, CC)是全球女性中第四大常见癌症,发病率和死亡率均排名第四 [1],尤其在发展中国家形势更为严峻。人乳头瘤病毒的高风险亚型(high-risk human papilloma virus, hrHPV)持续感染是宫颈癌及其癌前期阶段(宫颈上皮内瘤变,CIN)的必要但不完全的原因 [2]。HPV感染是全世界最常见的性传播感染,绝大多数性活跃的女性都曾在某一时刻感染HPV,其中大部分可以在几个月内被清除,而未能及时清除的少数人则可能出现宫颈上皮内瘤变乃至发展为宫颈癌 [3] [4] [5]。已经发现诸如吸烟、激素避孕药的使用、全身或局部的免疫功能缺陷以及孕产史等非病毒因素在HPV感染自然史中起到辅助作用 [6] [7] [8] [9],而包括阴道微生物组在内的局部宫颈微环境也可能影响HPV感染的自然史 [10]。
由于阴道乳酸杆菌可通过产生乳酸、过氧化氢(H2O2)和细菌素来阻止其他病原菌的定植,人们认为低度多样性的以乳酸杆菌为主导的女性生殖道微生物群为维护生殖道健康提供重要助力 [11] [12] [13]。随着下一代分子测序技术(“Next-generation” sequencing technology, NGS)高通量测序在科学研究中的广泛运用,人们将宫颈阴道微生物组测序后通过聚类分析划分为数个群落状态类型 [14] (community state type, CST),并以此研究不同CST与HPV感染、宫颈上皮内瘤变及宫颈癌之间的关系。然而因受限于样本量小、地域及种族差异、分析方法不统一等原因,各研究的结论尚存在一些争议性以及不确定性。我们将筛选出近10年符合标准的高质量文献,使用网络荟萃分析的方法进行系统评价。
2. 资料与方法
2.1. 文献纳入标准
基于分子技术鉴定并定量评估女性阴道微生物群,进而通过聚类分析划分为至少两种不同类型CST,且报告了与HPV感染、宫颈上皮内瘤变和/或宫颈癌的关联,从而可实现风险评估的原始研究。包括横断面研究及纵向研究。
2.2. 文献排除标准
排除会议摘要、非英语文章、评论和重复出版物。排除对人细胞系或动物模型的研究以及仅基于显微镜检查或细菌性阴道病临床诊断的研究。缺少原始数据数值的研究也被排除在外。
2.3. 检索策略
2.3.1. 数据库选择
用计算机检索以下数据库:美国国家医学图书馆(NLM)所属的国家生物技术信息中心(NCBI)开发的生物医学信息检索系统PUBMED (数据库来源为MEDLINE)、全球最大最具权威性的生物医学与药理学文摘数据库EMBASE (前身为荷兰医学文摘)、大型循证医学资源数据库COCHRANE LIBRARY。
2.3.2. 检索词
选取“阴道微生物群”“人类乳头瘤病毒”“宫颈癌”“宫颈病变”“下一代测序”“序列分析”“16s RNA”等主题词及其近义词的英文形式如“Vaginal microbiome”、“human papillomavirus”、“cervical cancer”、“cervical dysplasia”、“Next generation sequencing”、“sequence analysis”、“16s RNA”等在数据库中进行检索。PUBMED使用Mesh主题词加附加词的形式进行检索,详细检索策略见附表1。检索时间为2010年1月至2020年11月。
2.3.3. 文献筛选和资料提取
由2名研究者(秦某、王某)分别阅读并进行标题/摘要筛选和全文审查,严格根据纳入和排除标准来筛选文献。由以上2名研究者对纳入文献进行资料提取:(1) 文献的基本情况,如作者、发表年份、资料收集时间、研究类型、研究样本量等;(2) 研究对象的基本情况,如年龄、民族、地域等;(3) 研究中划分宫颈阴道微生物群CST类型的鉴定方法;(4) 分组情况及依据;(5) 主要结果及结论;(6) 纳入文献的质量评价。
2.4. 文献质量评价
采用美国卫生保健质量和研究机构(AHRQ)评价横断面研究的评分量表进行文献质量评价 [15]。该量表从11个方面对横断面研究进行质量评分:(1) 是否明确了资料来源;(2) 是否列出了暴露组与非暴露组(病例组与对照组)纳入及排除标准或参考既往文献;(3) 是否说明鉴别患者的时间段;(4) 非人群来源的研究,研究对象是否连续(是否纳入某时间段内的所有患者);(5) 对患者的主观化指标评估是否与其他客观指标相隔离;(6) 是否描述了任何为保证质量而进行的评估(如对主要结局指标的检测、再检测);(7) 是否解释了将部分患者剔除的原因;(8) 描述了如何评价和/或控制混杂因素;(9) 如果存在缺失值,解释了如何处理缺失数据;(10) 总结了患者的应答率和数据收集的完整性;(11) 如果有随访,提供了查明预期患者不完整数据所占百分比或随访结果。资料分析方法是否恰当。每项内容均用“是”、“否”、“不清楚”、“不适用”来评价并计分。“是”得1分,“否”、“不清楚”、“不适用”得0分,0至3分为低质量,4~7分为中等质量,8~11分为高质量。
2.5. 统计学方法
采用Stata/MP 16.0软件进行Meta分析,安装network资源包进行网络分析。计量资料采用加权均数差(Weighted Mean Difference, WMD)为效应指标,计数资料根据需要采用比值比/优势比(Odds Ratio, OR)、风险比(Risk Ratio, RR)、对数比值比(Log Odds Ratio)或比率(Proportion)为效应指标。所有分析均计算95%置信区间(95%CI),对于小样本量(n < 200)比率的95%置信区间则使用调整后的得分法(Score)进行计算以得到更为精确的端点值的95%置信区间(例如1/7) [16]。通过X2检验各研究间的异质性。当P < 0.05,I2 > 60%认为各研究间具有显著异质性,需进行敏感性分析;当I2 = 30%~60%时,根据实际需要评估后选用随机效应模型;如果P > 0.05,I2 < 30%认为各研究间异质性较小,可采用固定效应模型。
3. 结果
3.1. 文献检索结果
三个数据库检索结果显示总共1118篇文献(包含重复文献),经严格筛选后得到12篇符合要求的原始研究。筛选流程及结果见图1。
3.2. 纳入研究的基本特征及质量评价
研究基本特征见表1。12项研究中地区分布于四大洲,研究方法包括横断面研究及队列研究,均使用分子序列分析方法鉴定宫颈阴道微生物,发现的CST数量为3~8种,各项研究分组年龄分布较均匀,质量评价结果为3项研究在该评价体系中属于高质量、剩余9项研究为中等质量。评分详情见附表2。
3.3. CST分类
通过分子测序技术鉴定并进行聚类分析,各研究发现的宫颈阴道微生物CST数量和命名有一定差异,但主要簇群保持了一致。所有研究均包含至少2个以乳酸杆菌为优势菌的主要簇群,例如惰性乳杆菌(Lactobacillus iners)为主的CST,在图中将标记为“L. iners CST”,同时包含至少1个非乳酸杆菌优势的簇群,这样的簇群往往乳酸杆菌含量低、物种多样性高,以加德纳菌、普氏杆菌、假单胞菌等厌氧菌为主,我们将其统称为非/低乳酸杆菌CST,图中标记为“low L. spp CST”或“低L. spp CST”。除一项研究外,所有研究均发现以卷曲乳杆菌(Lactobacillus crispatus)为主的CST,图中标记为“L. crispatus CST” [17]。其他发现的CST依次有:加氏乳杆菌为主的CST,标记为:“L. gasseri CST”,詹氏乳杆菌为主的CST,标记为:“L. jensenii CST”。仅在一项研究中发现的CST将不被纳入经典meta分析,如镓乳杆菌为主的CST (L. gallinarum CST)、卷曲–惰性乳杆菌为主的CST (L. crispatus & iners CST) [17] [18]。
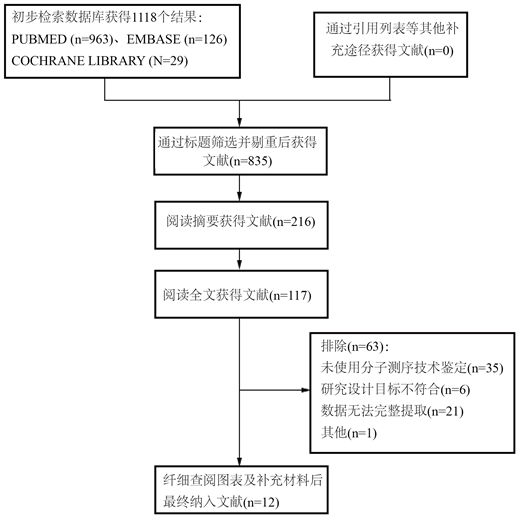
Figure 1. Literature screening results and process
图1. 文献筛选结果及流程
Table 1. Basic characteristics and quality evaluation of study
表1. 基本特征及质量评价
3.4. 各事件结局定义及分组依据
12项研究中有5项研究涉及不同CST与任何HPV感染的关联 [18] [19] [20] [21] [22],根据受试者宫颈阴道分泌物拭子HPV检测(PCR)试剂盒结果分组为任何HPV阳性组、任何HPV阴性组。7项研究涉及不同CST与高危HPV感染的关联 [17] [21] - [26],根据高危HPV分型检测是否阳性分为高危HPV阳性组、高危HPV阴性组,HPV高危型包括9个亚型:16、18、31、33、35、45、51、52、56、58、61。6项研究涉及不同CST与宫颈上皮内病变/癌症的关联 [19] [21] [24] [25] [26] [27],本文中宫颈上皮内病变包括任何宫颈细胞学异常和病理组织学诊断CIN者,宫颈细胞学异常包括未明确意义的非典型鳞状上皮细胞(atypical squamous cells of undetermined significance, ASCUS)、低度鳞状上皮内病变(low-grade squamous intraepithelial lesion, LSIL)、高度鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL)等 [24]。2项纵向研究观察了不同CST与高危HPV的清除或病变的消退之间的关联 [23] [28]。
3.5. 经典Meta分析结果
3.5.1. 各事件主要CST占比森林图
图2分别显示了任何HPV阳性组、任何HPV阴性组、高危HPV阳性组、高危HPV阴性组、高危HPV清除或CIN2消退组、高危HPV未清除或CIN2未消退组、高级病变组(HSIL、CIN2+)、低级病变组(LSIL、ASCUS、CIN1−)中各主要CST的占比。其中CIN2+包括:CIN2、CIN3及CC,CIN1−包括:CIN1及其他病理结果除外高级别病变和癌症者。低乳酸杆菌为主的CST在HPV阳性组、高危HPV阳性组、高级病变组和高危HPV清除或CIN2消退组中的加权合并占比分别为:52%,95%CI (46%, 59%);49%,95%CI (38%, 60%);42%,95%CI (18%, 65%);49%,95%CI (40%, 57%)。低乳酸杆菌为主的CST在HPV阴性组、高危HPV阴性组、低级病变组和高危HPV未清除或CIN2未消退组中的加权合并占比分别为:36%,95%CI (26%, 46%);37%,95%CI (27%, 48%);32%,95%CI (16%, 48%);27%,95%CI (20%, 34%)。相应地,卷曲乳杆菌为主的CST及惰性乳杆菌为主的CST在各组中的加权占比也在图中显示,在此不做赘述(图中高危HPV未清除或CIN2未消退组标记为“持续/进展组”)。
3.5.2. 低乳酸杆菌CST发生各事件风险森林图
以乳酸杆菌为主的CST作为对照组,检验了低乳酸杆菌为主的CST与任何HPV感染、高危HPV感染、任何宫颈病变或癌症及高危HPV的清除或CIN2的消退之间的关联,效应量均采用优势比(OR),异质性检验结果位于森林图左下角。
图3显示了低乳酸杆菌CST与任何HPV感染的关联,OR = 1.78,其95%CI为(1.29, 2.47)。
图4显示了低乳酸杆菌CST与高危HPV感染的关联,OR = 0.33,其95%CI为(0.24, 0.42)。
图5显示了低乳酸杆菌CST与任何宫颈病变或癌症的关联,OR = 0.33,其95%CI为(0.24, 0.42)。
图6显示了低乳酸杆菌CST与高危HPV清除或CIN2消退的关联,OR = 0.33,其95%CI为(0.24, 0.42)。
3.6. 网络荟萃分析结果
3.6.1. 网络关系图
图7显示了12项研究中涉及的宫颈阴道微生物CST类型及其相互关系的网络图,圆点越大表示涉及该CST的研究数量越多,线条越粗表示关联两CST的研究数量越多,同时也以数字形式进行了标记。根据每项研究检测的结局指标分别绘制为各CST与三种事件关联的网络关系图,即(1) 任何HPV阳性;(2) 高危HPV阳性;(3) 任何宫颈病变或癌症。

Figure 2. Forest maps of weighted pooled proportion of main CSTs
图2. 主要CST加权占比森林图
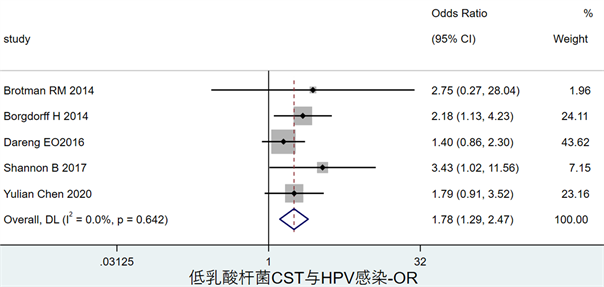
Figure 3. Forest map of the association between low lactobacilli CST and any HPV infection
图3. 低乳酸杆菌CST与HPV感染风险关联森林图
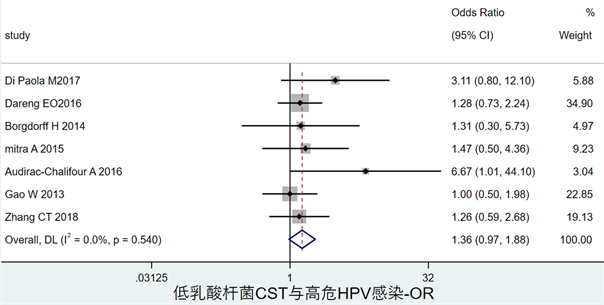
Figure 4. Forest map of the association between low lactobacilli CST and hrHPV infection
图4. 低乳酸杆菌CST与高危HPV感染风险关联森林图
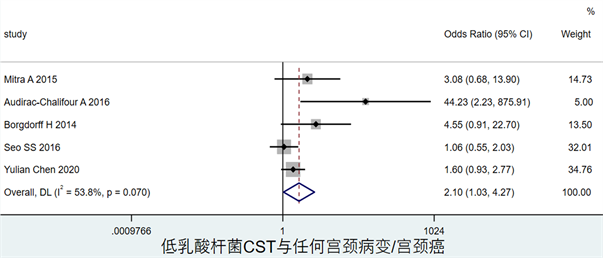
Figure 5. Forest map of the association between low lactobacilli CST and the risk of cervical dysplasia and cancer
图5. 低乳酸杆菌CST与宫颈病变或癌症风险关联森林图
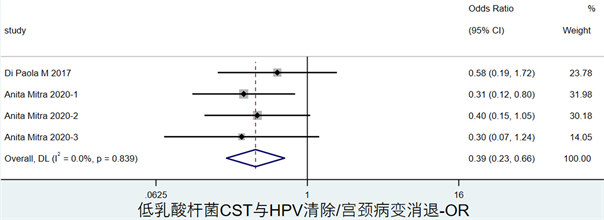
Figure 6. Forest map of the association between low lactobacilli CST and the clearance of hrHPV or the regression of CIN2
图6. 低乳酸杆菌CST与高危HPV清除或CIN2消退关联森林图
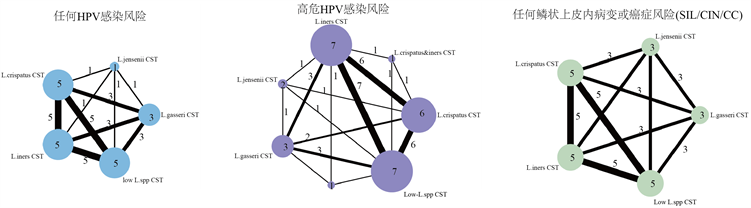
Figure 7. Network maps of the association between the vaginal microbiota CSTs and the risk of any prevalent HPV, high-risk HPV or cervical dysplasia and cancer
图7. 各CST与任何HPV阳性、高危HPV阳性、任何宫颈病变或癌症的网络关系图
3.6.2. 网络荟萃森林图
图8显示了各CST与三种主要事件(任何HPV阳性、高危HPV阳性、任何宫颈病变或癌症)的关联网络图,效应量选用更近似正太分布的对数比值比(log odds ratio),异质性检验结果显示于图中左下角。
3.6.3. 优选概率排名曲线图
图9为各CST与各事件的关联效应的优选概率排名曲线(the surface under the cumulative ranking curve, SUCRA)图,也称累计排序概率–秩次曲线图 [29]。SUCRA图通过累计曲线下面积直观展示了每种CST与任何HPV感染、高危HPV感染及任何宫颈病变或癌症发生的关联强度排名。同时附图1展示了详细的SUCRA值。
4. 讨论
近年来HPV疫苗的推广和宫颈癌早期筛查的普及有望使女性罹患宫颈癌的风险大幅降低,但在发展中国家宫颈癌的发病率和死亡率仍居高不下,且呈现年轻化的趋势。因此探究HPV自然史的影响因素对宫颈癌的早预防、早诊断和早治疗尤为重要,本系统评价和荟萃分析从多个角度综合分析了宫颈阴道微生物菌群结构与HPV感染、宫颈上皮内瘤变和宫颈癌之间的关联。由于研究的样本量、研究类型、地区、民族和CST鉴定分类等差异,各项研究中涉及的CST和结局分类并不一致。因此经典的meta分析难以进行直观全面的分析,例如无法对某些非同时出现的CST进行直接比较。在这里我们引入了可以同时进行多个干预因素直接和间接比较的网络荟萃分析的方法。网络荟萃分析中需要进行各研究之间的两两比较,仅仅进行全局不一致性模型分析是不够的,因此我们使用节点劈裂法进行了局部不一致性分析(结果未显示) [30]。

Figure 8. Network forest plots showing the association between CSTs and the risk of any prevalent HPV, high-risk HPV or cervical dysplasia and cancer
图8. 各CST与HPV感染、高危HPV感染、任何宫颈病变或癌症的关联的网络森林图
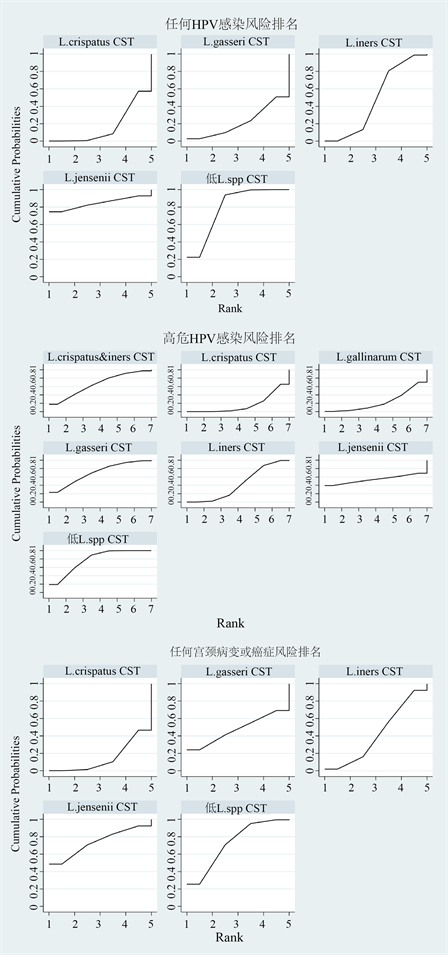
Figure 9. The surface under the cumulative ranking curve showing the association between CSTs and the risk of any prevalent HPV, high-risk HPV or cervical dysplasia and cancer
图9. (高危)HPV感染及任何宫颈病变或癌症风险中各CST优选概率排名曲线图
从经典荟萃分析的结果来看,我们发现高度多样性的低乳酸杆菌为主的CST与HPV感染和宫颈病变有关,这与大多数荟萃分析报道结果一致。在高危HPV的清除和CIN2的消退方面,卷曲乳杆菌为主的CST (L. crispatus CST)显示出最大的优势。而网络荟萃分析结果显示了一些少见的乳酸杆菌为主的CST可能与HPV感染、宫颈病变有更强的关联。如詹氏乳杆菌为主的CST (L. jensenii CST)在任何HPV阳性组和任意SIL组中SUCRA值均排名第一,而低乳酸杆菌CST排名第二。然而由于L. jensenii CST的检出率较低,因此对于此结果我们应慎重解读。对于高危HPV感染的清除或CIN2的消退,卷曲乳杆菌优势的CST优势比明显为2.36,95%CI (1.23, 4.52),但因纳入研究数量有限,结果中未显示。Anita等人的研究进行了为期2年的前瞻性纵向研究,观察了阴道CST与CIN2自然史之间的关联,在本次系统评价中根据不同的观察节点将其拆分为3个研究纳入荟萃分析 [28]。
本文纳入的12项研究中仅5项纵向研究,其余7项为横断面研究,单纯的横断面研究对于循证医学证据强度有限。我们呼吁更多纵向队列研究以便于更好地阐释宫颈阴道微生物类群与HPV感染、宫颈上皮内瘤变及宫颈癌之间的因果关系。同时希望扩大样本量、标准化研究方法、纳入更多种族和地区的女性受试者。随着基于高通量测序等分子技术的微生物代谢组学、宏基因组学蓬勃发展,提高了微生物群组研究的效率及准确性,有利于益生菌制剂的开发。最近的研究开始聚焦于研究宫颈阴道微生物组、HPV和细胞学变化对代谢谱的影响,这促进了持续病毒感染和癌变所必需的许多炎症和代谢机制的研究 [31] [32]。微生物标志和代谢标志物联合检测或许是未来宫颈癌早期预防的重要方向。
基金项目
本论文获得河南省教委自然科学基金和河南省科技攻关计划等基金项目支持。
文章引用
秦 丽,朱 莉,王瑞雅,任志帅,郭玉琪. 宫颈阴道微生物群与HPV感染、宫颈上皮内瘤变及宫颈癌的关系:系统评价和网络荟萃分析
Associations of Cervical Vaginal Microflora with HPV Infection, Cervical Intraepithelial Neoplasia and Cancer: A Systematic Review and Network Meta-Analysis[J]. 临床医学进展, 2021, 11(02): 698-713. https://doi.org/10.12677/ACM.2021.112101
参考文献
- 1. Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R.L., Torre, L.A. and Jemal, A. (2018) Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 68, 394-424. https://doi.org/10.3322/caac.21492
- 2. Walboomers, J.M., Jacobs, M.V., Manos, M.M., Bosch, F.X., Kummer, J.A., Shah, K.V., et al. (1999) Human Papillomavirus Is a Necessary Cause of Invasive Cervical Cancer Worldwide. The Journal of Pathology, 189, 12-19. https://doi.org/10.1002/(SICI)1096-9896(199909)189:1%3C12::AID-PATH431%3E3.0.CO;2-F
- 3. Ho, G.Y., Burk, R.D., Klein, S., Kadish, A.S., Chang, C.J., Palan, P., et al. (1995) Persistent Genital Human Papillomavirus Infection as a Risk Factor for Persistent Cervical Dysplasia. Journal of the National Cancer Institute, 87, 1365-1371. https://doi.org/10.1093/jnci/87.18.1365
- 4. Castle, P.E., Rodriguez, A.C., Burk, R.D., Herrero, R., Wacholder, S., Alfaro, M., et al. (2009) Short Term Persistence of Human Papillomavirus and Risk of Cervical Precancer and Cancer: Population Based Cohort Study. BMJ, 339, b2569. https://doi.org/10.1136/bmj.b2569
- 5. Kjaer, S.K., Frederiksen, K., Munk, C. and Iftner T. (2010) Long-Term Absolute Risk of Cervical Intraepithelial Neoplasia Grade 3 or Worse Following Human Papillomavirus Infection: Role of Persistence. Journal of the National Cancer Institute, 102, 1478-1488. https://doi.org/10.1093/jnci/djq356
- 6. Roura, E., Castellsague, X., Pawlita, M., Travier, N., Waterboer, T., Margall, N., et al. (2014) Smoking as a Major Risk Factor for Cervical Cancer and Pre-Cancer: Results from the EPIC Cohort. International Journal of Cancer, 135, 453-466. https://doi.org/10.1002/ijc.28666
- 7. Eldridge, R.C., Pawlita, M., Wilson, L., Castle, P.E., Waterboer, T., Gravitt, P.E., et al. (2017) Smoking and Subsequent Human Papillomavirus Infection: A Mediation Analysis. Annals of Epidemiology, 27, 724-730.e1. https://doi.org/10.1016/j.annepidem.2017.10.004
- 8. Moreno, V., Bosch, F.X., Munoz, N., Meijer, C.J., Shah, K.V., Walboomers, J.M., et al. (2002) Effect of Oral Contraceptives on Risk of Cervical Cancer in Women with Human Papillomavirus Infection: The IARC Multicentric Case-Control Study. Lancet, 359, 1085-1092. https://doi.org/10.1016/S0140-6736(02)08150-3
- 9. Munoz, N., Franceschi, S., Bosetti, C., Moreno, V., Herrero, R., Smith, J.S., et al. (2002) Role of Parity and Human Papillomavirus in Cervical Cancer: The IARC Multicentric Case-Control Study. Lancet, 359, 1093-1101. https://doi.org/10.1016/S0140-6736(02)08151-5
- 10. Castle, P.E. and Giuliano, A.R. (2003) Chapter 4: Genital Tract Infections, Cervical Inflammation, and Antioxidant Nutrients—Assessing Their Roles as Human Papillomavirus Cofactors. Journal of the National Cancer Institute Monographs, 31, 29-34. https://doi.org/10.1093/oxfordjournals.jncimonographs.a003478
- 11. Curty, G., de Carvalho, P.S. and Soares, M.A. (2019) The Role of the Cervicovaginal Microbiome on the Genesis and as a Biomarker of Premalignant Cervical Intraepithelial Neoplasia and Invasive Cervical Cancer. International journal of molecular sciences, 21, 222. https://doi.org/10.3390/ijms21010222
- 12. Witkin, S.S. and Linhares, I.M. (2017) Why Do Lactobacilli Dominate the Human Vaginal Microbiota? BJOG, 124, 606-611. https://doi.org/10.1111/1471-0528.14390
- 13. Mitra, A., Macintyre, D.A., Marchesi, J.R., Lee, Y.S., Bennett, P.R. and Kyrgiou M. (2016) The Vaginal Microbiota, Human Papillomavirus Infection and Cervical Intraepithelial Neoplasia: What Do We Know and Where Are We Going Next? Microbiome, 4, Article No. 58. https://doi.org/10.1186/s40168-016-0203-0
- 14. Ravel, J., Gajer, P., Abdo, Z., Maria Schneider, G., Koenig, S.S.K., McCulle, S.L., et al. (2011) Vaginal Microbiome of Reproductive-Age Women. Proceedings of the National Academy of Sciences of the United States of America, 108, 4680-4687. https://doi.org/10.1073/pnas.1002611107
- 15. Agency for Healthcare Research and Quality (US) (2020) Cross-Sectional/Prevalence Study Quality. http://www.ncbi.nlm.nih.gov/books/NBK35156/.
- 16. Lewis, J.R. and Sauro, J. (2006) When 100% Really Isn’t 100%: Improving the Accuracy of Small-Sample Estimates of Completion Rates. Journal of Usability Studies, 1, 136-150.
- 17. Gao, W., Weng, J., Gao, Y. and Chen, X. (2013) Comparison of the Vaginal Microbiota Diversity of Women with and without Human Papillomavirus Infection: A Cross-Sectional Study. BMC Infectious Diseases, 13, Article No. 271.
- 18. Shannon, B., Yi, T.J., Perusini, S., Gajer, P., Ma, B, Humphrys, M.S., et al. (2017) Association of HPV Infection and Clearance with Cervicovaginal Immunology and the Vaginal Microbiota. Mucosal Immunology, 10, 1310-1319.
- 19. Chen, Y., Qiu, X., Wang, W., Li, D., Wu, A., Hong, Z., et al. (2020) Human Papillomavirus Infection and Cervical Intraepithelial Neoplasia Progression are Associated with Increased Vaginal Microbiome Diversity in a Chinese Cohort. BMC Infectious Diseases, 20, 629. https://doi.org/10.1186/s12879-020-05324-9
- 20. Brotman, R.M., Shardell, M.D., Gajer P., Gajer, P., Kathleen Tracy, J., Zenilman, J.M., et al. (2014) Interplay between the Temporal Dynamics of the Vaginal Microbiota and Human Papillomavirus Detection. The Journal of Infectious Diseases, 210, 1723-1733. https://doi.org/10.1093/infdis/jiu330
- 21. Borgdorff, H., Tsivtsivadze, E., Verhelst, R., Marzorati, M., Jurriaans, S., Ndayisaba, G.F., et al. (2014) Lactobacillus-Dominated Cervicovaginal Microbiota Associated with Reduced HIV/STI Prevalence and Genital HIV Viral Load in African Women. The ISME Journal, 8, 1781-1793.
- 22. Dareng, E.O., Ma, B., Famooto, A.O., Akarolo-Anthony, S.N., Offiong, R.A., Olaniyan, O., et al. (2016) Prevalent High-Risk HPV Infection and Vaginal Microbiota in Nigerian Women. Epidemiology & Infection, 144, 123-137. https://doi.org/10.1017/S0950268815000965
- 23. Di Paola, M., Sani, C., Clemente, A.M., Iossa, A., Perissi, E., Castronovo, G., et al. (2017) Characterization of Cervico-Vaginal Microbiota in Women Developing Persistent High-Risk Human Papillomavirus Infection. Scientific Reports, 7, Article No. 10200. https://doi.org/10.1038/s41598-017-09842-6
- 24. Mitra, A., MacIntyre, D.A., Lee, Y.S., Smith, A., Marchesi, J.R., Lehne, B., et al. (2015) Cervical Intraepithelial Neoplasia Disease Progression is Associated with Increased Vaginal Microbiome Diversity. Scientific Reports, 5, Article ID: 16865. https://doi.org/10.1038/srep16865
- 25. Zhang, C., Liu, Y., Gao, W., Pan, Y., Gao, Y., Shen, J., et al. (2018) The Direct and Indirect Association of Cervical Microbiota with the Risk of Cervical Intraepithelial Neoplasia. Cancer Medicine, 7, 2172-2179. https://doi.org/10.1002/cam4.1471
- 26. Audirac-Chalifour, A., Torres-Poveda, K., Bahena-Román, M., Téllez-Sosa, J., Martínez-Barnetche, J., Cortina-Ceballos, B., et al. (2016) Cervical Microbiome and Cytokine Profile at Various Stages of Cervical Cancer: A Pilot Study. PLoS ONE, 11, e0153274. https://doi.org/10.1371/journal.pone.0153274
- 27. Seo, S.S., Oh, H.Y., Lee, J.K., Kong, J.S., Lee, D.O. and Kim, M.K. (2016) Combined Effect of Diet and Cervical Microbiome on the Risk of Cervical Intraepithelial Neoplasia. Clinical Nutrition, 35, 1434-1441. https://doi.org/10.1016/j.clnu.2016.03.019
- 28. Mitra, A., MacIntyre, D. A., Ntritsos, G., Smith, A., Tsilidis, K.K., Marchesi, J.R., Bennett, P.R., Moscicki, A.B. and Kyrgiou, M. (2020) The Vaginal Microbiota Associates with the Regression of Untreated Cervical Intraepithelial Neoplasia 2 Lesions. Nature Communications, 11, Article No. 1999. https://doi.org/10.1038/s41467-020-15856-y
- 29. Tu, Y.-K. (2016) Node-Splitting Generalized Linear Mixed Models for Evaluation of Inconsistency in Network Meta-Analysis. Value in Health the Journal of the International Society for Pharmacoeconomics & Outcomes Research, 19, 957-963. https://doi.org/10.1016/j.jval.2016.07.005
- 30. 张天嵩, 董圣杰, 周支瑞. 高级meta分析方法: 基于stata实现[M]. 上海: 复旦大学出版, 2015.
- 31. Laniewski, P., Cui, H., Roe, D.J., Barnes, D., Goulder, A., Monk, B.J., et al. (2019) Features of the Cervicovaginal Microenvironment Drive Cancer Biomarker Signatures in Patients Across Cervical Carcinogenesis. Scientific Reports, 9, Article No. 7333. https://doi.org/10.1038/s41598-019-43849-5
- 32. Ilhan, Z.E., Laniewski, P., Thomas, N., Roe, D.J., Chase, D.M. and Herbst-Kralovetz, M.M. (2019) Deciphering the Complex Interplay between Microbiota, HPV, Inflammation and Cancer through Cervicovaginal Metabolic Profiling. EBioMedicine, 44, 675-690. https://doi.org/10.1016/j.ebiom.2019.04.028
附录
Table S1. Literature search strategy
附表1. 文献检索策略
Table S2. AHRQ quality assessment of all 12 included studies
附表2. 12项研究的AHRQ质量评分
注:“1”:是否明确了资料来源;“2”:是否列出了暴露组与非暴露组(病例组与对照组)、纳入及排除标准或参考既往文献;“3”:是否说明鉴别患者的时间段;“4”:非人群来源的研究,研究对象是否连续(是否纳入某时间段内的所有患者);“5”:对患者的主观化指标评估是否与其他客观指标相隔离;“6”:是否描述了任何为保证质量而进行的评估(如对主要结局指标的检测、再检测);“7”:是否解释了将部分患者剔除的原因;“8”:描述了如何评价和/或控制混杂因素;“9”:如果存在缺失值,解释了如何处理缺失数据;“10”:总结了患者的应答率和数据收集的完整性;“11”:如果有随访,提供了查明预期患者不完整数据所占百分比或随访结果。
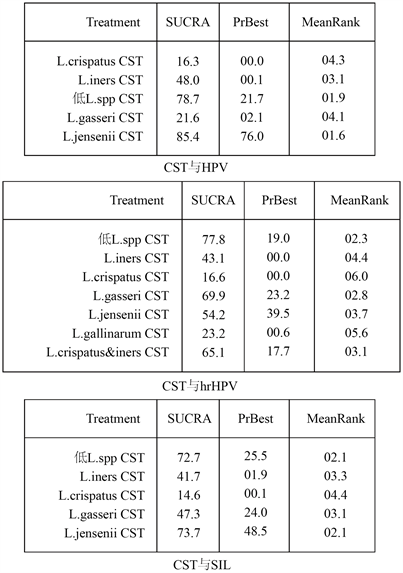
Figure S1. The SUCRA values and mean ranks for each CST for the risk of (high-risk) HPV or cervical dysplasia and cancer
附图1. (高危) HPV感染及任何宫颈病变或癌症风险中各CST平均SUCRA值排名
