Advances in Clinical Medicine
Vol.
10
No.
11
(
2020
), Article ID:
38759
,
10
pages
10.12677/ACM.2020.1011407
蟾毒灵联合顺铂对骨肉瘤143B细胞凋亡 的影响
贾林1,张人龙1,王嘉军1*,张伟2#
1湖北民族大学医学部,湖北 恩施
2三峡大学医学院,湖北 宜昌

收稿日期:2020年11月2日;录用日期:2020年11月18日;发布日期:2020年11月25日

摘要
目的:探讨蟾毒灵和顺铂对骨肉瘤(Osteosarcoma, OS) 143B细胞增殖和凋亡的影响及其机制。方法:选取OS-143B细胞为实验细胞,分为阴性对照、蟾毒灵、顺铂和蟾毒灵 + 顺铂联合组四组。MTT法检测细胞增殖;荧光显微镜观察细胞凋亡形态;流式细胞仪检测细胞周期和细胞凋亡;Western blot检测Bcl-2、Bax和Caspase-3蛋白表达。结果:蟾毒灵和顺铂均抑制OS-143B细胞增殖(P < 0.01),细胞生长减缓,细胞生长阻滞S期、G2期(P < 0.05);细胞凋亡率均显著高于对照组(P < 0.01);蟾毒灵和顺铂组较对照组Bax,caspase-3表达显著增加(P < 0.01),而Bcl-2表达显著减低(P < 0.01),上述结果联合组较两单药组作用更显著(P < 0.01)。结论:蟾毒灵与顺铂均可抑制OS-143B细胞增殖,呈时间–浓度依赖性,细胞周期在S期、G2期阻滞;蟾毒灵与顺铂均可促进OS-143B细胞凋亡,可能与上调Bax,caspase-3蛋白,下调Bcl-2蛋白的表达有关。联合组较单用二药对抑制OS细胞生长、促进其凋亡的作用显著增强。
关键词
骨肉瘤,蟾毒灵,顺铂,细胞周期,细胞凋亡

The Effect of Bufalin Combined with Ciplatin on Apoptosis of Osteosarcoma 143B Cells
Lin Jia1, Renlong Zhang1, Jiajun Wang1*, Wei Zhang2#
1Department of Medicine in Hubei Minzu University, Enshi Hubei
2Medical College of China Three Gorges University, Yichang Hubei

Received: Nov. 2nd, 2020; accepted: Nov. 18th, 2020; published: Nov. 25th, 2020

ABSTRACT
Objective: To investigate the effects and mechanism of bufalin and cisplatin on proliferation and apoptosis of osteosarcoma 143B cells. Methods: OS-143B cells were selected as experimental cells and divided into four groups: the negative control group, the bufalin group, the cisplatin group and the bufalin + cisplatin group. MTT method was used to detect cell proliferation, fluorescence microscope to observe the morphology of apoptosis, flow cytometry to detect cell cycle and apoptosis, and western blot to detect the expression of Bcl-2, Bax and Caspase-3. Results: Both bufalin and cisplatin inhibited the proliferation of OS-143B cells, slowed down the cell growth, blocked S phase and G2 phase, and the apoptosis rate was significantly higher than that in the control group (P < 0.01). The expression of Bax, caspase-3 in the bufalin and cisplatin group was significantly higher than that in the control group, while the expression of Bcl-2 in the bufalin and cisplatin group was significantly lower than that in the control group (P < 0.01). The effect of the bufalin and cisplatin group was more significant than that of the two single drug groups. Conclusions: Both bufalin and cisplatin can inhibit the proliferation of OS-143B cells in a time-concentration dependent manner, and the cell cycle is arrested in S phase and G2 phase, and both bufalin and cisplatin can promote the apoptosis of OS-143B cells, which may be related to the up-regulation of Bax, caspase-3 protein and down-regulation of Bcl-2 protein expression. The effect of the combination group on inhibiting the growth and promoting the apoptosis of OS cells was significantly stronger than that of the two drugs alone.
Keywords:Osteosarcoma, Bufalin, Cisplatin, Cell Cycle, Apoptosis

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
骨肉瘤(Osteosarcoma, OS),以大量梭形肉瘤细胞直接形成不成熟骨为特征,是最常见的高度原发性骨恶性肿瘤 [1]。目前治疗OS常用顺铂(Cisplatin, DDP)作为一线化疗优选方案基础药物 [2],但大剂量顺铂不仅有明显的毒副作用,而且其造成的多重耐药性是导致OS治疗失败的重要因素 [3]。蟾毒灵(Bufalin, BF)是中药蟾酥(Bufonis venenum)的提取物,其对多种恶性肿瘤如胃癌、胰腺癌、肝癌等有明显抗瘤和逆转药物耐受性的效果 [4] [5]。BF对OS-143B细胞的作用未见报道。本研究通过探讨BF和DDP联合应用对OS-143B细胞增殖和凋亡的影响和机制,为中西药结合治疗骨肉瘤提供相应的实验依据。现将结果报告如下:
2. 材料与方法
2.1. 材料
2.1.1. 细胞株
人骨肉瘤143B细胞购于上海中乔新舟生物科技有限公司,源购于美国模式菌种收集中心(American Type Culture Collection, ATCC)。
2.1.2. 主要药物和试剂
蟾毒灵(成都植标化有限公司);顺铂(齐鲁制药有限公司);BCA蛋白浓度测定试剂盒(普利莱有限公司);胎牛血清、MEN培养基(美国Gibco公司);Annexin V-FITC/PI凋亡试剂盒(凯基有限公司);SDS-PAGE 凝胶试剂盒(科瑞有限公司);β-Actin兔抗体、Caspase-3抗体(美国Cell Signaling Technology公司);Bax兔单抗(美国Proteintech公司);Bcl-2兔单抗(美国Sabta Cruz Technology公司);羊抗兔IgG (美国Jackson公司)。
2.1.3. 主要仪器
应用CKX31/41倒置显微镜(日本OLYMPUS公司);全波长酶标仪(俄罗斯Thermo分公司);电泳槽、电转膜仪(美国Bio Rad公司);化学发光成像分析仪(美国通用电气医疗集团);流式细胞仪(美国Becton Dickinson公司);LE-SH800SEP细胞分选仪(日本SONY公司)进行相关实验及检测。
2.2. 方法
2.2.1. 人骨肉瘤143B细胞复苏与培养传代
按细胞复苏及培养传代常规方法操作。
2.2.2. MTT法检测143B细胞的增殖抑制率
收集对数生长的143B细胞,细胞培养传代消化制备成2 × 104个/mL的细胞悬液,以200 ul/孔置于96孔板,将孔板置于培养箱继续培养12 h,弃除细胞培养基进行用药处理。分别以BF的用药浓度为:6.25、12.5、25、50和100 nmol和DDP的用药浓度为:50、100、200、400 ng/mL加入孔板,以培养基为空白对照组,加入细胞和细胞培养基为阴性对照组,每组设置6个复孔,孔板在细胞培养箱进行24 h、48 h、72 h培养。用药处理后取96孔板,依次加20 ul/孔 MTT溶液,置于培养箱继续培养4 h,吸除上清,依次加DMSO 150 ul/孔,置于摇床避光缓慢震荡15 min,待结晶溶解充分后,将孔板置于调设为490 nm波长的酶标仪检测其OD值,计算用药后143B细胞抑制率、其IC50值和联合用药的评价。
2.2.3. 金氏公式 [6] [7] 评价48 h联合用药效果
通过取得BF IC50值和DDP IC50值,BF设置3个浓度组(1/4 IC50, 1/2 IC50, IC50),DDP设置3个浓度组(1/4 IC50, 1/2 IC50, IC50),BF和DDP联合用药3个浓度组(BF 1/4 IC50 + DDP 1/4 IC50, BF 1/2 IC50 + DDP 1/2IC50, BF IC50 + DDP IC50),行MTT检测求OD值,计算143B细胞增殖抑制率,用金氏公式计算q值评价其联合效果。公式:q = IAB/(IA + IB − IA × IB),IAB代表两药联合细胞抑制率,IA、IB分别代表单药细胞抑制率,其中联合拮抗作用为q < 0.85,相加作用为0.85~1.15,协同作用为q > 1.15。
2.2.4. 倒置显微镜观测OS-143B细胞形态学
6 × 104个/mL的细胞悬液,以3 mL/孔接种于六孔板,设置空白对照组、BF组、DDP组、BF+DDP组,待12 h后143B细胞贴壁完全分别加药处理48 h,倒置显微镜下观察。
2.2.5. 荧光显微镜观察荧光染色后OS-143B细胞凋亡形态
(前期操作同2.2.4)加Hoechst33258染液充分覆盖细胞,再将六孔板放入培养箱培养30分钟,弃除染液,PBS洗涤3~4次,置于荧光显微镜下观察。
2.2.6. 细胞分选仪检测OS-143B细胞凋亡
(前期操作同2.2.4)细胞培养48 h后,吸取各孔培养基于对应15 mL离心管,4℃,2000 rpm离心5 min,弃上清。用1.5 mL PBS清洗2次后1 mL PBS重悬,移入1.5 mL对应EP,加500 ul Binding Buffer入EP管,按检测分组依次加5 ul Annexin V-FITC和5 ul PI混匀,室温避光反应15 min,2000 rpm离心5 min,弃上清,加500 ul PBS重悬,2000 rpm离心5 min,弃除上清,加入500 ul Binding Buffer重悬细胞装入各组流式管待机检测。
2.2.7. 流式细胞仪检测OS-143B细胞周期
(前期操作同2.2.4)细胞培养48 h后,弃除各组上清液装入对应15 mL离心管,用PBS洗涤2~3次,1000 rmp离心5 min,弃上清,PBS清洗一次,1000 rmp离心5 min,再弃上清,用1.5 mL含PBS的75%乙醇重悬细胞,置于4℃冰箱固定过夜。离心管中固定液1000 rmp离心5 min,弃上清,用1.5 mL的PBS重悬后置于2 mL EP管,1000 rmp离心5 min,弃上清,加500 ul含Rnase和TritonX-100的混合液和PI液20 ul,37℃水浴锅内避光30 min,尼龙膜过滤至流式管,上机检测。
2.2.8. Western blot 检测143B细胞相关凋亡蛋白表达
(前期操作同2.2.4)细胞总蛋白和核蛋白的抽提方法按照核蛋白/胞浆蛋白试剂盒操作说明进行,蛋白浓度使用常规BCA法检测。根据标准曲线计算各组蛋白上样体积,95℃变性10 min,上样后SDS-PAGE电泳(5%浓缩胶,12%分离胶),再电转至PVDF膜,室温加入BSA封闭液中封闭2 h,加入一抗,摇床4℃过夜。再加入相应二抗孵育45 min,漂洗3次(TBST,每次10 min),室温摇床孵育2 h。在避光显影室用ECL A液和B液按800:800比例混合,PVDF膜在混合液中浸湿,置于凝胶成像系统显影成像保存。用Image J软件检测目的蛋白条带,β-actin为内参,目的蛋白条带比内参求蛋白相对表达量。
2.2.9. 统计学分析
采用SPSS 22.0软件进行数据分析,数据以 ± s表示,P < 0.05为差异有统计学意义。
3. 结果
3.1. BF和DDP单用对OS-143B细胞增殖的影响
MTT法检测不同浓度BF (6.25、12.5、25、50和100 nmol)及DDP (50、100、200和400 ng/mL)在24、48、72 h对骨肉瘤143B细胞增殖的影响。BF (见图1(a))和DDP (见图1(b))在三个时间点均显著抑制143B细胞增殖,且与药物浓度(P < 0.05, P < 0.01)和作用时间呈正相关(P < 0.05, P < 0.01)。应用SPSS软件分别计算出BF和DDP干预143B细胞48 h的IC50值为15 nmol和150 ng/ml。本研究侧重于BF联合DDP对骨肉瘤143B细胞的影响,故后续实验均采用药物干预48 h后进行检测。
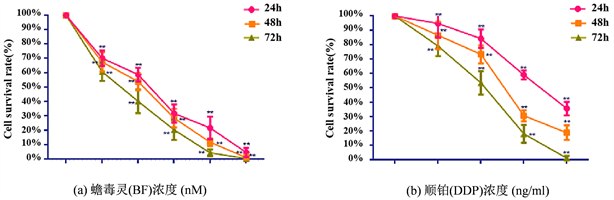 注:与对照组比较,*P < 0.05,**P < 0.01。
注:与对照组比较,*P < 0.05,**P < 0.01。
Figure 1. Effects of different concentrations of BF and DDP on osteosarcoma 143B cells at 24, 48 and 72 hours by MTT
图1. MTT法检测不同浓度的BF和DDP在24、48、72小时下对骨肉瘤143B细胞的影响
3.2. BF联合DDP对OS-143B细胞增殖影响效果评价
如3.1计算BF、DDP的IC50值分别为15 nmol、150 ng/mL,则BF设置浓度为3.75 nmol、7.5 nmol和15 nmol,DDP设置浓度为37.5 ng/mL、75 ng/mL和150 ng/mL,BF + DDP用药浓度为3.75 nmol + 37.5 ng/mL,7.5 nmol + 75 ng/mL,15 nmol + 150 ng/mL,分别对OS-143B细胞干预48 h后行MTT实验,计算143B细胞各组浓度的细胞增殖抑制率,采用金氏公式计算q值评价联用效果(见2.2.2)。计算BF + DDP (15 nmol + 150 ng/mL)干预细胞48 h后q值为1.29,大于1.15,表明此联合浓度对OS-143B细胞的抑制具有协同作用,所以后续实验的分组为阴性对照组、BF (15 nmol)组、DDP (150 ng/mL)组、BF + DDP (15 nmol + 150 ng/mL)组,药物干预时间为48 h。
3.3. 各组药物对OS-143B的细胞形态的影响
对照组、BF组、DDP组和BF + DDP组干预48 h后,使用倒置显微镜(40×)观测各组OS-143B细胞生长状况,对照组143B细胞增殖速度快,生长旺盛,细胞贴壁和生长密集程度较好。BF组和DDP组单药组较对照组143B细胞密度降低、变形皱缩,漂浮细胞数明显增多,贴壁不良。BF + DDP组比两单药组的细胞数明显减少,细胞间距明显增大,皱缩变圆,大量漂浮细胞聚堆,贴壁极差,见图2。
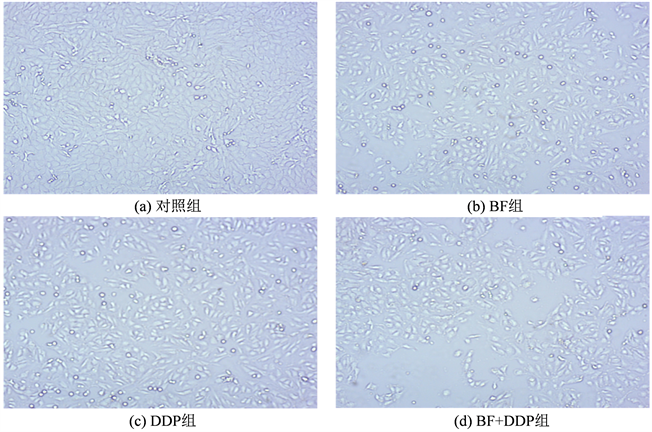
Figure 2. Effects of BF, DDP and BF + DDP groups on morphological changes of 143B cells by inverted microscope (40×)
图2. 倒置显微镜观察BF、DDP和BF + DDP组对143B细胞形态学的影响(40×)
3.4. 各组药物对OS-143B细胞凋亡的作用
Hoechst33258染色后荧光倒置显微镜(300×)观察结果,对照组143B细胞形态正常,可见微弱均匀的淡蓝色荧光,而BF组和DDP单药组较对照组细胞数目减少,且均可见少量细胞致密浓染。BF + DDP组较单药组,细胞数目显著减少,细胞呈斑块或呈碎块状致密浓染的细胞核明显增加,细胞透亮且部分细胞出现核碎裂、固缩典型性凋亡形态,见图3。

Figure 3. Effects of BF, DDP and BF + DDP groups on the apoptotic morphological changes of 143B cells by Hoechst 33258 staining assay (300×)
图3. 33258荧光染色法检测BF和DDP单用及联合使用对143B细胞凋亡形态学的影响(300×)
3.5. 各组药物对OS-143B细胞凋亡率的影响
Annexin V-FITC/PI双染色后,细胞分选仪检测各组细胞凋亡率,BF组细胞凋亡率(43.35 ± 4.27)%和DDP组细胞凋亡率(43.51 ± 3.01)%均较对照组细胞凋亡率(17.80 ± 2.38)%显著增高(P < 0.01);而BF + DDP组细胞凋亡率(62.75 + 4.26)%显著高于BF组和DDP组(P < 0.01),见图4。
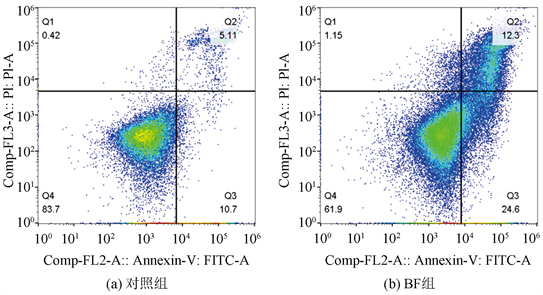
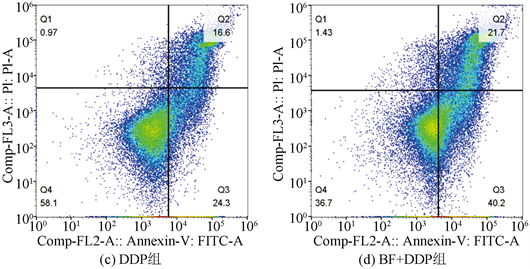
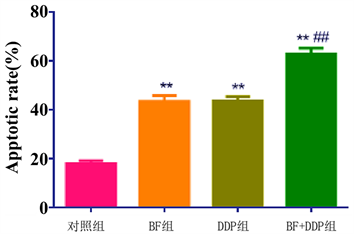 注:与对照组比较,*P < 0.05,**P < 0.01;与单药组比较,#P < 0.05,##P < 0.01。
注:与对照组比较,*P < 0.05,**P < 0.01;与单药组比较,#P < 0.05,##P < 0.01。
Figure 4. Effects of BF, DDP and BF + DDP groups on apoptotic rate of osteosarcoma 143B cells by cell sorter
图4. 细胞分选仪检测BF,DDP和BF + DDP组对骨肉瘤143B细胞凋亡率的影响
3.6. 各组药物对OS-143B细胞周期的影响
PI染色后经流式细胞仪检测各组的细胞周期,BF组和DDP组较对照组细胞在S、G2期阻滞显著增强,其中BF组阻滞主要在G2期细胞阻滞由7.5%上升至18.85% (P < 0.05),而DDP组在S期细胞阻滞由26.12%上升至38.77% (P < 0.05)、G2期细胞阻滞由7.5%上升至22.24% (P < 0.05);BF + DDP组S期细胞阻滞由26.12%上升至42.10% (P < 0.01),G2期细胞阻滞由7.5%上升至28.18% (P < 0.01),见图5。
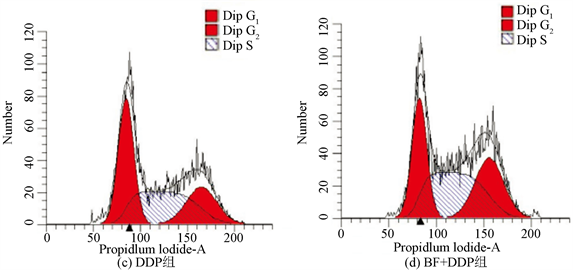
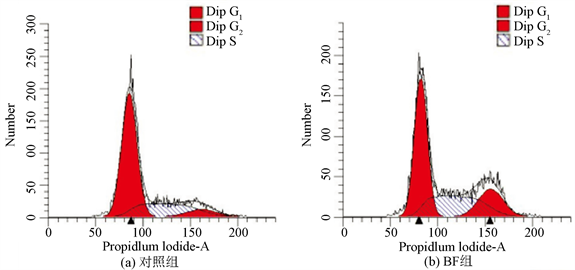
 注:与对照组比较,*P < 0.05,**P < 0.01;与单药组比较,#P < 0.05,##P < 0.01。
注:与对照组比较,*P < 0.05,**P < 0.01;与单药组比较,#P < 0.05,##P < 0.01。
Figure 5. Effects of BF, DDP and BF + DDP groups on cell cycle of osteosarcoma 143B cells by flow cytometry
图5. 流式细胞仪检测BF,DDP和BF + DDP组对骨肉瘤143B细胞周期的影响
3.7. 各组药物对OS-143B细胞凋亡相关蛋白表达的影响
Western bolt检测Bax、Caspase-3和Bcl-2等细胞凋亡相关蛋白表达。BF组、DDP组和BF + DDP组中Bax和Caspase-3表达均较对照组显著增高(P < 0.01),其中DDP组较BF表达增高(P < 0.01),而BF + DDP组较BF、DDP单药组均显著增高(P < 0.01)。BF组、DDP组和BF + DDP组中Bcl-2表达较对照组均显著降低(P < 0.01),其中DDP组Bcl-2的表达较BF组降低,而BF + DDP组中Bcl-2表达较BF和DDP单药组均显著降低(P < 0.01),见图6。

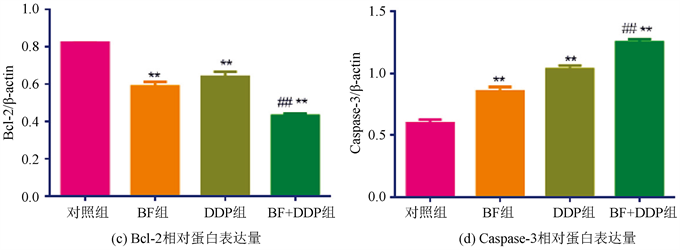 注:与对照组比较,*P < 0.05,**P < 0.01;与单药组比较,#P < 0.05,##P < 0.01。
注:与对照组比较,*P < 0.05,**P < 0.01;与单药组比较,#P < 0.05,##P < 0.01。
Figure 6. Effects of BF, DDP and BF + DDP groups on the protein expression of Bax, Bcl-2 and Caspase-3 in osteosarcoma 143B cells by Western blot
图6. Western blot检测BF,DDP和BF + DDP组对骨肉瘤143B细胞Bax,Bcl-2和Caspase-3蛋白表达的影响
4. 讨论
OS在恶性骨肿瘤比例高达20%,属最常见的原发性骨恶性肿瘤 [8] [9]。目前治疗OS以术前化疗、手术切除治疗和术后辅助化疗为主,治疗后的OS具有转移早、复发高、预后较差的特点。治疗OS常规化疗药物DDP等的大剂量使用,造成了强烈的毒副作用和多重耐药性从而限制其在临床的推广 [10] [11]。BF属于细胞的拓扑异构酶II抑制剂,可对增殖的肿瘤细胞产生抑制、阻止肿瘤细胞分裂和促使其凋亡得作用 [12] [13],对多种恶性肿瘤有明显抗瘤和逆转药物耐受性的效果 [14]。因此,联合应用BF和DDP,既可发挥双重抗瘤作用,同时又能够降低单药使用浓度,减轻毒副作用。通过中西药联合用药,协同作用治疗OS。
本研究首先采用MTT法检测单独使用不同浓度BF和DDP作用于OS-143B细胞不同时间后,对瘤细胞增殖的影响。结果显示,BF和DDP均可在体外抑制该细胞的增殖和促进其凋亡,且抑制效果与药物浓度和作用时间呈正相关。表明单独使用BF和DDP可有效抑制肿瘤细胞增殖,药物浓度高、作用时间长抑制瘤细胞增殖增长效果强。计算BF、DDP的IC50值分别为15 nmol、150 ng/mL,因实验主要考察BF和DDP联合作用,采用金氏公式评价分析联用效果,BF浓度为15 nmol和DDP浓度为150 ng/mL两者联合时q值为1.29大于1.15,说明BF和DDP联合有协同作用。后续分组分别在单独或联合使用BF和DDP的1/4 IC50、1/2 IC50和IC50浓度体外干预OS-143B细胞48 h后进行相应检测。
倒置显微镜观察结果表明,BF、DDP单药组和BF + DDP组均显著抑制OS-143B细胞生长,联合组较单药组对抑制效果增强。荧光染色后细胞分选仪分别对各组染色和凋亡率的检测则表明,BF + DDP组较各单药组诱导OS-143B细胞凋亡率显著增高。流式细胞仪对各组细胞周期检测结果显示,BF + DDP组较各单药组对OS-143B细胞S和G2期的阻滞显著增强。说明体外BF + DDP联合作用对OS-143B细胞无论是阻滞其生长,还是促进其凋亡的效果比单独使用BF或DDP显著提高,两药联合应用表现出更强的协同效应。
当今抗肿瘤药物研究的主要作用靶点是诱导肿瘤细胞凋亡 [15]。细胞凋亡可分为依赖Caspase的凋亡途径和非依赖Caspase的凋亡途径两大类,依赖Caspase的凋亡途径可分为死亡受体、线粒体和内质网介导三类。Caspase-3的激活将会引起肿瘤细胞不可逆的级联反应性凋亡,Bax和Bcl-2则是线粒体凋亡途径中的重要分子,其中Bax可促进细胞凋亡,而Bcl-2则抑制细胞凋亡 [16]。本研究发现,BF、DDP单药组和BF+DDP组较对照组Caspase-3和Bax表达显著增加,而Bcl-2表达显著却减低;BF + DDP组较单药组Caspase-3、Bax表达显著增加,Bcl-2显著减少。这表明BF、DDP可通过诱导OS-143B细胞高表达Caspase-3、Bax,促进细胞凋亡,降低Bcl-2表达,减弱抗凋亡能力。而BF + DDP联合诱导促进OS-143B细胞凋亡,降低其抗凋亡的作用显著高于单独使用两种药物。BF、DDP引起OS-143B细胞中Caspase-3、Bax和Bcl-2三种凋亡相关分子表达的变化,可能是药物促进细胞凋亡的作用机制。
5. 结论
综上所述,单用BF、DDP及BF + DDP联合用药均可有效抑制OS-143B细胞生长并促进其凋亡,其作用可能通过药物诱导该细胞Caspase-3高表达后促使线粒体凋亡途径中Bax/Bcl-2通路来实现。BF + DDP较单用二药对抑制OS细胞生长、促进其凋亡的作用显著增强,提示BF与DDP协同抗肿瘤作用明显增强,同时可降低单药的剂量和毒副作用。
基金项目
国家自然科学基金(81760289)和湖北省风湿性疾病发生与干预重点实验室开放基金共同资助(OIR19008A)。
文章引用
贾 林,张人龙,王嘉军,张 伟. 蟾毒灵联合顺铂对骨肉瘤143B细胞凋亡的影响
The Effect of Bufalin Combined with Ciplatin on Apoptosis of Osteosarcoma 143B Cells[J]. 临床医学进展, 2020, 10(11): 2674-2683. https://doi.org/10.12677/ACM.2020.1011407
参考文献
- 1. Misaghi, A., Goldin, A., Awad, M., et al. (2018) Osteosarcoma: A Comprehensive Review. SICOT-J, 4, 12-20. https://doi.org/10.1051/sicotj/2017028
- 2. Olivo, M. and Ali-Seyed, M. (2007) Apoptosis Signalling Mechanisms in Human Cancer Cells Induced by Calphostin-PDT. International Journal of Oncology, 30, 537-543. https://doi.org/10.3892/ijo.30.3.537
- 3. Meyers, P.A., Schwartz, C.L., Krailo, M.D., et al. (2015) Osteosarcoma: The Addition of Muramyl Tripeptide to Chemotherapy Improves Overall Survival—A Report from the Children’s Oncology Group. Journal of Clinical Oncology, 26, 633-638. https://doi.org/10.1200/JCO.2008.14.0095
- 4. Zhu, Z., Sun, H., Ma, G., et al. (2012) Bufalin Induces Lung Cancer Cell Apoptosis via the Inhibition of PI3K/Akt Pathway. International Journal of Molecular Sciences, 13, 2025-2035. https://doi.org/10.3390/ijms13022025
- 5. Strauss, S.J. and Whelan, J.S. (2018) Current Questions in Bone Sarcomas. Current Opinion in Oncology, 30, 1-10. https://doi.org/10.1097/CCO.0000000000000456
- 6. 金正均. 合并用药中的相加[J]. 中国药理学报, 1980, 1(2): 70-76.
- 7. 金正均, 张效文. 概率和曲线与“Q50” [J]. 上海第二医学院学报, 1981, 1(1): 15-18.
- 8. Saraf, A.J., Fenger, J.M. and Roberts, R.D. (2018) Osteosarcoma: Accelerating Progress Makes for a Hopeful Future. Frontiers in Oncology, 8, 4-11. https://doi.org/10.3389/fonc.2018.00004
- 9. Milroy, M.J. (2018) Cancer Statistics: Global and National. In: Hopewood, P. and Milroy, M., Eds., Quality Cancer Care, Springer, Cham, 29-35. https://doi.org/10.1007/978-3-319-78649-0_3
- 10. 曹思思, 张毕奎. 顺铂肝毒性机制的研究进展[J]. 中南药学, 2016, 14(6): 641-643.
- 11. 林清, 刘炜, 张慧卿, 等. 蟾毒灵抗肿瘤作用的分子机制研究进展[J]. 中医药导报, 2016(10): 40-42.
- 12. 祝利民. 蟾毒灵抗肿瘤作用的实验研究进展[J]. 中华中医药学刊, 2014(9): 2246-2248.
- 13. Chen, Y., Guo, Q., Zhang, B.O., et al. (2012) Bufalin Enhances the Antitumor Effect of Gemcitabine in Pancreatic Cancer. Oncology Letters, 4, 792-800. https://doi.org/10.3892/ol.2012.783
- 14. Danova, M., Torchio, M., Comolli, G., et al. (2018) The Role of Automated Cytometry in the New Era of Cancer Immunotherapy (Review). Molecular and Clinical Oncology, 8, 568-576. https://doi.org/10.3892/mco.2018.1701
- 15. Min, X., Heng, H., Yu, H.L., et al. (2018) Anticancer Effects of 10-Hydroxycamptothecin Induce Apoptosis of Human Osteosarcoma through Activating Caspase-3, p53 and Cytochrome c Pathways. Oncology Letters, 15, 2459-2463. https://doi.org/10.3892/ol.2017.7610
- 16. Kulsoom, B., Shamsi, T.S., Afsar, N.A., et al. (2018) Bax, Bcl-2, and Bax/Bcl-2 as Prognostic Markers in Acute Myeloid Leukemia: Are We Ready for Bcl-2-Directed Therapy? Cancer Management & Research, 10, 403-416. https://doi.org/10.2147/CMAR.S154608
NOTES
*通讯作者。
#同等贡献作者。