Traditional Chinese Medicine
Vol.
11
No.
06
(
2022
), Article ID:
58416
,
9
pages
10.12677/TCM.2022.116189
红景天苷通过抑制炎症因子减轻急性肺损伤
赵敏,张顺发,牛永,李本富*
丽江文化旅游学院,云南 丽江
收稿日期:2022年10月28日;录用日期:2022年11月17日;发布日期:2022年11月28日

摘要
目的:探讨红景天苷(Sal)对脂多糖(LPS)诱导的急性肺损伤(ALI)炎症因子的作用。方法:将36只SD大鼠随机分成6组,分别为生理盐水对照组(NS组)、5 mg/kg LPS损伤组(LPS组)、不同浓度的Sal处理组(10 mg/mL、40 mg/mL、80 mg/mL)、阳性对照组(5 mg/kg地塞米松组(DEX组)),每组6只。大鼠腹腔注射LPS构建急性肺损伤模型。造模6 h后观察大鼠一般活动状况,然后处死大鼠;取右下肺叶计算肺湿重和干重质量比值变化(W/D);右肺上叶做组织匀浆,其余肺组织放在−80度冰箱冻存备用;BCA法测定肺组织中的总蛋白含量;酶联免疫吸附法(ELISA)测定TNF-α、IL-6、GM-CSF、ACE2的含量。结果:Sal处理后的大鼠一般活动状况明显改善;Sal处理后的大鼠肺W/D比值相比LPS组明显降低(P < 0.05);Sal处理后的大鼠总蛋白含量的水平相比LPS组明显降低(P < 0.05);Sal处理后的大鼠相比LPS组肺组织炎症因子(TNF-α、IL-6、GM-CSF)含量明显降低(P < 0.01);Sal处理后的大鼠相比LPS组肺组织中ACE2的含量升高(P < 0.01)。结论:Sal通过抑制炎症因子的产生和提高ACE2的含量而对ALI具有治疗作用。
关键词
红景天苷,急性肺损伤,IL-6,TNF-α,GM-CSF

Salidroside Alleviates Acute Lung Injury by Inhibiting Inflammatory Factors
Min Zhao, Shunfa Zhang, Yong Niu, Benfu Li*
Lijiang Culture and Tourism College, Lijiang Yunnan
Received: Oct. 28th, 2022; accepted: Nov. 17th, 2022; published: Nov. 28th, 2022

ABSTRACT
Objective: To investigate the effect of salidroside (Sal) on inflammatory factors in lipopolysaccharide (LPS)-induced acute lung injury (ALI). Methods: Thirty-six SD rats were randomly divided into 6 groups: normal saline control group (NS group), 5 mg/kg LPS injury group (LPS group), different concentrations of Sal treatment groups (10 mg/mL, 40 mg/mL, 80 mg/mL), positive control group (5 mg/kg dexamethasone group (DEX group)), 6 rats in each group. Rat model of acute lung injury was established by intraperitoneal injection of LPS. After 6 hours of modeling, the general activity of rats was observed, and then the rats were sacrificed. The right lower lobe was taken to calculate the ratio of wet weight to dry weight (W/D). The upper lobe of the right lung was homogenized, and the rest of the lung tissue was stored in the refrigerator at −80˚C. BCA method was used to determine the total protein content in lung tissue. The contents of TNF-α, IL-6, GM-CSF and ACE2 were determined by enzyme-linked immunosorbent assay (ELISA). Results: After Sal treatment, the general activity of rats was significantly improved. The lung W/D ratio of Sal-treated rats was significantly lower than that of LPS group (P < 0.05). The total protein content of Sal-treated rats was significantly lower than that of LPS group (P < 0.05). The contents of inflammatory factors (TNF-α, IL-6, GM-CSF) in lung tissue of Sal-treated rats were significantly lower than those of LPS group (P < 0.01). ACE2 content in lung tissue of Sal-treated rats was increased compared with LPS group (P < 0.01). Conclusion: Sal has a therapeutic effect on ALI by inhibiting the production of inflammatory factors and increasing the content of ACE2.
Keywords:Salidroside, Acute Lung Injury, IL-6, TNF-α, GM-CSF

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
急性肺损伤(Acute lung injury, ALI)是一种由肺血管通透性 [1] 增加引起的非心源性肺水肿引起的低氧呼吸功能不全的肺部炎症综合征。如果ALI不能及时治疗,可发展为急性呼吸窘迫综合征(Acute respiratory distress syndrome, ARDS)。ARDS是一种致命的疾病 [2] [3] [4],其死亡率高达40%的 [5]。因此,早期控制疾病的发展对改善患者的预后具有重要意义。虽然糖皮质激素等西医治疗方法在临床实践中已经存在,但它们可能产生许多不良反应,并不能达到理想的治疗效果。目前,目前还缺乏具体的药物和方法,因此在临床实践中ALI的发病率和死亡率仍然很高。中医主要采用疾病辨证论治的方法,以中药复方或单一中药预防和治疗ALI,并取得了一定的疗效 [6]。
脂多糖(LPS)是革兰氏阴性细菌的一种成分 [7]。LPS进入淋巴和循环系统会干扰全身炎症反应,是ALI的重要危险因素 [8]。促炎细胞因子肿瘤坏死因子α (TNF-α)和白细胞介素6 (IL-6)对炎症反应的启动和调节起作用。研究 [9] [10] 表明,当肺暴露于LPS时,TNF-α的释放迅速发生。
红景天是一种用于治疗高原病(高山缺氧)和缺氧的草药。红景天苷(Sal)是玫瑰红景天的活性成分,具有多种生物学特性,介导抗氧化、抗衰老、抗炎、抗缺氧、抗癌、抗纤维化和抗疲劳作用 [11] [12] [13] [14] [15]。在本研究中,我们研究了Sal在LPS诱导的ALI大鼠模型中的保护作用,并阐明了潜在的抗炎机制。
2. 大鼠与试剂
雄性大鼠从四川成都达硕实验动物有限公司购买(大鼠均为SPF级,类型为SD大鼠,雄性,7~8周龄,200~240 g),饲养于丽江文化旅游学院动物实验中心。红景天苷购买于PCM公司,脂多糖购于美国Sigma公司。阳性药物,根据文献 [16] [17] 选择地塞米松。由于地塞米松(DEX)是糖皮质激素类药物,因此临床上常用来治疗炎。TNF-α、IL-6、GM-CSF和血管紧张素转化酶2 (ACE2) ELISA试剂盒购买于北京四正柏生物科技有限公司。
3. 方法
3.1. 动物分组及模型建立
(一) 动物分组:将刚购买回来的SD大鼠,放在鼠笼中给予食物和水适应1周,一周后随机采用数字标记法分成6组,每组6只,即生理盐水组(NS组)、5 mg/kg脂多糖损伤组(LPS组)、5 mg/kg脂多糖 + 10 mg/kg红景天组(Sal-L组)、5 mg/kg脂多糖 + 40 mg/kg红景天组(Sal-M组),5 mg/kg脂多糖 + 80 mg/kg红景天组(Sal-H组)、5 mg/kg脂多糖 + 5 mg/kg地塞米松组(DEX组)。
(二) 急性肺损伤模型建立:实验前所有大鼠禁食12小时,自由饮水。
① NS组:−30分钟时0.3 mL生理盐水腹腔注射,0点时0.3 mL生理盐水注射。
② LPS组:−30分钟时0.3 mL生理盐水腹腔注射,0点时5 mg/kg LPS腹腔注射。
③ Sal-L组:−30分钟时10 mg/kg红景天组腹腔注射,0点时5 mg/kg LPS腹腔注射。
④ Sal-M组:−30分钟时40 mg/kg红景天组腹腔注射,0点时5 mg/kg LPS腹腔注射。
⑤ Sal-H组:−30分钟时80 mg/kg红景天组腹腔注射,0点时5 mg/kg LPS腹腔注射。
⑥ DEX组:−30分钟时5 mg/kg地塞米松腹腔注射,0点时5 mg/kg LPS腹腔注射。各组处理完后,放于鼠笼中,自由饮食和饮水。
3.2. 取材及处理
(一) 肺湿重和干重质量比值的变化(W/D)
取右肺下叶,用滤纸将表面的液体吸干,再于电子天平上称其湿重(W),并记录,随后将右肺下叶放于80度烘箱中,烘干48小时,达到恒重时称其干重(D)。计算肺湿重/干重(W/D)的质量比值,以此变化来反映大鼠肺水肿的严重程度。
(二) 肺组织匀浆的制备
取右肺上叶,置于提前准备好的4度生理盐水中漂洗,去除血渍,用滤纸吸干表面水分,称重,质量在65~70 mg。随后放入盛有适量生理盐水的玻璃匀浆器中,充分匀浆,将组织匀浆置于离心机中以2500 rpm 4度离心15分钟,收集上清液,冻存于−80度冰箱中备用。
3.3. 肺组织蛋白提取和蛋白定量
① 根据RIPA (Radio Immunoprecipitation Assay)裂解液的操作步骤来提取肺组织蛋白,试剂制备:溶解RIPA裂解液并混合。取适量的裂解液,在使用前的几分钟内以1:50的比例将磷酸酶抑制剂II加入RIPA裂解液中,并添加100 mM PMSF至终浓度1 mM。将组织切成小块后,将裂解液以20 mg组织的比例加入到150~250 μL裂解液中,并使用玻璃匀浆器进行匀浆直至完全裂解。组织完全溶解后,以12,000 rpm在4度下离心5分钟,然后取上清液即蛋白质。
② BCA蛋白定量:根据BCA蛋白定量试剂盒操作,试剂准备:取适量的5 mg/mL蛋白质标准液,用PBS稀释至终浓度为0.5 mg/mL蛋白质标准液。根据样品数,将50倍体积的BCA试剂A加到1体积的BCA试剂B中,以配制适量的BCA工作溶液,并充分混合;稀释BSA标准品,根据与待测蛋白样品的稀释度一致的稀释剂直接稀释BSA标准品(稀释梯度为500、400、300、200、100、0 μg/mL);在96孔板中,分别加入20 μL待测蛋白样品和标准品。标记并为每个样品制作3个重复孔(标准产品除外);最后将200 μL准备好的BCA工作溶液加入到每个标准产品和待测样品孔中,并在37度下放置20~30分钟;然后将其取出,在酶标仪中进行测量(波长为A562)。使用EXCLE或其他软件绘制标准曲线并计算样品中的蛋白质浓度。
3.4. 肺组织匀浆中细胞因子含量的ELISA测定
(一) TNF-α、IL-6和GM-CSF的含量测定
取出冻存的各组的肺组织匀浆样品,按照北京四正柏生物科技有限公司的大鼠TNF-α、IL-6和GM-CSF的ELISA说明书操作。试剂准备:提前30分钟从冰箱中取出试剂盒,并平衡至室温。配置缓冲溶液,将浓缩的洗涤溶液和超纯水以1:20的比例稀释;标准品的配置,根据需要将标准品进行稀释,IL-6的稀释浓度梯度为2000、1000、500、250、125、62.5、0 pg/mL;TNF-α的稀释浓度梯度为2000、1000、500、250、125、62.5、0 pg/mL;GM-CSF的稀释浓度梯为1000、500、250、125、62.5、31.25、15.625 pg/mL。根据每孔100 μL计算生物素化抗体工作溶液的总剂量。浓缩的生物素化溶液和生物素化抗体稀释剂以1:100的比例稀释;酶结合物工作液也应与酶结合物浓缩液按照1:100比例配置。
① 根据要测试的样本数量和标准数量计算所需的板条数量。将不同浓度的样品和标准品以100 μL/孔添加到相应的孔中,然后将反应孔用密封胶带密封,并在37度孵育90分钟。
② 洗板4次,从孵箱取出板条后,甩尽孔内液体,再给每孔加洗涤液330 μL,静置30秒后,甩尽孔内液体,最后在滤纸上拍干。将生物素化抗体工作液(100 μl/孔)加入孔中,用封纸封住反应孔,37℃孵育1个小时。
③ 每孔加入酶结合物工作液(100 μL/孔),用封纸封住反应孔,37度孵育半个小时。
④ 洗板4次(同3)。
⑤ 每孔加入显色剂100 μL/孔,避光,37℃孵育10~20分钟。
⑥ 每孔加入终止液100 μL/孔,终止显色,混匀后5分钟内测量OD450值。
⑦ 浓度计算:标准品、对照和样品的OD值减去零标准的OD值,取两个复孔的平均值,根据标准品的标准曲线,得出样品的TNF-α、IL-6和GM-CSF的浓度。
(二) ACE2的含量测定
① 加样:分别设置空白孔(空白对照孔不加样品和ELISA试剂,其他各步操作相同)。将50 μL标准品或样品加入抗体预涂微滴度板的适当孔中,轻轻混合。37℃孵育45分钟。
② 配置液:30倍洗涤液用蒸馏水稀释30倍备用。
③ 洗涤:取液,甩干,每孔加入洗涤缓冲液,静置30秒后取出,重复4次。
④ 加入生物素化抗-IgG:所有孔加入稀释的生物素化抗-IgG 50 μL,37℃孵育30分钟。
⑤ 清洗:同3操作。
⑥ 加入链霉亲和素HRP:各孔加入链霉亲和素HRP 50 μL,37℃轻轻混匀,孵育15分钟。
⑦ 清洗:同3操作。
⑧ 显色:先加入显色剂A 50 μL,再加入显色剂B 50 μL,37℃孵育15分钟。
⑨ 停止反应:每孔加50 μL终止液。(蓝色立即变为黄色)。
⑩ 测定:取空白样置零,加入终止液后在450 nm处,15 min内测定光密度(OD)。
4. 统计学分析
采用EXCEL记录实验数据,实验计量数据用 表示,采用prism8.0.2统计软件进行分析,各组间数据的比较采用t检验,两两比较用P < 0.05或P < 0.01为差异有统计学意义。
5. 实验结果
5.1. 大鼠一般活动状况及全肺大体观
对照组(NS)大鼠活动状况良好,活动自如,没有呼吸急促表现。LPS组大鼠活动缓慢,呼吸急促,精神萎靡。与LPS组相比,DEX组与各红景天苷组的大鼠有不同程度的改善且肺组织出血和淤血减少。
5.2. 肺组织湿重和干重的比值(W/D)
如表1所示,与NS对照组比,LPS组W/D比值明显升高(P < 0.05),提示大鼠经腹腔注射LPS后会导致大鼠肺含水量增加。与LPS组比,DEX组W/D比值明显下降(P < 0.05)。不同剂量的Sal处理后,都会有不同程度的下降(P < 0.05),其中Sal-M组的W/D比值下降最为明显。
Table 1. Ratio of wet weight to dry weight of lung tissue (W/D)
表1. 肺组织湿重和干重的比值(W/D)
*P < 0.05 VS NS group; #P < 0.05 VS LPS group. Mean ± SD, n = 6.
5.3. 各组肺组织的总蛋白定量
如表2所示,与NS对照组比,LPS组总蛋白含量明显升高(P < 0.05),提示大鼠经腹腔注射LPS后会导致大鼠肺总蛋白量增加。与LPS组比,DEX组总蛋白量明显下降(P < 0.05)。不同剂量的Sal处理后,肺总蛋白量都会有不同程度的下降(P < 0.05)。
Table 2. Protein quantity of lung tissue in each group
表2. 各组肺组织的蛋白定量
*P < 0.05 VS NS group; #P < 0.05 VS LPS group. Mean ± SD, n = 6.
5.4. 肺组织匀浆中TNF-α、IL-6、GM-CSF、ACE2的ELISA浓度检测
如图1所示:与NS组相比,腹腔注射LPS,肺组织匀浆中的IL-6、TNF-α、GM-CSF含量明显上升(P < 0.01);与LPS组比,DEX组中的IL-6、TNF-α、GM-CSF含量明显下降(P < 0.01);不同剂量组Sal肺组织匀浆中的IL-6、TNF-α、GM-CSF含量均有所下降(P < 0.01);其中Sal-M组IL-6、TNF-α、GM-CSF含量下降较为明显。
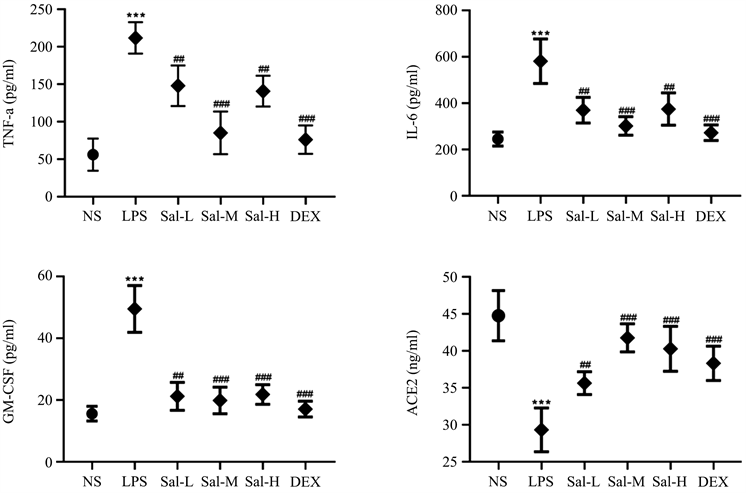
Figure 1. ELISA concentration changes of TNF-α, IL-6, GM-CSF and ACE2 in lung homogenate
图1. 肺组织匀浆中TNF-α、IL-6、GM-CSF、ACE2的ELISA浓度变化
6. 讨论
炎症因子是免疫细胞分泌的低分子蛋白或多肽,包括白介素、干扰素、肿瘤坏死因子、集落刺激因子等 [18],具有广泛生物学活性。在人体中受到病毒和其他感染后,组织和器官中的免疫细胞会分泌多种细胞因子和趋化因子,然后将白细胞和淋巴细胞募集到病变部位,并不断被激活和增加,通过释放炎性介质来消除病毒 [19],但是炎性因子的过度增加会损害免疫系统的稳态和正常细胞的功能,从而引起细胞因子的风暴。ARDS是急性肺损伤的严重阶段,是由于创伤、烧伤和败血症等应激所引起的严重并发症,可导致非心源性呼吸衰竭与死亡。由于其病因复杂以及死亡率高,ARDS一直是研究的焦点。因此,想要阻断ARDS,首先要对ALI进行治疗。
LPS是革兰阴性杆菌外膜的主要成分,能进入血液循环引起剧烈的炎症反应,处理不及时会导致死亡。当LPS袭击肺部时,会引起肺泡毛细血管膜的损害,导致一系列致炎介质的释放,引发失控性炎症反应 [20];并且LPS诱导的ALI以肺组织炎症为特征 [21]。研究证实,在LPS诱导的ALI中,一个复杂的细胞因子网络介导炎症反应。炎症细胞因子TNF-α、IL-6和IL-1β在ALI大鼠和小鼠模型中显著增加 [22]。血管紧张素(Ang II)通过血管紧张素转换酶(ACE)从Ang I转化而来 [23]。ACE2是一种单羧肽酶,可产生Ang 1-7。研究 [24] 表明,ACE2表达的增加可减少LPS诱导的炎症和肺损伤。
Sal具有广泛的药理作用,其中最显著的就是抑制炎症因子,降低其水平;通过抗氧化、抗炎和抗缺氧作用介导细胞保护,并抑制自由基的产生 [25]。大量的体内实验证明 [26] [27] [28],红景天苷可以抑制炎症因子的产生而对肺组织具有保护作用。
本实验显示经腹腔注射LPS 6 h,大鼠活动缓慢,呼吸急促,精神萎靡。取肺标本可见肺组织肿胀,双肺表面出血及淤血,有较多的红色渗出物。研究结果显示,Sal能够明显缓解肺炎的一般症状,减轻肺组织的弥漫性出血和渗出,降低W/D的比值能够有效的减轻肺水肿。由于肺炎的损伤程度与炎症因子的分泌具有极大的关系。因此我们首先检测了肺组织的总蛋白含量的变化,发现实验组的总蛋白浓度远远高于对照组,并且给予不同浓度Sal后,发现总蛋白的含量相比较实验组来看,有显著的降低。推测出实验组某些炎症因子的含量可能有所升高,所以我们检测了一些和炎症相关的炎症因子。结果显示,红景天苷能够明显减少IL-6、TNF-α和GM-CSF的含量;符合实验组中总蛋白含量升高的结果,Sal能够降低肺炎中肺组织总蛋白含量。ACE2是肾素–血管紧张素系统(renin-angiotensin system, RAS)的负调节剂,可平衡ACE的多种功能。对心血管系统和其他器官有明显的保护作用。ACE2能够通过调节ACE2/Ang-(1-7)/Mas和ACE/Ang II/AT1轴维持RAS的动态平衡,减轻炎症反应,保护肺损伤。我们的实验证明了红景天苷能够使肺炎状态下的ACE2含量升高。从我们的实验结果可以推测红景天苷通过抑制炎症因子的分泌,和升高ACE2含量来保护肺组织。可能是治疗肺炎的潜在药物。但是Sal经过何种机制来抑制肺炎的发生,升高ACE2含量,来保护肺组织,还未知晓。
IL-1β是一种参与ALI发病机制的细胞因子 [29]。NF-κB信号通路和NLRP3炎症体信号通路调节IL-1β的成熟和分泌 [30]。研究表明,Sal显著抑制LPS诱导的NF-κB激活和NLRP3炎症体表达。这些结果表明,Sal可能通过抑制NF-κB和NLRP3信号通路来抑制LPS诱导的ALI。NLRP3被病原体相关分子模式或损伤相关分子模式激活,以刺激炎症反应。NLRP3炎症体诱导的细胞因子释放需要两个信号:1) 转录调节,即启动:通过激活主要炎性转录因子NF-κB上调NLPR3炎症体成分和合成前IL-1β;2) 炎症小体的组装过程:炎症小体的形成导致IL-1β的成熟和分泌。在未来,我们将关注Sal参与NLRP3炎症体表达的分子机制。
7. 结论
综上所述,TNF-α、IL-6、GM-CSF和ACE2对急性肺损伤的发生发展有着重要作用,Sal对LPS所诱导的大鼠急性肺损伤具有治疗作用,其机制可能与通过抑制炎症因子的分泌和升高ACE2的含量有关。
基金项目
丽江文化旅游学院学院校级科研基金,红景天苷对急性肺损伤炎症因子的作用,编号:2022XY20。
文章引用
赵 敏,张顺发,牛 永,李本富. 红景天苷通过抑制炎症因子减轻急性肺损伤
Salidroside Alleviates Acute Lung Injury by Inhibiting Inflammatory Factors[J]. 中医学, 2022, 11(06): 1300-1308. https://doi.org/10.12677/TCM.2022.116189
参考文献
- 1. Shaw, T.D., McAuley, D.F. and O’Kane, C.M. (2019) Emerging Drugs for Treating the Acute Respiratory Distress Syndrome. Expert Opinion on Emerging Drugs, 24, 29-41. https://doi.org/10.1080/14728214.2019.1591369
- 2. Zhang, Y., Zhang, H., Li, S., et al. (2022) Metformin Alleviates LPS-Induced Acute Lung Injury by Regulating the SIRT1/NF-κB/NLRP3 Pathway and Inhibiting Endothelial Cell Pyroptosis. Frontiers in Pharmacology, 13, Article 801337. https://doi.org/10.3389/fphar.2022.801337
- 3. Reilly, J.P., Calfee, C.S. and Christie, J.D. (2019) Acute Respiratory Distress Syndrome Phenotypes. Seminars in Respiratory and Critical Care Medicine, 40, 19-30. https://doi.org/10.1055/s-0039-1684049
- 4. Fan, E., Brodie, D. and Slutsky, A.S. (2018) Acute Respiratory Distress Syndrome: Advances in Diagnosis and Treatment. JAMA, 319, 698-710. https://doi.org/10.1001/jama.2017.21907
- 5. Matthay, M.A., Zemans, R.L., Zimmerman, G.A., et al. (2019) Acute Respiratory Distress Syndrome. Nature Reviews Disease Primers, 5, Article No. 18. https://doi.org/10.1038/s41572-019-0069-0
- 6. 范文京, 任娟宁, 战秀俊, 李彤, 雷鹏, 任晓亮, 姜苗苗. 桔梗汤及其活性成分治疗急性肺损伤的作用机制研究进展[J]. 中草药, 2022, 53(4): 1230-1239.
- 7. Sperandeo, P., Martorana, A.M. and Polissi, A. (2019) Lipopolysaccharide Biosynthesis and Transport to the Outer Membrane of Gram-Negative Bacteria. In: Kuhn, A., Ed., Bacterial Cell Walls and Membranes. Subcellular Biochemistry, Vol. 92, Springer, Cham, 9-37. https://doi.org/10.1007/978-3-030-18768-2_2
- 8. Chen, T., Guo, Q., Wang, H., et al. (2015) Effects of Esculetin on Lipopolysaccharide (LPS)-Induced Acute Lung Injury via Regulation of RhoA/Rho Kinase/NF-κB Pathways in Vivo and in Vitro. Free Radical Research, 49, 1459-1468. https://doi.org/10.3109/10715762.2015.1087643
- 9. Liu, L., Wang, P., Liang, C., et al. (2013) Distinct Effects of Nampt Inhibition on Mild and Severe Models of Lipopolysaccharide-Induced Myocardial Impairment. International Immunopharmacology, 17, 342-349. https://doi.org/10.1016/j.intimp.2013.06.017
- 10. Jiang, Q., Yi, M., Guo, Q., et al. (2015) Protective Effects of Polydatin on Lipopolysaccharide-Induced Acute Lung Injury through TLR4-MyD88-NF-κB Pathway. International Immunopharmacology, 29, 370-376. https://doi.org/10.1016/j.intimp.2015.10.027
- 11. Xu, F., Xu, J., Xiong, X. and Deng, Y. (2019) Salidroside Inhibits MAPK, NF-κB, and STAT3 Pathways in Psoriasis-Associated Oxidative Stress via SIRT1 Activation. Redox Report, 24, 70-74. https://doi.org/10.1080/13510002.2019.1658377
- 12. Hu, R., Wang, M., Ni, S., et al. (2020) Salidroside Ameliorates Endothelial Inflammation and Oxidative Stress by Regulating the AMPK/NF-κB/NLRP3 Signaling Pathway in AGEs-Induced HUVECs. European Journal of Pharmacology, 867, Article ID: 172797. https://doi.org/10.1016/j.ejphar.2019.172797
- 13. Sun, S., Tuo, Q., Li, D., et al. (2020) Antioxidant Effects of Salidroside in the Cardiovascular System. Evidence-Based Complementary and Alternative Medicine, 2020, Article ID: 9568647. https://doi.org/10.1155/2020/9568647
- 14. Mao, G.X., Xu, X.G., Wang, S.Y., et al. (2019) Salidroside Delays Cellular Senescence by Stimulating Mitochondrial Biogenesis Partly through a miR-22/SIRT-1 Pathway. Oxidative Medicine and Cellular Longevity, 2019, Article ID: 5276096. https://doi.org/10.1155/2019/5276096
- 15. Rong, L., Li, Z., Leng, X., et al. (2020) Salidroside Induces Apoptosis and Protective Autophagy in Human Gastric Cancer AGS Cells through the PI3K/Akt/mTOR Pathway. Biomedicine & Pharmacotherapy, 122, Article ID: 109726. https://doi.org/10.1016/j.biopha.2019.109726
- 16. 高钰琪. 基于新冠肺炎病理生理机制的治疗策略[J]. 中国病理生理杂志, 2020, 36(3): 568-572, 576.
- 17. Xiang, Z., Liu, J.L., Shi, D.K., et al. (2020) Glucocorticoids Improve Severe or Critical COVID-19 through Activating ACE2 and Reducing IL-6 Levels. International Journal of Biological Sciences, 16, 2382-2391. https://doi.org/10.7150/ijbs.47652
- 18. 王玉亮, 王峰, 耿洁. 细胞因子与细胞因子风暴[J]. 天津医药, 2020, 48(6): 494-499.
- 19. Teijaro, J.R. (2017) Cytokine Storms in Infectious Diseases. Seminars in Immunopathology, 39, 501-503. https://doi.org/10.1007/s00281-017-0640-2
- 20. 臧益民, 臧伟进, 王晓明. 心力衰竭的病理生理机制及治疗概述[J]. 心脏杂志, 2002, 14(5): 417-419.
- 21. Reutershan, J., Vollmer, I., Stark, S., et al. (2009) Adenosine and Inflammation: CD39 and CD73 Are Critical Mediators in LPS-Induced PMN Trafficking into the Lungs. The FASEB Journal, 23, 473-482. https://doi.org/10.1096/fj.08-119701
- 22. Ricard, J.D., Dreyfuss, D. and Saumon, G. (2001) Production of Inflammatory Cytokines in Ventilator-Induced Lung Injury: A Reappraisal. American Journal of Respiratory and Critical Care Medicine, 163, 1176-1180. https://doi.org/10.1164/ajrccm.163.5.2006053
- 23. 王悦, 李航, 李腾越. 血管紧张素II在肿瘤发病机制中的研究进展[J]. 吉林医药学院学报, 2017, 38(6): 463-465.
- 24. Ye, R. and Liu, Z. (2020) ACE2 Exhibits Protective Effects against LPS-Induced Acute Lung Injury in Mice by Inhibiting the LPS-TLR4 Pathway. Experimental and Molecular Pathology, 113, Article ID: 104350. https://doi.org/10.1016/j.yexmp.2019.104350
- 25. Zhao, X., Jin, L., Shen, N., et al. (2013) Salidroside Inhibits Endogenous Hydrogen Peroxide Induced Cytotoxicity of Endothelial Cells. Biological and Pharmaceutical Bulletin, 36, 1773-1778. https://doi.org/10.1248/bpb.b13-00406
- 26. 黄莺, 周芬, 袁文胜, 徐芳. 红景天苷改善慢性阻塞性肺疾病炎症模型及气道重塑的机制[J]. 实用医学杂志, 2022, 38(14): 1753-1758.
- 27. 虢强, 朱美意, 张杰, 许杰, 郭友祥. 红景天苷调节CLP诱导的脓毒症小鼠肺纤维化及JAK2/STAT3的活化[J]. 中国免疫学杂志, 2022, 38(10): 1196-1200.
- 28. 王小勤, 幸黔鲁, 马一翔. 红景天苷对高氧致新生小鼠支气管肺发育不良的保护作用研究[J]. 现代医药卫生, 2022, 38(9): 1451-1454.
- 29. Kolb, M., Margetts, P.J., Anthony, D.C., et al. (2001) Transient Expression of IL-1β Induces Acute Lung Injury and Chronic Repair Leading to Pulmonary Fibrosis. The Journal of Clinical Investigation, 107, 1529-1536. https://doi.org/10.1172/JCI12568
- 30. Latz, E., Xiao, T.S. and Stutz, A. (2013) Activation and Regulation of the In-flammasomes. Nature Reviews Immunology, 13, 397-411. https://doi.org/10.1038/nri3452
NOTES
*通讯作者。
