Traditional Chinese Medicine
Vol.
12
No.
09
(
2023
), Article ID:
73179
,
11
pages
10.12677/TCM.2023.129414
基于网络药理学、分子对接探讨青蒿治疗 脓毒症的作用机制
周银
湖北中医药大学第一临床学院,湖北 武汉
收稿日期:2023年7月20日;录用日期:2023年9月14日;发布日期:2023年9月26日

摘要
目的:应用网络药理学方法预测青蒿抗脓毒症的活性成分和作用机制。方法:首先利用TCMSP数据库获取青蒿的活性成分;基于PubChem数据库及SwissTargetPrediction数据库预测活性成分靶点;利用GeneCards数据库获取脓毒症基因,将基因映射到活性成分靶点,得到青蒿抗脓毒症的靶点;使用String数据库构建蛋白互作关系网络(PPI);使用Cytoscape软件构建“青蒿–活性成分–交集靶点”网络图;DAVID数据库进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)通路富集分析;通过分子对接检验核心成分与核心靶点的结合活性。结果:青蒿治疗脓毒症的主要活性成分主要有双氢青蒿素、槲皮素、木樨草素等,获得88个交集靶点,包括SRC、MAPK3、AKT1、MAPK1、EGFR、HSP90AA1、RHOA、MMP9、MAPK14、APP、F2、ADRBK1,这12个靶向基因可能在疾病治疗中起关键作用。获得GO富集条目共544个和KEGG富集通路146条,主要与脂质与动脉粥样硬化、内分泌阻力、肺结核、弓形体病、癌症的途径、EGFR酪氨酸激酶抑制剂耐药性等通路有关。分子对接结果表明青蒿的主要活性成分对核心靶点具备良好的亲和力,在治疗脓毒症中发挥核心作用。结论:初步研究了青蒿治疗脓毒症的作用机制,青蒿具有多成分、多靶点的特点,可以通过多个靶点、多条通路来发挥治疗脓毒症的作用。
关键词
青蒿,脓毒症,网络药理学,分子对接

Based on Network Pharmacology and Molecular Docking, the Mechanism of Action of Artemisia annua in the Treatment of Sepsis Was Discussed
Yin Zhou
The First Clinical College of Hubei University of Chinese Medicine, Wuhan Hubei
Received: Jul. 20th, 2023; accepted: Sep. 14th, 2023; published: Sep. 26th, 2023

ABSTRACT
Objective: To apply network pharmacology to predict the active ingredients and mechanism of action of Artemisia annua anti-sepsis. Methods: First, the active ingredients of Artemisia annua were obtained by TCMSP database. Prediction of active ingredient targets based on PubChem database and SwissTargetPrediction database; the GeneCards database was used to obtain sepsis genes, and the genes were mapped to active ingredient targets to obtain the anti-sepsis target of Artemisia annua. Use the String database to build a protein interaction network (PPI); the Cytoscape software was used to construct the network diagram of “Artemisia annua-active ingredient-intersec- tion target”; DAVID database for gene ontology (GO) enrichment analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment analysis; the binding activity of core components and core targets was tested by molecular docking. Results: The main active ingredients of Artemisia annua in the treatment of sepsis were mainly dihydroartemisinin, quercetin, luteolin, and 88 intersection targets were obtained, including SRC, MAPK3, AKT1, MAPK1, EGFR, HSP90AA1, RHOA, MMP9, MAPK14, APP, F2, ADRBK1, these 12 targeted genes may play a key role in disease treatment. A total of 544 GO enrichment entries and 146 KEGG enrichment pathways were obtained, mainly related to lipid and atherosclerosis, endocrine resistance, tuberculosis, toxoplasmosis, cancer pathways, EGFR tyrosine kinase inhibitor resistance and other pathways. The molecular docking results showed that the main active components of Artemisia annua had good affinity for the core target and played a central role in the treatment of sepsis. Conclusion: The mechanism of action of Artemisia annua in the treatment of sepsis has been preliminarily studied, and Artemisia annua has the characteristics of multi-component and multi-target, which can play a role in the treatment of sepsis through multiple targets and multiple pathways.
Keywords:Artemisia annua, Sepsis, Network Pharmacology, Molecular Docking

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
脓毒症(sepsis)是感染引起宿主反应失调,导致危及生命的器官功能损害的症候群,是一个高发病率、高病死率的临床综合征。脓毒症不但严重威胁人类健康,还给医疗卫生带来了巨大的经济负担。我国脓毒症发病率研究绝大多数是来自ICU住院患者。2020年的一项报告显示,ICU脓毒症的发病率为20.6% [1] 。目前对于脓毒症的治疗主要是使用抗生素、糖皮质激素、血管活性药物、抗凝治疗等,但是这些治疗手段总体效果并不理想。
中医在治疗脓毒症方面有其独特的优势,大量数据表明中药和中药复方,具有良好的抗炎、调节免疫、保护器官功能等作用 [2] [3] 。青蒿(A. annua)为菊科蒿属,始载于《神农本草经》,具有退虚热、凉血、解暑、治疟的功效。现代药理学证实青蒿具有抗疟疾、抗肿瘤、抑菌杀虫、解热抗炎、免疫调节等多种药理活性 [4] 。
网络药理学是将药理学、分子生物学、电子技术和生物信息学相结合,形成中药有效成分、相关靶点、通路以及疾病之间的网络关系的一种很有前景的方法学 [5] 。因此本研究采用网络药理学方法筛选青蒿治疗脓毒症的活性化合物及其作用靶点并探讨其作用机制,旨在为脓毒症治疗提供新的理论依据。
2. 材料和方法
2.1. 数据库和软件
药物成分数据库:中药系统药理学数据库分析平台(TCMSP, http://tcmspw.com/tcmsp.php)。药物靶点数据库:有机小分子生物活性数据库(Pubchem, https://pubchem.ncbi.nlm.nih.gov)。疾病目标数据库:人类基因的综合数据库(GeneCards, https://www.genecards.org/)。小分子药物靶点预测在线平台(SwissTarget Prediction, http://www.swisstargetprediction.ch/)。在线韦恩图(https://bioinfogp.cnb.csic.es/tools/venny/index.html)。微生信平台(http://www.bioinformatics.com.cn/)。Cytoscape3.9.1软件。蛋白质相互作用分析平台(String, https://String-db.org/)。生物信息数据库:(DAVID, https://david.ncifcrf.gov/)。分子对接软件:AutoDock,PyMOL。
2.2. 青蒿活性成分和靶标的收集
青蒿所有的活性成分均取自TCMSP [6] ,分类标准是根据大于或等于0.18的药物相似性(DL)和大于或等于30%的口服生物利用度(OB)定义的,而后将TCMSP数据库中获取的化合物名称输入pubchem数据库,将化合物的SMILES号输入Swiss Target Prediction数据库,获得化合物所有的靶标。
2.3. 筛选用青蒿治疗脓毒症的基因
在Genecards数据库 [7] 中,输入“sepsis”作为检索关键词以获得脓毒症相关靶点,然后利用韦恩图(venny)获得青蒿与脓毒症的交集靶点。
2.4. 构建“药物–活性成分–交集靶点”网络
使用Cytoscape 3.9.1软件进行分析,构建“青蒿–活性成分–交集靶点”关系网络。利用Centiscape 2.2插件计算得到核心成分。
2.5. PPI网络的构建及核心靶点筛选
为了研究青蒿治疗脓毒症的靶蛋白之间的相互作用,将交集靶点通过String数据库 [8] 进行相互作用蛋白查询并构建蛋白相互作用网络(PPI),物种设置为“homosapiens”,设置互相作用评分 ≥ 0.900,隐去没有相互联络的节点,其余参数保持默认设置,得到青蒿治疗脓毒症的蛋白相互作用网络。利用Cytoscape 3.9.1软件计算网络拓扑参数并获得核心靶点。
2.6. GO分析和KEGG通路富集分析
GO分析被广泛应用于生物基因功能分类,主要用于注释基因的功能,包括细胞功能、分子功能等。使用DAVID数据库对交集靶点进行富集分析,以研究青蒿治疗脓毒症靶点的主要生物学过程和代谢通路,将结果导入微生信软件,画图并分析。
2.7. 分子对接验证核心成分与核心靶点的结合能力
在TCMSP数据库中检索并下载核心成分“mol2”格式文件,作为对接的配体。将1.4项下筛选的核心靶点作为分子对接的靶点蛋白,在PDB数据库中下载蛋白结构。采用AutoDock软件完成分子对接,最后运用PyMol软件处理结果。
3. 结果
3.1. 青蒿成分及靶点筛选
利用TCMSP检索,在OB大于等于30%,DL大于等于0.18的条件下进行筛选,去除非靶标成分,获得了22种潜在的有效成分。利用Pubchem和SwissTargetPrediction数据库,设置P值大于0.1,共获得了367个潜在靶点对应于20种潜在有效成分(其中vicenin-2_qt、vitexin_qt对应靶点P值小于0.1,舍去),见表1。
Table 1. Potential active ingredients of Artemisia annua
表1. 青蒿潜在有效成分
3.2. 青蒿治疗脓毒症相关靶点获取结果
从GeneCards数据库中筛选共获得脓毒症相关基因2046个,将疾病基因和药物靶点相交,获得88个交集靶点的韦恩图。见图1。
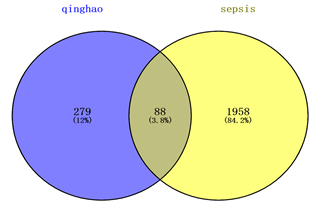
Figure 1. Intersection target information of drug genes (blue) and disease genes (yellow)
图1. 药物基因(蓝色)和疾病基因(黄色)的交集靶点信息
3.3. 构建“药物–活性成分–交集靶点”网络
使用Cytoscape 3.9.1软件进行分析,构建“青蒿–活性成分–交集靶点”关系网络(见图2)。利用Cytoscape插件计算,degree值排名前10的化合物为双氢青蒿素、(乙酸[(2S)-2-[[[(2S)-2-(苯甲酰基氨基)-3-苯基丙酰基]氨基]-3-苯基丙基]乙酸盐、艾黄素、条叶蓟素、柽柳黄素、异鼠李素、泽兰黄醇、槲皮素、藤菊黄素、木樨草素。这些化合物可能是青蒿治疗脓毒症的关键化合物。
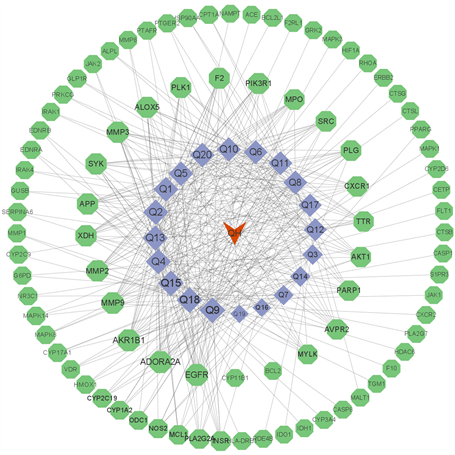
Figure 2. Qinghao-component-target network diagram
图2. 青蒿–活性成分–交集靶点网络构建图
3.4. PPI网络的构建及核心靶点筛选
将青蒿与脓毒症的交集靶点(88个)导入STRING数据库构建PPI网络,借助Cytoscape 3.9.1软件对PPI网络进行拓扑分析,计算自由度、介数、中心度,筛选出核心靶点12个。核心靶点参数值见表2,核心靶点PPI网络见图3。
Table 2. Core targets and topology parameter values
表2. 核心靶点及拓扑参数值
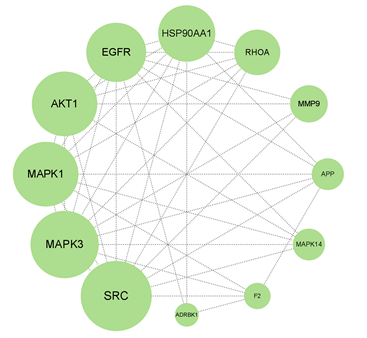
Figure 3. Core target PPI network
图3. 核心靶点PPI网络
3.5. GO和KEGG富集分析
利用DAVID数据库分析药物–疾病交集靶点,GO分析将基因的功能分为三个组成部分,有细胞成分(CC)、生物过程(BP)和分子功能(MF),并富集了385个BP、65个CC、94个MF。利用微生信平台,气泡图中节点的大小和颜色由相关基因的数量和-log10 (p value)值决定。节点大小表示关联了多少个靶基因,从红色到绿色的颜色从高到低反映了-log10 (p value)值。GO分析每个模块的前10个重要项目(P值 ≤ 0.05)如图4所示。在生物过程方面主要与蛋白磷酸化 [9] 、细胞对镉离子的反应、蛋白水解、单萜类代谢过程、凋亡过程的负调控、细胞对脂多糖的反应等有关。在细胞成分方面主要与细胞外空间、大分子复合物、细胞质核周区、细胞质 [10] 、胞外区等有关。在分子功能方面主要与血红素结合 [11] 、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、铁离子结合、酶结合、肽酶活性等有关。
KEGG分析结果显示,这些基因主要富集在146个KEGG通路中,前20个项目如图5所示。结果表明,青蒿中的活性成分可能通过多种途径共同作用,例如脂质与动脉粥样硬化 [12] [13] 、内分泌阻力、肺结核、弓形体病、癌症的途径、EGFR酪氨酸激酶抑制剂耐药性等通路有关。
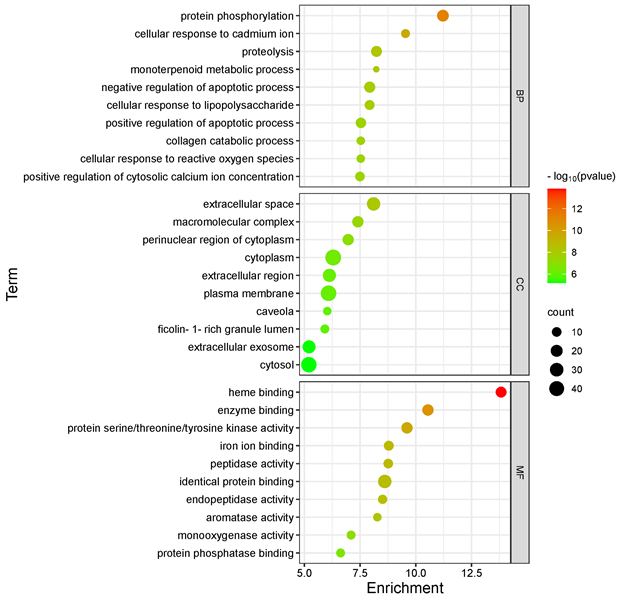
Figure 4. GO enrichment analysis of intersection targets of Artemisia annua in treatment of sepsis
图4. 青蒿治疗脓毒症交集靶点的GO富集分析

Figure 5. KEGG pathway enrichment analysis of Artemisia annua therapeutic sepsis intersection targets
图5. 青蒿治疗脓毒症交集靶点的KEGG通路富集分析
3.6. 分子对接分析
将部分核心成分与核心靶点分别进行分子对接,整理得到分子对接结果,见表3。成分与靶点的结合能均小于−5 kcal/mol,表明两者结合良好。利用PyMol软件对结果进行处理,结果见图6。
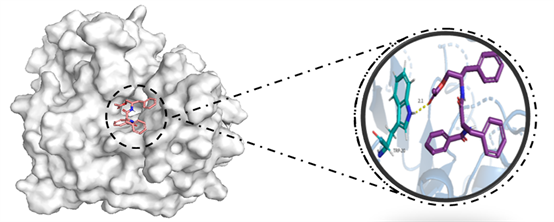

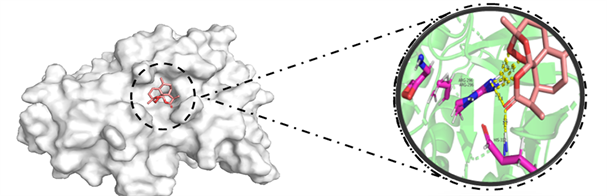
Figure 6. Molecular docking between representative active ingredients and key targets
图6. 部分活性成分与关键靶点的分子对接示意图
Table 3. Binding energy of active ingredients to key targets
表3. 活性成分与关键靶点的结合能
4. 讨论
脓毒症在中医学没有具体记载,结合临床不同阶段表现可将其归为“外感热病”、“脱证”、“暴喘”、“神昏”、“脏竭症”等范围。通过各医家的经验分析发现,脓毒症的病机主要是正虚与邪实,正气不足是发病基础,邪气外侵是发病的重要条件 [14] 。临床研究表明中医药的复方、单方、提取物等在脓毒症的过程中有着重要意义,这些药物能通过调控炎症和免疫反应,改善微循环,增加抗生素的治疗效果,辅助杀菌,减轻脓毒症脏器的炎症损伤,预防脓毒症的发生和进展。
有研究表明双氢青蒿素对脓毒症小鼠血脑屏障损伤具有保护作用,双氢青蒿素通过抑制TNF-α条下脑血管内皮细胞中SNAI1的表达,上调紧密连接蛋白OCLN的表达,从而降低脑血管内皮细胞的通透性,脓毒症脑损伤的保护作用可能与其减轻早期脑损伤、降低血脑屏障通透性、降低脑含水量和脑组织TNF-α含量有关 [15] 。研究表明,柽柳黄素在用LPS激活后减少树突状细胞分泌各种炎性细胞因子。它还促进了抗炎细胞因子白细胞介素(IL)-10的分泌,并特异性地增加了LPS激活的脾细胞中分泌IL-10的免疫细胞的数量 [16] 。艾黄素、条叶蓟素、异鼠李素、槲皮素是黄酮类化合物,具有抗氧化活性 [17] 。槲皮素可能通过上调PI3K/AKT/mTOR通路降低脓毒症小鼠心肌组织炎症和氧化应激反应,从而减轻心肌损伤 [18] 。证据表明,补充槲皮素可能通过减轻炎症和氧化应激、下调toll样受体(TLR)的mRNA表达、调节免疫反应和缓解脓毒症相关器官功能障碍,对脓毒症产生有益影响 [19] 。调节炎症反应是槲皮素最显著的作用之一。报道发现木犀草素可以影响炎症引发途径,如Toll样受体和高迁移率组box-1,并降低产生炎性细胞因子的基因的表达,如Nod受体蛋白-3和活化B细胞的核因子κ轻链增强子。木犀草素还通过调节免疫反应来减少巨噬细胞、中性粒细胞细胞外陷阱和淋巴细胞的过度活跃 [20] 。木犀草素可能通过抑制ROS/TXNIP轴活化,来改善脓毒症ALI小鼠肺组织炎症及氧化应激损伤 [21] 。木犀草素有助于减轻CLP诱导的ALI小鼠模型的肺损伤,并减轻肺组织中caspase-11依赖性细胞焦亡。该机制可能与调节Treg的频率和Treg衍生的IL-10的水平有关 [22] 。
本文通过网络药理学方法,共预测得到SRC、MAPK3、AKT1、MAPK1、EGFR、HSP90AA1、RHOA、MMP9、MAPK14、APP、F2、ADRBK1等12个青蒿治疗脓毒症的关键靶点,体现了中药治疗的多靶点特点。其中,AKT1是AKT的一种亚型,广泛分布在全身组织中,可以被类似的信号通路以PI3K依赖性方式激活,参与细胞凋亡。研究表明,缺乏Akt1的小鼠表现出细胞凋亡增强和生长迟缓 [23] 。SRC家族酪氨酸激酶(SFK)是一组酪氨酸激酶,已被证明在调节免疫细胞募集和宿主防御中起主要作用。此外,显示SRC参与炎症相关的信号通路 [24] 。MAPK1是炎症通路重要一员,是重要的炎症评价指标。MAPK1是丝裂原活化蛋白激酶家族中的一员,参与炎症的各个方面,对细胞生理学和免疫反应的调节具有重要作用。MAPK1的激活可促使炎性因子表达,诱导上皮细胞分泌黏液及杯状细胞增生,进而加重炎症反应。RHOA是一种普遍表达的细胞质蛋白,属于小GTP酶家族。RHOA充当分子开关,与趋化因子、细胞因子和生长因子的结合而被激活,并通过mDia和ROCK信号级联调节细胞骨架蛋白和其他因子的激活 [25] 。Chen [26] 等认为,RhoA/ROCK通路的抑制是香豆素化合物七叶苷改善LPS诱导的肺上皮炎症损伤机制的重要组成部分。HSP90AA1是最重要的热休克蛋白之一。有研究发现HSP90AA1可以通过调节PI3K/Akt/mTOR信号通路促进自噬 [27] 。在脓毒症发生时,SRC介导了NF-κB的降解,诱导了NF-κB的释放和亚基的核转移,启动了TNF-α、IL-6及 IL-1β等炎性因子的合成和释放,可进一步刺激CASP3蛋白的表达,同时会促进HSP90AA1的蛋白表达,其机制可能与PI3K/AKT信号通路相关,炎症因子会刺激RHOA激活,进而刺激其下游分子ROCK,从而激活RhoA/ROCK信号通路 [28] 。
综上所述,本研究通过网络药理学技术对青蒿治疗脓毒症的作用机制进行系统分析,并利用分子对接技术初步验证了作用靶点。结果初步表明青蒿可通过“多靶点、多通路”治疗脓毒症,可缓解炎症反应、免疫抑制,减轻细胞凋亡。本研究存在的局限性包括:无法排除数据库算法差异对结果带来的影响。未来可进一步完善相关实验,对机制加以验证。
文章引用
周 银. 基于网络药理学、分子对接探讨青蒿治疗脓毒症的作用机制
Based on Network Pharmacology and Molecular Docking, the Mechanism of Action of Artemisia annua in the Treatment of Sepsis Was Discussed[J]. 中医学, 2023, 12(09): 2761-2771. https://doi.org/10.12677/TCM.2023.129414
参考文献
- 1. 王仲, 魏捷, 朱华栋, 等. 中国脓毒症早期预防与阻断急诊专家共识[J]. 临床急诊杂志, 2020, 21(7): 517-529.
- 2. 郑兰芝, 丁黎敏, 徐文婷, 等. 基于升降散加减的清透解毒方对脓毒症毒热证患者临床疗效的影响[J]. 中国中西医结合急救杂志, 2022, 29(1): 22-26.
- 3. 刘良, 金瑶瑛, 周心蓓, 等. 从邪伏湿遏论脓毒症合并多重耐药菌感染[J]. 河南中医, 2022, 42(11): 1653-1656.
- 4. 李海波, 秦大鹏, 葛雯, 等. 青蒿化学成分及药理作用研究进展[J]. 中草药, 2019, 50(14): 3461-3470.
- 5. 郑静茹, 季春莲, 占靓卉, 等. 基于网络药理学与实验验证探讨三叶青治疗脓毒症的作用及机制[J]. 中国中药杂志, 2022, 47(17): 4744-4754.
- 6. Ru, J., Li, P., Wang, J., et al. (2014) TCMSP: A Database of Systems Pharmacology for Drug Discovery from Herbal Medicines. Journal of Cheminformatics, 6, Article No. 13. https://doi.org/10.1186/1758-2946-6-13
- 7. Marilyn, S., Dalah, I., Alexander, J., et al. (2010) GeneCards Version 3: The Human Gene Integrator. Database: The Journal of Biological Databases and Curation, 2010, baq020. https://doi.org/10.1093/database/baq020
- 8. Damian, S., Kirsch, R., Koutrouli, M., et al. (2022) The STRING Database in 2023: Protein-Protein Association Networks and Functional Enrichment Analyses for any Sequenced Genome of Interest. Nucleic Acids Research, 51, D638-D646.
- 9. 赵雷, 钱风华, 丁纯蕾, 等. 升降散对脓毒症大鼠心肌p38~(MAPK)蛋白磷酸化水平的影响[J]. 中国临床医学, 2017, 24(1): 6-11.
- 10. 李红梅. 内毒素休克小鼠肝脏细胞质膜蛋白质组学研究[D]: [博士学位论文]. 广州: 南方医科大学, 2008.
- 11. 王凌峰, 卢尧, 孙桂香, 等. 血红素上调STAT3磷酸化放大脂多糖诱导的小鼠炎症反应[J]. 中国输血杂志, 2018, 31(12): 1354-1357.
- 12. 刘玲. 青蒿素及其衍生物体外降脂作用研究[D]: [硕士学位论文]. 上海: 上海交通大学, 2019: 104.
- 13. 吕娜. 脓毒症患者外周血非靶向脂质组学分析研究[D]: [硕士学位论文]. 呼和浩特: 内蒙古医科大学, 2019: 64.
- 14. 孔令博, 晏军, 张迪, 等. 中医药治疗脓毒症领域临床优势的探讨[J]. 中国实验方剂学杂志, 2022, 28(5): 211-218.
- 15. 刘付红. 青蒿及活性成分双氢青蒿素对脓毒症小鼠血脑屏障的保护作用及机制研究[D]: [博士学位论文]. 济南: 山东中医药大学, 2022: 120.
- 16. Park, H.J., Lee, S.J., Cho, J., et al. (2018) Tamarixetin Exhibits Anti-Inflammatory Activity and Prevents Bacterial Sepsis by Increasing IL-10 Production. Journal of Natural Products, 81, 1435-1443. https://doi.org/10.1021/acs.jnatprod.8b00155
- 17. 刘云鹤, 司雨, 焦玉凤, 等. 蒿属植物中黄酮类成分及其药理活性的研究进展[J]. 特产研究, 2020, 42(1): 80-94.
- 18. 吴柳, 蒋永艳, 刘微, 等. 槲皮素通过PI3K/AKT/mTOR通路减轻脓毒症小鼠心肌损伤[J]. 中国急救医学, 2021, 41(3): 238-243.
- 19. Karimi, A., Naeini, F., Asghari, A.V., et al. (2021) A Comprehensive Systematic Review of the Therapeutic Effects and Mechanisms of Action of Quercetin in Sepsis. Phytomedicine, 86, Article ID: 153567. https://doi.org/10.1016/j.phymed.2021.153567
- 20. Vajdi, M., Karimi, A., Karimi, M., et al. (2023) Effects of Luteolin on Sepsis: A Comprehensive Systematic Review. Phytomedicine, 113, Article ID: 154734. https://doi.org/10.1016/j.phymed.2023.154734
- 21. 翁珍丽, 杨勤, 方雪彬. 木犀草素通过ROS/TXNIP轴减轻脓毒症小鼠急性肺损伤的机制[J]. 中国老年学杂志, 2023, 43(13): 3265-3270.
- 22. Zhang, Z.T., Zhang, D.Y., Xie, K., et al. (2021) Luteolin Activates Tregs to Promote IL-10 Expression and Alleviating Caspase-11-Dependent Pyroptosis in Sepsis-Induced Lung Injury. International Immunopharmacology, 99, Article ID: 107914. https://doi.org/10.1016/j.intimp.2021.107914
- 23. Peng, X., Xu, P.Z., Chen, M.L., et al. (2003) Dwarfism, Impaired Skin Development, Skeletal Muscle Atrophy, Delayed Bone Development, and Impeded Adipogenesis in Mice Lacking Akt1 and Akt2. Genes & Development, 17, 1352-1365. https://doi.org/10.1101/gad.1089403
- 24. Eun, B.S., Yi, Y.S., Jueun, O., et al. (2012) The Role of Src Kinase in Macrophage-Mediated Inflammatory Responses. Mediators of Inflammation, 2012, Article ID: 512926. https://doi.org/10.1155/2012/512926
- 25. Bros, M., Haas, K., Moll, L., et al. (2019) RhoA as a Key Regulator of Innate and Adaptive Immunity. Cells, 8, Article No. 733. https://doi.org/10.3390/cells8070733
- 26. Chen, T., Guo, Q.Q., Zhang, H.X., et al. (2015) Effects of Esculetin on Lipopolysaccharide (LPS)-Induced Acute Lung Injury via Regulation of RhoA/Rho Kinase/NF-κB Pathways in Vivo and in Vitro. Free Radical Research, 49, 1459-1468. https://doi.org/10.3109/10715762.2015.1087643
- 27. Xiao, X., Wang, W., Li, Y.Q., et al. (2018) HSP90AA1-Mediated Autophagy Promotes Drug Resistance in Osteosarcoma. Journal of Experimental & Clinical Cancer Research: CR, 37, 201. https://doi.org/10.1186/s13046-018-0880-6
- 28. 李丽梅, 于虹敏, 黄美霞, 等. 基于网络药理学与实验验证探讨连翘苷治疗脓毒症的作用及机制[J/OL]. 中药药理与临床: 1-20. https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C45S0n9fL2suRadTyEVl2pW9UrhTDCd PD65LAyGDX49vZvUyPB6dgXjowD6NUe4sNqOmOAjMN7 khG5LsCpW8V0CE&uniplatform=NZKPT, 2023-06-07.
