Open Journal of Fisheries Research
Vol.04 No.03(2017), Article ID:21988,7
pages
10.12677/OJFR.2017.43015
Application of In Situ Hybridization in the Detection of Cyprinus carpio in Infected Carp
Bin Wu1, Hong Wang2, Lin Zhang1, Huijun Zhao1
1Liaoning Entry-Exit Inspection and Quarantine Bureau, Dalian Liaoning
2The First Affiliated Hospital of Dalian Medical University, Dalian Liaoning

Received: Aug. 14th, 2017; accepted: Aug. 28th, 2017; published: Sep. 11th, 2017

ABSTRACT
Spring Viremia of Carp Virus (SVCV) is a rhabdovirus that occurs mainly in the spring, which can cause large-scale outbreaks of Cyprinus carpio (falciparum) in fishes or adult fish. In vitro expansion of SVCV infected healthy carp by artificial infection. In situ hybridization (ISH) was used to identify and detect SVCV molecules in the head, viscera of diseased fish that with obvious symptoms of carp spring virulence and identified as positive by PCR. The results showed that there was a high level of virus in brain and viscera of diseased fish. In this study, SVCV in situ hybridization detection method was established, which can initially identify the distribution of SVCV in different tissues of diseased fish.
Keywords:Spring Viremia of Carp Virus (SVCV), Carpon Virulence (SVC), Carp, Artificial Infection, In Situ Hybridization (ISH)
应用原位杂交技术检测感染鲤鱼体内 的鲤春病毒
吴斌1,王红2,张琳1,肇慧君1
1辽宁出入境检验检疫局,辽宁 大连
2大连医科大学附属第一医院,辽宁 大连
收稿日期:2017年8月14日;录用日期:2017年8月28日;发布日期:2017年9月11日

摘 要
鲤春病毒(Spring Viremia of Carp Virus, SVCV)是一种弹状病毒,主要发生于春季,它能引起鲤科鱼类的鱼苗或成鱼大规模暴发鲤春病毒血症(SVC)。体外扩增的SVCV经人工方法感染健康鲤鱼,运用原位杂交技术(ISH),对感染后出现明显症状并经PCR鉴定阳性的病鱼,取其头部、内脏等组织切片进行SVCV分子定位和检测。结果显示,病鱼体内检出病毒,其中脑部和内脏含量较高。本文建立的SVCV原位杂交法,可初步确定SVCV在病鱼体内不同组织的分布情况。
关键词 :鲤春病毒(SVCV),鲤春病毒血症(SVC),鲤鱼,人工感染,原位杂交(ISH)

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
鲤春病毒(Spring Viremia of Carp Virus, SVCV)是一种弹状病毒,主要发生于春季,它可以引起鲤科鱼类的鱼苗或成鱼大规模暴发鲤春病毒血症(SVC)。SVC又称鲤鱼传染性腹水症,是一种急性、出血性传染性败血病。该病可以危害鲤鱼,鲶鱼,鲫鱼,鲢鱼,鳙鱼等,在欧、亚两洲均有流行。SVCV是鱼类口岸检疫的第一类检疫对象,世界动物卫生组织(OIE)将其列为需要向申报的疫病,我国农业部定为一类动物疫病 [1] 。
SVCV传统检测方法是根据典型症状进行初步诊断,再通过细胞分离病毒进行确认,最后采用免疫学方法,如中和试验和ELISA,或者分子生物学方法,如PCR和DNA探针等进行鉴定 [2] 。原位杂交法可以对组织切片中不同细胞、不同部位靶基因进行精确定位,具有特异性强、灵敏度高等特点,可以作为一种很好的水生动物病毒定位检测方法 [3] 。本文利用SVCV核蛋白基因的高保守高特异性,采用巢式PCR扩增出714 bp片段,地高辛(DIG)标记探针,建立测定SVCV的ISH方法,初步确定SVCV在病鱼体内存在的部位,为进一步研究SVCV的发病机理提供了基础材料。
2. 材料与方法
2.1. 材料
2.1.1. 毒株
传染性胰脏坏死病毒(IPNV)、传染性造血器官坏死病毒(IHNV)、鲤春病毒(SVCV)、流行性造血器官坏死病毒(EHNV)等毒株由本实验室保存。
2.1.2. 实验样品
人工感染的鲤鱼鱼苗为市场购买。
2.1.3. 仪器和试剂
显微镜:德国蔡氏AXIOPHOT显微镜。
试剂盒:Roche生产的DIG High Prime DNA Labeling and Detection Starter Kit I,DIG Wash and Block Buffer。
2.2. 实验方法
2.2.1. 病毒液的制备
利用FHM细胞对SVCV病毒的敏感性体外扩增SVCV病毒,并用Karber法测定病毒滴度为10−6.127/0.1 mL。
2.2.2. 人工感染
购买的鲤鱼鱼苗经过一周饲养确定没有病变症状,将20条鱼分成2组(对照组和实验组各10条)。将2组鱼饲养在10℃水箱中,将病毒液按1:1000比例投入实验组,适应性感染3 d。用滴度为105左右的SVCV病毒液5 μL对实验组斑马鱼进行背鳍基部肌肉注射,进一步强化。注射后每天观察记录染毒鱼的状态,并持续饲养直至实验组出现明显的病变症状。
2.2.3. 引物设计
根据文献设计引物并合成(见表1)。
2.2.4. 病鱼的PCR鉴定
对出现典型症状的病鱼提取病毒RNA,进行PCR鉴定。
2.2.5. 探针的制备
1) 制作模板DNA:病毒液提取病毒RNA,利用设计的引物扩增出一条714 bp的片段。产物经1.5%琼脂糖凝胶电泳鉴定。按照凝胶回收试剂盒说明对PCR扩增出的714 bp片段进行回收。
2) DIG标记:按照DIGDNA高效标记检测试剂盒说明,将回收的714 bp片段标记成DIG-714探针。
3) 探针浓度的选择:按照DIGDNA高效标记检测试剂盒说明,选择适合的探针浓度。
2.2.6. 切片的制作
实验组病鱼经10%甲醛固定24 h后,分成头部、内脏和尾臀三部分。经过梯度酒精脱水,二甲苯透明,最后石蜡包埋。切片待检。头部取脑、眼处横切片,内脏部取内脏部分中间处切片,尾臀取有最大横切面积的切片。
2.2.7. ISH检测
将载有病鱼切片的玻片60℃恒温45 min水化,随后经二甲苯脱蜡、梯度乙醇水化;加入含100 mg/L蛋白酶K的PBS,37℃消化15 min;预冷的0.4%甲醛室温固定5 min;2 × SSC (0.3 M NaCl,0.03 M枸橼酸钠,pH7.0)室温漂洗5 min;500 μL预杂交液(4 × SSC,50%甲酰胺,0.02% BSA,0.02%聚蔗糖,0.02% PVP,5%硫酸葡聚糖) 37℃预杂交30 min;DIG-714探针溶液稀释到1 ng/μL
Table 1. RT-PCR Primes of SVCV
表1. SVCV RT-PCR引物
抗DIG碱性磷酸酶复合物中孵育30 min;室温Buffer I洗片10 min,Buffer III (100 mM Tris-HCl, 100 mM NaCl, 50 mM MgCl2, pH 9.5)平衡5 min;滴加500 μL显色液(75 mg/mL NBT, 50 mg/mL BCIP),室温避光显色3 h;室温Buffer IV终止反应15 min;0.5%皮斯麦棕复染色5 min。梯度乙醇脱水,二甲苯置换10 min。树胶封片镜检。可见阳性信号成紫色。结果用照片显示。同时设置阴性对照:以对照组健康鲤鱼鱼苗为材料制作切片,完全按照上述方法进行检测。
3. 结果与讨论
3.1. 探针的制备
以SVCV胶回收产物作为模板,并对回收产物进行浓度测定,平行测定两次取平均值作为探针模板的浓度(表2)。计算结果SVCV的模板浓度是352.15 ng/μL。
按照罗氏DIG-DNA高效标记检测试剂盒的说明进行模板DNA标记,DIG标记后两种探针浓度均为100 ng/μL。
3.2. 探针浓度的选择
在硝酸纤维素(NC)膜上进行斑点杂交反应选择探针的浓度,结果如图表明。图1显示,DIG探针在0.1 pg/μL显示的亮度与对照组1 pg/μL稀释的亮度相当,表明原标记液中探针的含量高于理论值,按照DIG标记效率曲线关键点推算出大约为2300 ng。在做Southern blot时,使用稀释至25 ng/mL的杂交液,做组织切片杂交实验时使用稀释至1 ng/μL的杂交液。
3.3. 探针特异性检测
图2为转膜前电泳检测结果,以714 bp的SVCV、224 bp的IPNV、505 bp的VHSV、580 bp的EHNV作为对照组,得到相应的目的条带。
图3为SVCV探针特异性southern blot杂交结果图,1号SVCV出现杂交结果,且信号强度良好,而其他样品均没有杂交信号,说明探针与其他样品无杂交反应,对SVCV具有良好的特异性。
3.4. ISH结果
人工感染草鲤鱼的SVCV探针ISH检测结果(图4)与对照组健康鱼ISH检测结果(图5)对比显示,在
Table 2. Concentration of template DNA
表2. SVCV模板浓度

Figure 1. Quantification of labeling efficiency with DIG-SVCV; C: Positive control; 1,2: DIG-SVCV
图1. SVCV探针浓度的选择;C:阳性对照;1,2:标记的DIG探针
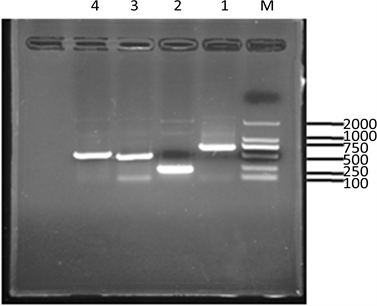
Figure 2. Electrophoresis map for RT-PCR product; M: Marker 2000; 1: SVCV714 bp; 2: ipnv224 bp; 3: VHSV505 bp; 4: EHNV580 bp
图2. PCR产物电泳图;M:Marker 2000;1:SVCV714 bp;2:ipnv224 bp;3:VHSV505 bp;4:EHNV580 bp
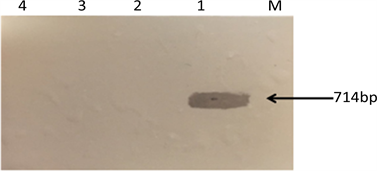
Figure 3. The result of DIG-SVCV Southern blot hybridization; M: Marker 2000; 1: SVCV714 bp; 2: ipnv224 bp; 3: VHSV505 bp; 4: EHNV580 bp
图3. SVCV探针特异性southern blot杂交结果图;M:Marker 2000;1:SVCV714 bp;2:ipnv224 bp;3:VHSV505 bp;4:EHNV580 bp
内脏、眼、脑、肌肉组织切片中均检测到了深紫色的阳性信号斑点(显微照片中为黑色小圆形斑点,能够明显的与组织复染后照片中的颜色区分)。其中,整个脑、肌肉组织的阳性斑点较多,眼组织中也可观察到较少的阳性信号,但总体信号较弱。
对健康草鲤鱼切片进行SVCV探针混合液的ISH,显微结果(图5)表明健康鱼各组织切片中均没有出现杂交斑点,证明病鱼组织切片中的蓝紫色斑点是病鱼组织中SVCV与探针产生的杂交斑点。
4. 结论
ISH是分子生物学与组织学相结合的一种技术,它从细胞水平上研究特异核酸的分布、数量以及与细胞分化、生理、病理状态、形态特征演化之间的关系,可在受染细胞内显示特定病毒的DNA序列,为病毒的组织细胞定位提供了一个更为有效的方法。ISH技术在医学上应用很广泛 [4] ,并且BP、IHHNV
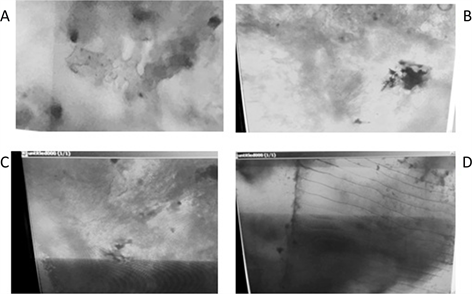
Figure 4. The result of ISH with DIG-SVCV for infected samples A: internal organs; B: brain; C: eyes; D: muscle
图4. SVCV感染草鲤鱼组织石蜡切片ISH结果图A:内脏;B:脑;C:眼;D:肌肉
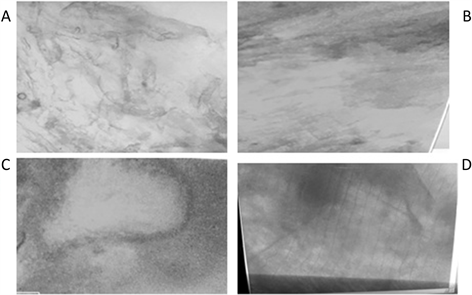
Figure 5. The result of ISH with DIG-SVCV for healthy samples A: internal organs; B: brain; C: eyes; D: muscle
图5. 健康草鲤鱼组织石蜡切片ISH结果图 A:内脏;B:脑;C:眼;D:肌肉
等核酸探针已商品化,为SVCV的检测提供了有利工具。ISH靠探针的渗透作用进入细胞内与特异的核酸片段杂交。探针长度影响其渗透力,从而使结果产生偏差,甚至可能出现假阴性结果。据报道,大致700 bp探针有良好的渗透力 [5] 。
本文根据糖蛋白基因设计的特异性引物,对SVCV进行扩增,并对扩增产物进行DIG标记,得到探针DIG-714。通过比较对照标记反应产生的点的强度差异,计算出DIG标记DNA的量,SVCV探针稀释至0.1 pg的点与对照DNA的点均可见,说明标记的探针达到了预期的标记效率,按照标记效率曲线关键点推算出大约为2300 ng。在做Southern blot时,使用稀释至25 ng/mL的杂交液,做组织切片杂交实验时使用稀释至1 ng/μL的杂交液。探针的特异性实验结果表明,两种探针能够标记相应的病毒,对其他的对照组并没有交叉反应,DIG-SVCV特异性良好。人工感染实验结果表明,鱼内脏、眼、脑、肌肉组织切片中均检测到深紫色的阳性信号斑点,其中整个脑、肌肉组织的阳性斑点较多,眼组织中也可观察到较少的阳性信号。因此,本文建立的方法是一种用于检测鲤春病毒在感染宿主中的分布、定位、以及细胞和分子病理的有效方法,也适用于其他水生动物病毒的检测和诊断。
基金项目
国家质检公益项目(201410059)。
文章引用
吴 斌,王 红,张 琳,肇慧君. 应用原位杂交技术检测感染鲤鱼体内的鲤春病毒
Application of In Situ Hybridization in the Detection of Cyprinus carpio in Infected Carp[J]. 水产研究, 2017, 04(03): 92-98. http://dx.doi.org/10.12677/OJFR.2017.43015
参考文献 (References)
- 1. 王姝, 徐立蒲, 王静波, 等. 鲤春病毒血症风险分析[J]. 北京农业, 2012(18): 107-110.
- 2. 陈爱平, 江育林, 钱冬, 等. 鲤春病毒血症[J]. 中國水產, 2010, 2010(9): 63-64.
- 3. 吕玲, 何建国, 邓敏, 等. 核酸探针原位杂交检测白斑综合症病毒的组织特异性[J]. 热带海洋, 2000, 19(4): 86- 91.
- 4. 路建平, 野村慎太郎, 稻泽壤治, 等. 非放射性杂交技术[M]. 海口: 南海出版公司, 1996: 67 -78.
- 5. 何建国, 周化民, 姚泊, 等. 白斑综合症杆状病毒的感染途径和宿主种类[J]. 中山大学学报(自然科学版), 1999, 38(2): 65-69.
