Open Journal of Fisheries Research
Vol.05 No.02(2018), Article ID:25512,13
pages
10.12677/OJFR.2018.52008
Study on Fish Organogenesis and Development
Xiaoqiang Gao, Bin Huang, Changtao Guan, Baoliang Liu, Yudong Jia, Lei Hong*
Key Laboratory for Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao Shandong

Received: Jun. 4th, 2018; accepted: Jun. 14th, 2018; published: Jun. 21st, 2018

ABSTRACT
In the early stages of fish, ontogeny involves important changes in the function and structure of larval tissues, organs, and systems, which are essential for larvae to adapt to living environment, improve the survival rate and ensure optimal growth of larvae. It is necessary to better understand about larval special physiological period, develop feeding protocols, and optimize rearing conditions and larval-rearing techniques by comprehensive studies of the ontogeny. In this paper, progress on the study of fish organogenesis has been summarized in detail, which focuses on the regular pattern of development of larval respiratory organ, visual system, digestive system, and immune system, which will provide the important theoretical basis for artificial breeding, the efficient and sustainable development of the industry in fish culture. Meanwhile, the result will further supplement and perfect the development biology in early life stages.
Keywords:Organogenesis, Respiratory Organ, Visual System, Digestive System, Immune Organs
鱼类器官的早期发生发育研究
高小强,黄滨,关长涛,刘宝良,贾玉东,洪 磊*
中国水产科学研究院,黄海水产研究所,农业部海洋渔业可持续发展重点实验室,山东 青岛

收稿日期:2018年6月4日;录用日期:2018年6月14日;发布日期:2018年6月21日

摘 要
在鱼类早期发育过程中,其组织、器官及系统发生发育伴随着重要结构和功能的改变,这些结构功能的出现对鱼类早期适应外界生活环境、成活和生长至关重要。在鱼类的人工繁养殖过程中,全面研究各个组织、器官及系统发生发育对了解仔鱼特殊的生理时期、投喂策略的建立以及养殖条件的优化非常必要。本文对鱼类早期发育时期的各个组织、器官及系统进行了全面归纳、概括,详细阐述了早期发育过程中的呼吸、视觉、消化及免疫等器官的发生发育,旨在为鱼类繁育育种、高效养殖、可持续发展提供重要的理论基础,也为进一步补充和完善鱼类早期发育生物学提供至关宝贵的资料。
关键词 :器官发育,呼吸器官,视觉系统,消化系统,免疫器官

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
鱼类早期发育是一个高度动态变化的复杂过程,它直接关系到仔、稚、幼鱼的成活及生长。一般而言,鱼类早期发育均遵循相似的发育模式,但不同的种类之间各个组织、器官和系统发生发育时序却存在着很大的差异。掌握鱼类早期发育的生物学规律及变化,对解释鱼类早期生理机能及发生途径至关重要,这样不仅可以揭示鱼类早期生活史,而且能进一步提高和优化人工繁育和养殖技术,因此,全面研究鱼类早期发育是非常必要的。为此,本文从硬骨鱼类早期发育阶段的各个组织、器官和系统等方面着手,对当前硬骨鱼类早期发生发育相关研究进行了归纳、概括,详细阐述了硬骨鱼类不同发育时期呼吸、视觉、消化及免疫等的发生发育过程,旨在为鱼类繁育育种及高效养殖提供重要的理论基础,也为进一步补充和完善鱼类早期发育生物学提供至关宝贵的资料。
2. 鳃的发生发育
大多数初孵仔鱼的鳃缺乏鳃丝,不具备呼吸功能,此时的呼吸作用主要依赖于整个身体表皮细胞完成,而鳃的初始功能主要是与渗透调节有关 [1] [2] 。大多数初孵仔鱼即已具备鳃原基,随后,4对原始的鳃弓形成,由一些未分化的上皮覆盖的成软骨细胞中心组成。鳃弓未分化的上皮细胞继续向鳃腔内分化增生,形成原始的鳃丝。鳃进一步分化,鳃弓内原始血管系统形成,血细胞明显,鳃弓上鳃丝继续向鳃腔内生长,其两侧的扁平细胞向外凸起,形成原始的鳃小叶,氯细胞在鳃弓基底部出现 [3] [4] [5] (图1)。可见,早期仔鱼鳃的结构和功能发育不完善,只具备了鳃的基本结构,呼吸方面发挥着很小的作用。然而Falk-Petersen等对大西洋狼鱼Anarhichas lupus的研究表明,初孵仔鱼的鳃具备了次要的鳃丝且布满了毛血血管,这说明了大西洋狼鱼仔鱼在孵化后既具备了初始呼吸功能 [6] 。随着仔鱼的生长发育,鳃进一步发育,假鳃在鳃腔紧靠眼睛后侧的地方出现,鳃盖逐渐覆盖咽腔区域的鳃缝,鳃软骨和鳃动脉出现,氯细胞大量增生,鳃丝和鳃小叶不断延伸、增长,数量大量增加,鳃中血管系统不断发育成熟,可见明显流动的血细胞,仔鱼的鳃在结构和功能上与幼鱼相似,已经基本发育完成,此阶段鳃已经完成了功能性的转变,在气体交换方面发挥着主要作用。
3. 心脏的发生发育
仔鱼的心脏形成于胚胎期,在孵化前既已开始搏动,此时心脏仅为一个简单的细管状结构。Hall等等研究表明,大西洋鳕Gadus morhua在受精167小时后心脏出现 [7] ;佟雪红指出大菱鲆Scophthalmus


 BC, blood cells; CC, chloride cells; DT, digestive tract; GA, gill arches; Ga, gill anlage; YS, yolksac. BC,血细胞;CC,氯细胞;DT,消化道;GA,鳃弓;Ga,鳃原基;GF,鳃丝;YS,卵黄囊。
BC, blood cells; CC, chloride cells; DT, digestive tract; GA, gill arches; Ga, gill anlage; YS, yolksac. BC,血细胞;CC,氯细胞;DT,消化道;GA,鳃弓;Ga,鳃原基;GF,鳃丝;YS,卵黄囊。
Figure 1. The histological development of the gill in American shad. (a) Gill anlage at hatching; (b) At 1 DAH, yolksac, incipient digestive tract, primordial gill arches; (c) 5 DAH showing primordial gill filaments and lamellae in the gill arches, cartilaginous frameworks, chloride cells, blood cells in the internal vascular system
图1. 美洲鲥鳃早期发育 [3] 。(a) 初孵仔鱼鳃原基出现;(b) 1日龄,所示鳃弓原基;(c) 5日龄所示鳃小叶原基、鳃软骨和氯细胞
maximus在94 h心脏开始跳动,胚胎期并未出现血细胞,说明了此时体液的循环主要是为促进卵黄营养物质的吸收,而不是气体交换 [8] 。初孵仔鱼心脏为未分化的直管状结构,位于体腔前端,鳃原基下方,直接与卵周隙相通,在围心膜和心脏之间可见明显的围心腔。随着仔鱼生长发育,心脏开始分化发育。蓝鳍金枪鱼Thunnus thynnus在孵化后2天,心脏既已分化为四个腔室:动脉窦、心房、心室、静脉窦,6日龄,心室与心房连接处的内膜层向腔两侧凸起形成瓣状结构,房室瓣形成,血细胞循环明显,11日龄可见心房小梁,17日龄心脏发育完全 [5] ;美洲鲥Aiosa sapidissima在2日龄心脏分化明显,分为三个部分:心室、心房和动脉球,4日龄,静脉窦形成,连接心房和总主静脉,此时心脏分化为四个部分:心室、心房、动脉球和静脉窦,心室内肌纤维及内膜细胞向内延伸形成心室小梁,此时房室瓣出现,可见少量血细胞,8日龄,心室和动脉窦之间形成半月瓣,13日龄,心房内小梁形成,22日龄,心房和静脉窦之间形成窦房瓣,心脏心室、心房小梁和血细胞数量大量增加,此时心脏瓣膜全部形成,心脏发育完全 [3] (图2)。条石鲷Oplegnathus fasciatus在孵化后1天,心脏分化为三个部分(心房、心室和动脉球),2日龄静脉窦形成,3日龄耳室瓣、半月瓣形成,6日龄窦耳瓣和心室小梁出现,27日龄心脏发育完全 [9] ;三长棘赤鲷Pagrus auriga在孵化后3日龄,心脏分化为心房、心室和动脉窦三个部分,血细胞可见,6日龄心室小梁出现,7日龄心脏分化为四个部分,15日龄房室瓣形成,20日龄窦房瓣、半月瓣形成 [10] 。综上可知,心脏的分化发育主要包括了四个腔室(心室、心房、动脉球和静脉窦)分化、三个瓣膜(房室瓣、半月瓣及窦房瓣)形成及起支撑作用小梁(心室小梁和心房小梁)结构的出现。另外,Yúfera 等指出心脏的快速分化伴随着氧气和二氧化碳转运的增加,支持其快速游泳和尽可能的捕食 [5] 。因此,早期发育阶段,心脏更早的发育可以为仔鱼提供更多的血液供应,保证其快速的游泳,在一定程度上提高了捕食的成功率。
4. 鳔的发生发育
鰾是鱼类游泳过程中的压力调节器,它的发生发育对早期仔鱼的生长发育至关重要。一般而言,鱼类鳔早期发育主要分为三大类型,即闭鳔类,以条石鲷为例:1日龄仔鱼鳔原基出现,4日龄鳔管原基形成,10日龄仔鱼的鳔开始充气,17日龄充气完成,此时鳔管开始退化,发育至30日龄鳔管消失,条石鲷鳔发育完成 [11] (图3)。细点牙鲷Dentex dentex L.的鰾管和鰾原基在3日龄出现,7日龄鳔腺和迷网出现,10~11日鳔开始充气,23~46日龄鳔管退化 [12] 。蓝鳍金枪鱼1日龄鰾原基出现,2日龄鳔管原基形
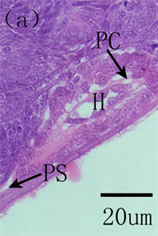
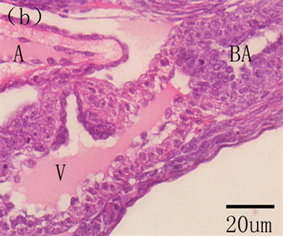

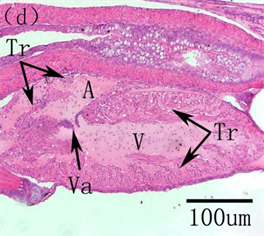
 A, atrium; BA, bulbus arteriosus; GC, goblet cells; H, heart; OE, oesophagus; PC, pericardial cavity; PS, perivitelline space; Sv, sinus venosus; Tr, trabeculae; V, ventricle; Va, valve A,心房;BA,动脉窦;GC,杯状细胞;H,心脏;OE,食道;PC,围心腔;PS,卵周隙;Sv,静脉窦;Tr,小梁;V,心室;Va,瓣膜
A, atrium; BA, bulbus arteriosus; GC, goblet cells; H, heart; OE, oesophagus; PC, pericardial cavity; PS, perivitelline space; Sv, sinus venosus; Tr, trabeculae; V, ventricle; Va, valve A,心房;BA,动脉窦;GC,杯状细胞;H,心脏;OE,食道;PC,围心腔;PS,卵周隙;Sv,静脉窦;Tr,小梁;V,心室;Va,瓣膜
Figure 2. The histological development of the heart in American shad. (a) Heart at hatching. (b) At 2 DAH, discernible heart differentiated into three compartments. (c) At 4 DAH, buccopharyngeal cavity, four cardiac cavities, valves between ventricle and atrium and trabecular proliferation visible in the heart, goblet cells in the oesophagus. (d) At 13 DAH, the trabeculae appeared in the atrium. (e) Heart valves completely formed, four heart compartments, trabecular proliferation at 22 DAH
图2. 美洲鲥心脏早期发育 [3] 。(a) 初孵仔鱼所示心脏原基;(b) 2日龄,心脏分化为明显的三部分;(c) 4日龄,心脏分化为四个腔室,房室瓣形成,心室小梁可见;(d) 13日龄,心房小梁形成;(e) 22日龄,心脏瓣膜全部形成,可见明显的四腔室及增生的小梁
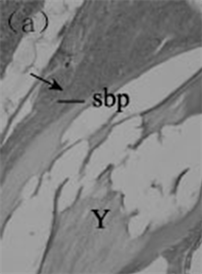

 gg. gas gland; pd. pneumatic duct; sbe. swim bladder epithelium; sbp, swim bladder primordium; St, stomach; Y, yolk sac; gg.气腺;pd.鳔管;sbe.鳔上皮细胞;sbp.鳔原基;St.胃;Y.卵黄囊。
gg. gas gland; pd. pneumatic duct; sbe. swim bladder epithelium; sbp, swim bladder primordium; St, stomach; Y, yolk sac; gg.气腺;pd.鳔管;sbe.鳔上皮细胞;sbp.鳔原基;St.胃;Y.卵黄囊。
Figure 3. The histological development of the swim bladder in Oplegnathus fasciatus. (a) One day after hatching. The cavity of swim bladder primordium (arrowhead) was visible; (b) Eight DAH ×400, Bar = 50 μm; (c) Twenty DAH. The pneumatic duct continued to degenerate (arrow), ×100, Bar = 200 μm
图3. 条石鲷鳔早期发育 [11] 。(a) 1日龄仔鱼。横线所示为鳔原基,箭头所示为鳔原基空腔;(b) 8日龄仔鱼,×400,标尺= 50 μm;(c) 20日龄仔鱼。箭头所示为退化的鳔管,×100,标尺 = 200 μm
成,2~3日龄可见鳔腺和迷网,6~7日龄开始充气,10~11日龄鳔充气完成,鳔管退化发生在11~28日龄 [5] 。可见,闭鳔类鱼类鳔早期的发育模式为鳔原基出现、鳔充气、鳔管退化消失及鳔发育完善。第二种类型为管鳔类,主要为鲱形目及鲤形目鱼类,如美洲鲥2日龄仔鱼鰾原基出现,3日龄鰾原基不断膨大,向前后两个方向扩张,中央形成一个小腔,鰾气腺出现,鰾后半部分偏左的地方,鰾管原基出现,6日龄鰾迷网出现,自9日龄开始,鳔开始充气,20日龄鰾腺和气腔不断增加发育,鰾管不断增厚、管腔不断扩增,随着仔鱼的生长发育,鰾组织继续延伸,鰾管始终存在 [3] (图4)。短盖巨脂鲤Piaractus brachypomum在1日龄鳔原基出现,2日龄鳔管及鳔腔形成,4~5日龄鳔开始充气,11日龄充气完成,自13日龄开始,鳔壁和鳔管结构逐渐发育完善 [13] 。可见,管鳔类鱼类鳔早期的发育模式鳔原基出现、鳔充气和鳔、管鳔发育完善。第三类为无鳔类,主要为鲽形目鱼类,如大菱鲆鳔原基2日龄出现,5日龄鳔管出现且鳔开始充气,19日龄鳔充气完成,鳔管封闭,25日龄鳔前端气腺上皮细胞开始退化,31日龄腹部气腺上皮细胞退化,47日龄气腺完全消失,63日龄鳔消失 [14] 。菱鲆Scophthalmus rhombus L在2日龄鳔原基出现,6日龄鳔腺及迷网形成,8日龄鳔管出现,19~21日龄鳔充气明显,23~38日龄鳔逐渐萎缩消失 [4] 。塞内加尔鳎Solea senegalensis在3日龄鳔原基出现,4.5日龄鳔管及迷网出现,7.7日龄鳔充气且鳔腔显著增加,15.2日龄鳔器官开始退化,30.9日龄鳔消失 [1] (图5)。可见,无鳔类鱼类鳔早期的发育模式为鳔原基形成、鳔充气、鳔退化及鳔消失。综上,不同鱼类鳔的早期发生发育模式存在着差异性,这可能与鱼类个体发育策略及生活环境有关,这种差异性的存在可能对提高其自然状态下种群的生存具有一定的生态意义。然而具体原因还有待进一步探索。
5. 鱼类视觉系统发生发育
视觉作为主要的感觉器官,在鱼类摄食、熟悉环境、逃避敌害、集群和洄游等活动中发挥着不可代替的作用 [15] [16] ,了解不同发育时期的鱼类视觉器官的发生发育,对了解其生理活动、生态适应性、仔鱼开口时间、最佳投喂时间和饵料选择上具有重大意义。
5.1. 胚胎发育时期
视网膜和晶状体在视觉成像中发挥着重要的作用,在鱼类视觉发生发育过程中是最早形成的。条石鲷受精10.5 h后胚胎发育至原肠晚期,眼囊原基出现,至15.5 h后胚胎器官开始分化,原始视网膜及晶状体形成,受精22 h后,胚胎发育至孵化期,角膜在脉络膜裂口处形成 [17] 。高小强等对美洲鲥的研究表明,受精21 h 13 min,胚盘下包90%,眼囊原基出现,受精35 h 44 min后,器官开始分化,原始的视网膜和晶状体形成,受精60 h 15 min,仔鱼出膜前期,角膜形成 [18] 。佟雪红等指出大菱鲆在58 h 30 min,


 gg, gas gland; Pd, pneumatic duct; SB, swim bladder; gg,气腺;Pd,鰾管;SB,鰾。
gg, gas gland; Pd, pneumatic duct; SB, swim bladder; gg,气腺;Pd,鰾管;SB,鰾。
Figure 4. The histological development of the swim bladder in American shad. (a) The primordial swim bladder at 2 DAH; (b) The gas gland and the pneumatic duct anlage at 3 DAH; (c) The gas gland increased considerably in size and gas chamber constantly expanded at 20 DAH
图4. 美洲鲥鳔早期发育 [3] 。(a) 2日龄,所示鰾原基;(b) 3日龄,鰾气腺和鰾管原基出现;(c) 20日龄所示体积增加中的鰾
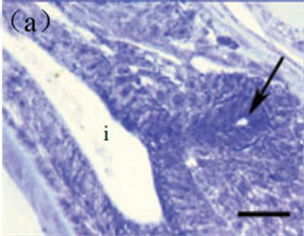


 gc, gas chamber; i, intestine; rm, rete mirabile; gc,鳔室;i,肠;rm,迷网。
gc, gas chamber; i, intestine; rm, rete mirabile; gc,鳔室;i,肠;rm,迷网。
Figure 5. The histological development of the swim bladder in Solea senegalensis. (a) Early development of the swimbladder at 3 dph (→) scale bar = 50 μm. (b) The gas chamber and rete mirabile formed at 4.5 dph, scale bar = 50 μm. (c) The gas chamber significantly increased in size and notice the presence of the rete mirabile at 7.7 dph, (→) scale bar = 50 μm. (d) The gas chamber decreased at 15.2 dph, scale bar = 50 μm
图5. 塞内加尔鳎鳔早期发育 [1] 。(a) 3日龄早期发育的鳔(→)标尺 = 50 μm;(b) 4.5日龄鳔室及迷网形成,标尺 = 50 μm;(c) 7.7日龄鳔室显著增加,迷网清晰可见,(→)标尺 = 50 μm;(d) 15.2日龄鳔开始退化,标尺 = 50 μm
胚盘下包90%,视嚢原基形成,发育至69 h进入器官分化期,视网膜及晶状体原基出现,94 h眼杯的角膜形成 [19] 。大西洋鳕也具有类似的发育特点 [7] 。可见,大多数硬骨鱼类的眼囊原基出现在原肠晚期,在器官分化期开始分化形成原始的视网膜和晶状体,未分化的视网膜、晶状体及角膜构成了初孵仔鱼最原始的视觉系统。然而在河川沙塘鳢Odontobutis potamophila的研究发现,受精后141 h,原始视网膜及晶状体出现;213 h,晶状体开始分化,角膜–巩膜明显,此时视网膜分化为6层;376 h,胚胎进入孵化前期,角膜分化为5层,视网膜分化为10层,虹膜–脉络膜明显。可知,河川沙塘鳢在孵化前眼各个组织结构均开始分化发育,初孵仔鱼已经具备了较为完善的视觉系统 [20] 。这种发育模式可能与鱼类的生活环境及种质间的差异有关。
5.2. 胚后发育时期
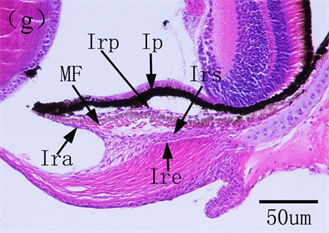
仔鱼眼睛的快速分化和发育对于生长发育至关重要,不仅可以为早期仔鱼视觉成像系统的建立提供保证,而且为仔鱼开口摄食提供了必备的视觉基础。2日龄美洲鲥仔鱼巩膜形成,3日龄仔鱼视网膜完全分化,由自外向内的色素层、视觉细胞层、外界膜、外核层、外网膜层、内核层、内网膜层、视神经节细胞层、视神经纤维层和内界膜10层构,原始脉络膜和虹膜出现 [18] (见图6);条石鲷1日龄视网膜及角膜开始分化,2日龄巩膜和脉络膜出现,3日龄虹膜出现,6日龄视网膜分化完全 [17] ;南方鲇Silurus meridionalis仔鱼1日龄视网膜及晶状体均开始分化,2日龄角膜分化,脉络膜出现,7日龄虹膜形成 [21] 。可见,大多数仔鱼在开口摄食前,眼的各个组织器官基本上开始发育,初始的视觉成像系统为仔鱼开口



 gc, gas chamber; i, intestine; rm, rete mirabile;
gc,鳔室;i,肠;rm,迷网。
gc, gas chamber; i, intestine; rm, rete mirabile;
gc,鳔室;i,肠;rm,迷网。
Figure 5. The histological development of the swim bladder in Solea senegalensis. (a) Early development of the swimbladder at 3 dph (→) scale bar = 50 μm. (b) The gas chamber and rete mirabile formed at 4.5 dph, scale bar = 50 μm. (c) The gas chamber significantly increased in size and notice the presence of the rete mirabile at 7.7 dph, (→) scale bar = 50 μm. (d) The gas chamber decreased at 15.2 dph, scale bar = 50 μm
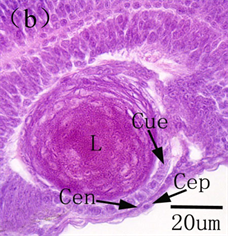
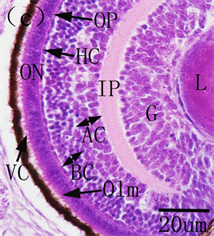
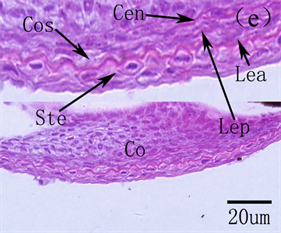
图6. 美洲鲥眼早期发育 [18] 。(a) 初孵仔鱼可见明显的晶状体、分化出的神经节细胞层;(b) 1日龄仔鱼角膜分化为上皮和内皮细胞层;(c) 2日龄仔鱼视网膜;(d) 3日龄仔鱼可见单层环状的虹膜;(e) 14日龄仔鱼角膜完全分化;(f) 22日龄仔鱼所示脉络膜腺体和线状银膜;(g) 26日龄稚鱼所示完全发育的虹膜
摄食、躲避敌害提供了保障。随着仔鱼外源营养的建立,仔鱼迅速生长发育,眼睛也进一步分化,美洲鲥角膜14日龄分化完成,由自外向内的复层扁平上皮、前弹性层、基质层、后弹性层和内皮层5层构成,26日龄脉络膜分化完全,由外向内依次为银膜层、血管层和色素层,虹膜也完全分化,由外向内依次为虹膜内皮层、前缘层、基质层、后缘层和色素层 [18] ;条石鲷13日龄角膜分化完善,21日龄脉络膜、虹膜发育完善 [17] (见图6);南方鲇角膜、虹膜及脉络膜分别在40、31和50日龄发育完成 [21] 。角膜、虹膜和脉络膜的发育成熟使仔鱼具备了较强的屈光能力和完善的遮光、调节能力,此时,成熟的鱼类视觉成像系统完全建立。
6. 消化系统的发生发育
在鱼类早期发育阶段,大多数仔鱼在第一次摄食时,消化系统并不成熟,需要经历一系列的发育变化阶段才成具备完善的功能 [22] [23] 。因此,在仔鱼阶段,全面研究消化系统的生态变化、发育分化和相关腺体的发生对了解仔鱼特殊的消化功能和营养生理非常重要,消化系统形成和快速发育使仔鱼具备摄食、消化和吸收的能力,为仔鱼存活率的提高提供了重要保证 [24] 。
对于大多数硬骨鱼类而言,其消化系统的发生发育一般主要分为三个重要阶段 [25] [26] [27] ,即:初孵仔鱼的内源性营养期为第一发育阶段,此时仔鱼完全依靠卵黄囊和油球中的营养物质完成生长发育。此阶段仔鱼消化道为一条简单未分化的管状结构,位于卵黄囊的背部,平行于躯干部,其上皮主要是由单层立方柱状细胞组成,其顶端具有微绒毛,口和肛门并未与外界相通 [28] [29] ;在消化道和卵黄囊后部之间出现了大量未分化的嗜碱性细胞群,将来分化发育成肝脏和胰脏 [30] [31] 。
仔鱼的混合营养期为第二发育阶段,此阶段仔鱼消化系统已经开始分化发育,具备了初始的摄食、消化和吸收的能力。Hachero-Cruzado等对菱鲆的研究表明,在混合营养阶段,菱鲆仔鱼在2日龄,口和肛门开通,消化道已初步分化为口咽腔、食道和肠道三部分,3日龄食道开始延伸折叠,中后肠出现粘液细胞,4日龄食道粘液细胞出现,7日龄胃原基形成,8日龄下颌齿和咽齿出现。肝脏和胰脏在2日龄分化完成,此时肝脏可见明显的血窦、糖原和脂肪空泡,胰脏中存在大量的酶原颗粒,胰岛出现 [4] 。Pradhan等也表明,双斑绚鲶Ompok bimaculatus仔鱼在混合营养期仔鱼消化道在2日龄开始分化为三部分(口咽腔、食道和肠道),且口咽腔内味蕾、咽齿和粘液细胞出现,后肠开始弯曲,肠瓣形成,在3~4日龄之间的杯状细胞首次在肠中出现,在4日龄肠道进一步延伸褶曲,肠细胞中可见明显的脂肪颗粒。在2日龄肝脏和胰脏分化,胰脏管形成,在3~4日龄,肝脏中糖原、蛋白和脂肪出现 [32] 。蓝鳍金枪鱼也发现,在孵化后2天,仔鱼口和肛门开通,口咽腔、食道和肠分化,2~3日龄,肠开始卷曲,肠瓣形成,将肠道分为前肠和后肠,粘液细胞在口咽腔和食道出现,3~4日龄,前肠和后肠出现粘液细胞。肝脏和胰脏在2日龄形成,3日龄肝脏中出现糖原、蛋白颗粒和脂肪空泡,胰脏内部含有大量的嗜酸性的酶原颗粒蛋白,胰岛出现 [5] 。第二阶段的消化系统虽说已经开始分化发育,具备了初始的生理功能,但是消化功能依旧很弱,仔鱼的消化吸收主要依靠胞饮作用和细胞内消化的机制完成营养物质的吸收 [27] [33] 。
外源性营养阶段为第三发育阶段,即胃腺形成及胃蛋白酶开始分泌时期,是仔鱼营酸性消化模式的开始,此阶段主要就是味蕾、齿、粘液细胞和杯状细胞的大量增加,食道、肠和胃的快速折叠、卷曲及肌肉层的逐渐增厚,胃腺的大量增加;肝胰脏主要是在体积和大小上的持续增加,结构和形态上并未发生太大的变化 [1] [4] [5] [10] [24] [32] [34] 。此阶段消化系统在功能上已经成熟,消化模式已经转变为幼鱼或成年鱼的消化方式,在形态和生理上已经具备了消化吸收人工配合饲料的特征。
7. 免疫器官的发生发育
7.1. 胸腺的发生发育
胸腺是鱼类淋巴细胞增殖分化的主要场所,是鱼类的中枢免疫器官,为左右对称的一对实质性结构,位于第3和第4鳃原基上方,紧邻背部鳃盖的连接处位于鳃腔背后侧。在早期发育过程中,鱼类胸腺发生大致分为三个阶段:胸腺原基形成,为一群嗜碱性母细胞组成细胞团;随着仔鱼生长发育,淋巴母细胞开始出现,其细胞较大,核染色较深,网状细胞在边缘处形成,呈现不规则状,淋巴母细胞开始分化为淋巴细胞,胸腺进入淋巴化阶段;胸腺进一步分化发育,分为两大部分:由富含淋巴样细胞的皮质和上皮样细胞、网状细胞的髓质,同时胸腺小梁形成,深入到胸腺内部,此时胸腺发育完全。胸腺发生发育的时序与不同的鱼种之间存在着较大的差异。细点牙鲷胸腺在16日龄出现,36日龄开始胸腺细胞开始淋巴化 [12] ;美洲鲥12日龄,胸腺原基出现,18日龄,淋巴母细胞出现,22日龄,淋巴化开始,45日龄胸腺发育完全,分为皮质和髓质 [3] .(图7);条石鲷胸腺在10日龄出现,在11日龄出现淋巴母细胞,15日龄淋巴细胞出现,23日龄胸腺皮质和髓质形成,49日龄胸腺小梁出现,此时胸腺发育完成 [35] 。胸腺的免疫能力在鱼类个体发育过程中发挥着重要的生理作用,但胸腺会随着年龄增长而逐步退化,并出现生理性萎缩、凋亡现象 [36] 。如小点猫鲨Scyliorhinus canicula胸腺孵化后3周便开始出现退化 [37] ;青

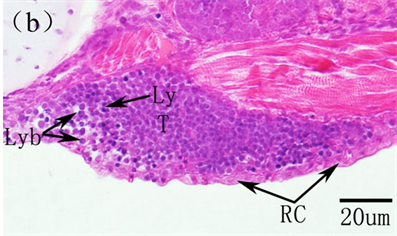
 Co, cortex; Me, medulla; Ly, lymphocyte; Lyb, lymphoblasts; T, thymus; Tr, trabeculae Co,皮质;Me,髓质;Ly,淋巴细胞;Lyb,淋巴母细胞;T,胸腺;Tr,小梁
Co, cortex; Me, medulla; Ly, lymphocyte; Lyb, lymphoblasts; T, thymus; Tr, trabeculae Co,皮质;Me,髓质;Ly,淋巴细胞;Lyb,淋巴母细胞;T,胸腺;Tr,小梁
Figure 7. The histological development of thymus in American shad. (a) Thymus anlage at 12 DAH; (b) At 18 DAH, the lymphoblasts and reticular cells were present in thymus; (c) A completely development thymus at 45 DAH
图7. 美洲鲥胸腺早期发育 [3] 。(a) 12日龄,胸腺原基出现;(b) 18日龄,胸腺中淋巴母细胞和网状细胞出现;(c) 45日龄所示完全发育的胸腺
鱂Oryzias latims在12月龄胸腺完全退化消失 [38] ;虹鳟在15月龄时胸腺开始退化 [39] 。关于鱼类胸腺退化的生理机制及意义仍然有待进一步研究。
7.2. 肾脏的发生发育
鱼类的肾脏与哺乳动物的肾脏在结构和功能上存在着很大的差异。鱼类的肾脏主要分为头肾和体肾两个部分,头肾是产生B淋巴细胞的主要淋巴器官,在分泌抗体上属于次级淋巴器官,而且也是发生吞噬作用的场所,在免疫功能上发挥着至关重要的作用,功能类似于哺乳动物的骨髓,而体肾主要是进行排泄 [40] [41] 。在鱼类早期发育过程中,头肾首先作为排泄器官存在,之后随着仔鱼的生长发育,头肾逐渐由泌尿器官转化为造血组织,成为次级淋巴器官。鱼类的肾脏形成于胚胎时期,为一对笔直的原始肾管,位于脊索下方。在对美洲鲥研究表明,5日龄,原始的前肾小体出现,由肾小球和原始肾小囊组成,肾小球中为大量的毛血血管盘曲交织,肾小囊由单层扁平上皮构成,9日龄,肾小球中造血组织及血细胞大量出现,14日龄,前肾中淋巴母细胞出现,为大的染色较深的细胞,18日龄,头肾前肾小管、造血组织和血窦大量存在,淋巴母细胞分化发育为淋巴细胞,此时头肾淋巴化开始,22日龄,前肾小管和前肾管上皮细胞开始崩解,细胞间轮廓模糊,细胞嗜酸性明显增强,被伊红染成红色,肾管退化开始,28日龄,头肾中的造血组织及淋巴细胞继续增多,中肾明显,含有大量的肾小管和前肾小管,此时头肾已经由分泌和排泄组织向免疫和造血淋巴样组织转化完成,而体肾也逐步成熟,作为进一步的排泄器官存在 [3] [42] (图8)。在条石鲷、三长棘赤鲷、条斑星鲽等也发现了类似的发育特征 [10] [35] [43] 。可见,鱼类肾脏的早期发育主要分为前肾小体形成、头肾的淋巴化、头肾肾管退化、头肾免疫造血系统的形成及体肾分泌排泄系统的成熟。
7.3. 脾脏的发生发育
鱼类的脾脏为次级的淋巴器官,是鱼类重要的造血组织。在鱼类早期发育过程中,脾脏紧邻肠壁,位于鰾的腹侧面,由一些疏松的间叶细胞群组成,之后被胰脏组织包围,呈现椭圆形,内部间充质细胞开始分化为造血干细胞和网状细胞,随着脾脏体积迅速增加,淋巴母细胞和巨噬细胞出现。淋巴母细胞分化为淋巴细胞,静脉终端椭圆体和原始的血窦出现,脾脏淋巴化开始。随着生长发育,脾脏内微血管、血窦、淋巴细胞大量增加,网状内皮系统发达,此时脾脏发育完全 [3] [5] [35] [43] (图9)。在一些硬骨鱼类,脾脏在非特异免疫方面的作用也许比特异性免疫更加显著,尤其是在早期发育过程中。如在大西洋

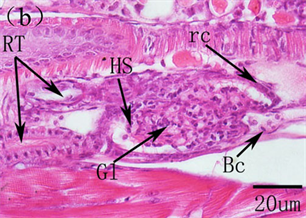
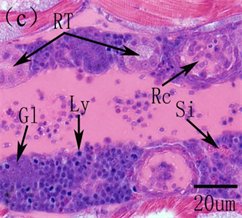
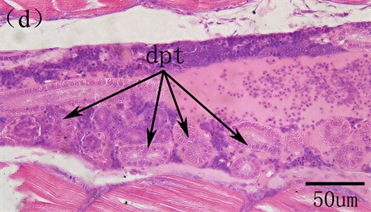
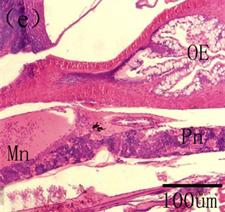 Bc, blood cells; dpt, degenerating pronephric tubules; Gl, glomerulus; HS, hematopoietic stem cells; Ly, lymphocytes; Mn, mesonephros; OE, oesophagus; Pn, pronephros; RC, reticular cells; Rc, renal pronephros; RT, renal tubules; Si, sinusoids Bc,血细胞;dpt,退化的前肾小管;Gl,肾小球;HS,造血干细胞;Ly,淋巴细胞;Mn,中肾;OE,食道;Pn,前肾;Rc,前肾;RC,网状细胞;RT,肾小管;Si,血窦
Bc, blood cells; dpt, degenerating pronephric tubules; Gl, glomerulus; HS, hematopoietic stem cells; Ly, lymphocytes; Mn, mesonephros; OE, oesophagus; Pn, pronephros; RC, reticular cells; Rc, renal pronephros; RT, renal tubules; Si, sinusoids Bc,血细胞;dpt,退化的前肾小管;Gl,肾小球;HS,造血干细胞;Ly,淋巴细胞;Mn,中肾;OE,食道;Pn,前肾;Rc,前肾;RC,网状细胞;RT,肾小管;Si,血窦
Figure 8.The histological development of kidney in American shad. (a) primordial renal pronephros evident at 5 DAH; (b) At 9 DAH showing the developing renal pronephros, mass of hematopoietic stem cells and blood cells were visible; (c) At 18 DAH, increase of kidney size; convolution and proliferation of renal tubules and abundant lymphocytes and sinusoid; (d) At 22 DAH, the pronephric tubules were degenerated; (e) Pronephric and mesonephric kidney at 28 DAH
图8.美洲鲥肾脏早期发育 [3] [42] 。(a) 原始的肾单位在5日龄形成;(b) 9日龄,肾小体明显,可见大量的造血组织和血细胞;(c) 18日龄所示发育的肾脏,大量的肾小管、血窦和淋巴细胞;(d) 22日龄,前肾小管开始退化,标志着头肾的形成;(e) 28日龄所示头肾和中肾
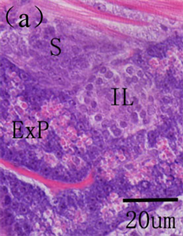

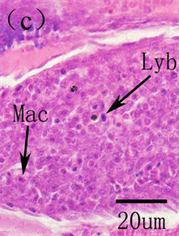
 ExP, exocrine pancreas; HS, hematopoietic stem cells; IL, islet of Langerhans; Ly, lymphocyte; Lyb, lymphoblasts; Mac, macrophages; RC, renal capsule; RP, red pulp; S, spleen; SE, splenic ellipsoids; WP, white pulp ExP,外分泌胰脏;HS,造血干细胞;IL,胰岛;Ly,淋巴细胞;Lyb,淋巴母细胞;Mac,巨噬细胞;RC,网状细胞;RP,红髓;S,脾脏;SE,椭圆体;WP,白髓
ExP, exocrine pancreas; HS, hematopoietic stem cells; IL, islet of Langerhans; Ly, lymphocyte; Lyb, lymphoblasts; Mac, macrophages; RC, renal capsule; RP, red pulp; S, spleen; SE, splenic ellipsoids; WP, white pulp ExP,外分泌胰脏;HS,造血干细胞;IL,胰岛;Ly,淋巴细胞;Lyb,淋巴母细胞;Mac,巨噬细胞;RC,网状细胞;RP,红髓;S,脾脏;SE,椭圆体;WP,白髓
Figure 9. The histological development of spleen in American shad. (a) 8 DAH showing the spleen anlage, exocrine pancreas and islet of Langerhans; (b) 11 DAH exhibiting islet of Langerhans and exocrine pancreas, spleen surrounded by exocrine pancreas; (c) The lymphoblasts and macrophages were seen in spleen at 20 DAH; (d) Spleen with the white pulp and the red pulp at 42 DAH
图9. 美洲鲥脾脏早期发育 [3] 。(a) 8日龄所示脾脏原基、外分泌胰脏和胰岛;(b) 11日龄,胰脏包围脾脏;(c) 20日龄,淋巴母细胞和巨噬细胞在脾脏中出现;(d) 42日龄,脾脏分为两部分:白髓和红髓
鲑一生中,脾脏一直能够生成红血球 [44] ;在金头鲷Sparus aurata中,脾脏在孵化后5天出现,而在77天后才出现淋巴细胞 [45] 。在鲈鱼Dicentrarchus labrax中也同样发现,脾脏原基在17日龄出现,但是在1年之后才在血管样组织周围发现淋巴细胞 [46] 。
8. 内分泌组织发生发育
内分泌组织如胰岛、甲状腺等在仔鱼早期生长发育过程中也是较早出现的 [47] [48] 。Yúfera等研究表明,甲状腺在鱼类早期分化、发育和生长方面发挥着重要的作用,尤其是在早期眼睛的着色和视网膜神经发生的过程中 [5] 。甲状腺滤泡位于眼部的后方,鳃弓的侧下方,为单层立方上皮细胞围成的小腔,内含有嗜酸性的胶原性物质。美洲鲥第一个甲状腺滤泡在2日龄出现,之后随着仔鱼的生长发育,大量增加 [3] 。细点牙鲷3日龄第一个甲状腺滤泡出现,4~9日龄具有2个滤泡,10~22日龄具有4个滤泡,23~36日龄滤泡大量增加 [31] 。三长棘赤鲷第一个甲状腺滤泡在5日龄出现,11日龄开始大量增加 [10] 。而在黑头呆鱼Pimephales promelas、大西洋狼鱼Anarhichas lupus和花狼鱼Anarhichas minor的仔鱼在孵化时就已存在功能性的甲状腺滤泡 [6] [47] 。在美洲鲥、蓝鳍金枪鱼、菱鲆及塞内加尔鳎胰岛自始至终均为一个 [1] [3] [4] [5] 。而在细点牙鲷的研究发现,仔鱼胰岛在3日龄出现,4~22日龄期间始终为一个,自23日龄开始,几个较小的胰岛在胰脏中出现 [31] ,这说明了细点牙雕对糖的利用能力可能比其他鱼类效率高。许多研究表明了内分泌组织早期出现可能对早期仔鱼的新陈代谢、发育及其变态发挥着至关重要的生理作用 [47] [49] 。
9. 小结
掌握鱼类早期发育的生物学规律及其变化,对解释鱼类早期生理机能及发生途径具有重要的科学意义和实际应用价值。一方面可以深入探讨鱼类组织器官发生发育过程,揭示鱼类早期生活史,丰富鱼类发育生物学基础理论;另一方面研究鱼类组织器官的发生发育可以进一步反映出其在养殖过程中可能受到来自营养条件、环境因素或者遗传等的胁迫,从而通过营养改良、养殖参数调整等进一步提高和优化人工繁育和养殖技术。在鱼类早期发育过程中,消化、免疫、视觉、呼吸等重要功能结构的完全发育,为仔、稚鱼快速生长发育创造了有利的条件。因此,在苗种培育过程中,为了确保仔鱼的健康生长发育,这些个体组织器官分化发育的差异应该被重视。
基金项目
青岛博士后应用研究项目(Q51201611);中央级公益性科研院所基本科研业务费专项,(20603022015005)。
文章引用
高小强,黄 滨,关长涛,刘宝良,贾玉东,洪 磊. 鱼类器官的早期发生发育研究
Study on Fish Organogenesis and Development[J]. 水产研究, 2018, 05(02): 51-63. https://doi.org/10.12677/OJFR.2018.52008
参考文献
- 1. Padrós, F., Villalta, M., Gisbert, E., et al. (2011) Morphological and Histological Study of Larval Development of the Senegal Sole Solea senegalensis: An Integrative Study. Journal of Fish Biology, 79, 3-32. https://doi.org/10.1111/j.1095-8649.2011.02942.x
- 2. Rombough, P.J. (2004) Gas Exchange, Ionoregulation, and the Functional Development of the Teleost Gill. American Fisheries Society Symposium Series, 40, 47-83.
- 3. Gao, X.Q., Hong, L., Liu, Z.F., et al. (2015) An Integrative Study of Larval Organogenesis of American Shad Alosa sapidissima in Histological Aspects. Chinese Journal of Oceanology & Limnology, 33, 1-17.
- 4. Hachero-Cruzado, I., Ortiz-Delgado, J.B., Borrega, B., et al. (2009) Larval Organogenesis of Flatfish Brill Scophthalmus rhombus L: Histological and Histochemical Aspects. Aquaculture, 286, 138-149. https://doi.org/10.1016/j.aquaculture.2008.09.039
- 5. Yúfera, M., Ortiz-Delgado, J.B., Hoffman, T., et al. (2014) Organogenesis of Digestive System, Visual System and Other Structures in Atlantic bluefin Tuna (Thunnus thynnus) Larvae Reared with Copepods in Mesocosm System. Aquaculture, 426–427, 126-137. https://doi.org/10.1016/j.aquaculture.2014.01.031
- 6. Falk-Petersen, I.B. and Hansen, T.K. (2001) Organ Differentiation in Newly Hatched Common Wolfish. Journal of Fish Biology, 59, 1465-1482. https://doi.org/10.1111/j.1095-8649.2001.tb00212.x
- 7. Hall, T.E., Smith, P. and Johnston, I.A. (2004) Stages of Embryonic Development in the Atlantic Cod Gadus morhua. Journal of Morphology, 259, 255-270. https://doi.org/10.1002/jmor.10222
- 8. 佟雪红. 大菱鲆早期发育及其相关生理特性研究[D]: [博士学位论文]. 青岛: 中国科学院研究生院(海洋研究所), 2010.
- 9. 何滔, 肖志忠, 刘清华,等. 条石鲷(Oplegnathus fas-ciatus)心脏早期发育的组织学观察[J]. 海洋与湖沼, 2012, 43(2):268-272.
- 10. Sánchez-Amaya, M.I., Or-tiz-Delgado, J.B., García-López, Á., et al. (2007) Larval Ontogeny of Redbanded Seabream Pagrus auriga Valen-ciennes, 1843 with Special Reference to the Digestive System. A Histological and Histochemical Approach. Aquaculture, 263, 259-279. https://doi.org/10.1016/j.aquaculture.2006.10.036
- 11. 肖志忠, 何滔, 于道德, 等. 条石鲷鳔器官早期发育的组织学观察[J]. 海洋科学, 2010, 34(12): 8-13.
- 12. Santamarı́a, C.A., Mateo, M.M.D., Traveset, R., et al. (2004) Larval Organogenesis in Common Dentex Dentex dentex L. (Sparidae): Histological and Histochemical Aspects. Aquaculture, 237, 207-228. https://doi.org/10.1016/j.aquaculture.2004.03.020
- 13. 郭恩棉, 张艳萍, 王鑫. 短盖巨脂鲤鳃、伪鳃和鳔胚后发育学研究[J]. 海洋湖沼通报, 2005(3): 31-37.
- 14. 门强, 雷霁霖. 大菱鲆鳔器官发育的形态学与组织学特征[J]. 中国水产科学, 2003, 10(2): 111-116.
- 15. 胡先成, 赵云龙. 河川沙塘鳢视觉器官的发育及其与摄食的关系[J]. 动物学杂志, 2007, 42(5): 41-48.
- 16. 柴毅, 谢从新, 危起伟, 等. 中华鲟视网膜早期发育及趋光行为观察[J]. 水生生物学报, 2007, 31(6): 920-922.
- 17. 何滔, 肖志忠, 刘清华, 等. 条石鲷视觉器官早期发育的组织学观察[J]. 海洋科学, 2012, 36(3): 49-53.
- 18. 高小强, 洪磊, 刘志峰, 等. 美洲鲥(Alosa sapidissima) 眼睛早期发育的组织学观察[J]. 渔业科学进展, 2016, 37(2): 1-8.
- 19. 佟雪红, 马道远, 徐世宏, 等. 大菱鲆(Scophthalmus maximus)胚胎发育的形态学和组织学研究[J]. 海洋与湖沼, 2011, 42(6): 844-849.
- 20. 胡先成. 河川沙塘鳢(Odontobutis potamophila)早期发育过程中的器官发生, 营养代谢及其能量收支的研究[D]: [硕士学位论文]. 上海: 华东师范大学, 2007: 26-35.
- 21. 敖磊. 南方鲇嗅觉和视觉器官结构及发育的研究[D]: [硕士学位论文]. 重庆: 西南师范大学, 2002: 1-42.
- 22. Canino, M.F. and Bailey, K.M. (1995) Gut Evacuation of Walleye Pollock Larvae in Response to Feeding Conditions. Journal of Fish Biology, 46, 389-403. https://doi.org/10.1111/j.1095-8649.1995.tb05979.x
- 23. Chen, B.N., Qin, J.G., Kumar, M.S., et al. (2006) Ontogenetic Development of the Digestive System in Yellowtail Kingfish Seriola lalandi Larvae. Aquaculture, 256, 489-501. https://doi.org/10.1016/j.aquaculture.2006.01.041
- 24. Comabella, Y., Franyutti, A.H., Hurtado, A., et al. (2013) Ontogenetic Development of the Digestive Tract in Cuban Gar (Atractosteus tristoechus) Larvae. Reviews in Fish Biology & Fisheries, 23, 245-260. https://doi.org/10.1007/s11160-012-9289-z
- 25. Bisbal, G.A. and Bengtson, D.A. (1995) Development of the Digestive Tract in Larval Summer Flounder. Journal of Fish Biology, 47, 277-291. https://doi.org/10.1111/j.1095-8649.1995.tb01895.x
- 26. Boulhic, M. and Gabaudan, J. (1992) Histological Study of the Organogenesis of the Digestive System and Swim Bladder of the Dover Sole, Solea solea (Linnaeus 1758). Aquaculture, 102, 373-396. https://doi.org/10.1016/0044-8486(92)90190-V
- 27. Buddington, R.K. (1985) Digestive Secretions of Lake Sturgeon, Acipenser fulvescens, during Early Development. Journal of Fish Biology, 26, 715-723. https://doi.org/10.1111/j.1095-8649.1985.tb04311.x
- 28. Hernández, M.P.G., Lozano, M.T., Elbal, M.T., et al. (2001) Development of the Digestive Tract of Sea Bass (Dicentrarchus labrax L). Light and Electron Microscopic Studies. Anatomy & Embryology, 204, 39-57. https://doi.org/10.1007/s004290100173
- 29. Mai, K., Yu, H., Ma, H., et al. (2005) A Histological Study on the Development of the Digestive System of Pseudosciaena crocea Larvae and Juveniles. Journal of Fish Biology, 67, 1094-1106. https://doi.org/10.1111/j.0022-1112.2005.00812.x
- 30. Gisbert, E., Sarasquete, M.C., Williot, P., et al. (1999) Histochemistry of the Development of the Digestive System of Siberian sturgeon during Early Ontogeny. Journal of Fish Biology, 55, 596-616. https://doi.org/10.1111/j.1095-8649.1999.tb00702.x
- 31. Elbal, M.T., Hernández, M.P.G., Lozano, M.T., et al. (2004) Development of the Digestive Tract of Gilthead Sea Bream (Sparus aurata L.). Light and Electron Microscopic Studies. Aquaculture, 234, 215-238. https://doi.org/10.1016/j.aquaculture.2003.11.028
- 32. Pradhan, P.K., Jena, J., Mitra, G., et al. (2013) Ontogeny of the Digestive Enzymes in Butter Catfish Ompok bimaculatus (Bloch) Larvae. Aquaculture, 372-375, 62-69. https://doi.org/10.1016/j.aquaculture.2012.10.024
- 33. Watanabe, Y. (1984) Morphological and Functional Changes in Rectal Epithelium Cells of Pond Smelt during Postembryonic Development. Nihon-suisan-gakkai-shi, 50, 805-814. https://doi.org/10.2331/suisan.50.805
- 34. He, T., Xiao, Z., Liu, Q., et al. (2012) Ontogeny of the Digestive Tract and Enzymes in Rock Bream Oplegnathus fasciatus (Temminck et Schlegel 1844) Larvae. Fish Physiology & Biochemistry, 38, 297-308. https://doi.org/10.1007/s10695-011-9507-y
- 35. Xiao, Z., Tao, H.E., Jun, L.I., et al. (2013) Ontogeny of the Immune System in Rock Bream Oplegnathus fasciatus. Chinese Journal of Oceanology & Limnology, 31, 1028-1035. https://doi.org/10.1007/s00343-013-2278-9
- 36. Chilmonczyk, S. (1992) The Thymus in Fish: Development and Possible Function in the Immune Response. Annual Review of Fish Diseases, 2, 181-200. https://doi.org/10.1016/0959-8030(92)90063-4
- 37. Pulsford, A., Morrow, W.J.W. and Fänge, R. (2006) Structural Studies on the Thymus of the Dogfish. Scyliorhinus canicula L. Journal of Fish Biology, 25, 353-360. https://doi.org/10.1111/j.1095-8649.1984.tb04882.x
- 38. Cooper, E.L., Zapata, A., Barrutia, M.G., et al. (1983) Aging Changes in Lymphopoietic and Myelopoietic Organs of the Annual Cyprinodont Fish. Nothobranchius guentheri. Experimental Gerontology, 18, 29-38. https://doi.org/10.1016/0531-5565(83)90048-7
- 39. Tatner, M.F. and Manning, M.J. (1983) Growth of the Lymphoid Organs in Rainbow Trout, Salmo gairdneri from One to Fifteen Months of Age. Journal of Zoology, 199, 503-520.
- 40. Manning, M.J. (1994) Fishes. In: Turner, R.J., Ed., Immunology: A Comparative Approach, John Wiley & Sons, Chichester, 69-100.
- 41. Bayne, C.J. (1986) Pronephric Leucocytes of Cyprinus carpio: Isolation, Separation and Characterization. Veterinary Immunology and Immunopathology, 12, 141-151. https://doi.org/10.1016/0165-2427(86)90118-2
- 42. 高小强. 美洲鲥Alosa sapidissima早期发育组织学及相关生理特性研究[D]: [博士学位论文]. 青岛: 中国海洋大学, 2015: 1-133.
- 43. 肖志忠, 于道德, 孙真真, 等. 条斑星鲽免疫器官个体发生的组织学观察[J]. 海洋科学, 2008, 32(7): 88-92.
- 44. Ellis, A.E. (1997) Ontogeny of the Immune Respones in Salmo salar. Histogenesis of the Lymphoid Organs and the Appearance of Membrane Immunoglobulin and Mixed Leucocyte Reactivity. In: Solomon, J.B. and Horton, J.D., Eds., Developmental Immunobiology, Elsevier, Amsterdam, 225-231.
- 45. Jósefsson, S. and Tatner, M.F. (1993) Histogenesis of the Lymphoid Organs in Sea Bream (Sparus aurata L.). Fish & Shellfish Immunology, 3, 35-49. https://doi.org/10.1006/fsim.1993.1004
- 46. Abelli, L., Picchietti, S., Romano, N., et al. (1996) Immunocytochemical Detection of Thymocyte Antigenic Determinants in Developing Lymphoid Organs of Sea Bass Dicentrarchus labrax (L.). Fish & Shellfish Immunology, 6, 493-505. https://doi.org/10.1006/fsim.1996.0047
- 47. Tanaka, M., Tanangonan, J.B., Tagawa, M., et al. (1995) Development of the Pituitary, Thyroid and Interregnal Glands and Applications of Endocrinology to the Improved Rearing of Marine Fish Larvae. Aquaculture, 135, 111-126. https://doi.org/10.1016/0044-8486(95)01019-X
- 48. Vadstein, O., Mo, T.A. and Bergh, Ø. (2004) Microbial Interactions, Prophylaxis and Diseases. In: Moksness, E., Kjørsvik, E. and Olsen, Y., Eds., Culture of Cold Water Marine Fish, Blackwell Publishing Ltd., Oxford, 28-64. https://doi.org/10.1002/9780470995617.ch3
- 49. Huang, L., Miwa, S., Bengtson, D.A., et al. (1998) Effect of Triiodothyronine on Stomach Formation and Pigmentation in Larval Striped Bass (Morone saxatilis). Journal of Experimental Zoology, 280, 231-237. https://doi.org/10.1002/(SICI)1097-010X(19980215)280:3<231::AID-JEZ4>3.0.CO;2-O
NOTES
*通讯作者。