Journal of Comparative Chemistry
Vol.01 No.01(2017), Article ID:21619,10
pages
10.12677/cc.2017.11005
Building Bridges between Organic Chemistry and Inorganic Chemistry
Wenxiang Hu1,2*, Mixia Ma3
1Space Systems Division, Strategic Support Troops, Chinese People’s Liberation Army, Beijing
2Xianghu Microwave Chemistry Union Laboratory in North China, Beijing Excalibur Space Military Academy of Medical Sciences, Beijing
3Beijing Union University, Beijing

Received: Jul. 18th, 2017; accepted: Aug. 4th, 2017; published: Aug. 7th, 2017

ABSTRACT
This paper introduces the speech related content of Ronald Hoffman prize winner Nobel in 1981. It is a typical thought of comparative chemistry.
Keywords:The Isolbal Analogy, Organic Chemistry, Inorganic Complex, Building Bridges, Comparative Chemistry
构筑有机化学通向无机化学的桥梁
胡文祥1,2*,马密霞3
1中国人民解放军战略支援部队航天系统部,北京
2北京神剑天军医学科学院华北祥鹄微波化学联合实验室,北京
3北京联合大学,北京

收稿日期:2017年7月18日;录用日期:2017年8月4日;发布日期:2017年8月7日

摘 要
本文介绍了1981年诺贝尔化学奖获得者霍夫曼的获奖演讲及其相关内容,是比较化学的典型思想方法。
关键词 :等瓣类似性,有机化学,无机复杂络合物,筑桥,比较化学

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 前言
分门别类的科学研究和社会分工在历史上的推动作用是不言而喻的。正如古典经济学之父亚当·斯密在1776年3月发表的《国富论》(关于国民财富的本质和原因的研究)中指出的那样:人类如果没有分工,“没有互通有无、物物交换和相互交易的倾向,各个人都须亲自生产自己生活上的一切必须品和便利品,而一切人的任务和工作全无分别,那么工作差异所产生的才能的巨大差异,就不可能存在了。”
同样早在古希腊、古印度和古代中国,科学研究也是混沌的、一统的,后来发展到分门别类的研究,分出哲学、自然科学和社会科学等,并各自细分为许多分支学科后,科学研究才取得巨大的进步。人们看到这种分类的巨大作用,也享受到了分类的巨大红利,进而让科学的分门别类愈来愈精细了。殊不知,这种愈分愈细的倾向,造成了学科之间的巨大鸿沟,也影响科学深入的发展。因此,恩格斯曾经尖锐的指出:绝对的分明和无条件的界限是不存在的,横断学科、交叉边缘学科成为当代科学发展的热点。
无机化学和有机化学是化学的两个重要的领域,多年来,人们人为地把它们分为界限分明的两门学科。随着科技的发展和人们认识水平的提高,这一界限已被突破,无机化学和有机化学相结合出现了一门新的交叉学科——金属有机化学,近30年来,这门学科飞速发展已成为当前最活跃、最热门的化学研究领域之一。
“在无机化学和有机化学之间建立桥梁”,这是1981年诺贝尔化学奖获得者之一(另一得奖者是建立了前线轨道理论的福井谦一) R. Hoffmann教授在诺贝尔授奖仪式的学术演讲题目,本文作者强烈推荐这篇文章 [1] ,请读者细细研读品味,相信读者不仅能获得R. Hoffmann“等瓣类似性”的绝妙思想,还能对“比较化学”概念有一个深刻的理解。我国知名金属有机化学专家陆熙炎教授将R. Hoffmann的演讲译成的中文发表在《有机化学》 [2] 上,译的非常好,建议读者细心品读。
R. Hoffmann在诺贝尔奖授奖仪式上的演讲,震动了科学界。他以量子化学计算为基础提出了无机碎片和有机碎片之间的等瓣类似性关系,把无机化学和有机化学联系起来,从而使复杂的金属有机化合物结构解析成为可能,找到了有机结构与无机结构之间的相互联系,也为复杂金属有机化合物的设计合成提供了一种理论途径。
Ronald Hoffmann,1937年生于波兰,后到美国求学,大学毕业于哥伦比亚大学,在哈佛大学得硕士学位。在哈佛大学期间,跟随Lipscomb教授进行学习和研究。1963年发表扩充的Huckel法,是量子化学领域中的一大重要贡献。其后,和已故著名有机化学家R.B. Woodward幸运地合作,在1965年发表了有机化学中“战后最重要的贡献”——Woodward-Hoffmann规则,因而获得1981年诺贝尔化学奖。后来,他发表了“通过空间(through space)”,“通过键(through bond)”等突出的概念。他的兴趣逐渐转到金属有机化学,在量子化学的基础上,把金属有机络合物系统化,其中心是“等瓣性类似”概念。
R. Hoffmann演讲开篇讲到:“R.B. Woodward,这位杰出的大师使自然中的混乱变成有规律,是我的老师之一。我谨以这一讲演奉献给他,因为由于我们在轨道对称守恒(控制化学反应过程的电子因素)方面的合作,被授予1981年诺贝尔化学奖金的一半。我从Woodward那里,学到很多东西:诸如实验对理论的重要促进作用,创立解释方法的技巧,和美学在科学中的重要性等。在这里将试图介绍如何将化学理论的特色应用于建立无机化学和有机化学之间概念性的桥梁”。
2. 碎片
取代基、链节、环等这些是构成近代有机化学神秘大厦的基石。任何一个碳氢化合物都可以在纸上从甲基CH3,亚甲基CH2,次甲基CH,和碳原子C,组合而成,经过取代和引入杂原子,可以得到所有骨架的和想像的官能团,包括从乙烷到河豚毒素(tetrodotoxin)。
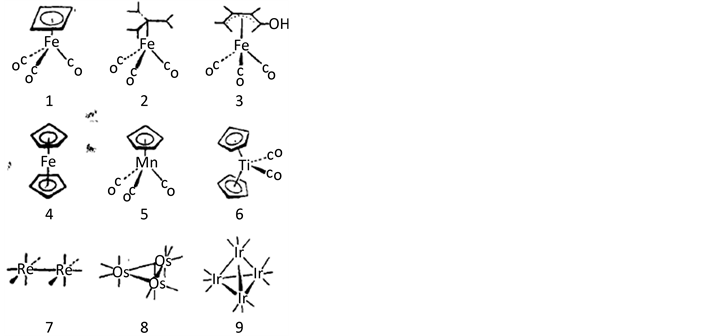
近30多年来,无机化学的复兴方兴未艾,尤其在过渡金属的有机金属化学领域更是鲜花盛开。结构1~3说明了过渡金属碎片的独特面貌,这里是三种有机组成部分的三羰基铁络合物,即环丁二烯、三亚甲基甲烷和一种烯醇即羟基丁二烯,这三种有机组成部分本身的动力学和热力学稳定性都很差,但是当这些分子和Fe(CO)3络合后就比较稳定,能保存于瓶子中。这一无机碎片在这里并不是以弱键相连的无关紧要的组分(或组成部分),而是在实质上改变了分子中的成键性质。
结构4~6包含了常见的茂基(Cp)配位体,在最早的代表性化合物二茂铁中有二个茂环,在CpMn(CO)3中有一个,在Cp2Ti(CO)2中有二个弯的茂基。结构7~9是正在发展的簇族类化合物的最简单代表——具有外来配位体的二个或二个以上金属原子的集合。
如果我们寻找这些络合物的条理性和统一性,就不难发现这些分子都以过渡金属与配位体碎片MLn作为基石,例如M(CO)5,M(CO)4,M(CO)3,MCp等。必须指出的是:羰基配位体在这里并没有什么特殊性,它仅仅是有机金属络合物普通组份的一个代表而已,磷类、烯烃、烷基也能起同样作用。
要重新构成络合物1~9,我们需要了解这些碎片的电子结构,对于这些分子的键合状态简单的定性描述,我们并不需要知道每一分子的电子结构每一细节,只要知道碎片的前沿轨道——最高占有轨道和最低空轨道,换言之,即每一碎片的化合价活性轨道(Valence active orbitals)就足够了。首先使我们懂得前沿轨道的重要性要归功于福井谦一(K. Fukui.1981年与R. Hoffmann共获得诺贝尔化学奖),我们将看到:就是无机和有机组成部分的前沿轨道相似性这一点,为这门科学的两个次级学科之间提供了我们所寻找的桥梁。
20世纪70年代,R. Hoffmann及其合作者积累了有关MLn碎片的轨道函数的数据,完成这些工作是应用完全定性的、扩充的Huckel法近似分子轨道计算(这是R. Hoffmann的另一位老师W.N. Lipscomb所发展的方法),和对称性的论述(其价值是从R. Hoffmann的另一位老师M.P. Gouterman那里学来的)。分子轨道理论——这是R.S. Mulliken对化学的伟大贡献——是我们方法的基础,其它如构成碎片的特殊轨道函数,分子变形时轨道函数的变化,或若干个这种碎片相互作用以构成这种复合分子。但是当用最简单的可能方法告诉你们这些碎片的轨道函数时,要追溯到L. Pauling所提出的价键理论。
让我们回到构成这些化合物的基石,常见的碎片MLn,结构10~13可以用各种不同方法来观察。一个方便的方法是把它们看作为正八面体的一个部分,这类似于在正四面体中对CH3、CH2、和CH的理解。尽管这不是唯一的方法,但却是有用的方法。如果有了正八面体或是它的一部分,让我们来考虑正八面体中金属原子的键合状态,然后再装上合适数目的配位体。

过渡金属的化合价轨道函数为nd,(n+1)s和(n+1)p,其中n=3,4,5,要使得金属原子成键,必须形成六个相等的正八面体杂化键。在结构14中,利用了所有的s和p函数和两个d函数,还剩有三个d函数dxz,dxy及dyz没有进行杂化,我们也像通常正八面体的晶体场理论、配位场理论或分子轨道理论一样,称之为t2g组。

要形成正八面体络合物,须引入六个配位体以利用这六个正八面体的杂化键,在这里须要澄清一下对配位体的习惯表示法,配位体总是被看作偶数电子的路易斯碱,尽管有时配位体有受体的性质或路易斯酸性,但是它的路易斯碱性或供体的性质总是主要的。我们知道CO,PH3,和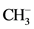 (15~17)的孤对电子的碱性,乙二胺(18)或丁二烯(19)具双合型四电子配位体的碱性,或相当于三个二电子碱的电子三配合体(electronically tridentate)
(15~17)的孤对电子的碱性,乙二胺(18)或丁二烯(19)具双合型四电子配位体的碱性,或相当于三个二电子碱的电子三配合体(electronically tridentate)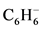 ,
,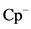 (20)的碱性。
(20)的碱性。

让六个二电子配位体接近正八面体成键的金属原子时,相当大的σ交盖导致形成强的金属–配位体σ成键组合,和它们的强的金属–配位体的σ*反键部分,配位体的六对电子进入六个成键的组合中,金
Table 1. Modified Mendeleev periodic table of elements
表1. 改进的门捷列夫周期表
属所贡献的电子则进入t2g轨道中。实际上,Cr(CO)6有6个金属电子,可以完成完美的闭壳层构型,这符合于有机化学中力学和热力学上有相对稳定性的情形。
有多少电子被分配在前线轨道中,可利用改进的Mendeleev周期表来计算(见表1),由表1可知,Fe(0)与Co(I),Ni(II)的价电子数均为8。
3. 等瓣类似性(等叶片类似性)
试考虑d7的碎片,Mn(CO)5 (或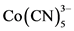 )在t2g组的三对孤对电子的上面的杂化轨道中有单个电子,朝着离开ML5的那个方向,它和甲基的相似性是很清楚的。
)在t2g组的三对孤对电子的上面的杂化轨道中有单个电子,朝着离开ML5的那个方向,它和甲基的相似性是很清楚的。

这里的画法是示意性的,画出了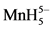 和CH3的a1轨道(图1),这样可以作一个实际的比较。
和CH3的a1轨道(图1),这样可以作一个实际的比较。
如果d7ML5与CH3相似,那么他们的行为也应该类同。如甲基能二聚成乙烷,并开始自由基链,那么Mn(CO)5或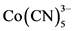 也有相似的性质,它们能分别二聚成Mn2(CO)10或
也有相似的性质,它们能分别二聚成Mn2(CO)10或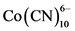 ,而且各有其丰富的自由基类型。人们甚至可以使有机和无机碎片进行共二聚而生成(CO)5 MnCH3,这可能不是在实验室制备这个标准有机金属烷基络合物的好方法,但在纸上绘出,完全是可能的。
,而且各有其丰富的自由基类型。人们甚至可以使有机和无机碎片进行共二聚而生成(CO)5 MnCH3,这可能不是在实验室制备这个标准有机金属烷基络合物的好方法,但在纸上绘出,完全是可能的。

此外,还可以看到它们之间的另一个相似之处,例如为了比较它们的单电子占有的a1轨道的相似性,用实际的配位体,如氢之间的重叠(如图2所示),可以看到这二个重叠是相平行的,H-CH3之间重叠处都比H-MnL5间的重叠为小,但二者对于距离的依赖性则极为类似。CH3和d7ML5肯定不是等结构的,也不是等电子的,但这二个碎片具有性质相似的前沿轨道,我们称这二个碎片为等瓣性(isolobal)的,也即它们的前沿轨道数目、对称性、能级和形状以及电子数目都是类似的,不是相等,而是类似。CH3和Mn(CO)5称为具有等瓣性。这里,我们还要引入一个表示等瓣性
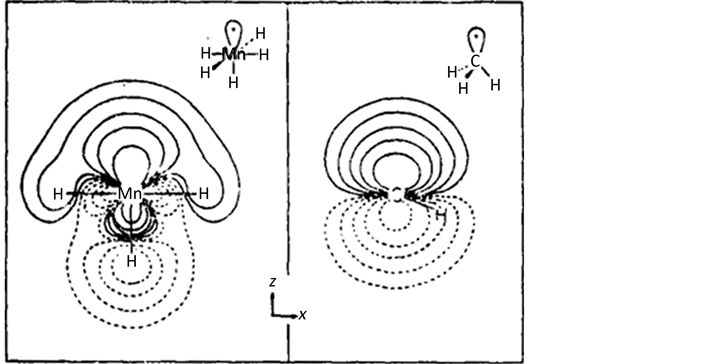
Figure 1. The electron density contour map calculated using the expanded Huckel method
图1. 用扩充的Huckel法计算的电子密度等高图
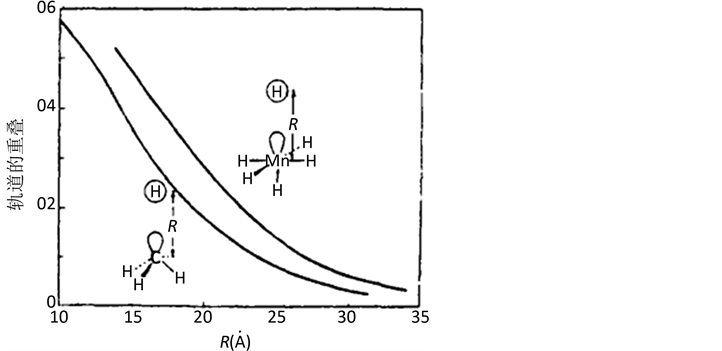
Figure 2. The relationship between the overlap integral of  and CH3’s a1 front orbital and the H1s orbital to the distance of Mn-H or C-H
and CH3’s a1 front orbital and the H1s orbital to the distance of Mn-H or C-H
图2. 和CH3的a1前线轨道同H1s轨道的重叠积分对Mn-H或C-H距离的关系
和CH3的a1前线轨道同H1s轨道的重叠积分对Mn-H或C-H距离的关系
关系的符号:即下面带有半个轨道的双箭头线,如:
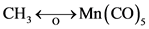
在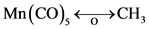 成立的情况下,可作如下推广 [3] :
成立的情况下,可作如下推广 [3] :
1) Tc(CO)5、Re(CO)5和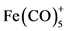 也与CH3等瓣类似,因为α1杂化轨道的形状并不因主量子数不同而有很大变化:即
也与CH3等瓣类似,因为α1杂化轨道的形状并不因主量子数不同而有很大变化:即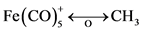
2) Cr(CO)5,Mo(CO)5或W(CO)5将和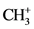 有等瓣性,Fe(CO)5 (正方锥)与
有等瓣性,Fe(CO)5 (正方锥)与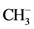 有等瓣性。
有等瓣性。
3) Mn(PR3)5和 或其它d7-ML5也与CH3有等瓣性。CpFe(CO)2也一样,在ML4碎片中,显然d8-ML4如Fe(CO)4与CH2 (卡宾)有等瓣性。即
或其它d7-ML5也与CH3有等瓣性。CpFe(CO)2也一样,在ML4碎片中,显然d8-ML4如Fe(CO)4与CH2 (卡宾)有等瓣性。即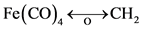 ,因CH2可二聚成乙烯,Fe(CO)4也可以二聚成Fe2(CO)8或CH2Fe(CO)4,但Fe2(CO)8不稳定。Fe(CO)4,Ru(CO)4,Os(CO)4和CH2还可以形成三聚物,如
,因CH2可二聚成乙烯,Fe(CO)4也可以二聚成Fe2(CO)8或CH2Fe(CO)4,但Fe2(CO)8不稳定。Fe(CO)4,Ru(CO)4,Os(CO)4和CH2还可以形成三聚物,如

均已得到。需指出的是:
1) Fe2(CO)8不稳定,这是等瓣类似性的一个局限性,按其建造的化合物并不一定稳定。
2) 在[M(CO)4]3中只有M = Os时可以。在Fe3(CO)12分子中含有一个μ2-CO,这是等瓣类似性的又一局限性,这是因为桥连的能量低。
4. 八面体之外的金属有机碎片的等瓣类似性关系
金属有机碎片具有更高的配位数时,它与有机碎片的等瓣类似性关系可以在18电子规则的基础上来寻找。如果d6-ML6配合物是满足18电子规则的,那么d6-ML5在反键和成键或非键轨道之间将有一个空的杂化轨道,象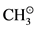 ;d6-ML4将有两个杂化的空轨道,像
;d6-ML4将有两个杂化的空轨道,像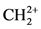 。
。
在七配位的化合物中,满足18电子规则的是d4-ML7,其衍生出的等瓣类似性关系为:
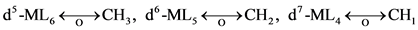
在八配位的配合物中,d2-ML8满足18电子规则,可导出:
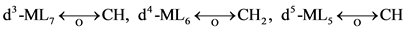
不同配位的金属有机碎片等瓣类似性关系总结如表2所示。常见金属有机碎片等瓣类似性关系的例子列于表3 [4] 。
5. 等瓣类似性关系的某些应用
5.1. 等瓣类似性关系在合成化学中的应用
就像药物化学中的电子等排原理一样,在药物分子设计中起到重要作用,可以指导设计合成许多新颖结构的活性化合物。同样,具有等瓣类似性的有机或无机碎片在一定情况下可以互相代替(不妨可以称为广义等排原理,这样从经典电子等排到生物电子等排再到广义等排,概念一步步拓展,给分子设计带来更为广阔的前景),设计出许多结构独特的新型化合物,非常令人神往!利用无机、有机分子碎片的类似性可相互替代设计新化合物,然后由实验合成验证。从而对合成化学发生指导作用,这一方面越来越受到人们的重视和青睐。
由已知的金属有机化合物可指导有机化合物的合成。例如,由于 可以推知:
可以推知:
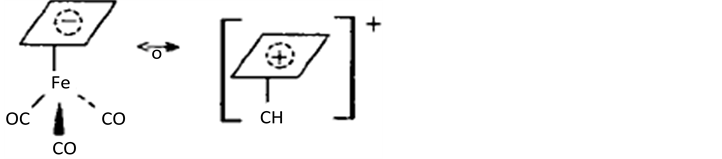
Table 2. The isolbal analogy with different bits of metal organic fragments
表2. 不同配位数的金属有机碎片等瓣类似性关系
Table 3. The isolbal analogy examples with common metal organic fragments
表3. 常见金属有机碎片等瓣类似性关系的例子
从而指导后者的合成等。
据已知的有机化合物利用金属有机分子碎片取代等瓣类似的有机碎片合成金属有机化合物,这方面研究得较多。
1980年Vahren Kamp等 [5] 实验合成庚烷的金属有机类似物
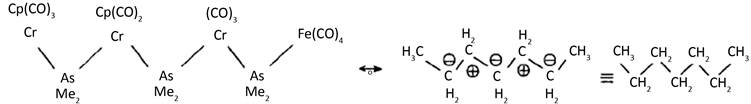
锇的簇合物合成的进展也是很好的例子。1977年Chur Chill等 [6] 测定了Os3(CO)12的晶体结构,三个Os原子构成一个对称的三角形,由于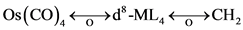 可知Os3(CO)12是环丙烷的类似物,其后几年合成了Os5(CO)19(E)和Os6(CO)17[P(OMe)3]4。
可知Os3(CO)12是环丙烷的类似物,其后几年合成了Os5(CO)19(E)和Os6(CO)17[P(OMe)3]4。
有机化合物中一个典型结构——立方烷(C8H8)的金属有机类似物的合成是其应用的另一个好实例:Dahl等先后合成了(η5-C5H5)4Co4S4,Fe4S4(CO)12。这里M4骨架为正四面体,所以前两个化合物均为立方烷的类似物。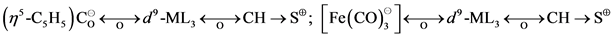 。
。
总之,等瓣类似性关系在合成化学特别是金属有机化合物的合成中有一定价值,但需注意的是该关系所预言的化合物不一定能稳定存在。尽管如此,在合成化学目标化合物的设计中,等瓣类似性关系仍是一种很有效的手段。
5.2. 等瓣类似性与结构的关系
等瓣类似性的一个应用是有关结构方面的。由于这一类似性,使我们对看起来结构复杂的分子可以看清楚它的简单本质。
Kaesz及其合作者发现的簇化合物HRe3(CO)12Sn(CH3)2的结构 [7] ,氢的位置未确定,把氢作质子去掉,则得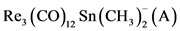 ,由于
,由于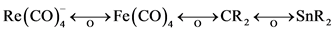 就会发现其结构与从前已知的(B)和(C)非常相似。
就会发现其结构与从前已知的(B)和(C)非常相似。

有趣的是用这一方法可以推出还未发现的这一系列的有机部分,如, 及
及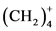 。
。
如前所述Fe(CO)8是不稳定的,与锡原子结合得(D) [8] ,有趣的是这一结构与螺戌烷的结构类似
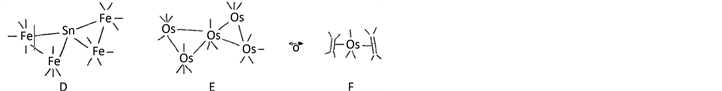
Os5(CO)19(E)的结构看来相当复杂,但实际上是典型的双三角锥Os(CO)5的衍生物。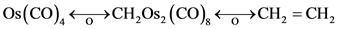 ,以乙烯代替Os2(CO)8可得(F)。像这样的例子还有很多,用等瓣性类似的概念可以阐明许多复杂结构的无机络合物或有机金属化合物的结构细节,大大促进了金属有机化学领域的发展。
,以乙烯代替Os2(CO)8可得(F)。像这样的例子还有很多,用等瓣性类似的概念可以阐明许多复杂结构的无机络合物或有机金属化合物的结构细节,大大促进了金属有机化学领域的发展。
等瓣类似性是一种概念模型,化学工作者的义务是将它进一步发展。对于任何模型来说,都有它独创的地方,也存在着一些真实性。另一方面,由于它仅仅是模型,所以不是在任何情况都能实际应用的,有一定的局限性。这一模型的引人入胜之处在于它把两个不同的领域联系了起来。我们把自己人为地分为有机化学家、无机化学家、物理化学家、生物化学家、分析化学家等等,按其所合成出的各种分子的多样性以及研究它们的方法不同,导致产生了专门的词汇,造成各种专门化。但是,在可望看到的复杂性下面,一定蕴藏着统一性 [9] 。
文章引用
胡文祥,马密霞. 构筑有机化学通向无机化学的桥梁
Building Bridges between Organic Chemistry and Inorganic Chemistry[J]. 比较化学, 2017, 01(01): 23-32. http://dx.doi.org/10.12677/cc.2017.11005
参考文献 (References)
- 1. Hoffmann, R. (1982) Building Bridges between Inorganic and Organic Chemistry (Nobel Lecture). Angewandte Chemie International Edition in English, 21, 711-724.
- 2. Hoffmann, R. 在无机化学和有机化学之间建立桥梁[J]. 陆熙炎, 译. 有机化学, 1983(3): 216, 229-240.
- 3. 李忠芳, 王素文. 在无机化学和有机化学之间建立起的桥梁[J]. 菏泽师专学报, 1996, 18(4): 26-32.
- 4. Stone, F.G.A. (1984) Metal-Carbon and Metal-Metal Multiple Bonds as Ligands in Transition-Metal Chemistry: The Isolobal Connection. Angewandte Chemie International Edition in English, 23, 89-99. https://doi.org/10.1002/anie.198400893
- 5. Langenbach, H.J., Heller, E. and Vahrenkamp, H. (1980) Reaktivität von met-al-metall-bindungen. Vierkernkomplexe mit kettenförmiger anordnung von metall- und brükenatomen. Journal of Organometallic Chemistry, 191, 95-106. https://doi.org/10.1016/S0022-328X(00)88558-7
- 6. Churchill, M.R. and De Boer, B.G. (1977) Structural Studies on Polynu-clear Osmium Carbonyl Hydrides. 1. Crystal Structures of the Isomorphous Species Undecacarbonyldihydrotriosmium and Dodeca-carbonyltriosmium. Role of an Equatorial .mu.2-Bridging Hydride Ligand in Perturbing the Arrangement of Carbonyl Ligands in a Triangular Cluster. Inorganic Chemistry, 16, 878-884. https://doi.org/10.1021/ic50170a032
- 7. Haie, B.T., Kirtley, S.W., Knobler, C.B. and Kaesz, H.D. (1981) Synthesis, Spectroscopic Characterization and Crystal and Molecular Structure of μ-(dimethylstannado)-μ-(hydrido) Dodecacarbonyltrirhenium. Journal of Organometallic Chemistry, 213, 45-62. https://doi.org/10.1016/S0022-328X(00)93950-0
- 8. Cotton, J.D., et al. (1966) Tin-Iron Carbonyl Clusters and Sequences. Chemical Communications, 9, 253. https://doi.org/10.1039/C19660000253
- 9. 胡文祥, 李博. 比较化学——构筑量子化学通向分子药学的桥梁[M]. 北京: 化学工业出版社, 2013.
