Material Sciences
Vol.07 No.09(2017), Article ID:23203,7
pages
10.12677/MS.2017.79101
Preparation and Properties 5-Fluorouracil-Loaded Chitosan Microsphere
Yuting Chen, Fengmei Cheng, Leihao Zhang, Yushuang Miao, Haiqin Yuan, Jing Li
College of Material and Textile Engineering, Jiaxing University, Jiaxing Zhejiang

Received: Dec. 3rd, 2017; accepted: Dec. 19th, 2017; published: Dec. 28th, 2017

ABSTRACT
5-Fluorouracil/chitosan (5-Fu/Cs) microspheres were prepared in emulsion by using glutaraldehyde as cross-linking agent, span -80 and magnesium stearate mixture as emulsifier, and paraffin oil-vacuum pump oil mixture as oil phase. The morphology, dimension and drug-encapsulation capabilities of 5-Fu/Cs microspheres were explored. The surface of 5-Fu/Cs microspheres is smooth, and the dimension is regular and uniform (~400 nm); strong interaction between the 5-Fu and Cs has been found. The drug encapsulation efficiency was determined (~87.6%). The microspheres showed excellent sustained-release effect in buffer solutions with pH = 7.4 and pH = 1.2, while higher release rate was found in lower pH solution. In addition, the release was also affected by the feed ratio of 5-Fu to Cs. With decreasing weight fraction of 5-Fu, increasing releasing rate was found.
Keywords:5-Fluorouracil, Chitosan, Microspheres, Sustained-Release
5-氟尿嘧啶/壳聚糖载药微球的制备及性能研究
陈雨婷,程凤梅,张雷浩,缪玉霜,袁海琴,李晶
嘉兴学院材料与纺织工程学院,浙江 嘉兴
收稿日期:2017年12月3日;录用日期:2017年12月19日;发布日期:2017年12月28日

摘 要
选择高分子材料壳聚糖为药物载体,戊二醛为交联剂,司班-80和硬脂酸镁为复合乳化剂,液体石蜡和真空泵油为混合油相,采用乳液-化学交联法制备了5-氟尿嘧啶/壳聚糖载药微球。考察了载药微球的微观形貌、尺寸和药物包封率等理化性能,并对微球的释药性能进行了研究评价。结果表明微球表面结构规整、均匀,壳聚糖与5-氟尿嘧啶之间存在着比较强的分子间作用力,粒径在400 nm左右,且分散性比较好,药物包封率可达87.6%。在pH = 7.4和pH = 1.2的缓冲溶液中都有较好的缓释效果,但pH值越低条件下的缓释效果越好。5-氟尿嘧啶与壳聚糖的质量投料比越小,微球的释药速率越快。
关键词 :5-氟尿嘧啶,壳聚糖,微球,缓释

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着人类生活水平逐步提高,生活节奏加快,癌症的发病率与日俱增。5-氟尿嘧啶(5-Fu)是一种广谱抗癌药物,因其治疗效果可靠而被广泛应用于临床,主要用于治疗消化道肿瘤,也常用于治疗肝癌、乳腺癌、卵巢癌、宫颈癌、膀胱癌等 [1] [2] 。但其毒性较大,代谢过程过快而使其应用受到了一定程度的限制。其对肿瘤细胞的选择性差,在杀伤癌细胞的同时,也对人体产生了严重的毒副作用。尤其在浓度较大的情况下,对正常细胞的毒副作用更加明显 [3] 。它在体内的半衰期短,仅为5~10分钟,临床上为了达到有效的体内血药浓度,往往采用大剂量、持续给药或反复多次给药等均增加了癌症病人的痛苦 [4] 。以新型高分子为载体的缓释给药系统能够实现减少给药次数,在病人体内持续释药,并降解为具有生物相容性的物质的目的。在增加患者顺应性,提高药物的治疗效果,减少用药的总剂量等方面成为一种潜在的解决途径 [5] [6] [7] [8] 。
壳聚糖(Cs)是天然多糖中唯一的碱性多糖,具有许多独特的物理化学特性和生物学功能。Cs及其分解产物无毒,具有良好的生物相容性和生物可降解性,可选择性地与肿瘤细胞聚集,抑制肿瘤细胞的生长,并可通过活化免疫系统,显示抗癌活性。Cs作为药物的包覆材料,在缓释给药系统中的应用己引起了人们浓厚的兴趣 [9] [10] [11] [12] [13] 。Ohya [11] 首次用水/油(W/O)型乳化剂,以戊二醛为交联剂,运用乳化交联法制备了氟尿嘧啶壳聚糖微球(平均粒径:0.8 ± 0.1 μm),该微球可被细胞表面特殊的受体识别,对SK-ep-1肝癌细胞有特殊亲和力和抗癌作用 [12] 。近年来,国内外以高分子材料为载体,以5-Fu为模型药物的微球制备虽然己有报道,但是所得的微球或者粒径普遍比较大,或者药物包封率和药物含量较低,无法兼顾 [3] [14] - [19] 。本文以壳聚糖作为包封材料,抗癌代表性药物5-Fu为模型药物,制备缓释给药5-氟尿嘧啶/壳聚糖载药微球(5-Fu/Cs微球),进行探讨性的研究,检测微球各项性能指标,包括微观形态、药物包封率、释放性能等,以观察该微球作为药物载体的可行性,为将来的临床应用提供实验依据。
2. 实验部分
2.1. 主要原料及试剂
5-氟尿嘧啶(5-Fu):天津金耀氨基酸有限公司;壳聚糖(Cs):分析纯,国药集团化学试剂上海有限公司;Span80、石蜡油:化学纯,广州市思伽化工有限公司;戊二醛(25%水溶液)、醋酸(36%)、氢氧化钠:分析纯,天津市精细化工研究所;无水乙醇、盐酸、磷酸氢二钠、磷酸二氢钠、氯化钠:分析纯,北京化学试剂公司;汽油、真空泵油(100#):中国石油天然气股份有限公司大连石化分工司。
2.2. 主要仪器
紫外可见分光光度仪:752N,上海瑞科有限公司;气浴恒温震荡器:SHZ-88A,江苏太仓实验设备厂;台式高速冷冻离心机:LGR10-4.2型,北京医用离心机厂;恒速数显电动搅拌器:DSX-90型,杭州仪表电机有限公司;红外光谱仪:V70型,德国Bruker公司;场发射扫描电子显微镜:S-4800型,日本日立公司。
2.3. 制备5-Fu-Cs微球
采用乳液-化学交联法,称取壳聚糖溶于0.2 mol/L的醋酸溶液,配成20 g/L的Cs溶液100 ml,按m(5-Fu):m(Cs)分别为1:1、1:3、1:5、1:6和1:7称取5-Fu加入到25 g上述Cs溶液中,搅拌溶解,慢慢加入到油相中,油相为200 ml含15 g/L司班-80和5 g/L硬脂酸镁的真空泵油与石蜡油混合物,V (真空泵油):V (石蜡油)为1:1,反应容器为三口圆底烧瓶。搅拌至乳液状反应0.5 h缓慢加入戊二醛溶液15 ml。升温至40℃反应2 h,用氢氧化钠溶液(25 wt%)调节pH = 7,再反应1 h后离心分离,产物先用汽油洗涤,然后用无水乙醇洗涤,在50℃条件下真空干燥得到粉末状产品。
2.4. 测试与表征
标准曲线的绘制:取125 mg 5-Fu分别用0.1 mol/L稀HCl溶液、pH = 7.4的缓冲溶液,及pH = 1.2的缓冲溶液,定容至50 ml (2.5 mg/mL),分别取稀释后的溶液2 ml、3 ml、4 ml、5 ml、6 ml再分别定容至50 ml,配制成0.1~0.3 mg/mL的标准溶液,在260 nm处用紫外-可见分光光度计测试吸光度,拟合曲线得标准曲线方程A1 = 1.104C1 − 0.004(R*R = 0.9999) K1 = 1.8,B1 = 0.0;A2 = 1.076C2 − 0.0084(R*R = 0.9998) K2 = 1.9,B2 = 0.0;A3 = 1.072C3 + 0.0076(R*R = 0.9997) K3 = 1.9,B3 = 0.0。
微球药物含量和包封率的测定:准确称取5-Fu/Cs微球20 mg加到锥形瓶中,用0.1 mol/L HCl溶液50 ml溶解24 h后过滤,滤液移至100 ml容量瓶中定容,测试其吸光度,根据工作曲线来求其浓度,按下列公式计算药物含量和包封率 [10] :
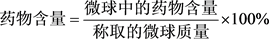

微球缓释性能分析:称取5-Fu/Cs微球50 mg放入透析袋中并封口,分别置于盛有pH = 1.2缓冲溶液和pH = 7.4缓冲溶液的250 ml磨口锥形瓶中,37℃条件下以100 r/min的速率恒温震荡,定时取5 ml释放介质测定其紫外吸光度,同时补充等量释放液,根据工作曲线计算其浓度,并绘制累计释药率-时间曲线。
红外光谱表征:采用溴化钾压片法,扫描范围500~4000 cm−1。
微观形态表征:样品喷金后在场发射扫描电子显微镜下观察并拍照。
3. 结果与讨论
3.1. 红外光谱分析
图1为原料(5-Fu)与产品(Cs微球和5-Fu-Cs微球)的红外光谱图。5-Fu谱图中1682.1 cm−1归属于5-Fu

Figure 1. IR spectra of raw material and product
图1. 原料及产品的红外光谱图
的特征吸收峰(C=O和C=C伸缩振动吸收峰),1488.2 cm−1归属于-CF=CH-中的C-H的面内弯曲振动吸收峰,1238.6 cm−1归属于C-N伸缩振动吸收峰,868.3 cm−1归属于-CF=CH-中的C-H的面外弯曲振动吸收峰,818.4 cm−1和775.6 cm−1归属于-CF=CH-中的C-H的面外变形振动吸收峰。Cs微球谱图中在1663.5 cm−1处出现Cs微球的特征吸收峰,归属于C=O的伸缩振动,1425.2 cm−1处是-CH2-的弯曲振动吸收峰,1084.3 cm−1和1062.7 cm−1归属于CS吡喃环中C-H的弯曲振动吸收峰。5-Fu/Cs微球谱图中在1278.2 cm−1处是5-Fu中的C-N伸缩振动红移吸收峰,900.1 cm−1处出现了5-Fu中的-CF=CH-中的C-H的面外弯曲振动红移吸收峰,吸收峰洪移表明Cs包裹5-Fu后,5-Fu分子之间的作用力被Cs削弱。818.4 cm−1和775.6 cm−1处归属于-CF=CH-中的C-H的面外变形振动吸收峰。在1663.5 cm−1处Cs的吸收峰消失,而在1641.3 cm−1处出现了特征吸收峰,1084.3 cm−1处吸收峰向低波数1062.7 cm−1漂移且变弱,而1030.0 cm−1的吸收峰大大减弱,这些情况说明5-Fu与Cs产生了较强的分子间相互作用力。
3.2. 微球微观形态分析
图2为5-Fu/Cs微球的SEM图。由图可见5-Fu/Cs微球的外观形态规整,无塌陷,为球形,且为单分散性,粒径均匀,微球彼此未发生黏连,粒径在400 nm左右。
3.3. 药物包封率
5-Fu/Cs微球的药物包封率与投料比之间的关系见表1,药物包封率在45.2%~87.6%。由于乳化阶段形成粒径小且分布均匀的微球,此时粒径与搅拌器转速有关,交联剂使微球固化,将模型药固定在壳聚糖骨架中。其次5-Fu在水中的溶解度比较大且呈弱酸性,该工艺与传统方法相比成球固化时间缩短,通过控制体系的PH值及投料比,使药物包封率提高。
3.4. 微球释药性分析
图3为5-Fu和5-Fu/Cs微球在pH = 1.2缓冲溶液中药物释放曲线,5-Fu在1.5 h基本上就释放完全了,而5-Fu/Cs微球在前3h内释放的快,当药物释放率达到50%左右释放逐渐减缓,40 h时释放率达到62%,未释放的还有38%左右,这说明5-Fu/Cs微球的控释性能很好。由于醛氨缩合反应形成键桥使微球固化,将药固定在壳聚糖骨架中,从而达到缓释效果。
Table 1. The relationship between embedding rate of chitosan microspheres and raw material rate
表1. 微球药物包封率与投料比关系

Figure 2. SEM image of 5-Fu/Cs microspheres
图2. 5-Fu/Cs微球的SEM图

Figure 3. Drug-releasing curves of sample in solution (pH = 1.2)
图3. 在pH = 1.2缓冲溶液中的释放曲线
3.5. 投料质量比对释药性的影响
图4为5-Fu/Cs微球在pH = 1.2缓冲溶液中的释放曲线,m(5-Fu):m(Cs)为1:5的微球在5 h释药已达56%而m(5-Fu):m(Cs)为1:3的微球释药到65%,这是因为CS较多形成的囊壁较厚,所以随着m(5-Fu):mCs)比的减小,微球的缓释效果增强。
3.6. 溶液pH值对微球释药性的影响
图5中在初期(前2 h)微球的释药性基本不受溶液pH值的影响;但2 h后,在pH = 7.4条件下微球的释药速度要比pH = 1.2条件下快,尤其是20 h之后更加明显。两种不同pH值条件下前5 h释药速度快,10 h后趋于平缓,24 h后载药微球在pH = 1.2缓冲溶液中释放率为57%,在pH = 7.4缓冲溶液中释放71%,可见微球的体外释药性与溶液pH值有关,酸性条件下缓释效果更好。

Figure 4. Drug-releasing curves of 5-Fu/Cs microspheres in solution (pH = 1.2)
图4. 5-Fu/Cs微球在pH = 1.2缓冲溶液中的释放曲线

Figure 5. Drug-releasing curves of 5-Fu/Cs microspheres in different solution
图5. 5-Fu/Cs微球在不同pH值缓冲溶液中的释放曲线
4. 结论
以壳聚糖为药物载体,戊二醛为交联剂,真空泵油和石蜡油为混合油相,司班-80和硬脂酸镁为复合乳化剂是一种行之有效的制备5-氟尿嘧啶/壳聚糖载药微球的方法。所得5-Fu/Cs微球的外观形态规整,无塌陷,且为单分散性,粒径均匀,微球彼此未发生黏连。粒径约400 nm,药物包封率在45.2%~87.6%。体外释药性分析表明5-Fu/Cs微球具有良好的缓释性能,随着m(5-Fu):m(Cs)比值的减小,微球的缓释效果增强,酸性环境下缓释效果更好,优越于碱性环境。
基金项目
嘉兴学院SRT资助项目(SRT2016C148),嘉兴学院实验室开放基金(201601),浙江省“十二五”省级实验教学示范中心重点建设项目。
文章引用
陈雨婷,程凤梅,张雷浩,缪玉霜,袁海琴,李 晶. 5-氟尿嘧啶/壳聚糖载药微球的制备及性能研究
Preparation and Properties 5-Fluorouracil-Loaded Chitosan Microsphere[J]. 材料科学, 2017, 07(09): 776-782. http://dx.doi.org/10.12677/MS.2017.79101
参考文献 (References)
- 1. 张赪, 崔福英, 张继恩, 等. 载5-氟尿嘧啶纳米微球治疗荷H22腹水瘤小鼠的实验研究[J]. 中华临床医师杂志, 2012, 6(11): 2993-2998.
- 2. Yang, L., Wu, D., Luo, K., et al. (2009) Andrographolide Enhances 5-Fluorouracil-Induced Apoptosis via Caspase-8-Dependent Mitochondrial Pathway Involving p53 Participation in Hepatocellular Carcinoma (SMMC-7721) Cells. Cancer Letters, 27, 180-8.
https://doi.org/10.1016/j.canlet.2008.11.015 - 3. 赵仲, 孟乐乐, 陈霓祥. 装载于PLGA 中的5-氟尿嘧啶缓释微球的制备及其体外释放的研究[J]. 现代生物医学进展, 2011, 11(24): 4801-4803.
- 4. Yerriswamy, B.C., Lak-shmi, N.R., Venkata, C.P., et al. (2010) Controlled Release Studies of 5-Fluorouracil through Poly(vinyl caprolac-tum-co-vinyl acetate) Microspheres. Asian Journal of Pharmaceutics, 3, 200-204.
- 5. Huhtala, A., Ronkko, S., terasvirta, M., et al. (2009) The Effects of 5-Fluorouracilon Ocular Tissues in Vitro and Vivo after Controlled Release from Multifunctional in Plant. Investigative Ophthalmology & Visual Science, 50, 2216-2223.
https://doi.org/10.1167/iovs.08-3016 - 6. Zhang, C., Cheng, Y., Qu, G.W., et al. (2008) Preparation and Char-acterization of Galactosylated Chitosan Coated BSA Microspheres Containing 5-Fluorouracil. Carbohdrate Polymers, 72, 390-397.
https://doi.org/10.1016/j.carbpol.2007.09.004 - 7. Chung, T.W., Lin, S.Y., Liu, D.Z., et al. (2009) Sustained Release of 5-FU from Poloxamer Gels Interpenetrated by Crosslinking Chitosan Network. International Journal of Pharmaceutics, 382, 39-44.
https://doi.org/10.1016/j.ijpharm.2009.07.035 - 8. 符旭东, 陈晓, 匡长春, 等. 氟尿嘧啶3种原位形成植入体的体外释放度研究[J]. 中国药师, 2011, 14(5): 602-605.
- 9. 朱荣刚, 陈智. 5-氟尿嘧啶的药剂学研究进展[J]. 中国医药指南, 2013, 11(8): 450-451.
- 10. 何强芳, 李国明, 巫海珍, 等. 5-氟尿嘧啶壳聚糖微球的制备及其释药性能[J]. 应用化学, 2004, 21(2): 192-196.
- 11. Ohya, Y. (1993) Release Behaviour of 5-Fluorouracil from Chitosan-Gel Microspheres Immobilizing 5-Fluorouracil Derivative Coated with Polysaccharides and Their Cell Specific Recognition. Journal of Microencapsulation, 10, 1-9.
https://doi.org/10.3109/02652049309015307 - 12. 杨子明, 彭政, 周敏, 等. 壳聚糖靶向缓释功能高分子载药微球及其特性研究[J]. 功能材料, 2013, 44(12): 1703-1708
- 13. Anitha, R.D. and Bioadhesive, L.S. (2010) Chitosan Nanoparticles: Preparation and Characterization. Carbohydrate Polymers, 81, 243-251.
https://doi.org/10.1016/j.carbpol.2010.02.026 - 14. 李可欣, 赵秀峰, 庞大海, 等. 5-尿嘧啶结肠定位壳聚糖微球在大鼠体内的药物动力学及生物利用度考察[J]. 沈阳药科大学学报, 2008, 25(6): 439-443.
- 15. 毕宏生, 宋继科, 吴建峰, 等. 眼科用汉防已甲素联合5-氟尿嘧啶壳聚糖微球的制备及其质量评估[J]. 山东医药, 2010, 50(42): 1-3.
- 16. 杨春梅, 顾磊, 孙怡, 等. 戊二醛一步固化法制备氟尿嘧啶壳聚糖微球[J]. 中国医药工业杂志, 2010, 41(1): 23-26.
- 17. 毕秀增, 潘伟华, 南开辉, 等. 5-氟尿嘧啶缓释剂制备及体外释药性能比较[J]. 中国组织工程研究, 2012, 16(8): 1430-1434.
- 18. 童春义, 唐凤霞, 刘斌, 等. 氟尿嘧啶-壳寡糖/硒纳米微球的制备及抑制肿瘤细胞生长活性[J]. 高等学校化学学报, 2014, 35(7): 1603-1607.
- 19. 李像, 魏坤, 罗云, 等. 聚乳酸羟基乙酸/纳米羟基磷灰石-5-氟尿嘧啶复合微球的制备及体外释放[J]. 中国组织工程研究, 2009, 13(47): 9282-9286.
