Material Sciences
Vol.
11
No.
02
(
2021
), Article ID:
40446
,
10
pages
10.12677/MS.2021.112012
化学储热研究进展
邢闯,刘立强*,闫绍华,李杨,丁聪,张硕,孙涛
山东建筑大学,材料科学与工程学院,山东 济南
收稿日期:2021年1月14日;录用日期:2021年2月8日;发布日期:2021年2月20日

摘要
化学储热利用可逆的化学反应来储存和释放能量,相比显热储热和潜热储热,化学储热储热密度大、长时间储热几乎无热损失,是可再生能源及节能领域中极具挑战性和发展前景的储热新技术。本文按照储热材料种类的不同将化学储热进行了分类,并对其研究现状及进展做了系统综述。同时,基于研究现状的分析,指出了当前化学储热研究中存在的问题,并进一步指出了该技术未来需要克服的问题和研究方向。
关键词
化学储热,储热密度,化学反应,可再生能源,节能

Research Progress on Chemical Heat Storage
Chuang Xing, Liqiang Liu*, Shaohua Yan, Yang Li, Cong Ding, Shuo Zhang, Tao Sun
School of Materials Science and Engineering, Shandong Jianzhu University, Jinan Shandong
Received: Jan. 14th, 2021; accepted: Feb. 8th, 2021; published: Feb. 20th, 2021

ABSTRACT
Chemical heat storage stores and releases energy through reversible chemical reactions. It has the advantages of high heat storage density, almost no heat loss during long-term heat storage. It is a new heat storage technology with challenging and promising prospect in the field of renewable energy and energy conservation. In this paper, chemical heat storage is classified according to different types of heat storage materials and its research status and progress are systematically reviewed. At the same time, based on the analysis of the present research status, the problems existing in the current research on chemical heat storage have been pointed out. Furthermore, the future problems and research directions of this technology are pointed out.
Keywords:Chemical Heat Storage, Heat Storage Density, Chemical Reaction, Renewable Energy, Energy Saving

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
化石燃料储量有限,并且使用过程中对环境质量产生较大的负面影响,日益严重的能源危机促进能源技术向可持续和清洁可再生能源发展。然而,可再生能源间歇性和不稳定的缺点限制了其大规模应用。此外,能量转换与利用的过程中常常存在着时空供求不匹配的矛盾,工业生产中则存在着热量利用率低、能源浪费等问题。由于储热技术能够解决能量时空供求不匹配的矛盾,是提高能源利用率的有效技术手段。因此,高效储热技术已成为可再生能源及节能领域的研究热点。化学储热是一种储热密度大,具有挑战性和发展前景的储热新技术,该技术的发展将能为能量在时空利用上存在的矛盾及工业余废热的利用等提供一种解决途径。本文主要对化学储热原理及优势和化学储热体系及其进展进行了分析及介绍。
2. 化学储热原理及优势
化学储热是利用可逆的化学反应来储存和释放能量,即在吸热反应阶段,能量通过打破化学键储存;在放热反应阶段,能量通过生成化学键释放。化学储热可以简化为如图1所示的过程。
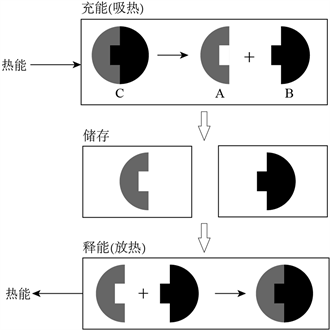
Figure 1. Process in a closed TCS cycle: charging, storaging and dischaging
图1. 化学储热的充能、储热、释能过程 [1]
如图1所示,物质C经过充能(吸热)分解为物质A和B,此过程实现了热能向化学能的转变,将物质A和B分别储存到不同的容器当中,热能就能以化学能的形式进行储存及运输。当需要使用储存的热能时,则将物质A和B混合,并在一定条件下发生化合反应生成C,这个过程释放出充能(吸热)过程储存的热量,化学能又再次转化为热能。
显热储热和潜热储热是除化学储热外的另外两种储热方式。显热储热仅依靠储热物质本身温度的升高和降低来进行热量的存储和释放,其储热量与储热材料质量、比热容和储热过程的温升值这三个条件成正比。其特点是原料常见、原理简单、技术成熟度高,但材料储热密度及工作温度低,放热时温度波动较大。潜热储热又被称为相变储热,它依靠储热材料在相转变(如固–固、固–液、固–气等)过程中的吸放热行为来进行热量的存储及释放,其储热量与储热材料的质量及潜热值成正比。其特点是材料储热密度大、放热过程温度稳定,但材料具有一定的腐蚀性且易发生相分离现象。
三种储热方式的比较如表1所示。相比显热和潜热储热技术,化学储热有几个明显的优势:储热密度高;理论上储热时间无限长;适合远距离运输;可供选择材料多,适用温区广。
Table 1. Comparison of three types of heat storage methods
表1. 三种储热方式的比较 [2]
3. 化学储热及其进展
目前,正在研究的化学储热体系有多种,按照储热材料种类的不同,可以分为氨的合成与分解体系、金属氢化物体系、甲烷二氧化碳重整体系、碳酸盐热分解体系、无机氢氧化物体系和氧化还原体系。
3.1. 氨的合成与分解体系
氨的合成与分解反应是一个可逆反应,其正、逆反应都需要在高温高压以及催化剂的条件下才能进行,表2给出了氨分解反应的热力学特性。氨的合成与分解反应如下:
(2-1)
Carden等在1977年 [3] 首次提出将氨的合成与分解体系应用到高温太阳能化学储热系统中。经过三十多年的研究,澳大利亚国立大学(ANU)建立了一套完整的太阳能驱动的氨基化学储热体系 [4]。NH3白天在太阳能作用下热分解为H2和N2,热反应物在逆流热交换器中与液氨交换热能后进入储存器。液氨自动与H2和N2发生相分离,分别储存在容器的底部和顶部。当N2和H2发生合成氨反应时释放出热能加热工作介质,进而推动涡轮机发电。Chen等 [5] 在实验室建立了管内蒸汽、壳层填充多孔铁催化剂的同心管氨合成反应器以及一个模拟氨合成反应器中超临界蒸汽加热的模型,并得出结论,改善传热和降低进口氨质量分数对提高反应器在单位合成气质量流率下的蒸汽质量流率是至关重要;Lavine等 [6] 通过建模和实验证明:1) 氨合成可以将超临界蒸汽加热到350℃~650℃;2) 吸热离解反应器可以集成在与SAM中的熔盐接收器具有相同尺寸包膜、相同设计热容量的塔式接收器内,并且在设计条件下估计热效率为94%;3) 确定了氨解反应管环绕场塔系统在技术上是可行的。
太阳能接收器反应堆是氨基太阳能化学储热系统中的重要组成部分。ANU [7] [8] [9] 从理论上对其进行了研究并得出结论,碟形集中器适用于氨基太阳能储热系统,因为碟形集中器提供了均匀分布的太阳能、系统简单而且有利于化学反应器的设计。
Table 2. Thermodynamic properties of ammonia decomposition reactions
表2. 氨分解反应的热力学特性 [10]
3.2. 金属氢化物体系
金属氢化物(MH)是一种在氢气压力下加热制备的可逆吸收氢形成的金属或合金材料,热能储存在金属和氢之间的化学键中。释放氢时所吸收的反应热与形成氢化物时所获得的反应热相同,没有氢被消耗,因此理论上很少有热量损失。通过改变金属氢化物的组成,可以使其在特定的温度和压力下工作。金属氢化物的吸放热反应如下:
(2-2)
使用金属氢化物作为储热材料并不是一个新概念,例如Caldwell等 [11] 在20世纪60年代设计了一种以LiH作为储热材料的小型空腔式太阳能集热系统,系统运行温度高达760℃,设想为太阳能驱动的能量转换系统提供连续的热量。Kawamura等 [12] 在1983年设计制造了一种以Mg2Ni的氢化物作为储热材料的用于间歇聚合反应的储热系统,其最高运行温度为350℃。近年来,金属氢化物类的储热材料因其极高的储能密度得到了国内外研究者的广泛关注。图2所示是部分金属氢化物的A)重量储能密度和B)体积储能密度的理论值。周承商等 [13] 对金属氢化物作为储能材料的工作温度、压力和储热密度的研究进展做了详细论述。
在金属氢化反应的过程中,大量的反应热会通过反应床,因此金属氢化物,尤其是复合金属氢化物的热导率至关重要 [14] [15]。Pohlmann等 [16] 已经证明含膨胀天然石墨的复合氢化物可以提供比纯复合氢化物高一个数量级的热导率,约为40 W/mK。热导率的提高主要是在压制颗粒的径向方向,并随天然膨胀石墨含量的增加而提高。Chen等 [17] 研究了泡沫镍对AB2型金属氢化物导热性能的影响。他们发现反应床的导热系数提高了10倍。由于翅片通过提供高导热率的热传导路径来改善传热性能,所以反应器内的翅片布置也会对反应器的性能产生显著影响。Ma [18] 和Singh [19] 等人研究发现,在所有参数中,如翅片半径、厚度和数量,翅片数量在改善系统性能方面最为有效。
3.3. 甲烷二氧化碳重整体系
甲烷和二氧化碳都是廉价且含碳丰富的含碳气体,之前对甲烷二氧化碳重整的研究主要集中在获取高附加值的合成气上,近年来,人们开始发现它在化学储热领域的研究价值。甲烷二氧化碳重整(DRM)体系的储热/释能反应方程式如下:
(2-3)

Figure 2. Theoretical maximum A) weight storage density and B) volume storage density of partial metal hydrides
图2. 部分金属氢化物的理论最大A)重量储能密度和B)体积储能密度 [20]
DRM利用CH4和CO2作为反应原料,具有较高的反应热,还能将温室气体转变为用途广泛的合成气,有效缓解温室效应,因此在储热领域具有更大的发展优势。图3所示是甲烷二氧化碳重整工艺的流程图。
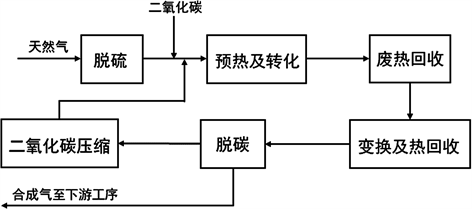
Figure 3. Methane carbon dioxide reforming process flow chart
图3. 甲烷二氧化碳重整工艺流程图 [21]
DRM是一个强吸热反应,而且CH4和CO2分子都比较难以活化,因此,为了实现较高的原料转化率,DRM反应一般在较高温度下(>700℃)进行 [22],目前制约甲烷重整应用的主要因素是较高的反应温度会导致积碳现象并导致催化剂失活 [23] [24] [25],因此为了提高反应以及化学储热的效率,研究和开发出抗积碳的催化剂变得至关重要。Rabelo等 [26] 通过燃烧法制备了LaNiO3/SiCeO2催化剂,该催化剂能有效减少甲烷裂解和CO2歧化反应过程中碳的沉积以及金属烧结,提高了催化剂的稳定性。Roh等 [27] 用Ce0.8Zr0.2O2作为载体和NiO通过共沉淀法制备了Ni-Ce-ZrO2催化剂。与浸渍法制备的Ni-Ce-ZrO2催化剂相比,共沉淀法Ni-Ce-ZrO2催化剂具有较高的比表面积和较小的纳米晶粒尺寸,因而其具有更好的镍分散能力、更高的镍表面积和更强的氧转移能力。由于上述优越的特性,共沉淀Ni-Ce-ZrO2催化剂在800℃和体积空速高于100,000 ml/(h g)的条件下,表现出高活性和稳定性。
3.4. 碳酸盐热分解体系
碳酸盐热分解体系是一种利用无机氧化物的碳化/煅烧可逆化学反应为基础的化学储热技术,这些无机氧化物在与CO2反应时会放出较高的化学反应热,储热/释能反应方程式如下:
(2-4)
在这些碳酸盐热分解体系中,CaO/CO2储热体系的原料碳酸钙价格低廉、来源广泛并且无毒害、环境友好,因此被认为是一种很有发展潜力的化学储热技术,图4所示为钙循环在太阳能输热和储热中的应用。

Figure 4. Application of calcium cycle in solar energy heat transfer and storage
图4. 钙循环在太阳能输热和储热中的应用 [28]
CaO/CO2储热体系储热(煅烧)/释能(碳化)反应方程式如下所示:
(2-5)
CaO的碳化反应早期被应用在从烟气中收集CO2 [29],并对该正逆反应都有了比较成熟的研究和应用。后来钙循环(CaL)过程因为它以化学键的形式储存能量而在化学储热领域受到广泛研究。Edwards等 [28] 提出了一种新型的CSP电厂的概念,并详细介绍了采用太阳能塔作为煅烧炉和加压流化床碳化器,实现露天布雷顿动力循环的能源生产的CaL工厂;Chacartegui等 [30] 用pinch-analysis对CSP-CaL-power集成系统进行了深入的分析,在有利于天然石灰石中氧化钙多循环转化稳定且高值的条件下,得到了整体效率可达到45%以上集成模型;Munoz-Anton等 [31] 研究了在无蓄能的CSP电厂中集成CO2的Brayton循环以获得更高的循环效率。
尽管原料碳酸钙矿物来源广泛,但大多数天然钙基材料(如石灰石、大理石和白垩等)会随着碳化和煅烧次数的增加而逐渐的表现出失活现象。高CO2浓度下和高温会导致颗粒表面形成一层较厚的碳酸钙层,从而阻碍CO2进入CaO多孔骨架。因此,为了将CaCO3天然矿物应用于TCES系统,今后的研究应以避免孔隙堵塞为重点。Valverde等 [32] [33] [34] 研究发现加热预处理有助于碳化阶段反应的进行。Sun [35] 和Maryam等 [36] 发现在焙烧和高度烧结的样品中加入蒸汽和水可以提高碳化反应时CaO对CO2捕获能力。
3.5. 无机氢氧化物体系
用在TCES系统中的无机氢氧化物主要包括Mg(OH)2和Ca(OH)2,它们分别由CaO和MgO水化后生成,这两种原料发生水化反应时伴随着生成大量的反应热,且它们无毒无害,因此可被应用于中高温TCES系统。无机氢氧化物储热(煅烧)/释能(水化)的基本反应如下:
(2-6)
Ca(OH)2/CaO和Mg(OH)2/MgO储热体系储热密度较大,适用于中高温TCES中,但它们的发展也面临着两个难题:1) 反应物和生成物的传热性能差,影响系统的效率;2) 反应物的稳定性差,CaO和MgO产品易烧结,导致孔隙体积损失和晶粒长大,从而影响到反应物再水化的能力。目前已有很多针对改善这两项缺点的研究。
针对改善传热性能的研究,Mastronardo [37] 等将碳纳米管与Mg(OH)2纳米粒子通过沉积沉淀法制备了新型杂化材料,实验表明以该新型杂化材料作为储存介质,系统的传热性能得到了有效的改善,从而提高反应效率。Wereko等 [38] 针对Ca(OH)2/CaO体系导热性能较差的缺陷进行了研究,在反应物中使用必要数量的带翅片的塔板,可以加强传热,进而改善Ca(OH)2受热分解过程。
为了改善反应物烧结、团聚、稳定性降低,Xia等 [39] 提出一种以羧甲基纤维素钠(CMC)和蛭石为原料合成颗粒复合材料以减轻天然材料的缺陷的新方法,结果表明,颗粒状复合材料经过多次脱水/水化循环后仍具有良好的结构完整性,而压实后的天然材料则出现了破碎现象。此外,复合材料比天然材料具有更高的蓄热率。Roßkopf等 [40] [41] 使用二氧化硅(SiO2)复合纳米颗粒(Aerosil®300添加剂)循环操作后,反应材料的聚集率降低了。Sakellariou等 [42] 利用高岭石(Al2(Si2O5)(OH)4)作为粘结剂制备高岭石/CaO复合球团,在经过多次水化/脱水反应后,仍表现出良好的反应活性和机械稳定性。
3.6. 氧化还原体系
一些单金属在发生氧化反应时放出大量的热,并且它们的氧化还原反应完全可逆,除此之外,金属氧化还原体系在空气驱动CSP厂中的应用具有先天的优势:空气既可以作为传热流体,也可以作为反应物直接与储热材料(金属氧化物)接触,而无需额外的热交换器,很大程度减小了热损失,因此被认为是一类非常有潜力的化学储热材料。金属氧化物储热的三个关键性能指标是转化温度、蓄能密度和反应可逆性。表3给出了这些指标的定义。
金属/金属氧化物作为化学储热材料已经进行了广泛的研究,其反应通式如下:
(2-7)
Bowery等 [43] 早在1978年对BaO2/BaO做了5个氧化/还原循环,发现在温度高、加热和冷却速度快的条件下,氧化反应不完全;Wong等 [44] 对BaO2/BaO氧化还原进行了TGA研究,发现BaO2/BaO系统在空气中的氧化率相对较低,约为20%,他们认为这是由于氧化过程中在BaO颗粒表面形成了灰层,减少了氧气与包颗粒的接触,导致氧化缓慢。Carrillo等 [45] 对BaO2/BaO研究发现,如果通过热预处理去除杂质,系统反应转化率接近100%。Co3O4/CoO被广泛认为是最有前途的高温氧化还原储热复合材料,主要是因为其储热密度高,可逆性好,但是成本过高。Co3O4/CoO反应一般发生在700℃~900℃之间,受实验条件和气氛的影响较大。其理论温度为935℃,在20%O2含量的空气中为779℃,在纯Ar气氛的还原温度为772℃。Muller [46] 等人通过改变气体气氛中的氧含量,通过TGA研究证实Co3O4/CoO的氧化还原循环可以在480℃至630℃之间进行。
Table 3. Definition of key index of metal oxide heat storage
表3. 金属氧化物储热关键指标的定义 [47] [48] [49] [50] [51]
4. 结论
化学储热材料利用化学键的断裂/形成来存储/释放能量,相比于潜热储热和显热储热,化学储热材料的使用更加不受时间和空间的限制,是最有发展前景的储热材料。但目前化学储热体系的商业化进展却不够乐观,是因为化学储热体系涉及到多个学科的知识交叉,并且有许多实际应用中的限制。如所有的化学储热体系都需要将化学物质隔离存放,有些原料还对容器有十分严苛的要求。反应过程复杂,个别反应还需要催化剂,有些反应特性及现象无法解释。如果能解决上述问题,那么化学储热将在工业节能、化学热泵及可再生能源利用以等方面贡献极大的应用价值。接下来对化学储热的研究应主要集中在以下几个方向:
1) 根据所需的充放热温度区间,合理选择储热材料,综合可靠性和经济性优化设计储热系统。
2) 建立数值模型,对化学储热/释热反应过程进行模拟运算,深入研究反应机理。
3) 优化设计反应器结构,加强传热导热性能。
4) 发展并完善化学储热体系中能量转换理论及评价方法。
文章引用
邢 闯,刘立强,闫绍华,李 杨,丁 聪,张 硕,孙 涛. 化学储热研究进展
Research Progress on Chemical Heat Storage[J]. 材料科学, 2021, 11(02): 88-97. https://doi.org/10.12677/MS.2021.112012
参考文献
- 1. Abedin, A.H. and Rosen, M.A. (2012) Closed and Open Thermochemical Energy Storage: Energy- and Exergy-Based Comparisons. Energy, 41, 83-92. https://doi.org/10.1016/j.energy.2011.06.034
- 2. 李威, 陈威, 王丹丹. 基于水合盐热化学储能的技术研究与进展[J]. 制冷与空调, 2017, 17(8): 14-21.
- 3. Carden, P.O. (1977) Energy Cor-radiation Using the Reversible Ammonia Reaction. Solar Energy, 19, 365-378. https://doi.org/10.1016/0038-092X(77)90008-1
- 4. Dunn, R., Lovegrove, K. and Burgess, G. (2012) A Review of Ammonia-Based Thermochemical Energy Storage for Concentrating Solar Power. Proceedings of the IEEE, 100, 391-400. https://doi.org/10.1109/JPROC.2011.2166529
- 5. Chen, C., Aryafar, H., Lovegrove, K.M., et al. (2017) Modeling of Ammonia Synthesis to Produce Supercritical Steam for Solar Thermochemical Energy Storage. Solar En-ergy, 155, 363-371. https://doi.org/10.1016/j.solener.2017.06.049
- 6. Lavine, A.S., Lovegrove, K.M., Jordan, J., et al. (2016) Thermochemical Energy Storage with Ammonia: Aiming for the Sunshot Cost Target. https://doi.org/10.1063/1.4949126
- 7. Williams, O.M. (1980) Design and Cost Analysis for an Ammonia-Based Solar Thermochemical Cavity Absorber. Solar Energy, 24, 255-263. https://doi.org/10.1016/0038-092X(80)90482-X
- 8. Williams, O.M. (1980) Evaluation of Wall Temperature Difference Profiles for Heat Absorption Tubes Exposed Nonuniformly to Solar Radiation. Solar Energy, 24, 597-600. https://doi.org/10.1016/0038-092X(80)90360-6
- 9. Lovegrove, K. and Luzzi, A.J. (1996) Endothermic Reactors for an Ammonia Based Thermochemical Solar Energy Storage and Transport System. Solar Energy, 56, 361-371. https://doi.org/10.1016/0038-092X(96)00291-5
- 10. 李学德, 梁平, 曾东平. 氨基热化学蓄能太阳能热力发电研究的进展[J]. 广东电力, 2000(4): 3-6.
- 11. Caldwell, McDonald, J.W., et al. (1965) Solar-Energy Receiver with Lithium-Hydride Heat Storage. Solar Energy, 9, 48-60. https://doi.org/10.1016/0038-092X(65)90161-1
- 12. Kawamura, M., Ono, S. and Mizuno, Y. (1983) Dynamic Characteristics of a Hydride Heat Storage System. Journal of the Less-Common Metals, 89, 365-372. https://doi.org/10.1016/0022-5088(83)90346-6
- 13. 周承商, 刘煌, 刘咏, 等. 金属氢化物热能储存及其研究进展[J]. 粉末冶金材料科学与工程, 2019, 24(5): 391-399.
- 14. Andreas, Z. (2003) Materials for Hydrogen Storage. Materials Today, 6, 24-33. https://doi.org/10.1016/S1369-7021(03)00922-2
- 15. Ross, D.K. (2006) Hydrogen Storage: The Major Techno-logical Barrier to the Development of Hydrogen Fuel Cell Cars. Vacuum, 80, 1084-1089. https://doi.org/10.1016/j.vacuum.2006.03.030
- 16. Pohlmann, C. and Hutsch, T. (2013) Novel Approach for Thermal Diffusivity Measurements in Inert Atmosphere Using the Flash Method. Journal of Thermal Analysis and Calorimetry, 114, 629-634. https://doi.org/10.1007/s10973-013-3048-9
- 17. Chen, Y., Sequeira, C.A.C., Chen, C., et al. (2003) Metal Hydride Beds and Hydrogen Supply Tanks as Minitype PEMFC Hydrogen Sources. International Journal of Hydrogen Energy, 28, 329-333. https://doi.org/10.1016/S0360-3199(02)00064-2
- 18. Ma, J., Wang, Y., Shi, S., et al. (2014) Optimization of Heat Transfer Device and Analysis of Heat & Mass Transfer on the Finned Multi-Tubular Metal Hydride Tank. International Journal of Hydrogen Energy, 39, 13583-13595. https://doi.org/10.1016/j.ijhydene.2014.03.016
- 19. Singh, A., Maiya, M.P. and Murthy, S.S. (2015) Effects of Heat Exchanger Design on the Performance of a Solid State Hydrogen Storage Device. International Journal of Hy-drogen Energy, 40, 9733-9746. https://doi.org/10.1016/j.ijhydene.2015.06.015
- 20. Lai, Q., Thornton, A.W., Hill, M.R., et al. (2015) Hydrogen Storage Materials for Mobile and Stationary Applications: Current State of the Art. ChemSusChem, 8, 2789-2825. https://doi.org/10.1002/cssc.201500231
- 21. 赵倩, 丁干红. 甲烷二氧化碳重整工艺研究及经济性分析[J]. 天然气化工(C1化学与化工), 2020, 45(4): 71-75+81.
- 22. Zhao, Y., Kang, Y., Li, H., et al. (2018) CO2 Conversion to Synthesis Gas via DRM on the Durable Al2O3/Ni/Al2O3 Sandwich Catalyst with High Activity and Stability. Green Chemistry, 20, 2781-2787. https://doi.org/10.1039/C8GC00743H
- 23. Kambolis, A., Matralis, H., Trovarelli, A., et al. (2010) Ni/CeO2-ZrO2 Catalysts for the Dry Reforming of Methane. Applied Catalysis A General, 377, 16-26. https://doi.org/10.1016/j.apcata.2010.01.013
- 24. Bradford, M.C.J. and Vannice, M.A. (1996) Catalytic Reforming of Methane with Carbon Dioxide over Nickel Catalysts II. Reaction Kinetics. Applied Catalysis A General, 142, 97-122. https://doi.org/10.1016/0926-860X(96)00066-X
- 25. Tsipouriari, V.A. and Verykios, X.E. (2001) Kinetic Study of the Catalytic Reforming of Methane with Carbon Dioxide to Synthesis Gas over Ni/La2O3 Catalyst. Catalysis Today, 64, 83-90. https://doi.org/10.1016/S0920-5861(00)00511-3
- 26. Rabelo-Neto, R.C., Sales, H.B.E., Inocêncio, C.V.M., et al. (2018) CO2 Reforming of Methane over Supported LaNiO3 Perovskite-Type Oxides. Applied Catalysis B—Environmental, 221, 349-361. https://doi.org/10.1016/j.apcatb.2017.09.022
- 27. Roh, H.S., Potdar, H.S. and Jun, K.W. (2004) Carbon Dioxide Reforming of Methane over Co-Precipitated Ni-CeO2, Ni-ZrO2 and Ni-Ce-ZrO2 Catalysts. Catalysis Today, 93, 39-44. https://doi.org/10.1016/j.cattod.2004.05.012
- 28. Edwards, S.E.B. and Materic, V. (2012) Calcium Looping in Solar Power Generation Plants. Solar Energy, 86, 2494-2503. https://doi.org/10.1016/j.solener.2012.05.019
- 29. Cormos, A.M. and Simon, A. (2015) Assessment of CO2 Cap-ture by Calcium Looping (CaL) Process in a Flexible Power Plant Operation Scenario. Applied Thermal Engineering, 80, 319-327. https://doi.org/10.1016/j.applthermaleng.2015.01.059
- 30. Chacartegui, R., Alovisio, A., et al. (2016) Thermo-chemical Energy Storage of Concentrated Solar Power by Integration of the Calcium Looping Process and a CO2 Power Cycle. Applied Energy, 173, 589-605. https://doi.org/10.1016/j.apenergy.2016.04.053
- 31. Muñoz-Antón, J., Rubbia, C., Rovira, A., et al. (2015) Per-formance Study of Solar Power Plants with CO2 as Working Fluid. A Promising Design Window. Energy Conversion & Management, 92, 36-46. https://doi.org/10.1016/j.enconman.2014.12.030
- 32. Valverde, J.M., Sanchez-Jimenez, P.E. and Perez-Maqueda, L.A. (2014) Effect of Heat Pretreatment/Recarbonation in the Ca-Looping Process at Realistic Calcination Conditions. Energy and Fuels, 28, 4062-4067. https://doi.org/10.1021/ef5007325
- 33. Valverde, J.M., Sanchez-Jimenez, P.E. and Perez-Maqueda, L.A. (2014) Role of Precalcination and Regeneration Conditions on Postcombustion CO2 Capture in the Ca-Looping Technology. Applied Energy, 136, 347-356. https://doi.org/10.1016/j.apenergy.2014.09.052
- 34. Valverde, J.M., Barea-López, M., Perejón, A., et al. (2017) Effect of Thermal Pretreatment and Nanosilica Addition on Limestone Performance at Calcium-Looping Conditions for Thermochemical Energy Storage of Concentrated Solar Power. Energy and Fuels, 31, 4226-4236. https://doi.org/10.1021/acs.energyfuels.6b03364
- 35. Sun, P., Grace, J.R., Lim, C.J., et al. (2008) Investigation of Attempts to Improve Cyclic CO2 Capture by Sorbent Hydration and Modification. Industrial & Engineering Chemistry Research, 47, 2024-2032. https://doi.org/10.1021/ie070335q
- 36. Sayyah, M., Lu, Y.Q., et al. (2012) Mechanical Activation of CaO-Based Adsorbents for CO2 Capture. ChemSusChem, 6, 193-198. https://doi.org/10.1002/cssc.201200454
- 37. Mastronardo, E., Bonaccorsi, L., Kato, Y., et al. (2016) Thermo-chemical Performance of Carbon Nanotubes Based hybrid Materials for MgO/H2O/Mg(OH)2 Chemical Heat Pumps. Applied Energy, 181, 232-243. https://doi.org/10.1016/j.apenergy.2016.08.041
- 38. Wereko-Brobby, C.Y. and Gibbs, B.M. (1979) Calcium Hy-droxide as an Energy Storage Medium for Solar Power Systems. International Conference on Future Energy Concepts, London, 207-210.
- 39. Xia, B.Q., Zhao, C.Y., Yan, J., et al. (2019) Development of Granular Thermochemical Heat Storage Composite Based on Calcium Oxide. Renewable Energy, 147, 969-978. https://doi.org/10.1016/j.renene.2019.09.065
- 40. Roßkopf, C., et al. (2014) Improving Powder Bed Properties for Thermochemical Storage by Adding Nanoparticles. Energy Conversion & Management, 86, 93-98. https://doi.org/10.1016/j.enconman.2014.05.017
- 41. Roßkopf, C., Afflerbach, S., Schmidt, M., et al. (2015) In-vestigations of Nano Coated Calcium Hydroxide Cycled in a Thermochemical Heat Storage. Energy Conversion and Management, 97, 94-102. https://doi.org/10.1016/j.enconman.2015.03.034
- 42. Sakellariou, K.G., Criado, Y.A., Tsongidis, N.I., et al. (2017) Multi-Cyclic Evaluation of Composite CaO-Based Structured Bodies for Thermochemical Heat Storage via the CaO/Ca(OH)2 Reaction Scheme (vol. 146, pg 65, 2017). Solar Energy, 150, 619-620. https://doi.org/10.1016/j.solener.2017.05.049
- 43. Bowery, R.G. and Justen, J. (1978) Energy Storage Using the Reversible Oxidation of Barium Oxide. Solar Energy, 21, 523-525. https://doi.org/10.1016/0038-092X(78)90078-6
- 44. Wong, B. (2011) Thermochemical Heat Storage for Con-centrated Solar Power. Final Report for the US Department of Energy.
- 45. Carrillo, A.J., Sastre, D., Serrano, D.P., et al. (2016) Revisiting the BaO2/BaO Redox Cycle for Solar Thermochemical Energy Storage. Physical Chemistry Chemical Physics, 18, 8039-8048. https://doi.org/10.1039/C5CP07777J
- 46. Mueller, D., Knoll, C., Artner, W., et al. (2017) Combining In-Situ X-Ray Diffraction with Thermogravimetry and Differential Scanning Calorimetry: An Investigation of CO3O4, MnO2 and PbO2 for Thermochemical Energy Storage. Solar Energy, 153, 11-24. https://doi.org/10.1016/j.solener.2017.05.037
- 47. Pardo, P., Deydier, A., Anxionnaz-Minvielle, Z., et al. (2014) A Review on High Temperature Thermochemical Heat Energy Storage. Renewable & Sustainable Energy Reviews, 32, 591-610. https://doi.org/10.1016/j.rser.2013.12.014
- 48. André, L., Abanades, S. and Flamant, G. (2016) Screen-ing of Thermochemical Systems Based on Solid-Gas Reversible Reactions for High Temperature Solar Thermal Energy Storage. Renewable and Sustainable Energy Reviews, 64, 703-715. https://doi.org/10.1016/j.rser.2016.06.043
- 49. Wentworth, W.E. and Chen, E. (1976) Simple Thermal Decom-position Reactions for Storage of Solar Thermal Energy. Solar Energy, 18, 205-214. https://doi.org/10.1016/0038-092X(76)90019-0
- 50. Fahim, M.A. and Ford, J.D. (1983) Energy Storage Using the BaO2/BaO Reaction Cycle. Chemical Engineering Journal, 27, 21-28. https://doi.org/10.1016/0300-9467(83)80042-2
- 51. Castillo, A. and Gayme, D.F. (2014) Grid-Scale Energy Storage Applications in Renewable Energy Integration: A Survey. Energy Conversion & Management, 87, 885-894. https://doi.org/10.1016/j.enconman.2014.07.063
