Hans Journal of Chemical Engineering and Technology
Vol.
09
No.
04
(
2019
), Article ID:
31386
,
9
pages
10.12677/HJCET.2019.94046
Effect of Nano-Iron-Based Catalysts on Low-Rank Coal Pyrolysis Products and Reaction Kinetics
Menglin Ren1,2, Xuemei Ma1,2, Jie Chen1,2, Caiyun Feng1,2, Qingxiang Ma1,2, Hui Fan1,2*
1State Key Laboratory of High-Efficiency Utilization of Coal and Green Chemical Engineering, Ningxia University, Yinchuan Ningxia
2National Chemical Experimental Teaching Demonstration Center, School of Chemistry and Chemical Engineering, Ningxia University, Yinchuan Ningxia

Received: Jul. 3rd, 2019; accepted: Jul. 17th, 2019; published: Jul. 24th, 2019

ABSTRACT
The catalytic pyrolysis of low-rank coal can regulate the distribution of pyrolysis products and realize the directional transformation of coal, which is of great significance for the efficient and clean utilization of low rank coal. In this paper, nano-Fe2O3 was used as catalyst to investigate the effects of catalyst addition and pyrolysis temperature on catalytic pyrolysis products and catalytic pyrolysis kinetics of Hailar lignite. The results show that the catalytic pyrolysis process of Hailar lignite conforms to the first-order single reaction model in the temperature range of 317˚C - 430˚C and 430˚C - 560˚C. The apparent activation energy of catalytic pyrolysis under different addition amounts is lower than that of non-catalytic pyrolysis, indicating that the catalyst is more favorable for pyrolysis of lignite in the low temperature stage. Under experimental conditions, when the nano-Fe2O3 addition increased from zero to 5%, the maximum weight loss rate is increased from 0.23 to 0.394, and pyrolysis is basically completed at 580˚C. At the same time, the tar yield increased from 0.56% to 6.5%, and the gas yield increased from 6.89% to 33.5%.
Keywords:Low-Rank Coal, Thermogravimetric Analysis, Catalytic Pyrolysis, Reaction Kinetics
纳米铁基催化剂对低阶煤热解产物及 反应动力学的影响
任梦琳1,2,马雪梅1,2,陈杰1,2,冯彩云1,2,马清祥1,2,范辉1,2*
1宁夏大学省部共建煤炭高效利用与绿色化工国家重点实验室,宁夏 银川
2宁夏大学化学化工学院,国家级化学实验教学示范中心,宁夏 银川

收稿日期:2019年7月3日;录用日期:2019年7月17日;发布日期:2019年7月24日

摘 要
低阶煤的催化热解能够调节热解产物的分布,实现煤的定向转化,对低阶煤的高效洁净利用具有重要意义。本文以纳米Fe2O3为催化剂,考察了催化剂添加量和热解温度等条件对海拉尔褐煤催化热解产物及催化热解动力学方面的影响。研究表明,在317℃~430℃和430℃~560℃两个温度区间内,海拉尔褐煤的催化热解过程均符合一级单一反应模型,不同添加量下催化热解的表观活化能均低于非催化热解的活化能,说明催化剂更有利于褐煤在低温阶段热解;在实验条件下,纳米Fe2O3添加量从0增加到5%时,最大失重速率由0.23增加到0.394,并且在580℃时,热解基本完成。同时,焦油产率由0.56%增加到6.5%,气相产率由6.89%增至33.5%。
关键词 :低阶煤,热重分析,催化热解,反应动力学

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着国内能源需求日益增大和优质煤炭资源的大量减少,低阶煤逐渐成为炙手可热的煤炭资源。据统计,低阶煤在我国煤炭储量及产量中占很高比例,占全国已探明煤炭储量的55%以上 [1] 。低阶煤是处于低变质阶段的煤,水分、氧含量和挥发分较高,热值低,热稳定性差,直接开发利用较为困难 [2] 。为了避免导致高价值的化学能转化为低品位的热能,热解技术是低阶煤综合利用较好的途径 [3] 。通过干馏的方式,实现原煤的多级转化,是新型的低碳环保技术 [4] 。在煤热解过程中添加合适的催化剂可促进低阶煤的热解反应,提高热解转化率,因此低阶煤催化热解具有重要研究意义 [5] 。
近年来,一些研究人员研究了催化剂对煤热解反应的影响,以提高热解产物产率为目标,实现煤热解产物的定向转化 [6] [7] [8] 。而铁基催化剂价格低廉,对环境无污染,已成为最常用的催化剂之一。钟梅等 [9] 用Fe3+的硝酸盐处理脱灰和丰煤样,在热重分析仪中考察了处理煤样的失重特征和气体逸出规律,结果表明处理煤样的总失重率减少,CO2和H2的产量较原煤的高。Yu Fu等 [10] 以KCl、CaO和Fe2O3为催化剂,研究了黄陵煤的热解行为,通过气体组成的变化和动力学分析,讨论了催化机理,总结了催化剂对煤热解反应活性的影响。阎鑫等 [11] 采用低温溶液蒸发法制备NaFeS2纳米材料,研究了NaFeS2纳米材料在煤加氢热解工艺中的催化性能。Lei Zhang等 [12] 研究出Fe/γ-Al2O3催化剂在煤浆热解制氢反应中具有较好的催化活性,H2产率较高。
本研究采用水热合成法制备纳米级氧化铁催化剂,对其结构和形貌进行表征,并考察其在煤热解工艺中的催化性能。采用热重法研究海拉尔褐煤最有效的催化热解条件,建立热解过程的动力学模型,计算活化能E和指前因子A等热解动力学参数,并在固定床反应器上对热解产物产率进行了研究分析。
2. 实验
2.1. 实验原料
2.1.1. 煤样的制备
实验选用内蒙古海拉尔褐煤(HLE),经研磨筛选后选取粒径为200目以下的煤样,放入真空干燥箱中在80℃下干燥6 h,放入干燥器中备用。煤样的元素分析及工业分析见表1。
Table 1. Proximate and ultimate analyses of coal sample
表1. 煤样工业分析和元素分析
注:M为水分;A为挥发分;Fc为固定碳;V为挥发分。
2.1.2. 催化剂的制备
本实验采用水热合成法制备α-Fe2O3纳米立方体催化剂。称取FeC13∙6H2O和乌洛托品,将FeC13∙6H2O溶于10 ml二次去离子水中,将乌洛托品溶于30 m1去离子水中,并滴加盐酸调节pH值,使得pH = 1.8;边搅拌边将三氯化铁溶液缓慢滴加到含盐酸的乌洛托品溶液中,补加10 ml水,超声20 min后,将混合溶液倒入含有聚四氟乙烯内衬的不锈钢高压反应釜中,将反应釜放入预先加热到130℃的烘箱中,保温20 h。将高压釜中的产物全部倒入到离心机的PE离心管中,在3000 r/min高速下离心10 min;取出后,滤出上层溶液,重新加入适量的二次去离子水,并将其放入超声波清洗器中进行超声震荡,使沉淀的产物重新悬浮,再次进行离心;重复进行3次,将清洗过的产物转移至坩埚中,并放入到温度为65℃的烘箱中进行烘干,保温12 h。
2.2. 煤热解实验
煤热解实验在固定床反应装置上进行,实验装置流程示意图如图1所示,装置主要由配气系统、气体流量控制系统、预热器、管式反应器以及气体采集系统组成。
 Schematic of coal pyrolysis setup. 1: thermocouple; 2: tube furnace;
3: quartz tube; 4: temperature controller; 5, 6: secondary condensing
unit; 7: dryer; 8: gas flowmeter; 9: gas bag; 10: mass flow controller
Schematic of coal pyrolysis setup. 1: thermocouple; 2: tube furnace;
3: quartz tube; 4: temperature controller; 5, 6: secondary condensing
unit; 7: dryer; 8: gas flowmeter; 9: gas bag; 10: mass flow controller
Figure 1. The yield of pyrolysis char
图1. 热解装置流程示意图。1:热电偶;2:管式炉;3:石英管;4:温度控制器;5,6:二级冷凝装置;7:干燥装置;8:气体流量计;9:集气袋;10:质量流量控制器
实验中使用高纯N2 (99.999%)为载气,流量为100 ml∙min−1。实验时,将煤粉和纳米α-Fe2O3催化剂以一定比例(1%、2%、3%、5%、10%)进行机械混合,将混合样品放入热解炉内,通入氮气20 min后再进行热解实验。热解实验采用程序升温的加热方式,管式炉升温速率为5℃/min,待温度自室温上升至110℃后,保温20 min,以脱除煤样中的自由水,再升至热解终温(450℃、500℃、550℃、600℃、650℃)后保温30 min,停止加热。从200℃开始收集气体,待开始降温后采气结束。将收集的气相产物用方正GC-4200型气相色谱仪对(H2、CO2、CH4、CO)进行气相色谱分析;热解产生的焦油在冷阱中冷却,冷却介质为冰水,温度在0℃~4℃之间;待温度降至室温时,将热解后的半焦取出称量,计算半焦收率。
2.3. 热重分析实验
本实验热重分析是在Setsys 16热分析仪上进行。实验过程中以惰性气体高纯氩气(99.999%)为保护气,载气流速为100 ml∙min−1。参与热重分析实验的样品质量约l0 mg,测定的温度区间为室温~1000℃,升温速率为10℃/min.
3. 结果与讨论
3.1. 催化剂的表征
用德国布鲁克D8-advance A25型X射线衍射仪分析了α-Fe2O3纳米催化剂的组成和结构,如图2所示,由X射线衍射图谱可看出α-Fe2O3衍射峰尖锐,说明结晶性较好,未检测到其他杂质峰的存在;用HT770003040701型透射电子显微镜观察样品的微观形貌,如图3所示,可观察到所制得样品为平行六面体的纳米颗粒。
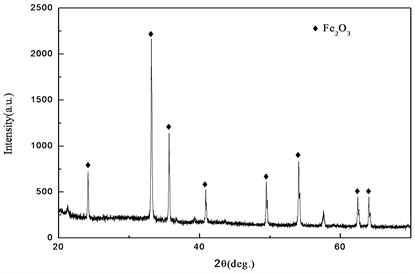
Figure 2. XRD pattern of the α-Fe2O3 catalyst
图2. α-Fe2O3催化剂X射线衍射图谱

Figure 3. SEM image of the α-Fe2O3 catalyst
图3. α-Fe2O3催化剂透射电子显微图
3.2. 热重分析
3.2.1. 不同催化剂添加量的热重分析
由图4及表2可知,加入Fe2O3的海拉尔褐煤热解效果比原煤的热解效果显著。在未加入Fe2O3纳米催化剂时,原煤的失重率是84.8%,加入添加剂Fe2O3后,海拉尔褐煤的热解转化率提高,最大失重率由原来的0.23上升到0.394,在催化剂加入5%时,失重率为79.7%,开始进行热解的温度由原煤的265.4℃降低到257.3℃,在温度到达580℃时,热解基本完成,说明催化剂加入有利于煤热解过程中挥发分的释放。但是当Fe2O3含量增加到10%时,煤样的失重率降低到75.2%,最大失重速率也是由0.394降低到0.19,这可能因为当催化剂过量时,会导致煤中孔隙结构的堵塞,进而影响热解过程的进行。考虑热解速率以及热解温度,催化剂的加入量为5%时,热解终温向低温段移动,失重率和热解速率达到最大,催化效果最好。
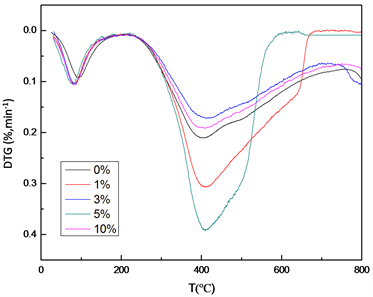
Figure 4. TG and DTG curves of different α-Fe2O3 addition (0%, 1%, 3%, 5%, 10%)
图4. α-Fe2O3的添加量为(0%、1%、3%、5%、10%)的TG和DTG曲线图
Table 2. The pyrolysis characteristic parameter of different α-Fe2O3 addition
表2. 不同α-Fe2O3的添加量热解特性参数表
3.2.2. 反应动力学分析
煤热解动力学是研究在热解过程中所涉及到的反应动力学参数,有利于描述煤热解所经历的复杂反应过程 [13] 。在动力学建模中,转化率x被定义为热解煤在时间t与初始煤的质量比如下:
(1)
w0、wt和 分别是样品的初始质量,t时刻样品的质量,反应结束时剩余样品的质量。
对煤催化热解的反应动力学模型建立过程如下:
(2)
根据Arrhenius经验方程可得
(3)
加热速率用β表示, ,β在热解过程中是固定值,将上式变形可得:
(4)
采用Coats-Redfern法 [14] 对式上式进行处理,得
当n = 1时,
(5)
当n ≠ 1时,
(6)
对一般的反应区和大部分的E而言,2RT/E远小于1, 可近似看做常数 。因此,当n = 1时, 对1/T作图;而当n ≠ 1时, 对1/T作图,都能得到一条直线,其斜率为 ,即可求得活化能E和指前因子A。
加入催化剂后,海尔拉褐煤的热解过程被分为了两个一级反应的过程,由表3可以看出,第一阶段的活化能小于第二阶段的活化能,这是因为首先进行的是煤样的活泼热分解阶段,这一阶段煤中的侧链和官能团稳定性较差,容易分解,生成挥发分,化学键键能小,容易断裂分解,进而这阶段的活化能较小;第二阶段主要发生的是大分子的断裂,需要吸收了大量的热量,活化能增大。加入催化剂,使煤样分解的温度明显降低,随着添加量的增加,350℃~560℃范围内活化能先减小后增大,5%时活化能最低,与前面热重实验结果一致。
3.3. 热解产物产率分析
3.3.1. 液体产物
海拉尔褐煤以及添加5%的催化剂在不同温度条件下焦油产率分布如图5所示,可以看出在添加催化剂后,焦油产率明显增多,最高可达6.5%。随着温度的升高,热解产生焦油呈上升趋势,原煤热解的焦油由0.56%增至2.1%;添加催化剂热解后的焦油由1.1%增加到6.5%,但是在温度达到600℃后增加不明显,这与之前热重实验结果相符。在催化剂存在下热解聚焦油产率明显高于原煤热解后焦油的产率,说明纳米α-Fe2O3对原煤具有较强的催化解聚作用。
Table 3. The kinetic parameters of HLE coal in different reaction areas
表3. 海尔拉煤在各反应区域的动力学参数
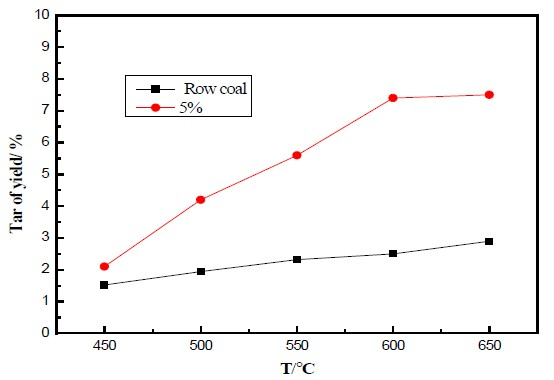
Figure 5. The yield of pyrolysis tar
图5. 热解焦油产率
3.3.2. 气相产物
如图6所示,图6(a)为不同终温下气相产率,随着温度的升高,原煤的气体产率不断增加,但在添加催化剂的情况下,产气率更高,最高为33.5%。图6(b)为热解终温600℃时,原煤和添加5%催化剂煤样热解气相组分的含量。由图可得,添加催化剂后各个组分的产量均有所提高。H2和CH4增加明显,分别增加了0.73和0.5。这主要因为过渡金属对氢化反应有较高的催化活性,可与煤中含氧官能团或不饱和烃中的化学键产生化学吸附,催化裂解烃类物质,使气体产物中H2和CH4含量大幅增加。
3.3.3. 固体产物
海拉尔褐煤以及在加入催化剂下的半焦产率变化过程如图7所示。在不添加催化剂的情况下,半焦的产率随着温度增加而下降。当加入添加剂后,半焦随温度的变化趋势与原煤类似。但是,半焦的产率明显减小,在600℃时,由原来的60%降到46%,减小了14%。
 (a) 不同热解终温下气相产率
(a) 不同热解终温下气相产率
 (b) 600℃时不同气体产率
(b) 600℃时不同气体产率
Figure 6. The yield of pyrolysis gas
图6. 热解气相产率

Figure 7. The yield of pyrolysis char
图7. 热解半焦产率
4. 结论
1) 通过热重实验对海拉尔褐煤失重过程进行研究,建立描述热解过程的动力学反应模型,并通过实验数据拟合动力学参数。热解动力学分析表明:在317℃~430℃和430℃~560℃两个区域温度区间内,褐煤的热解过程均符合一级单一反应模型,且不同添加量下催化热解的表观活化能均低于非催化热解的活化能。
2) 以提高热解煤气、焦油收率为目标进行催化热解实验,当纳米Fe2O3添加量为5%时,热解终温向低温移动,同时焦油产率由0.56%增加到6.5%,气相产率由6.89%增至33.5%,催化效果达到最佳。
基金项目
自治区高等学校科学技术研究项目(NGY2018-036);宁夏高等学校一流学科建设资助项目(NXYLXK2017A04);中国科学院西安分院“西部青年学者”B类项目(XAB2016AW03)。
文章引用
任梦琳,马雪梅,陈杰,冯彩云,马清祥,范辉. 纳米铁基催化剂对低阶煤热解产物及反应动力学的影响
Effect of Nano-Iron-Based Catalysts on Low-Rank Coal Pyrolysis Products and Reaction Kinetics[J]. 化学工程与技术, 2019, 09(04): 324-332. https://doi.org/10.12677/HJCET.2019.94046
参考文献
- 1. 张瑜, 谢欣馨, 徐宏伟, 等. 低阶煤在热解领域中的应用[J]. 煤炭加工与综合利用, 2018(6): 73-76.
- 2. 霍鹏举. 低阶煤的分质利用技术现状及发展前景[J]. 应用化工, 2018, 47(10): 2287-2291.
- 3. 史俊高, 安晓熙, 房有为. 我国低阶煤热解提质技术现状及研究进展[J]. 中外能源, 2019, 24(4): 15-23.
- 4. 倪维斗. 煤炭清洁高效利用势在必行[J]. 中国电力企业管理, 2015(5): 26-19.
- 5. 谢欣馨, 罗进成, 葛启明, 等. 催化剂对煤热解特性的影响[J]. 煤化工, 2015, 43(4): 38-42.
- 6. Zhu, P., Yu, Z., Zhang, J., et al. (2017) Catalytic Pyrolysis of Bituminous Coal under Pyrolysis Gas over a Ni/MgO Catalyst. Chemical Engineering & Technology, 40, 1605-1610. https://doi.org/10.1002/ceat.201700163
- 7. Li, Y., Amin, M.N., Lu, X., Li, C., Ren, F. and Zhang, S. (2016) Pyrolysis and Catalytic Upgrading of Low-Rank Coal Using a NiO/MgO-Al2O3 Catalyst. Chemical Engineering Science, 155, 194-200. https://doi.org/10.1016/j.ces.2016.08.003
- 8. Dong, C., Jin, L., Tao, S., Li, Y. and Hu, H. (2015) Xilinguole Lignite Pyrolysis under Methane with or without Ni/Al2O3 as Catalyst. Fuel Processing Technology, 136, 112-117. https://doi.org/10.1016/j.fuproc.2014.10.037
- 9. 钟梅, 赵渊, 李显, 等. K+、Ca2+和Fe3+对和丰煤热解产物分布、结构及品质的影响[J]. 燃料化学学报, 2018, 46(9): 1044-1054.
- 10. Fu, Y., Guo, Y. and Zhang, K.X. (2016) Effect of Three Different Catalysts (KCl, CaO, and Fe2O3) on the Reactivity and Mechanism of Low-Rank Coal Py-rolysis. Energy Fuels, 30, 2428-2433. https://doi.org/10.1021/acs.energyfuels.5b02720
- 11. 阎鑫, 赵鹏, 艾涛, 等. 多硫化铁纳米材料的制备及在煤催化加氢热解中的研究[J]. 化学工业与工程技术, 2014, 35(3): 1-3.
- 12. Zhang, L., Zhang, L., Shu, X., et al. (2013) Study on Supported Metal Catalysts for Hydrogen Production from Coal Slurry Pyrolysis. Asian Journal of Chemistry, 25, 5441-5444. https://doi.org/10.14233/ajchem.2013.14560
- 13. Calkins, W.H. (1987) Investigation of Organic Sulfur-Containing Structure in Coal by Flash Pyrolysis Experiments. Energy &Fuels, 1, 59-64. https://doi.org/10.1021/ef00001a011
- 14. 刘荣厚, 张大雷. 生物质热化学转换技术[M]. 北京: 化学工业出版社, 2005.
NOTES
*通讯作者。
