Hans Journal of Chemical Engineering and Technology
Vol.
12
No.
02
(
2022
), Article ID:
49184
,
7
pages
10.12677/HJCET.2022.122011
壳聚糖–海藻酸钠–丹参酮IIA微球的制备及其工艺优化
汤芮,史浩,郑佳琪,李千金,董祖琴,张腾
成都理工大学,四川 成都
收稿日期:2022年2月2日;录用日期:2022年2月28日;发布日期:2022年3月8日

摘要
目的:优化壳聚糖–海藻酸钠(CS-SA)包裹丹参酮IIA (TIIA)的工艺条件,得到最佳工艺。方法:研究海藻酸钠含量、壳聚糖含量、Ca2+含量、Span-80等工艺条件对微球粒径分布的影响,在此基础上,研究SA、CS、Ca2+含量对载药量的影响,以工艺参数进行优化。结果:最佳工艺条件:SA含量为1.5%、Ca2+含量30%、CS含量0.4%,在该最佳工艺条件下,最大载药量达到13.2%。结论:为CS-SA包裹TIIA工业化生产应用提供了方向。
关键词
壳聚糖,海藻酸钠,丹参酮IIA,微球

Preparation and Process Optimization of Chitosan-Sodium Alginate-Tanshinone IIA Microspheres
Rui Tang, Hao Shi, Jiaqi Zheng, Qianjin Li, Zuqin Dong, Teng Zhang
Chengdu University of Technology, Chengdu Sichuan
Received: Feb. 2nd, 2022; accepted: Feb. 28th, 2022; published: Mar. 8th, 2022

ABSTRACT
Objective: The research aimed to optimize the process conditions of tanshinone IIA (TIIA) encapsulated by chitosan-sodium alginate (CS-SA) and obtain the best process. Method: The effects of sodium alginate content, chitosan content, Ca2+ content, Span-80 and other process conditions on the particle size distribution of microspheres were studied. On this basis, the effects of SA, CS and Ca2+ content on drug loading were studied. The process parameters were optimized. Result: The optimal process conditions: SA content was 1.5%, Ca2+ content was 30%, CS content was 0.4%. Under the optimal process conditions, the maximum drug loading amount reached 13.2%. Conclusion: It provides a direction for the industrial production and application of CS-SA wrapped TIIA.
Keywords:Chitosan, Sodium Alginate, Tanshinone IIA, Microspheres

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
壳聚糖(CS)是可进行离子交联的聚合物类别中最通用的生物聚合物 [1]。由于其通过碱性脱乙酰作用从几丁质(自然界中最丰富的多糖)中衍生而来,因此含量丰富,且成本低廉且对环境友好。此外,壳聚糖存在胺基结构,使其在略低的pH值下具有良好的水溶性;氢键容易在分子内和分子间形成;由于存在不同的官能团(-OH、-NH2、-C-O-C),从而容易对其进行化学改性,因此具有出色的成膜能力。海藻酸钠(SA)是从褐藻中提取的一种线性阴离子多糖,由-1,4-D-麦芽糖酸(M)-1,4-L-古洛糖醛酸(G)和-1,4-L-古洛糖醛酸(G)单元交替排列而成,根据将M和G的排列组合,可以提供各种等级的SA [2] [3]。丹参酮IIA (Tanshinone IIA, TIIA)为丹参中的主要脂溶性有效成分,具有预防和治疗心血管疾病,脑血管疾病、改善微循环、和癌症等方面的多重药理作用 [4] [5] [6] [7] [8]。但是,TIIA的水溶性差(2.8 ng/mL)、半衰期短(1~2小时) [9],导致口服生物利用度低。因此,研究对TIIA进行包裹并且充分利用TIIA有着十分重要的意义。为此,我们优化了CS-SA包裹TIIA的最佳工艺条件,为TIIA工业化生产应用提供了方向。
2. 材料与方法
2.1. 材料
2.1.1. 研究对象
丹参酮IIA (TIIA)购买自阿拉丁试剂有限公司,纯度为98%。
2.1.2. 试剂
海藻酸钠,化学纯,青岛海伽生物科技有限公司;壳聚糖,化学纯,山东奥康生物科技有限公司;碳酸钙、液体石蜡、乙酸、Span-80、皆为分析纯,来自成都金山化学试剂有限公司。
2.1.3. 主要仪器
752型紫外分光光度计;Nicolet 6700型傅里叶变换红外光谱仪;飞纳Prox型扫描电镜;TG-20离心机;Lab-1 A50型冷冻干燥机。
2.2. 方法
2.2.1. CS-SA微球的制备方法
称取一定量海藻酸钠分散在100 mL蒸馏水中充分溶解后,按照设定比例添加适量碳酸钙,超声5 min作为水相。在液体石蜡中加入适量乳化剂Span-80,搅拌混合均匀后作为油相。称取特定量壳聚糖分散在100 mL 0.5%的醋酸溶液中,完全溶解后作为交联相。将上述水相缓慢滴加到油相中,机械搅拌乳化30 min。然后加入醋酸与碳酸钙反应2 h,使碳酸钙完全溶解。接着将所得乳液滴加至壳聚糖交联相中,滴加完毕后交联反应30 min。离心过滤,蒸馏水洗涤,冷冻干燥12 h,得到微球备用。
2.2.2. 单因素试验
1) SA含量的选择。固定Ca2+含量40%、Span-80含量1%、CS含量为0.4%作为不变因素,设定SA的含量为0.5%、1.0%、1.5%、2.0%、2.5%,研究SA含量对CS-SA的粒径分布好的影响。
2) Ca2+含量的选择。固定SA含量为1.5%、Span-80含量1%、CS含量为0.4%作为不变因素,设定Ca2+的含量为10%、20%、30%、40%和50%,研究Ca2+含量对CS-SA的粒径分布的影响。
3) CS含量的选择。固定SA含量为1.5%、Ca2+含量40%作为不变因素,设定CS的含量为0.2%、0.4%、0.8%和1.6%,研究CS含量对CS-SA的粒径分布的影响。
2.2.3. 丹参酮IIA标准曲线的测定方法
精密称取一定量的丹参酮IIA,将其分别溶于乙醇中配制成浓度分别为(3,4,5,6,7,8) mg/mL的溶液,用紫外分光光度计(752型)在270 nm处测定吸光度值(A),求得回归标准曲线方程:“y = 0.0757x + 0.0716”,R2 = 0.9992。
2.2.4. 载药率测定
称取15 mg载药微球加入到柠檬酸三钠(0.06 mol/L)和碳酸氢钠(0.2 mol/L)中,超声使丹参酮IIA从微球中完全释放,后转移至容量瓶中定溶至200 mL。在270 nm处紫外分光光度下测定所释放药物吸光度,根据方程计算出浓度,再计算出载药率。载药率(LC)用公式(1)计算:
(1)
其中,Ma——初始丹参酮IIA重量;Mb——损失丹参酮IIA重量;Mc——干燥后载药微球重量。
3. 结果与分析
3.1. 各因素对粒径分布影响的结果分析
3.1.1. SA含量对粒径分布的影响
由图1可知,SA的含量对微球的粒径分布有显著影响,含量分别在0.5%和1%时,微球的粒径分布的大小均显著低于其含量为1.5%与2.0%、2.5%的水平。这是因为SA含量越多,与Ca2+交联形成的水凝胶网络越牢固致密,但是交联固化程度越高,粒径分布也随之增加。SA浓度为1.5%、2.0%时的粒径分布与其浓度为25%时的差异不显著,说明SA与Ca2+的交联度达到最大,继续增加海藻酸钠含量并未增大粒径分布,反而会浪费材料。因此最终选用海藻酸钠含量为1.5%作为该复合物的最佳水平。
3.1.2. Ca2+含量对粒径分布的影响
由图2可知,由CS-SA形成的聚合电解质物质并不牢固,因此需要加入交联剂固化。本试验结果表明Ca2+含量对微球粒径分布影响显著。Ca2+含量为10%、20%时粒径分布不均匀,但当其浓度为50%时粒径分布跨度小且均匀。造成差异的原因可能是当Ca2+浓度为10%、20%时,交联固化不充分,其粒径分布跨度远高于其他水平。因此筛选Ca2+含量40%为最佳条件。
3.1.3. CS含量对粒径分布的影响
由图3可知,随着CS浓度的增加,微球的粒径分布均也呈现增加的趋势,表明CS用量适宜时,可以增大凝胶状物质的致密度,但随着CS含量的增加,反应体系的黏度也会明显增大,黏度过高会阻碍CS与SA反应的充分性。因此最后选取CS的含量为0.4%。

Figure 1. Effect of SA content on particle size distribution of CS-SA microspheres
图1. SA含量对CS-SA微球的粒径分布影响
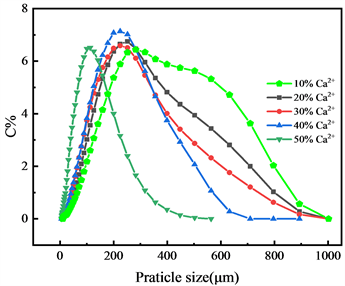
Figure 2. Effect of Ca2+ content on particle size distribution of CS-SA microspheres
图2. Ca2+含量对CS-SA微球的粒径分布影响
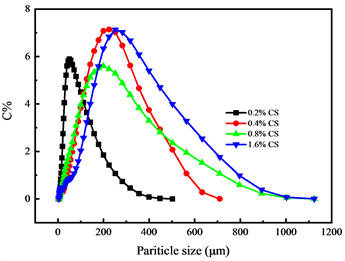
Figure 3. Effect of CS content on particle size distribution of CS-SA microspheres
图3. CS含量对CS-SA微球的粒径分布影响
3.2. 丹参酮IIA (TIIA)标准曲线的绘制
图4是丹参酮IIA的标准曲线。如图所示,其线性回归方程为:“y = 0.0757x + 0.0716”,方程相关系数R2 = 0.9992。表明在3~8 mg/mL浓度范围内,丹参酮IIA紫外吸光度A与其浓度C具有良好的线性关系。
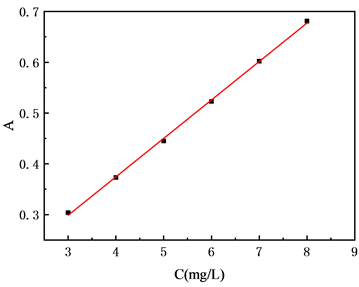
Figure 4. Tanshinone IIA standard curve
图4. 丹参酮IIA标准曲线
3.3. 各因素对载药量影响的结果分析
3.3.1. SA含量对载药量的影响
由图5分析可知,随着SA含量的变化,TIIA载药率在8.2%~12.6%之间波动,证明TIIA成功包裹到CS-SA微球中。SA具有相对较大分子量,含量增加后,基体的结构更为致密,使药物分子装载在微球的量更多,另外增加SA含量意味着交联剂Ca2+与SA的比例降低,在凝胶生成过程中,其中一部分微球的交联程度增大,出现强度收缩,形成更紧密的结构,从而延长了药物释放路径,避免了药物大量流失。但是SA含量在2.5%时,由于黏度过大,在制备过程中可能导致药物损失,造成浪费。
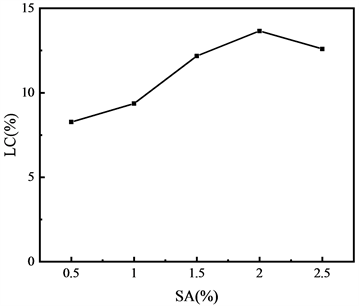
Figure 5. Effect of SA content on drug loading of CS-SA microspheres
图5. SA含量对CS-SA微球的载药量影响
3.3.2. CS含量对载药量的影响
从图6中可以看出,CS对载药率的影响也很大,随着CS含量从0%增加到0.8%后,药物负载效率从8.1%增加到12.5%,这表明CS中- 基团与SA中-COO−基团形成复合凝胶结构,仿佛给药物加盖一层外衣,起到更好的保护作用。即CS浓度越高,载药微球的外壳越厚,使得药物在制备过程中会损失掉更少。但是当CS浓度增到1.6%的时候,载药率有所下降,这是因为随着壳聚糖浓度的增加,交联相的黏度也会显著增加,黏度过高会阻碍交联反应充分进行。

Figure 6. Effect of CS content on drug loading of CS-SA microspheres
图6. CS含量对CS-SA微球的载药量影响
3.3.3. Ca2+含量对载药量的影响
从图7可知,随着Ca2+含量从10%增加到30%,LC从9.8%增加到13%,这种行为可能由于CS-SA微球拥有更紧密、更平滑的表面,减少了TIIA分子从CS-SA微球内核中转移出。当Ca2+浓度从30%增加到50%,LC从13.2%减少到4%,这是因为Ca2+与SA的缔结太过致密,微球的核减小,微球的内部表面积减小,TIIA装载的量也随之减小。
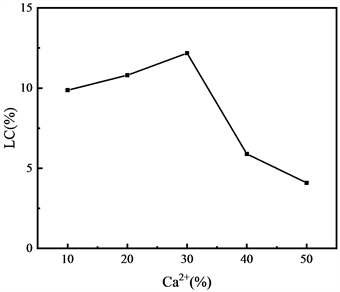
Figure 7. Effect of Ca2+content on drug loading of CS-SA microspheres
图7. Ca2+含量对CS-SA微球的载药量影响
4. 结论与讨论
壳聚糖–海藻酸钠微球具有无毒副作用、生物相容性高、生物可降解性和抗病毒等特点,因此本文以其作为药物递送系统包裹丹参酮IIA。采用乳化凝胶法壳制备壳聚糖–海藻酸钠(CS-SA)微球,研究海藻酸钠含量、Ca2+含量、壳聚糖含量等工艺条件对微球粒径分布的影响;以丹参酮IIA (TIIA)为生物大分子药物,研究对CS-SA/TIIA复合物的制备工艺进行优化。最佳工艺条件:SA含量为1.5%、Ca2+含量30%、CS含量0.4%,在该最佳工艺条件下,最大载药量达到13.2%。为CS-SA包裹TIIA工业化生产应用提供了方向。
致谢
首先,我要感谢我的导师,没有史浩老师的悉心的指导帮助,我不可能顺利完成实验和论文。其次,我要感谢李枭、李千金、董祖琴、张腾等我师弟师妹们,感谢他们在实验中给予的帮助和意见。最后对大学生创新创业计划的基金项目表达诚挚的谢意。
基金项目
大学生创新创业计划(201810616053)。
文章引用
汤 芮,史 浩,郑佳琪,李千金,董祖琴,张 腾. 壳聚糖–海藻酸钠–丹参酮IIA微球的制备及其工艺优化
Preparation and Process Optimization of Chitosan-Sodium Alginate-Tanshinone IIA Microspheres[J]. 化学工程与技术, 2022, 12(02): 74-80. https://doi.org/10.12677/HJCET.2022.122011
参考文献
- 1. Berger, J., Reist, M., Mayer, J.M., et al. (2004) Structure and Interactions in Covalently and Ionically Crosslinked Chitosan Hydrogels for Biomedical Applications. European Journal of Pharmaceutics and Biopharmaceutics, 57, 19-34. https://doi.org/10.1016/S0939-6411(03)00161-9
- 2. Caetano, L.A., Almeida, A.J. and Gonçalves, L. (2016) Effect of Experimental Parameters on Alginate/Chitosan Microparticle for BCG Encapsulation. Marine Drugs, 14, 85-90. https://doi.org/10.3390/md14050090
- 3. Dragan, E.S. (2014) Design and Applications of Interpenetrating Polymer Network Hydrogels. Chemical Engineering Journal, 243, 572-590. https://doi.org/10.1016/j.cej.2014.01.065
- 4. Han, J.Y., Fan, J.Y., Horie, Y., et al. (2008) Ameliorating Effects of Compounds Derived from Salvia miltiorrhiza Root Extract on Microcirculatory Disturbance and Target Organ Injury by Ischemia and Reperfusion. Pharmacology & Therapeutics, 117, 280-295. https://doi.org/10.1016/j.pharmthera.2007.09.008
- 5. Song, T., Yao, Y., Wang, T., et al. (2017) Tanshinone IIA Ameliorates Apoptosis of Myocardiocytes by Up-Regulation of miR-133 and Suppression of Caspase-9. European Journal of Pharmacology, 815, 343-350. https://doi.org/10.1016/j.ejphar.2017.08.041
- 6. Fu, J.J., Huang, H.Q., Liu, J.J., et al. (2007) Tanshinone IIA Protects Cardiac Myocytes against Oxidative Stress-Triggered Damage and Apoptosis. European Journal of Pharmacology, 568, 213-221. https://doi.org/10.1016/j.ejphar.2007.04.031
- 7. Zhou, W. and Wang, Y.H. (2014) A Network-Based Analysis of the Types of Coronary Artery Disease from Traditional Chinese Medicine Perspective: Potential for Therapeutics and Drug Discovery. Journal of Ethnopharmacology, 151, 66-77. https://doi.org/10.1016/j.jep.2013.11.007
- 8. Lin, C.Y., Wang, L., Wang, L.L., et al. (2013) Tanshinone IIA Inhibits Breast Cancer Stem Cells Growth in Vitro and in Vivo through Attenuation of IL-6/STAT3/NF-κB Signaling Pathways. Journal of Cellular Biochemistry, 114, 2061-2070. https://doi.org/10.1002/jcb.24553
- 9. Zhang, W.L., He, H.L., Liu, J.P., et al. (2013) Pharmacokinetics and Atherosclerotic Lesions Targeting Effects of Tanshinone IIA Discoidal and Spherical Biomimetic High Density Lipoproteins. Biomaterials, 34, 306-319. https://doi.org/10.1016/j.biomaterials.2012.09.058