Advances in Clinical Medicine
Vol.
10
No.
03
(
2020
), Article ID:
34453
,
6
pages
10.12677/ACM.2020.103031
Study on the Relationship between Non-Small Cell Lung Cancer and Thyroid Hormone
Xiaojun Zhao, Qiaolu Yan, Lianfu He
The Clinical Medical of Dali University, Dali Yunnan

Received: Feb. 17th, 2020; accepted: Mar. 3rd, 2020; published: Mar. 10th, 2020

ABSTRACT
Lung cancer is one of the most common malignant tumors in the world. Morbidity and mortality are on the rise year by year. The key to improve the survival rate of lung cancer patients is early detection, early diagnosis and early treatment. In recent years, a large number of indirect evidences have shown that there is an interaction between thyroid function and malignant diseases, especially breast carcinoma. However, the association between thyroid function and lung cancer has only been reported occasionally. It has been reported in the literature that the level of Thyroid hormone (TH) may change in many patients with non-thyroid diseases, especially in some patients with malignant tumors. Thyroid hormone may play a role in diseases other than hyperthyroidism and hypothyroidism. This article reviews the correlation between thyroid hormone levels and non-small cell lung cancer (NSCLC) patients, in order to provide reference for clinical evaluation of the condition and prognosis of NSCLC patients, and to guide clinical treatment.
Keywords:Non-Small Cell Lung Cancer, Thyroid Hormone, Correlation

非小细胞肺癌与甲状腺激素关系的探讨
赵晓军,严桥路,何连福
大理大学临床医学院,云南 大理

收稿日期:2020年2月17日;录用日期:2020年3月3日;发布日期:2020年3月10日

摘 要
肺癌是全球最常见的恶性肿瘤之一,发病率和死亡率呈逐年上升趋势。提高肺癌患者生存率的关键在于早发现,早诊断,早治疗。大量证据表明甲状腺功能的改变与恶性肿瘤,特别是乳腺癌之间存在相互作用关系。然而,甲状腺功能与肺癌是否有相关性,目前研究未明确,有关文献报道,许多非甲状腺疾病患者,特别是一些恶性肿瘤患者,其甲状腺激素(Thyroid hormone, TH)水平可能会发生变化。本文结合国内外相关研究进展,对非小细胞肺癌(non-small cell lung cancer, NSCLC)患者与甲状腺激素水平的相关性做一综述,为临床评估NSCLC患者的病情及临床预后提供参考。
关键词 :非小细胞肺癌,血清甲状腺激素,相关性

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肺癌(lung cancer)是全球最常见的恶性肿瘤之一,发病率和死亡率在全球范围内均居恶性肿瘤的首位,大约占恶性肿瘤整体死亡人数的17%,全球范围每年因肺癌死亡人数达130万 [1]。我国每年因非小细胞肺癌死亡人数高达80% [2]。肺癌中约80%~85%的病理类型为非小细胞肺癌(NSCLC) [3],包括鳞状上皮细胞癌、腺癌、大细胞癌、腺鳞癌、类癌、肉瘤样癌、唾液腺型癌(腺样囊性癌、粘液表皮样癌)等 [4]。与小细胞肺癌相比其癌细胞生长分裂较慢,扩散转移相对较晚。我国肺癌病死率呈逐年攀升的趋势,主要原因是由于肺癌早期无特异性症状及体征,缺乏有效的筛选和早期诊断指标,所以约80%的肺癌患者在确诊时已经是中晚期,失去了最佳的治疗时间。因此,早期诊断和治疗是提高肺癌患者生存时间的关键。
甲状腺激素(Thyroid hormone TH)包括由甲状腺滤泡分泌到血液循环中具有生物活性的四碘甲状腺原氨酸(T4)和3’,3,5-三碘甲状腺原氨酸(T3),分别占分泌总量的93%和7%。此外还有极少量无生物活性的逆–三碘甲腺原氨酸[3,3’,5’-T3(反T3或rT3)]。循环中T3约20%由甲状腺产生,其余80%主要来自于肝脏,由5’-脱碘酶(5’-DI)催化T4外环脱碘形成。rT3则经5-脱碘酶催化T4内环脱碘形成 [5] (图1)。甲状腺激素在生长,分化,发育和新陈代谢中起重要作用。通过与细胞核内甲状腺激素受体(TRs)结合,甲状腺激素可以诱导或抑制基因转录 [6] [7]。许多受甲状腺激素影响的途径也在肿瘤的增值中起作用。本文结合国内外相关研究进展探讨了NSCLC与甲状腺激素的作用关系。
2. 甲状腺激素与非小细胞肺癌的关系
许多研究证据表明甲状腺激素具有促进肿瘤细胞增殖,抗肿瘤细胞凋亡以及促进肿瘤相关血管生成的作用 [8]。大多数临床和流行病学研究表明 [9] [10],甲状腺功能亢进患者患非小细胞肺癌的风险更高。在预后方面,甲状腺功能减退的癌症患者生存时间更长,其机制可能与甲状腺激素的生长、成熟和代谢的作用相关。
3. 甲状腺激素诱导非小细胞肺癌增殖的机制
1) 整合蛋白αvβ3是质膜的异二聚体结构蛋白,可作为TRs有助于甲状腺激素诱导的非小细胞肺癌的增殖 [11],其主要在癌细胞 [12] 和快速分裂的血管内皮细胞中 [13] [14] 表达。αvβ3可结合细胞外基质(ECM)蛋白,并将特异性ECM蛋白-整合蛋白信号转导成特定离散细胞内反应,这种反应与细胞迁移和
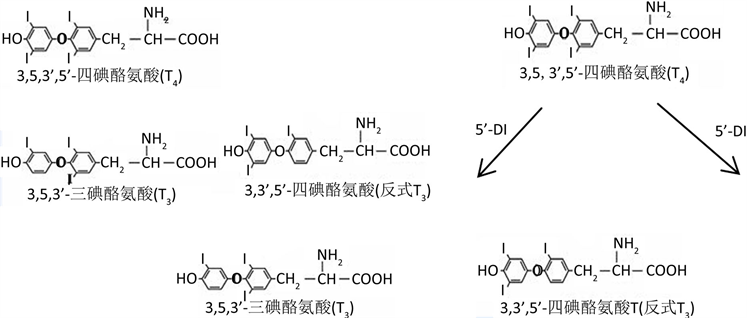
Figure 1. Chemical structure and conversion process of T3, T4 and rT3
图1. T3、T4、rT3化学结构及其转化流程
其他功能相关的 [15] [16]。有文献报道整合蛋白αvβ3含有甲状腺激素的离散受体位点,位于整合蛋白精氨酸-甘氨酸-天冬氨酸(argine-glycine-aspartic acid, Arg-Gly-Asp, RGD)识别位点附近 [17]。并有研究发现 [17] [18] 整合蛋白αvβ3上甲状腺激素的细胞表面受体与ERK1/ERK2[细胞外调节蛋白激酶1/2 (ERK1/2)]的激活以及ERK1/ERK2下游复杂的转录事件(如肿瘤细胞增殖和血管生成)有关。Bergh等学者 [17] 报道了T3和T4可以与纯化的质膜整合蛋白αvβ3相结合,αvβ3包含S1和S2两个TH结合位点 [19],S1与T3结合导致PI3K活化,通过PI3K可使T3诱导转录因子缺氧诱导因子-1 (hypoxia inducible factor-1, HIF-1)的α亚基的表达 [20],HIF-1在肿瘤生物学中起着关键作用,如促进血管生成、适应缺氧以及肿瘤的侵袭和转移等;S2主要结合T4,少量结合T3,最终激活ERK1/2通路 [21] 后诱导成纤维细胞生长因子2 (fibroblast growth factor-2, FGF-2)生成,FGF-2可刺激血管生成并因此促进肿瘤生长 [22]。此外,Meng等人 [18] 研究发现,T4以浓度依赖性的方式诱导非小细胞肺癌(NCI-H522)细胞中PCNA的积累,最大的影响浓度是在10−8 M到10−7 M之间;T3也增加了NCI-H522细胞PCNA的积累,但有效激素浓度超过了生理浓度水平,PCNA浓度的增加在一定程度上也促进了肿瘤细胞的增值。近年来也有文献报道 [17] 甲状腺激素的类似物四碘甲状腺乙酸(tetrac)可阻断甲状腺激素诱导的肺癌细胞的增殖,将来通过对其作用位点的研究,可能使该受体成为一个抗增殖作用的靶点,而tetrac可成为一种新型的抗增殖药物 [21]。
2) 核整合蛋白αv单体是促进肺癌细胞基因表达的激活因子
Hung-Yun等人 [23] 研究甲状腺激素诱导核整合蛋白αv单体内化的机制后,发现生理浓度的T4能在人非小细胞肺癌(NCI-H522)和卵巢癌(OVCAR-3)细胞中诱导整合蛋白αv单体的细胞内化和核易位,从而推断单聚体αv是一种新型共激活因子,由甲状腺激素调控的参与肿瘤发生和血管生成的基因所表达。核αv单体存在于暴露的T4细胞中,与癌细胞中具有重要作用的特定基因的启动子结合,如COX-2、ER、HIF-1和TR1的启动子区域。Lin HY [24] 和Cody [25] 也报道了单体αv和β3参与异二聚体整合蛋白αvβ3上的甲状腺激素受体位点,并且存在一种具有足够空间和离子属性的单体以结合和输入T4,与Hung-Yun等人的研究结果相符。
3) 雌激素受体ERα在甲状腺激素诱导的肺癌细胞增殖中的作用
Ran Meng等人 [18] 进行的在非小细胞肺癌NCI-H522和小细胞肺癌NCI-H510A癌细胞的胸腺嘧啶掺入研究实验中,发现雌激素受体ERα在非小细胞肺癌和小细胞肺癌细胞系中均有不同程度的表达,且NCI-H522细胞表达ERα水平比NCI-H510A非小细胞高2-5倍。在ERα阳性的人肺癌细胞中,由质膜启动的甲状腺激素诱导的细胞增殖作用部分是由ERα介导的,这种作用主要通过整合蛋白αvβ3与ERα的相互作用相关。同时还表明T4和T3均诱导ERK1/2活化和PCNA表达,但仅有T4引起这些细胞的ERα磷酸化。
4) 此外,还报道了甲状腺激素抗细胞凋亡作用的其他机制,如Kress等人 [26] 报道了甲状腺激素可以激活MAPK,在细胞核中,MAPK导致甲状腺激素受体的丝氨酸磷酸化,进而诱导血管生成和肿瘤细胞增殖;甲状腺激素可刺激程序性死亡-配体1(PD-L1)基因的表达,PD1/PD-L1位点在保护癌细胞免受T细胞破坏方面起着关键作用 [27];甲状腺激素还可降低TNF-α和FAS配体的表达,这两者都是激活细胞凋亡的细胞表面因子 [28]。
4. 非小细胞肺癌引起甲状腺激素改变的机制
近年来有研究报道提出肺癌患者下丘脑–垂体–甲状腺轴功能也发生明显改变 [29]。国内外研究 [30] 证实了肺癌患者甲状腺激素代谢的模式是血清T3浓度降低,T4浓度、游离甲状腺素指数(FTI)及TSH正常,并且rT3浓度增加,即甲状腺功能正常的病态综合征[euthyroid sick syndrome, ESS (低T3综合征)]。ESS的发生可能与以下机制有关:①肺癌患者尤其是晚期患者处于恶病质状态,因食欲减退,糖的摄入不足及利用降低,可使5’-脱碘酶的辅助因子——谷胱甘肽合成减少,因而使5’-脱碘酶的活性降低,导致T3生成减少,由于T4转化为T3减弱,则rT3相应生成增多。②肺癌患者因组织完整性遭到破坏,甲状腺素结合抑制物(THIB)大量渗入血循环,可抑制T3、T4与甲状腺结合球蛋白结合,导致低T3和(或)低T4血症。③罹患肿瘤时是一种应激状态,癌肿分泌促肾上腺皮质激素样物质增多,拮抗TSH对甲状腺的作用,抑制5’-脱碘酶活性,使TT4在外周脱碘减少,TT3产生不足,使T3降低。④由于肺癌患者消耗大量葡萄糖,葡萄糖是甲状腺中TSH作用所必需的基质,以及肺癌患者甲状腺内的TSH受体减少,故而导致甲状腺素合成、分泌均减少 [31]。国内学者王长江 [32] 对153例初诊NSCLC患者的TNM分期与甲状腺激素水平的研究中,发现随着肺癌病情的加重,内分泌紊乱的程度也加重,I~II期和肿瘤无转移患者FT3、FT4、TT3水平明显高于III~IV期和肿瘤有转移者,由此可见肺癌患者检测其甲状腺激素水平可以评估其病情严重程度。早期学者 [33] 认为T3降低是机体对原发疾病的有效适应,可降低能量代谢,对机体有保护作用,替代性的使用T4、T3并无疗效,反而导致TSH的抑制,延缓甲状腺功能的恢复。Moeller等人 [34] 研究报道,治疗引起的甲状腺功能减退与一些癌症预后良好相关,最突出的是肾细胞癌,在应用酪氨酸激酶抑制剂(TKIs)舒尼替尼治疗肾细胞癌的前瞻性研究中,甲状腺功能减退是治疗成功的独立预测因素。Garfield等人 [35] 认为,甲状腺功能减退症的诱导是TKIs延缓肿瘤生长的机制之一,而甲状腺功能减退症的纠正则消除了生存优势,使用T4替代治疗的癌症患者可能会使他们丧失甲状腺功能减退的潜在有益条件。
肺癌是全球性最常见的恶性肿瘤之一,发病率和死亡率呈逐年上升趋势。其病因及发病机制目前尚未明确,大量研究证实甲状腺激素可以通过αvβ3信号通路诱导肿瘤细胞增值及转移,Khan Samer [36] 等对甲状腺功能和癌症风险进行的鹿特丹研究中发现血清甲状腺激素水平与实体癌,如肺癌和乳腺癌的发病率增加呈正相关,将最高FT4三分位数与最低水平相比较,任何实体癌的风险增加1.13倍,乳腺癌风险增加1.14倍,肺癌风险几乎增加了一倍。甲状腺激素拮抗剂tetrac,特别是其纳米药物制剂,作为有效的抗增值及转移药物具有显著的治疗效果,将可能成为一种新型的抗增殖药物,但其作用机制还有待进一步研究。肺癌患者血清甲状腺激素水平也会发生改变,主要表现为低T3综合征,由于甲状腺激素的主要作用是促进代谢,所以肺癌患者血清甲状腺激素的降低,降低了机体代谢,减少能量消耗,减少了蛋白质的消耗,可视为机体的自我保护机制,故不宜用外源性甲状腺激素治疗,以免破坏这一自我保护性机制。综上所述,血清甲状腺激素水平检测对非小细胞肺癌的病情判断及疗效监测有一定的临床意义,但甲状腺功能在肺癌发病中的作用及作用机制值得进一步探讨。
文章引用
赵晓军,严桥路,何连福. 非小细胞肺癌与甲状腺激素关系的探讨
Study on the Relationship between Non-Small Cell Lung Cancer and Thyroid Hormone[J]. 临床医学进展, 2020, 10(03): 191-196. https://doi.org/10.12677/ACM.2020.103031
参考文献
- 1. 苟云久, 于珺, 何晓东, 谢定雄, 赵静. 肺癌与血清甲状腺激素水平关系的Meta分析[J]. 临床荟萃, 2014, 29(12): 1355-1361.
- 2. 高士豪, 王章站. 电视胸腔镜手术与传统手术相比治疗非小细胞肺癌患者对其心肺功能的影响[J]. 健康大视野, 2020(1): 58-59.
- 3. 刘艳琰. 非小细胞肺癌患者化疗前后血清甲状腺激素水平变化分析[J]. 中国实用医刊, 2015, 42(7): 117-118.
- 4. 葛均波, 徐永健. 内科学[M]. 第8版. 北京: 人民卫生出版社, 2014.
- 5. 朱大年, 王庭槐. 生理学[M]. 第8版. 北京: 人民卫生出版社, 2013.
- 6. Gonzalez-Sancho, J.M., García, V., Bonilla, F., et al. (2003) Thyroid Hormone Receptors/THR Genes in Human Cancer. Cancer Letters, 192, 121-132. https://doi.org/10.1016/S0304-3835(02)00614-6
- 7. Aranda, A., Martínez-Iglesias, O., Ruiz-Llorente, L., et al. (2009) Thyroid Receptor: Roles in Cancer. Trends in Endocrinology and Metabolism, 20, 318-324. https://doi.org/10.1016/j.tem.2009.03.011
- 8. Bailey, E.B.,Tantravahi, S.K., Poole, A., et al. (2015) Correlation of Degree of Hypothyroidism with Survival Outcomes in Patients with Metastatic Renal Cell Carcinoma Receiving Vascular Endothelial Growth Factor Receptor Tyrosine Kinase Inhibitors. Clinical Genitourinary Cancer, 13, 131-137. https://doi.org/10.1016/j.clgc.2014.11.002
- 9. Hellevik, A.I., Asvold, B.O., Bj?ro, T., et al. (2009) Thyroid Function and Cancer Risk: A Prospective Population Study. Cancer Epidemiology, Biomarkers & Prevention, 18, 570-574. https://doi.org/10.1158/1055-9965.EPI-08-0911
- 10. Mazzoccoli, G., Pazienza, V., Piepoli, A., et al. (2012) Al-teration of Hypothalamic-Pituitary-Thyroid Axis Function in Non-Small-Cell Lung Cancer Patients. Integrative Cancer Therapies, 11, 327-336. https://doi.org/10.1177/1534735411413269
- 11. Cabodi, S., del Pilar Camacho-Leal, M., Di Stefano, P., et al. (2010) Integrin Signalling Adaptors: Not Only Figurants in the Cancer Story. Nature Reviews. Cancer, 10, 858-870. https://doi.org/10.1038/nrc2967
- 12. Desgrosellier, J.S. and Cheresh, D.A. (2010) Integrins in Cancer: Biological Implications and Therapeutic Opportunities. Nature Reviews. Cancer, 10, 9-22. https://doi.org/10.1038/nrc2748
- 13. Belmadani, S., Zerfaoui, M., Boulares, H.A., et al. (2008) Microvessel Vascular Smooth Muscle Cells Contribute to Collagen Type I Deposition through ERK1/2 MAP Kinase, Alpha V Be-ta3-Integrin, and TGF-Beta1 in Response to ANG II and High Glucose. American Journal of Physiology. Heart and Circulatory Physiology, 295, 69-76.https://doi.org/10.1152/ajpheart.00341.2008
- 14. Cai, W. and Chen, X. (2006) Anti-Angiogenic Cancer Therapy Based on Integrin Alpha v Beta3 Antagonism. Anti-Cancer Agents in Medicinal Chemistry, 6, 407-428. https://doi.org/10.2174/187152006778226530
- 15. Arnaout, M.A., Goodman, S.L. and Xiong, J.P. (2007) Struc-ture and Mechanics of Integrin-Based Cell Adhesion. Current Opinion in Cell Biology, 19, 495-507. https://doi.org/10.1016/j.ceb.2007.08.002
- 16. Byzova, T.V., Goldman, C.K., Pampori, N., et al. (2000) A Mechanism for Modulation of Cellular Responses to VEGF: Activation of the Integrins. Molecular Cell, 6, 851-860. https://doi.org/10.1016/S1097-2765(00)00083-6
- 17. Bergh, J.J., Lin, H.Y., Lansing, L., et al. (2005) Integrin aVb3 Contains a Cell Surface Receptor Site for Thyroid Hormone that Is Linked to Activation of Mitogen-Activated Protein Kinase and Induction of Angiogenesis. Endocrinology, 146, 2864-2871. https://doi.org/10.1210/en.2005-0102
- 18. Meng, R., Tang, H.Y., Westfall, J., et al. (2011) Crosstalk between Integrin αvβ3 and Estrogen Receptor-α Is Involved in Thyroid Hormone-Induced Proliferation in Human Lung Carci-noma Cells. PLoS ONE, 6, 27547. https://doi.org/10.1371/journal.pone.0027547
- 19. Davis, P.J., Davis, F.B., Mousa, S.A., et al. (2011) Membrane Receptor for Thyroid Hormone: Physiologic and Pharmacologic Implications. Annual Review of Pharmacology and Toxicology, 51, 99-115. https://doi.org/10.1146/annurev-pharmtox-010510-100512
- 20. Moeller, L.C., Dumitrescu, A.M. and Refetoff, S. (2005) Cytosolic Action of Thyroid Hormone Leads to Induction of Hypoxia-Inducible Factor-1α and Glycolytic Genes. Molecular Endocrinology, 19, 2955-2963.https://doi.org/10.1210/me.2004-0542
- 21. Lin, H.Y., Sun, M., Tang, H.Y., et al. (2009) L-Thyroxine vs. 3,5,3’-Triiodo-L-Thyronine and Cell Proliferation: Activation of Mitogen-Activated Protein Kinase and Phosphatidyl-inositol 3-Kinase. American Journal of Physiology. Cell Physiology, 296, C980-C991. https://doi.org/10.1152/ajpcell.00305.2008
- 22. Moeller, L.C. and Führer, D. (2013) Thyroid Hormone, Thyroid Hormone Receptors, and Cancer: A Clinical Perspective. Endocrine-Related Cancer, 20, 19-29. https://doi.org/10.1530/ERC-12-0219
- 23. Lin, H.Y., Su, Y.F., Hsieh, M.T., et al. (2013) Nuclear Monomeric Integrin αv in Cancer Cells Is a Coactivator Regulated by Thyroid Hormone. The FASEB Journal, 27, 3209-3216. https://doi.org/10.1096/fj.12-227132
- 24. Lin, H.Y., Cody, V., Davis, F.B., et al. (2011) Identification and Functions of the Plasma Membrane Receptor for Thyroid Hormone Analogues. Discovery Medicine, 11, 337-347.
- 25. Cody, V., Davis, P.J. and Davis, F.B. (2007) Molecular Modeling of the Thyroid Hormone Interactions with Alpha v Beta 3 Integrin. Steroids, 72, 165-170. https://doi.org/10.1016/j.steroids.2006.11.008
- 26. Kress, E., Samarut, J. and Plateroti, M. (2009) Thyroid Hormones and the Control of Cell Proliferation or Cell Differentiation: Paradox or Duality? Molecular and Cellular Endocrinology, 313, 36-49. https://doi.org/10.1016/j.mce.2009.08.028
- 27. Lin, H.Y., Chin, Y.T., Nana, A.W., et al. (2016) Actions Oef l-Thyroxine and Nano-Diamino-Tetrac (Nanotetrac) on PD-L1 in Cancer Cells. Steroids, 114, 59-67. https://doi.org/10.1016/j.steroids.2016.05.006
- 28. Lin, H.Y., Glinsky, G.V., Mousa, S.A., et al. (2015) Thyroid Hormone and Anti-Apoptosis in Tumor Cells. Oncotarget, 6, 14735-14743. https://doi.org/10.18632/oncotarget.4023
- 29. Mazzoccoli, G., Pazienza, V., Piepoli, A., et al. (2012) Alteration of Hypothalamic-Pituitay-Thyroid Axis Function in Non-Small Cell Lung Cancer Patients. Integrative Cancer Therapies, 11, 327-336.https://doi.org/10.1177/1534735411413269
- 30. 薛荣梅, 葛伟. 肺癌患者血清甲状腺激素的变化及临床意义[J]. 现代肿瘤医学, 2015, 23(8): 1081-1083.
- 31. 李红燕, 王少芳, 王龙. 非小细胞肺癌患者化疗前后血清甲状腺激素水平的变化[J]. 中国临床研究, 2015, 28(9): 1131-1134.
- 32. 王长江, 许卫国. 甲状腺激素与N末端脑钠肽前体对非小细胞肺癌的诊断价值[J]. 国际检验医学杂志, 2019, 40(17): 2107-2111.
- 33. Chopra, I.J. (1997) Clinical Review 86 Euthyroid Sick Syndrome: Is It a Misnomer? The Journal of Clinical Endocrinology and Metabolism, 82, 329-334. https://doi.org/10.1210/jcem.82.2.3745
- 34. Moeller, L.C. and Führer, D. (2013) Thyroid Hormone, Thyroid Hormone Receptors, and Cancer: A Clinical Perspective. Endocrine-Related Cancer, 20, 19-29. https://doi.org/10.1530/ERC-12-0219
- 35. Garfield, D.H., Wolter, P., Sch?ffski, P., et al. (2008) Documentation of Thyroid Function in Clinical Studies with Sunitinib: Why Does It Matter. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 26, 5131-5132. https://doi.org/10.1200/JCO.2008.18.8680
- 36. Khan Samer, R., Layal, C., Rikje, R., et al. (2016) Thyroid Function and Cancer Risk: The Rotterdam Study. The Journal of Clinical Endocrinology and Metabolism, 101, 5030-5036. https://doi.org/10.1210/jc.2016-2104