Pharmacy Information
Vol.07 No.02(2018), Article ID:24281,6
pages
10.12677/PI.2018.72006
Research Progress in Malignant Glioma Targeting Delivery System Mediated with Receptors
Hongyan Wang, Yu Liu*
China Pharmaceutical University, Nanjing Jiangsu

Received: Mar. 10th, 2018; accepted: Mar. 22nd, 2018; published: Mar. 29th, 2018

ABSTRACT
The worldwide cancer incidence of malignant encephalic glioma is 3.20/100,000, the median survival for patients is less than 2 years and 9.8% of patients survived five years post diagnosis, with near 100% relapse rates and currently limited treatment options. Operations and chemotherapy drugs have limited efficacy for aggressive glioma with intrinsic resistance to drugs. Almost the whole of macromolecule and 98% of small-molecule drugs are unable to across blood-brain barrier. The receptor mediated endocytosis is one of the endogenous transporting channels, xenobiotics across blood-brain barrier and target glioma by taking advantages of cells. It provides a safer and more effective drugs delivery strategy for cancer treatment.
Keywords:Malignant Glioma, Blood-Brain Barrier, Receptor, Targeting Drugs Delivery
受体介导靶向恶性脑胶质瘤递药系统的研究进展
汪红艳,刘煜*
中国药科大学,江苏 南京

收稿日期:2018年3月10日;录用日期:2018年3月22日;发布日期:2018年3月29日

摘 要
恶性脑胶质瘤全球发病率为3.20/100,000,患者中位生存期不足2年,5年生存率仅9.8%,治疗后复发率几近100%,且目前仍无有效治疗方案。由于恶性胶质瘤存在浸润性生长的特点,手术无法根治,对于常用化疗药物又普遍存在内在抗拒性,导致化疗疗效有限。由于血脑屏障的存在,几乎全部的大分子药物以及98%以上的小分子药物都无法到达病灶,而受体介导的转运方式利用了血脑屏障自身的特性,通过内源性血脑屏障转运系统有效的跨越血脑屏障并靶向恶性胶质瘤进行药物输送,为胶质瘤的治疗提供了一种更为安全且有效的递药策略。
关键词 :恶性胶质瘤,血脑屏障,受体,靶向递药

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
神经胶质瘤是起源于神经胶质细胞的,最具多样化的中枢神经系统肿瘤之一。根据最新的WHO分类,胶质瘤被分为I~IV类。I、II类属低级别胶质瘤,常发于儿童或中青年,低级别胶质瘤患者总体预后较好,40%的患者经过治疗生存期可超过10年。恶性胶质瘤属高分级胶质瘤(III或IV级),分化程度较低,难治愈,患者预后差,占所有胶质瘤患者的77.5%,其中星型细胞瘤是中枢神经系统最常见的,具有浸润性的原发性恶性脑肿瘤。胶质母细胞瘤在星型细胞瘤中恶性程度最高,属于IV型胶质瘤,主要影响成人大脑半球的脑干区。依据基因型不同,可分为异柠檬酸脱氢酶野生型(IDH-野生型)和突变型(IDH-突变型)两类。90%的原发性胶质母细胞瘤属IDH-野生型,患者年龄主要集中在55~65岁之间,IDH-突变型则常见于有过低级别胶质瘤病史的年轻患者身上,属继发性胶质瘤 [1] 。胶质母细胞瘤的全球发病率为3.20/100,000 [2] ,患者中位生存期不足2年,5年生存率仅9.8%,即使在获得良好的治疗后,仍普遍存在肿瘤复发的情况,且复发率接近100% [3] [4] 。
胶质母细胞瘤患者术后放疗联合化疗在一定程度上抑制癌症进程。目前临床上治疗新诊断的恶性胶质瘤标准方法是通过手术切除病灶后接受放疗并辅以替莫唑胺治疗。替莫唑胺是美国FDA批准的可用于治疗恶性胶质瘤的口服化疗药物,这一联合治疗方案经临床试验证实具有一定实效,相较于单纯化疗,联合替莫唑胺治疗的患者5年生存期从1.9%提高到9.8% [5] ,2年生存率提高了16%以上。但对于恶性胶质瘤患者来说术后辅以替莫唑胺的效果仍然是有限的,患者肿瘤完全缓解(CR)率几乎为0,且长期大量服用替莫唑胺易产生多种副作用。
联合治疗至今无法取得理想疗效的原因在于:首先,恶性胶质瘤普遍存在浸润性生长的特点,单靠外科手术无法完全清除肿瘤细胞,残余的肿瘤细胞侵入正常脑组织,在手术后仍可继续增殖导致癌症复发,复发患者难以进行二次手术;其次,恶性胶质瘤对常见的化疗药物存在内在耐药性以及多药耐药性,可用于治疗恶性胶质瘤的药物极其有限;三,血脑屏障限制了药物向脑部转运。若希望辅助药物治疗取得更好的效果,一方面要致力于研发有效的治疗药物,近年来多种抗体类药物批准用于治疗癌症并取得疗效,目前贝伐单抗已被批准用于治疗复发性胶质瘤并有效延长患者生存期,提示我们抗体类药物可能为胶质瘤治疗提供助力,新的研究发现WNT5A信号通路可能与胶质瘤复发有关,它允许胶质母细胞瘤在大脑中扩散和生长,当关键基因WNT5A被激活时,胶质瘤干细胞分化成血管内皮样细胞,为肿瘤细胞提供营养,使肿瘤发生浸润性生长 [6] ,靶向WNT5A信号通路的药物联合贝伐单抗共同转运进脑部,可能进一步阻止肿瘤的扩散和复发;另一方面亟待解决的是如何使药物透过血脑屏障递送到肿瘤部位,基本上所有的大分子药物,如单抗,多肽等都无法透过血脑屏障,甚至于有98%以上的小分子药物也无法透过血脑屏障,如何跨过血脑屏障靶向脑部肿瘤递药成为治疗脑胶质瘤的一大难点。
血脑屏障主要由脑微血管内皮细胞构成,极大程度维持了脑内多种物质的动态平衡,但同时也限制了治疗性药物由血液向脑部转运,仅少部分分子量小于0.5 KDa的亲脂性小分子能通过,长期以来胶质瘤药物研究集中在易于透过血脑屏障的亲脂性小分子上。研究者尝试通过渗透、物理或化学等破化血脑屏障的方式向脑内递药,但这些方法或会降低药物活性 [7] ,或会不同程度损伤脑组织,严重的甚至引发癫痫、脑水肿等并发症 [8] 。加拿大的科学家曾利用超声打破血脑屏障的阻隔,成功递送药物进入脑部,但这一技术的安全性尚有待验证 [9] 。因此,现在更多的跨血脑屏障研究集中在利用血脑屏障自身特性上,如通过内源性血脑屏障转运系统进行药物输送就是一种更为安全且有效的递药策略 [10] 。脑微血管内皮细胞上存在大量受体,通过受体介导的转运方式能顺利将大分子转入脑实质 [11] ,如胰岛素受体可转运胰岛素样生长因子进入脑部;新生儿Fc受体能将脑内的免疫球蛋白逆转运到血液。其转运机制可分为3步:1) 配体与脑微血管内皮细胞膜上的受体发生特异性结合,细胞膜内陷形成递送囊泡;2) 递送囊泡运行到另一侧细胞膜上,并发生胞转作用;3) 在内皮细胞近腔侧发生胞吐作用,递送囊泡被传递到离子化的内皮细胞底层,并在此释放药物或载体 [12] 。如图1所示:
2. 多种受体介导的转运途径
目前与肿瘤相关研究较多的是乙酰胆碱受体(AChR)、转铁蛋白受体(TfR1)和低密度脂蛋白受体相关蛋白(LRP1和LRP2)。
2.1. AChR介导的转运系统
乙酰胆碱受体是一种整合膜蛋白。陆伟跃 [13] 课题组发现了一种来源于短神经毒素Candoxin的L构型多肽LCDX可以与nAChRs结合发生胞转作用。N型AChR是离子通道型受体,在中枢神经系统和周围神经系统都有高表达。研究者进一步通过多肽逆序合成法制备出D构型DCDX(GDRDEDIDRDTGDRDADEDRDWDSDEDKDF),有效的抑制了溶酶体对CDX的降解,提高了其在血液
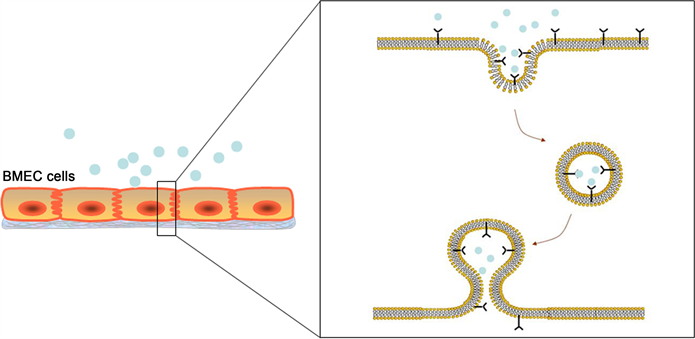
Figure 1. Receptor-mediated transepithelial permeability
图1. 受体介导的跨膜转运
中的稳定性。体内、体外实验也表明,DCDX具有比LCDX更高的体外BBB转运效率,经DCDX修饰的脂质体细胞摄取率更高,将其注射治疗原位脑胶质瘤裸鼠后,荷瘤小鼠的生存期明显延长。
2.2. TfR1介导的转运系统
TfR1在脑微血管内皮细胞表达量很高,为II型跨膜糖蛋白,是由两个分子量为90 KDa的单体组成的同源二聚体。TfR的表达受细胞所需铁含量的调节,在快速增殖的细胞中表达量明显增加。为了保持高增殖活性,恶性肿瘤往往会高表达TfR,含量约是正常组织的4~5倍 [14] 。TfR含量与肿瘤复发呈现正相关关系 [15] ,74%的患者肿瘤组织内存在TfR过表达现象。恶性程度越高的胶质瘤,TfR表达量也越多 [16] ,这也与其他细胞中TfR的表达趋势相符。鉴于TfR在脑微血管内皮细胞和恶性胶质瘤细胞上都高表达,具有潜在的血脑屏障和胶质瘤双靶向性,提示我们经TfR配体修饰的药物或能通过TfR介导的转胞吞作用递送入脑并靶向肿瘤部位。乳铁蛋白、HAIYPRH (T7)肽、抗TfR抗体都是有效的TfR配体。
Chen等 [17] 将具有抗实体瘤活性但无细胞穿透能力的天花粉蛋白(TCS)与细胞穿膜肽(CPP)和明胶裂解酶融合,再与乳铁蛋白特异结合,构成一个具有跨越血脑屏障,被明胶酶激活的,可穿透细胞的纳米杂化TCS毒素(rTLM-LF)。该蛋白递送系统首先可通过乳铁蛋白靶向血脑屏障上的TfR受体,协助蛋白向脑内转运,一旦蛋白到达肿瘤部位,明胶裂解酶可与胶质瘤相关的金属蛋白酶结合,从而释放TCS-CPP蛋白,该CPP则可介导TCS毒素向肿瘤和细胞内部渗透。研究者最后收获到了一个良好的小鼠体内脑靶向性及抗肿瘤活性,rTLM-LF大量聚集在小鼠脑部,而单纯的天花粉蛋白则弥散到全身,部分聚集在小鼠肾脏部位。抑瘤实验也表明,rTLM-LF组抑瘤效果更好,瘤块体积明显小于阴性对照组。
T7肽是一种通过噬菌体展示技术得到的TfR特异结合肽,分子量更小,结合率高,内源性的乳铁蛋白不但不会对T7肽产生竞争性抑制,反而会促进T7与TfR结合。有研究显示T7肽不仅仅介导药物跨血脑屏障转运,而且能增强抗癌药物在脑内的积累,因此是一个更有力的靶向脑内药物运载工具。Liu [18] 等利用高枝化多聚赖氨酸(DGL)包裹pORF-hTRAIL质粒,该质粒被释放出后能表达肿瘤坏死因子相关的诱导凋亡蛋白,促使肿瘤细胞凋亡,阿霉素通过谷氨酸连接在经T7肽修饰的DGL表面,构成了一个由T7肽修饰的化药联合基因治疗的DGL共转运系统。谷氨酸作为酸敏感性接头,当环境pH在7.4(血液中)时保持稳定,当T7肽将药物运输到脑部,被细胞摄取后,在细胞内环境pH接近5.0时释放阿霉素并驱动质粒表达。结果表明,经T7修饰的共转运系统能在体外被U87细胞大量摄取,体内实验进一步证明,经T7肽修饰的药物在脑内积累量远远大于经乳铁蛋白修饰的共运载系统,说明与乳铁蛋白相比,这种新型短肽具有更高的跨血脑屏障转运效率。Wang [19] 也发现经T7修饰的脂质体比单纯的脂质体具有更好的细胞摄取能力及脑内积累能力。
T7肽虽然具有好的脑靶向能力,但存在着受体饱和现象。TAT是人I型免疫缺陷病毒的反式激活蛋白,其所带的正电荷能促进TAT与细胞膜表面负电荷发生相互作用,促使细胞通透性增大。经TAT修饰的脂质体可以不依赖受体和转运子的方式高效转运入胞,且没有饱和现象。实验证明,T7与TAT双修饰的脂质体可以有效跨血脑屏障靶向脑部肿瘤 [20] ,且转运效率不受受体饱和作用影响。
2.3. LRP-1介导的转运系统
LRP-1是广泛表达于细胞表面的跨膜蛋白,由胞外区、跨膜区和胞质区组成。LRP-1在脑微血管内皮细胞上的表达量虽不及TfR,但其介导的跨膜效率是TfR的70倍。LRP-1的配体多达数十种,如载脂蛋白E、基质金属蛋白酶及丝氨酸蛋白酶等。加州大学研究人员 [21] 在新型迎球菌中发现了一种新型的金属蛋白酶Mpr1,可以帮助隐球菌跨过血脑屏障,感染脑部。未来Mpr1可能作为修饰基团,协助药物转运。
Demeule [22] 研究发现抑肽酶(Aprotinin)跨血脑屏障能力优于乳铁蛋白,并据此筛选出一类与Aprotinnin C-端氨基酸序列具有同源性的肽,命名为Angiopep家族。Angiopep是来源于Kunitz域家族的衍生肽,是LRP-1的配体且具有跨膜转运能力,通过将从中筛选出转运及脑内聚集能力最高的Angiopep-1,将其第七位的半胱氨酸残基突变成丝氨酸,得到了效率更高的Angiopep-2 (TFFYGGSRGKRNNFKTEEY),可用脑内药物递送系统。
经Angiopep-2表面修饰的递药系统可能具有更高的跨膜转运效率,并且具有大脑和胶质瘤双靶向作用。Yang [23] 等用Angiopep-2和tLyP-1(神经纤毛蛋白-1配体)双修饰的脂质体搭载VEGF的siRNA及多西紫杉醇,发现双修饰脂质体的细胞摄取率比单修饰或无表面修饰的脂质体更高,促细胞凋亡效果更好,体内实验也表明双修饰的脂质体具有更好的抑瘤效果。Angiopep-2-紫杉醇共轭物(ANG1005)的II期临床结果显示ANG1005可以通过乳腺癌复发性脑转移患者的血脑屏障,并保持活性。Angiopep-2与蛋白类大分子结合同样能发挥促转运作用,Yainoy [24] 通过原核表达系统表达了Angiopep-2与过氧化氢酶融合蛋白CAT-AP2,CAT-AP2保持了过氧化氢酶活性并能高效的被脑微血管内皮细胞摄取。我们在将Angiopep-2融合表达到单链Fab抗体的C端后,也发现单链Fab抗体体外渗透性得到极大提高,小鼠脑内跨血脑屏障转运速率及脑内分布量得到显著提升,说明Angiopep-2能显著促进大分子跨血脑屏障转运。
3. 结论
虽然真正进入临床实验阶段的跨血脑屏障递药系统还比较有限,但脑部递药研究的一系列新发现无疑为恶性胶质瘤治疗提供了一大助力,为疾病治疗提供了新的研究方向。除直接用配体修饰治疗药物,科学家利用一种新型合成肽载体K16ApoE [25] ,修饰药物,经静脉注射后,可以与血液中某种蛋白结合形成伪配体,再于血脑屏障细胞膜表面受体结合从而发挥转运功能。血脑屏障通透性可能受Mfsd2a基因调控,MFSD2A选择性的表达在血脑屏障相关的血管上,通过抑制内皮细胞上的胞吞作用阻止物质进行跨膜运输 [26] ,这项新发现也为跨血脑屏障途径提供了新的研究思路。
基金项目
Tfr抗体介导的海藻活性组分的抗脑胶质瘤活性及机制研究(SQ2017JSKF0027)-海南省创新能力建设计划(省属科研院所技术开发专项)。
文章引用
汪红艳,刘 煜. 受体介导靶向恶性脑胶质瘤递药系统的研究进展
Research Progress in Malignant Glioma Tar-geting Delivery System Mediated with Re-ceptors[J]. 药物资讯, 2018, 07(02): 27-32. https://doi.org/10.12677/PI.2018.72006
参考文献
- 1. Louis, D.N., Perry, A., Reifenberger, G., et al. (2016) The 2016 World Health Organization Classification of Tumors of the Central Nervous System: A Summary. Acta Neuropathologica, 131, 803-820. https://doi.org/10.1007/s00401-016-1545-1
- 2. Ostrom, Q. T., Gittleman, H., Stetson, L., et al. (2015) Current Understanding and Treatment of Gliomas. Springer International Publishing, Switzerland, 1-14.
- 3. Filley, A.C., Henriquez, M. and Dey, M. (2017) Recurrent Glioma Clinical Trial, CheckMate-143: The Game Is Not Over Yet. Oncotarget, 8, 91779-91794. https://doi.org/10.18632/oncotarget.21586
- 4. Lieberman, F. (2017) Glioblastoma Update: Molecular Biology, Diagnosis, Treatment, Response Assessment, and Translational Clinical Trials. F1000Research, 6, 1892. https://doi.org/10.12688/f1000research.11493.1
- 5. Stupp, R., Hegi, M.E., Mason, W.P., et al. (2009) Effects of Radiotherapy with Concomitant and Adjuvant Temozolomide versus Radiotherapy Alone on Survival in Glioblastoma in a Randomised Phase III Study: 5-Year Analysis of the EORTC-NCIC Trial. The Lancet Oncology, 10, 459-466. https://doi.org/10.1016/S1470-2045(09)70025-7
- 6. Hu, B., Wang, Q., Wang, Y.A., et al. (2016) Epigenetic Activation of WNT5A Drives Glioblastoma Stem Cell Differentiation and Invasive Growth. Cell, 167, 1281-1295. https://doi.org/10.1016/j.cell.2016.10.039
- 7. Tsutsumi, Y., Tsunoda, S., Kamada, H., et al. (1997) PEGylation of Interleukin-6 Effectively Increases Its Thrombopoietic Potency. Thrombosis and Haemostasis, 77, 168-173.
- 8. Gliadel (2018) Important Safety Imformation of GLIADEL Wafer. http://gliadel.com/hcp/index.php
- 9. Underwood, E. (2015) Ultrasound Therapies Target Brain Cancers and Alzheimer’s Disease. Science, 347, 1186-1187. https://doi.org/10.1126/science.347.6227.1186
- 10. Patel, M.M. and Patel, B.M. (2017) Crossing the Blood-Brain Barrier: Recent Advances in Drug Delivery to the Brain. Cns Drugs, 31, 109-133. https://doi.org/10.1007/s40263-016-0405-9
- 11. Zhang, Y. and Pardridge, W.M. (2006) Blood-Brain Barrier Targeting of BDNF Improves Motor Function in Rats with Middle Cerebral Artery Occlusion. Brain Research, 1111, 227-229. https://doi.org/10.1016/j.brainres.2006.07.005
- 12. Wang, Y.Y., Lui, P.C. and Li, J.Y. (2017) Receptor-Mediated Therapeutic Transport across the Blood-Brain Barrier. Immunotherapy, 1, 983-993. https://doi.org/10.2217/imt.09.75
- 13. 魏晓丽. 稳定性多肽介导跨血脑屏障的脑胶质瘤双重靶向递药系统研究[D]: [博士学位论文]. 上海: 复旦大学药学院, 2014.
- 14. O’Donnell, K.A., Yu, D., Zeller, K.I., et al. (2006) Activation of Transferrin Receptor 1 by c-Myc Enhances Cellular Proliferation and Tumorigene-sis. Molecular and Cellular Biology, 26, 2373-2386.
- 15. Hogemann-Savellano, D., Bos, E., Blondet, C., et al. (2003) The Transfer-ring Receptor: A Potential Molecular Imaging Marker for Human Cancer. Neoplasia, 5, 495-506.
- 16. 吴光勇. MIR分子影像学报告基因Tfr在胶质瘤中的表达及质粒的构建与鉴定[D]: [博士学位论文]. 湖南: 中南大学湘雅医院, 2007.
- 17. Chen, Y., Zhang, M., Jin, H., et al. (2017) Glioma Dual-Targeting Nanohybrid Protein Toxin Constructed by Intein-Mediated Site-Specific Ligation for Multistage Booster Delivery. Theranostics, 7, 3489-3503. https://doi.org/10.7150/thno.20578
- 18. Liu, S., Guo, Y., Huang, R., et al. (2012) Gene and Doxorubicin Co-Delivery System for Targeting Therapy of Glioma. Biomaterials, 33, 4907-4916. https://doi.org/10.1016/j.biomaterials.2012.03.031
- 19. Wang, Z., Zhao, Y., Jiang, Y., et al. (2015) Enhanced Anti-Ischemic Stroke of ZL006 by T7-Conjugated PEGylated Liposomes Drug Delivery System. Scientific Reports, 5, Article No. 12651. https://doi.org/10.1038/srep12651
- 20. Zong, T., Mei, L., Gao, H., et al. (2014) Enhanced Glioma Targeting and Penetration by Dual-Targeting Liposome Co-Modified with T7 and TAT. Journal of Pharmaceutical Sciences, 103, 3891-3901. https://doi.org/10.1002/jps.24186
- 21. Vu, K., Tham, R. and Uhrig, J. (2014) Invasion of the Central Nervous System by Cryp-tococcus Neoformans Requires a Secreted Fungal Metalloprotease. mBio, 5, e01101-e01114. https://doi.org/10.1128/mBio.01101-14
- 22. Demeule, M., Régina, A., Ché, C., et al. (2008) Identification and Design of Peptides as a New Drug Delivery System for the Brain. Journal of Pharmacology and Experimental Therapeutics, 24, 1064-1072.
- 23. Yang, Z.Z., Li, J.Q., Wang, Z.Z., et al. (2014) Tumor-Targeting Dual Peptides Modified Cationic Liposomes for Delivery of siRNA and Docetaxel to Gliomas. Biomaterials, 35, 5226-5239. https://doi.org/10.1016/j.biomaterials.2014.03.017
- 24. Yainoy, S., Houbloyfa, P., Eiamphungporn, W., et al. (2014) Engineering of Chimeric Catalase-Angiopep-2 for Intracellular Protection of Brain Endothelial Cells against Oxidative Stress. International Journal of Biological Macromolecules, 68, 60-66. https://doi.org/10.1016/j.ijbiomac.2014.04.021
- 25. Sarkar, G., Curran, G.L., Sarkaria, G.N., et al. (2014) Peptide Carrier-Mediated Non-Covalent Delivery of Unmodified Cisplatin, Methotrexate and Other Agents via In-travenous Route to the Brain. PLoS ONE, 9, e97655. https://doi.org/10.1371/journal.pone.0097655
- 26. Ben-Zvi, A., Lacoste, B., Kur, E., et al. (2014) MSFDA Is Critical for the Formation and Function of the Blood Brain Barrier. Nature, 509, 507-511. https://doi.org/10.1038/nature13324
NOTES
*通讯作者。