Hans Journal of Food and Nutrition Science
Vol.04 No.03(2015), Article ID:15964,8
pages
10.12677/HJFNS.2015.43013
Effect of L-Carnitine on Kazakh Sheep Hormones
Shuaiqi Sun, Yaosheng Yu, Shaoqi Cao, Zongsheng Zhao
College of Animal Science and Technology, Shihezi University, Shihezi Xinjiang
Email: 1850904007@qq.com
Received: Aug. 6th, 2015; accepted: Aug. 21st, 2015; published: Aug 31st, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In this experiment, by exogenously adding L-carnitine to Kazakh sheep, we observed the estrus behavior change of Kazakh sheep and analyzed the impact of added L-carnitine on hormones of Kazakh sheep. 16 Kazakh sheep were selected and randomly divided into two groups: experimental group and control group, which consisted of eight Kazakh sheep (1 year old), respectively. The sheep in experimental group fed on concentrate (200 g) that added L-carnitine (each sheep 75 mg/kg), the rest in control group fed only on concentrate (200 g). Blood samples were collected every day and stored serum, measured hormonal changes. The results show L-car- nitine dietary indirectly affects the MLT; E2; FSH; LH; P4 secretion of sheep and has an important impact on sheep breeding.
Keywords:Kazakh Sheep, L-Carnitine, Hormone
左旋肉碱对哈萨克绵羊激素的影响
孙帅琪,于要升,曹少奇,赵宗胜
石河子大学动物科技学院,新疆 石河子
Email: 1850904007@qq.com
收稿日期:2015年8月5日;录用日期:2015年8月21日;发布日期:2015年8月31日

摘 要
本试验通过对哈萨克绵羊外源性添加L-肉碱(左旋肉碱),观察哈萨克绵羊发情行为变化,分析添加L-肉碱对哈萨克绵羊激素的影响,试验选用16只1周岁哈萨克绵羊,将试验羊群随机分成2组:实验组与对照组,每组8只哈萨克绵羊(1岁)。实验组在精料(200 g)中添加肉碱(每只羊75 mg/kg),对照组只饲喂精料(200 g),每天采集血样并分离血清保存,测定激素变化。结果表明:饲料中添加的L-肉碱间接地影响了绵羊体内MLT (褪黑素);E2 (雌二醇);FSH (促卵泡素);LH (促黄体生成素);P4 (孕激素)的分泌量并在绵羊繁殖方面产生了重要影响。
关键词 :哈萨克绵羊,L-肉碱,激素

1. 引言
肉碱(carnitine)又称肉毒碱、维生素BT、卡尼汀,化学名为β-羟基-γ-三甲胺丁酸,是广泛存在于自然界中的一种高极性、小分子季胺类化合物。L-肉碱外观呈白色结晶或类白色结晶性粉末,无臭、无味。易溶干水,微溶于乙醇,难溶于有机溶剂,比旋光度−29℃~−32℃,pH 5.5~9.5之间,呈弱酸性,性质稳定,熔点在210℃~212℃之间,具较强吸湿性和水溶性。在水中的溶解度约为2500 g/L [1] 。早在20世纪初,1905年俄国科学家Krimberg和Gulewitsch首次从牛肉的抽浸汁提取物中发现了左旋肉碱。1927年其分子结构被Sendju和Tomita证实。1948年Feaenkel在大黄粉幼虫中发现了一种生长因子将其命名为维生素Vbt。1952年美国的Carter从酵母、动物肝脏中获取了肉碱结晶体,证实了L-肉碱是维生素Vbt,将其称为Carnitine。1953年起美国化学文摘将左旋肉碱划为维生素Vbt索引栏目下。左旋肉碱在80年代在国外上市可作为商品。到了1984年美国FDA发表声明指出L-肉碱其实是一种重要的营养强化剂。国外较早期已把左旋肉碱作为一种饲料添加剂应用于畜牧业,近几年国内对L-肉碱的研究逐渐成为畜牧、医药、美容和食品业等专家的关注 [2] 。本试验通过对哈萨克绵羊外源性添加L-肉碱(左旋肉碱),分析添加L-肉碱提高了MLT的分泌量,其控制促性腺激素及性激素的合成、分泌及繁殖周期等;同时显著提高了FSH和LH的分泌量,促进卵巢的卵泡发育成熟和引起排卵并生成黄体在饲料中添加左旋肉碱,促进绵羊发情,提高繁殖率。
2. 材料与方法
2.1. 材料
2.1.1. 饲料来源
L-肉碱购买于宣城晶瑞新材料有限公司,其纯度在99%。
育肥羊的精料补充料(671)来自于新疆天康畜牧生物技术股份有限公司。育肥料的主要成分:玉米、豆粕、棉粕、葵粕、石粉、磷酸氢钙、食盐、维生素、微量元素、氨基酸。饲料营养成分水平见下表1。
2.1.2. 试验动物
构建试验所需的试验羊群哈萨克绵羊16只,试验羊群在进入实验站之前,均隔离一个星期,并对绵羊的体况进行观察,试验开始之前做了相关疾病的检测,以保证试验安全顺利的进行。
将试验羊群随机分成2组,按性别再分成实验组和对照组,每组8只哈萨克绵羊(1岁)。本试验分为
Table 1. The nutrient level of feed
表1. 饲料营养成分水平
育肥羊的精料补充料为每千克饲粮提供VA 4000 IU,VD3 1000 IU,铁30 mg,铜5~20 mg,锌30~120 mg,锰20 mg。
预试期(两天)和试验期(十四天)。预试期开始前,每只绵羊称重,编号,并抽取3 ml左右的血液样本。实验组在精料(200 g)中添加肉碱(每只羊75 mg/kg),对照组只饲喂精料(200 g),以外部圈养的方式进行试验,饲养管理按常规进行。
2.1.3. 主要试剂
激素检测:E2;MLT;FSH;LH;P4等用酶联免疫测定(ELISA)试剂盒检测,这些试剂盒购买于上海蓝基生物科技有限公司。
主要仪器与设备
仪器:10 μL, 20 μL, 100 μL, 200 μL, 1000 μL的移液枪;排枪;真空采血管;离心管;
设备:Z36HK大容量高速冷冻离心机,THZ-C台式恒温振荡器,RT-1904C半自动生化仪,BCD-238DF型冰箱,酶标仪。
2.2. 方法
2.2.1. 血样采集
每天早晨在9:00~10:00由颈静脉采集不抗凝血一次,每次3 ml,共连续采集20天。倾斜放置至血液凝集,再在37℃条件下静止直至血清析出(10 h左右),以3000 r/min离心15 min,收集血清分装与离心管中,标记好号码后,−20℃低温保存置冰箱备用(在试验开始前采集一次血液,正式开始做试验后每天都采集血液,并采集20天)。
2.2.2. 绵羊ELISA测定
ELISA测定的项目有雌激素(E2);褪黑激素(MLT);促卵泡素(FSH);促黄体素(LH);孕激素(P4)。
以雌激素为例,其他激素除了添加的量不同,步骤类同。
实验前的准备:所有试剂都必须在使用前达到室温,使用后请立即按照说明书要求保存。洗液的配制按1:100的比例配制洗液备用。
操作步骤:
① 取出试剂盒,于室温(20℃~25℃)放置30分钟;将血清放置溶解并达到室温时待用。
② 取出酶标板,按照标准品的次序分别加入50 µL的标准品溶液于空白微孔中。
③ 空白孔中加入50 µL样品,空白对照加入50 µL PBS (pH 7.0~7.2)。
④ 在各孔中加入50 µL的酶标记溶液(不含空白对照孔)。
⑤ 将酶标板用封板膜密封后,37℃孵育反应1小时(在孵育箱中保持稳定的温度与湿度)。
⑥ 充分清洗酶标板5次,保持各孔有充足的水压(浓缩洗涤液以1:100的比例与蒸馏水稀释)。
⑦ 酶标板洗涤后用吸水纸彻底拍干。
⑧ 各孔中加入显色剂A 50 µL。
⑨ 各孔中加入显色剂B 50 µL。
⑩ 37℃下避光反应10~15分钟。
⑪ 各孔加入50 µL终止液,终止反应。
2.2.3. 数据处理
各项指标的数据均用平均数 ± 标准误表示。用SPSS for Windows 13.0软件进行单因素方差分析。
数据通过SPSS13.0和EXCEL等统计软件处理,计算以上五种激素在血清中的平均水平和标准差,并做相应检验分析。
3. 结果分析
3.1. 绵羊血液中MLT、E2、LH、FSH、P4的变化规律及母羊的发情表现
3.1.1. 血液中MLT、E2、LH、FSH、P4的变化规律
图1为母羊在发情季节25天内血清MLT浓度测定结果。肉碱组25天内血清中MLT浓度变化范围为(52.96 ± 47.61~2344.13 ± 974.28) pg/mL,平均值为(838.48~459.18) pg/mL。MLT的分泌量从第1天至第3天呈直线式增长,并达到最大值(2344.13 ± 974.28) pg/mL,之后就迅速下降直到第9天开始平稳浮动。而对照组MLT在第2天时达到顶峰之后在第3天突降,在第4天又增高直到第9天后达到平稳。总的说来,除去第3天对照组与肉碱组呈相反趋势外,整体变化趋势相同。
图2为母羊在发情季节25天内血清E2浓度测定结果。肉碱组25天内血清中E2浓度变化范围为(1184.67 ± 295.20~2548.30 ± 22.60) pg/mL,平均值为(1695.88 ± 258.89) pg/mL,第4天时,肉碱组血清中E2浓度为最低为(1184.67 ± 295.20) pg/mL,前7天E2浓度保持较低水平,在8天到11天之间逐渐上升达到试验期的最高峰(2548.30 ± 22.60) pg/mL,之后开始下降,但整个周期肉碱组的E2浓度处于上升趋势。在整个试验期对照组的E2分泌量呈波动式,在第9天时分泌量最高(2394.19 ± 195.34) pg/mL,但整个周期E2浓度处于下降趋势。
图3为母羊在发情季节25天内血清LH浓度测定结果。肉碱组25天内血清中LH浓度变化范围为(2.16 ± 1.05~5.47 ± 0.88) ng/mL,平均为(4.36 ± 1.55) ng/mL。肉碱组从开始就成增长趋势,在第4天时达到最大分泌量(5.47 ± 0.88) ng/mL,之后就开始下降在第8天时分泌量最低(2.16 ± 1.05) ng/mL,之后又一次增长,从整个试验期分析无明显变化。
图4为母羊在发情季节25天内血清FSH浓度测定结果。肉碱组25天内血清中FSH浓度变化范围为(1.13 ± 1.06~4.92 ± 5.87) ng/mL,平均值为(2.83±3.22) ng/mL。在整个试验期FSH呈脉冲式分泌,从整个周期的分泌量来看无明显变化,但肉碱组FSH的分泌量显著高于对照组。对照组FSH的分泌量变化基本稳定,且没超过1 ng/mL。
图5为母羊在发情季节25天内血清P4浓度测定结果。肉碱组25天内血清中P4浓度变化范围为(16.46 ± 2.14~26.67 ± 11.40) ng/mL,平均值为(19.05 ± 2.59) ng/mL。肉碱组P4的分泌量在第2天达到最大值(26.67 ± 11.40) ng/mL之后基本上处于平稳的波动。对照组P4在第3至5天时分泌量特别高之后处于平稳的波动范围。但从图的整体比较,在第1、6、9天时,肉碱组与对照组的分泌量基本一致,其余天数不是肉碱组的分泌量高于对照组,就是对照组的分泌量高于肉碱组。
3.1.2. 母羊的发情表现(阴门变化)

Figure 1. Comparison of the MLT changes in L-carnitine group and control group
图1. L-肉碱组与对照组MLT的变化比较

Figure 2. Comparison of the E2 changes in L-carnitine group and control group
图2. L-肉碱组与对照组E2的变化比较
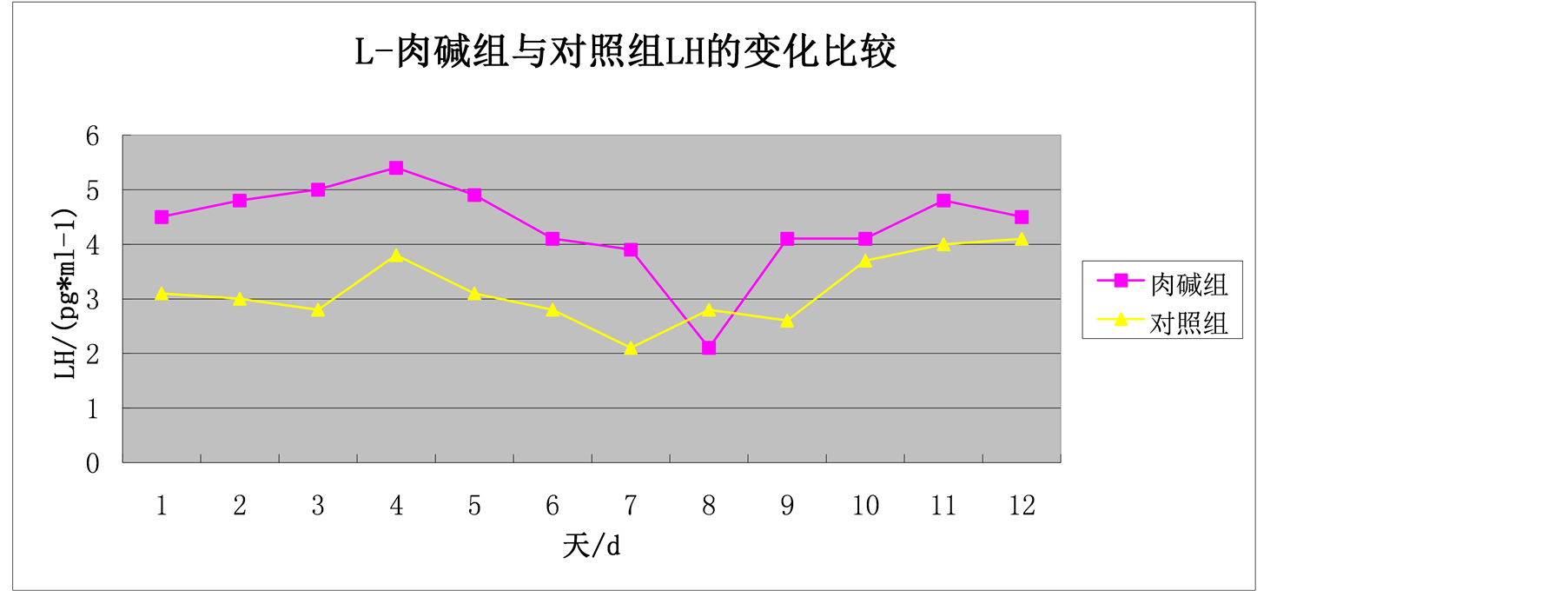
Figure 3. Comparison of the LH changes in L-carnitine group and control group
图3. L-肉碱组与对照组LH的变化比较

Figure 4. Comparison of the FSH changes in L-carnitine group and control group
图4. L-肉碱组与对照组FSH的变化比较
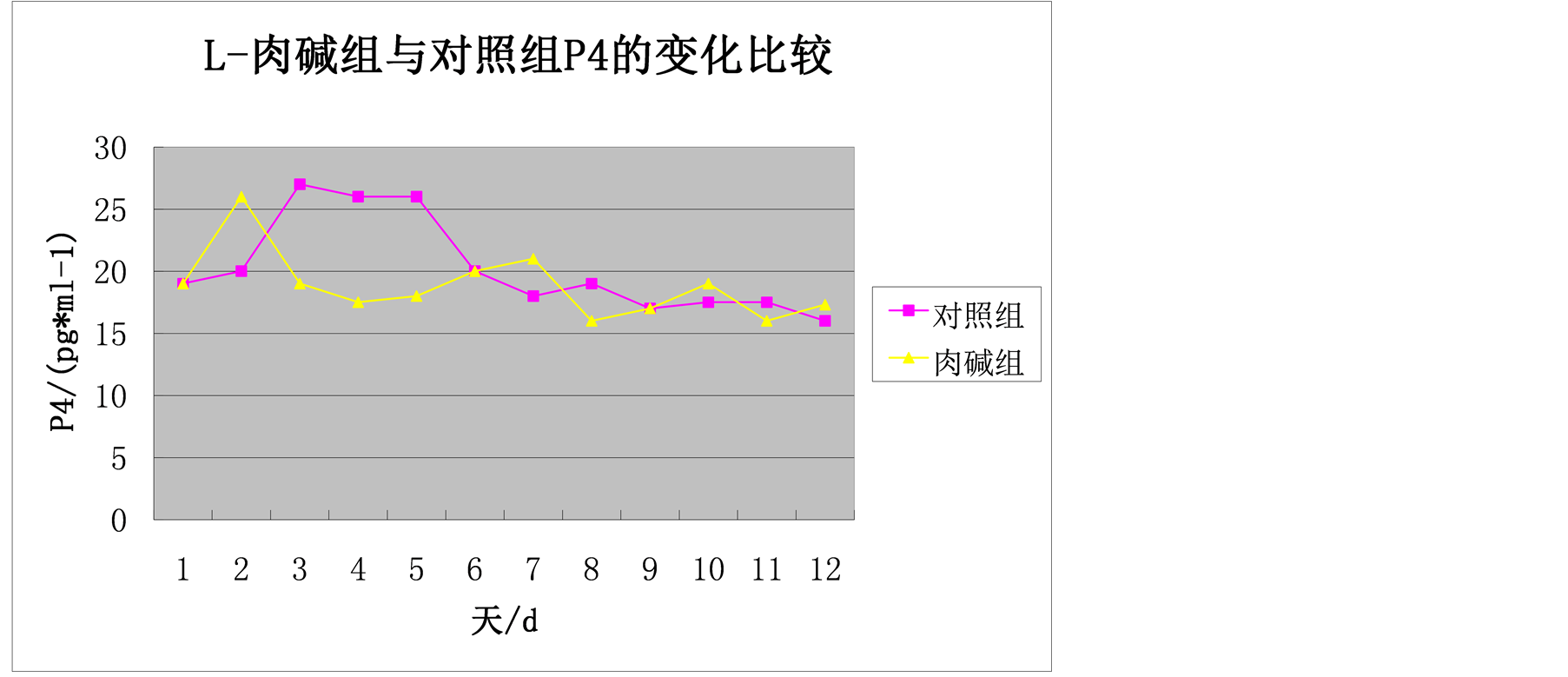
Figure 5. Comparison of the P4 changes in L-carnitine group and control group
图5. L-肉碱组与对照组P4的变化比较

Figure 6. The changes of vulva in L-carnitine group
图6. 肉碱组阴门变化

Figure 7. The changes of vulva in control group
图7. 对照组阴门变化
4. 讨论
L-肉碱对绵羊激素分泌的影响
激素(Hormone)是由一些特定的器官或细胞在特定的刺激(神经的或体液的)作用下分泌到体液中并由血液循环运输到靶器官,产生特定效应的特异性化学物质。
MLT又名黑色紧张素或褪黑素。主要由松果体分泌,MLT主要调节动物的青春期发育,控制促性腺激素及性激素的合成、分泌及繁殖周期等,尤其对繁殖活动与光周期相关的动物,其作用更明显。MLT抑制下丘脑GnRH的释放,延缓未成年动物的性成熟,降低GnRH诱发的排卵效应,阻断由绒毛膜促性腺激素引起的排卵与子宫增殖反应,缩短黄体寿命,降低孕酮含量。本试验中,饲料中添加L-肉碱在试验周期内总体趋势上降低了MLT的分泌量,其与对照组的变化趋势相似。
雌激素(Estrogen, E)是由动物的卵巢、睾丸、胎盘或肾上腺皮质所产生的十八碳固醇类激素。母畜体内分泌的雌激素主要有E2、E3两种形式,具有动情素作用,其含量可以影响动物的发情,但主要以E2的作用为主 [3] 。研究表明,母羊在发情时血浆雌激素浓度达到高峰,之后会迅速降低 [4] 。由于E2主要来源于卵巢的卵泡内膜细胞和卵泡颗粒细胞,说明充足、全面的营养水平对生殖细胞分泌E2具有较好的作用。而L-肉碱作为一种新型的绿色营养添加剂,将可以发挥作用。具体的作用原理还有待进一步研究。
促黄体素(Luteinizing-hormone, LH)是由脑垂体前叶嗜碱性细胞分泌的,它作用于成熟的卵胞,能引起排卵并生成黄体,还可促进黄体、内荚膜和间质细胞分泌动情素。LH具有促进卵泡成熟和排卵,刺激卵泡内膜细胞产生雌激素,促进排卵后的颗粒细胞黄体化,维持黄体细胞分泌孕酮的作用。本试验中,饲料中添加L-肉碱显著提高了LH的分泌量。
促卵泡激素(Follicle-stimulating hormone, FSH)是一种由脑垂体合成并分泌的激素,属于糖基化蛋白质激素。研究表明,促卵泡激素体内是很重要的激素之一,调控着发育、生长、青春期性成熟,促进卵巢卵泡饿生长,促进卵泡颗粒细胞的增生、雌激素合成,对卵泡腔形成后的卵泡发育至成熟起着决定性作用,促卵泡激素和黄体化激素在生殖相关的生理过程中协同发挥着至关重要的作用。FSH通过FSH受体调节卵巢卵泡的生长和雌二醇的分泌。有研究表示,营养物质可能对大脑神经系统进行正向调控,通过神经反射交互作用来刺激垂体前叶分泌FSH,降低卵泡成熟期闭锁卵泡的数量,促进卵巢的卵泡发育,提高了母羊排卵的数量、受胎数量,从而对母羊的产羔率起到了一定的提高作用。从本试验中可知,饲料中添加L-肉碱显著提高了FSH的分泌量。
孕激素(Progestogen, P)主要来源于卵巢的黄体细胞,在黄体期早期或妊娠初期,促进子宫内膜增生,使腺体发育功能增强;在妊娠期间,抑制子宫的自发活动,降低子宫肌层的兴奋作用,还可以促进胎盘发育,维持正常妊娠。大量孕酮抑制性中枢使动物无发情表现,但少量孕酮与雌激素协同作用可以促进发情表现。另一方面孕激素与促乳素有协同作用,促进乳腺腺泡发育。本试验中,饲料中添加L-肉碱对P4的分泌量作用不是很明显。
分析试验数据得出结论,在试验期,饲料中添加L-肉碱提高了MLT的分泌量,其控制促性腺激素及性激素的合成、分泌及繁殖周期等;同时显著提高了FSH和LH的分泌量,但抑制了E2和P4的分泌量。在羊的静脉注射试验中发现,给羊静脉注射左旋肉碱后可降低血液中氨的浓度,同时也促进了血糖的代谢 [5] 。在母羊怀孕最后一个月每周皮下静脉注射左旋肉碱,结果显示,肉碱可能通过提高血糖浓度来降低妊娠母羊酮病发病率 [6] 。这两个试验与本试验实验结果相符,表明在饲料中添加左旋肉碱对绵羊的血糖是有影响的,并且血糖的浓度也影响着发情状况。试验表明,在母羊基础日粮中同时添加左旋肉碱和长链脂肪酸钙盐,卵巢排卵时卵泡的数量和大小显著增大,排卵率升高 [7] 。本试验结果表明,在饲料中添加左旋肉碱后,显著提高了FSH和LH的分泌量,对于绵羊发情起着直接作用。
5. 结论
1) 在试验期,饲料中添加L-肉碱提高了MLT的分泌量,其控制促性腺激素及性激素的合成、分泌及繁殖周期等;同时显著提高了FSH和LH的分泌量,但抑制了E2和P4的分泌量。
2) 血糖是通过调节GnRH的释放来影响母畜的繁殖能力,饲料中添加L-肉碱使血糖浓度增加,促使LH的分泌量增加,促进绵羊的发情和黄体的形成。
文章引用
孙帅琪,于要升,曹少奇,赵宗胜. 左旋肉碱对哈萨克绵羊激素的影响
Effect of L-Carnitine on Kazakh Sheep Hormones[J]. 食品与营养科学, 2015, 04(03): 92-99. http://dx.doi.org/10.12677/HJFNS.2015.43013
参考文献 (References)
- 1. Nolan, C.J., Neuendorff, D.A., Godfrey, R.W., Harms, P.G., Welsh, T.H., McArthur, N.H. and Randel, R.D. (1990) In-fluence of dietary energy intake on prepubertal development of Brahman bulls. Journal of animal Science, 68, 638- 640.
- 2. 邓跃林, 冯定远, 张常明 (1999) 左旋肉碱营养的研究进展及其在彝猪生产中的应用. 国外畜牧学, 6, 17-21.
- 3. 任巧玲, 马强 (2006) 雌激素及其对动物生殖功能的影响. 河南农业科学, 4, 15.
- 4. 郎侠 (2009) 不同断奶日龄对母羊体况和雌激素分泌的影响. 家畜生态学报, 30, 21-24.
- 5. Chapa, A.M., Fernandez, J.M., White, T.W., Bunting, L.D., Gentry, L.R. and Ward, T.L. (1998) Influence of intravenous L-carnitine administration in sheep preceding an oral urea load drench. Journal of Animal Science, 76, 2930- 2937.
- 6. Rabie, M.H., Szilagyi, M. and Gippert, T. (1997) Effects of dietary L-carnitine supplementation and protein level on performance and degree of meatness and fatness of broilers. Acta Biologica Hungarica, 48, 221-239.
- 7. El-Shahata, K.H., and Abo-El maaty, A.M. (2010) The effect of dietary supplementation with calcium salts of long chain fatty acids and/or L-carnitine on ovarian activity of Rahmani ewes. Animal Reproduction Science, 117, 78-82. http://dx.doi.org/10.1016/j.anireprosci.2009.04.005
