Hans Journal of Food and Nutrition Science
Vol.07 No.02(2018), Article ID:24996,9
pages
10.12677/HJFNS.2018.72012
Hepatoprotective Effects of Ganoderma lucidum on Carbon Tetrachloride-Induced Chronic Liver Disease in Rats
Chieh-Ning Chiu1, Ting-Wei Lin1, Wei-Li Lin2, Wen-Chuan Lin2, Chin-Chu Chen1,3,4,5*
1Grape King Bio Ltd., Taoyuan Taiwan
2Department of Medicine, China Medical University, Taichung Taiwan
3Institute of Food Science and Technology, National Taiwan University, Taipei Taiwan
4Department of Food Science, Nutrition, and Nutraceutical Biotechnology, Shin Chien University, Taipei Taiwan
5Department of Bioscience Technology, Chung Yuan Christian University, Taoyuan Taiwan
Received: Apr. 28th, 2018; accepted: May 15th, 2018; published: May 22nd, 2018

ABSTRACT
The study is based on Ganoderma lucidum mycelium powder and Ganoderma lucidum fruiting body extract made of Ganoderma lucidum powder, to explore its effect on carbon tetrachloride (CCl4) hepatitis. Carbon tetrachloride (20%, 0.2 ml/100g body weight) is administered twice a week for a total of eight weeks. One day prior to the administration of carbon tetrachloride, the rats were orally administered with Ganoderma lucidum orally once daily until the end of the experiment. Ganoderma lucidum powder on the 1, 3, 6, 8 weeks of carbon tetrachloride increased serum AST, and ALT values significantly reduced. Carbon tetrachloride-induced chronic hepatitis in rats significantly increased the weight of the spleen, reduce the liver protein content, increase liver lipid peroxidation and collagen content. Ganoderma lucidum powder significantly increases the protein content, and reduces the degree of lipid peroxidation and collagen content. From these results, it is clear that Ganoderma lucidum powder can alleviate carbon tetrachloride-induced chronic hepatitis in rats.
Keywords:Ganoderma lucidum, Carbon Tetrachloride, Chronic Liver, Hepatoprotective Effects
灵芝对四氯化碳诱导大鼠慢性肝炎之 护肝功效评估
邱婕宁1,林定威1,林维莉2,林文川2,陈劲初1,3,4,5*
1葡萄王生技股份有限公司,台湾 桃园
2中国医药大学医学系,台湾 台中
3国立台湾大学食品科技研究所,台湾 台北
4实践大学食品营养与保健生技学系,台湾 台北
5中原大学生物科技学系,台湾 桃园
收稿日期:2018年4月28日;录用日期:2018年5月15日;发布日期:2018年5月22日

摘 要
本试验是以灵芝菌丝体粉及灵芝子实体萃取物制成之灵芝复合品,探讨其对四氯化碳(CCl4)肝炎的功效。四氯化碳(20%、0.2 ml/100g body weight)每星期投予两次,共八星期。大鼠于四氯化碳投予前一天,每日经口头喂予灵芝粉一次,直至实验结束。灵芝产品对第一、三、六、八周四氯化碳所升高的血清AST及ALT值由明显降低作用。四氯化碳诱发大鼠慢性肝炎明显增加脾脏重量,减少肝脏蛋白质含量,增加肝脏脂质过氧化程度及胶原蛋白含量。灵芝产品明显增加蛋白质含量,及降低脂质过氧化程度和胶原蛋白含量。由这些结果明确表示,灵芝粉可以减轻四氯化碳所诱发的大鼠慢性肝炎。
关键词 :灵芝,四氯化碳,慢性肝炎,护肝

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
灵芝(Ganoderma lucidum)又名赤芝,为担子菌多孔科(polyporaceae)的高等真菌,型态为伞状,坚硬,木质,菌盖肾形或半圆形,紫褐色有漆状光泽。其作为药用已具有千年的历史,从古至今为广泛使用的传统珍贵药材,被历代医药家视为滋补强壮、扶正固本的神奇珍品。许多古籍中均有提及药理活性,《神农本草经》始纪载灵芝「养命以应天,无毒,多服久服不伤人,轻身益气,不老延年」;《本草纲目》指出「苦、平、无毒。解胸胃郁结,补中益气,使人神志清明」,都意指灵芝无毒,适合长期食用,以渐进的方式,调节强化体质,维持身体健康。
灵芝以热带和亚热带地区居多,常寄生于栎及其他阔叶树根部。由于野生子实体生长周期长,易受气候影响产量与质量不稳定,在1950年代开启了大量人工培养技术的发展。如今,在日本、中国、美国,台湾以及亚洲等地皆有进行商业化种植。除了子实体栽培外,不少学者也利用高密度发酵培养菌丝体,透过培养基组成、pH与溶氧等发酵工艺提升灵芝活性物质,并广泛应用于医药及保健食品行业。近几十年来,陆续在中国与日本的临床研究发现,灵芝子实体及菌丝体对冠心病、心绞痛、高血脂症、支气管炎、神经衰弱及肝炎等慢性疾病有显着的疗效,证实了古籍中灵芝的药用价值也引发灵芝学术研究的热潮。灵芝的活性成分非常丰富,主要成分为多醣(polysaccharides)、三萜类(triterpenoids)、核苷酸(nucleotides)、小分子蛋白(LZ-8)、胺基酸(Amino acids)、多种微量元素和多肽类化合物(peptides)等 [1]。药理活性成分广泛,包含免疫调节、抗肿瘤 [2] 保护肝功能 [3] [4] 、抗氧化 [4] [5] [6] [7] 、降血脂 [8] 以及抗衰老 [9] 等多项生物活性。
灵芝的保肝功能在动物实验已有多起报告,灵芝的水或乙醇抽出物对四氯化碳引起的大鼠或鼷鼠急性肝炎有保护作用 [9] [10] [11]。已有文献指出灵芝所含的总三萜类能抑制四氯化碳及氨基半乳糖(D-galactosamine)所引起的肝损伤及急性肝炎 [12] [13] ,灵芝烯酸(ganoderenic acid) A、B或C2对四氯化碳的急性肝炎有保护作用 [14] ,灵芝菌丝体的热水及乙醇抽出物分离灵芝的三萜有抑制肝癌细胞的作用 [15] ,另一方面,也有报告指出灵芝多醣体具结抗大鼠胆道阻塞所引起的肝纤维化 [3] 及四氯化碳引起的肝损伤 [16]。Gao氏等人指出灵芝保肝作用机转有下列几个可能的途径,具有清除自由基的能力、抑制β-glucuronidase、抗纤维化、抗病毒活性、调节NO的产生、维持肝细胞内盖的恒定及免疫调节作用 [17]。
本试验依照台湾卫福部公告的评估方法 [18] ,使用四氯化碳(CCl4)诱发大鼠慢性肝炎的模式以评估灵芝菌丝体及灵芝子实体萃取物复合品的护肝功能,以做为日后产品开发提供预防保健之依据。
2. 材料与方法
2.1. 灵芝液态发酵条件及子实体萃取物制备方法
菌种(G. lucidum) (BCRC36041)购自台湾新竹市食品工业发展研究所生物资源保存及研究中心。在无菌操作台,将PDA (Potato dextrose agar)平板之灵芝菌丝,取1 cm正方大小菌块接种内含于1 L培养基的2 L摇瓶中,25℃,120 rpm中震荡一周,后接入500 L发酵槽培养一周,发酵条件相同,再接入50吨发酵槽中,40 rpm搅拌,0.5 vvm的通气及30℃培养7天后,得灵芝菌丝体发酵液,经干燥后得灵芝菌丝体粉。培养基使用2%黄豆粉、2%蔗糖及0.5%酵母抽出物,pH 4.0。灵芝子实体经纯水于100℃萃取30分钟后,将萃取液干燥得灵芝子实体萃取物。而后将上述样品存于4℃备用。
2.2. 实验动物及材料
使用Wistar大鼠,购自国科会国家实验动物繁殖及研究中心,饲养于中国医药大学医学系动物室。饲养环境为22℃ ± 2℃,光照12小时亮、12小时暗。饲料使用福寿牌老鼠饲料,饮水经逆渗透处理。动物适应二周后筛选出健康大鼠70只,在试验物质投予第一天,大鼠依体重大小,分成适当重量群,随机分组,除正常控制组10只外,其余5组每组12只。
2.3. 试验物质配制
灵芝菌丝体粉及灵芝子实体萃取物之复合品(以下简称灵芝粉)为本次试验物质。灵芝粉的建议量一人每天食用2.52 g (体重70 Kg),大鼠剂量依据大鼠与人的表面积比换算比率计算。因此将灵芝粉之低、中、高剂量以去离子水分别配制成22.5、67.5及180.0 mg/ml之悬浮液(分别为人体剂量1、3、8倍),经口头给予,投予体积为每100公克大鼠体重投予1毫升。控制组大鼠给予同体积的去离子水,对照药物silymarin (Sigma)悬浮于0.5% carboxmethyl cellulose (CMC),配制浓度为20 mg/ml。
2.4. 大鼠喂养及试验方法
试验物质于第一次四氯化碳溶液投予前一天开始投予,而后每日投予直至大鼠牺牲前一日止。每周两次经口投予四氯化碳溶液(溶于20%橄榄油溶液,每次投予量为0.2 ml/100g body weight),于第一次及第三次投予时,大鼠先绝食一晚,其他投予时不绝食。于四氯化碳投予后满一、三、六周时,大鼠在乙醚麻醉下尾动脉抽血,供血液生化值检定。第八周采血也同时牺牲大鼠,迅速取肝脏及脾脏,以冰冷生理食盐水洗净后,吸干水份,秤重。最大液肝脏分成两部分,相同的部位分别为浸于10%中性福尔马林溶液,供病理切片使用,与称重后在100℃完全烘干供胶原蛋白含量测定。其余肝脏分装4袋,储存于−80℃备用。每周称重一次,作为当周投予试验物质的体重依据。
2.5. 血清生化学试验
血液取得后,静置待其凝固后,以4700 rpm离心15分钟,取血清供生化检验用。第一、三周只进行alanine aminotransferase (AST)及aspartate aminotransferase (ALT)检验。第六、八周除AST、ALT外,增加白蛋白(albumin)的测定。检验使用市售检验试剂 (Roche),
以血清生化自动分析仪测定(COBAS MIRA)。
2.6. 肝脏组织其他指标的测定
肝组织Glutathione(GSH)的测定依据Sedlak and Lindsay [19] 的方法,使用5,5’-dithiobis-(2-nitrobenzoic acid)呈色,412 nm测吸亮度;脂质过氧化测定依据Ohkawa等人 [20] 的方法,在532 nm测吸光值。肝脏蛋白质的测定使用脂质过氧化测定的肝组织上清液,以市售蛋白质测定试剂Coomassie Blue(KenlirIndus.;USA)呈色,于540 nm测吸光值,以牛血清白蛋白为标准品;肝组织胶原蛋白(Hydroxyproline)的测定参照Neuman and Logan [21] 的方法,肝组织水解后加H2O2氧化,再以p-dimethylaminobenzoaldehyde呈色,于540 nm测吸光值;测定hydroxyproline的肝组织湿重减去干燥后的肝脏重量即为肝脏含水量;肝组织之前处理采用Xia等人 [22] 的方法,分别使用市售Superoxide dismutase(SOD)活性检验试剂Ransod(RANDOX Lab. Ltd UK)及Glutathione peroxidase (GSH-Px)活性检验试剂Ransel(RANDOX Lab. Ltd UK),依试剂说明步骤测定SOD及GSH-Px;Catalase(CAT)活性测定依据Aebi [23] 的方法测定。
2.7. 病理检验
组织经福尔马林固定后,进行石蜡包埋及切片制作,使用两种染色法,一为一般的H.E stain(He matoxylin and eosin stain),另一种为胶原蛋白的特殊染色(Sirius red stain)。病理学比较依照台湾卫生福利部公告的护肝功能评估办法,将肝脏的损伤或纤维化分为四个等级,加以评分。为了使病变的分客观,病理切片委托台湾中国医药大学医学系组织学曾昌衍教授判读评分。
2.8. 统计分析
除了病理判读数据外,其他实验所得数据均以单尾变异数分析(one-way analysis of variance),并进行Dunnet测试,以p < 0.05认为有显着意义。病理判读依据结果以Kruslall Wallis H变异数分析,而后进行Mann-Whitney U test检定,以p < 0.05认为有显着意义。
3. 结果
3.1. 体重变化
如表1所示,投予CCl4组,于第一周至第四周平均体重与正常控制组比较有下降的倾向,但没有达到统计意义,第五周至第八周的平均体重较正常控制组低。灵芝粉或silymarin处理之大鼠体重与CCl4组比较没有明显差异。
3.2. 对血清AST、ALT及albumin值的影响
如表2所示,CCl4组第一、三、六及八周的AST、ALT值均显着高于控制组。于第一、三、六、八周,灵芝粉之低、中及高剂量组之AST、ALT值低于CCl4组。silymarin处理之大鼠对第一至第八周的
Table 1. The effects of GL powder on the body weight of the CCl4-induced rats
表1. 灵芝粉对CCl4诱发大鼠慢性肝炎的体重变化
1A:control组,B:CCl4组,C:CCl4 + 低剂量灵芝粉组,D:CCl4 + 中剂量灵芝粉组,E:CCl4 + 高剂量灵芝粉组,F:silymarin组。2所有数据均以Mean ± S.E.表示,#表示与control组比较P < 0.05, ##表示与control组比较P < 0.01。
Table 2. The effects of GL powder on serum AST, ALT activities and albumin in the CCl4-induced rats
表2. 灵芝粉对CCl4诱发大鼠慢性肝炎血清AST及ALT值的影响
1A:control组,B:CCl4组,C:CCl4 + 低剂量灵芝粉组,D:CCl4 +中剂量灵芝粉组,E:CCl4 +高剂量灵芝粉组,F:silymarin组。2所有数据均以Mean ± S.E.表示,###表示与Control组比较P < 0.001,*表示与CCl4组比较P < 0.05,**表示与CCl4组比较P < 0.01,***表示与CCl4组比较P < 0.001。
AST、ALT值皆没有影响。而大鼠投予CCl4后,第六、八周的血清albumin值较控制组低。灵芝粉高剂量组处理之大鼠可以增加第六周血清albumin值;灵芝粉之低、中及高剂量组于第八周albumin值的下降也有改善作用。silymarin组对第六、八周albumin值没有改善作用。
3.3. 肝脏和脾脏重量的影响
如表3所示,CCl4组,最后肝及脾脏重量较控制组高。灵芝粉和silymarin处理组的肝脏重量与CCl4组较没有差异。而灵芝粉之三个剂量处理组其脾脏重量明显低于CCl4组;中、高剂量组的每克肝脏含水量较CCl4组低。silymarin组对大鼠肝脏、脾脏重量及含水量皆没有影响。
3.4. 肝脏组织其他指标的影响
如表4所示,所有组别对glutathione含量皆没有影响;灵芝粉之三个剂量处理组的肝脏MDA含量明显低于CCl4组,即降低脂质过氧化程度;灵芝粉中、高剂量组,其肝脏可溶性蛋白明显增加;高剂量组其肝脏hydroxyproline含量明显低于CCl4组及能有意义提升肝脏SOD活性。silymarin对CCl4引起肝脏可溶性蛋白质含量减少、hydroxyproline含量增加及三种酵素的活性降低皆没有影响。
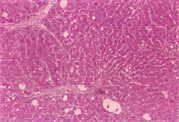
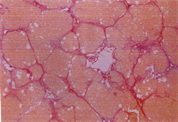
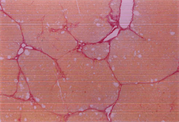
3.5. 病理变化
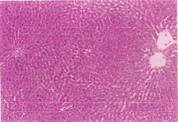
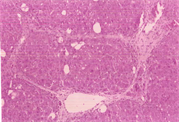
如表5及图1和图2所示,以H.E染色可以明显看出脂肪沉积及组织变性的情形(图1(b))。以Sirius red染色,在中央静脉区及门脉趋明显出现纤维化情形(图2(b))。灵芝粉之中、高剂量组的组织变性及胶原蛋白沉积较CCl4组轻(表5)。
4. 讨论
灵芝粉对四氯化碳诱发大鼠慢性肝炎的试验结果显示由建议用量推算之试验剂量1~8倍量能明显降低AST、ALT值,及改善最终肝硬化的指标。
肝脏受损伤,肝细胞的AST和ALT会漏出,使血清中AST、ALT活性上升是最常用的肝脏损伤生化指标 [24]。本试验使用四氯化碳造成肝损伤,血清中AST、ALT活性明显上升。灵芝粉能降低血清中AST、ALT活性,显示其能减轻CCl4对肝脏的伤害。AST、ALT只能静态的反映出肝脏最近受到伤害,
Table 3. The effects of GL powder levels of liver and spleen-related parameter in the CCl4-induced rats
表3. 灵芝粉对CCl4诱发大鼠慢性肝炎肝脏、脾脏重量及肝脏含水量的影响
1A:control组,B:CCl4组,C:CCl4 + 低剂量灵芝粉组,D:CCl4 +中剂量灵芝粉组,E:CCl4 +高剂量灵芝粉组,F:silymarin组。2所有数据均以Mean ± S.E.表示,#表示与Control组比较P < 0.05,###表示与Control组比较P < 0.001,*表示与CCl4组比较P < 0.05,**表示与CCl4组比较P < 0.01。
Table 4. The effects of GL powder levels of hepatic glutathione, lipid peroxidation, protein, hydroxyproline, and SOD, GSH-Px and Catalase activity in the CCl4-induced rats
表4. 灵芝粉对CCl4诱发大鼠慢性肝炎肝脏组织Glutathione、Lipid Peroxidation、Protein及Hydroxyproline含量与SOD、GSH-Px,Catalase的活性影响
1A:control组,B:CCl4组,C:CCl4 + 低剂量灵芝粉组,D:CCl4 +中剂量灵芝粉组,E:CCl4 +高剂量灵芝粉组,F:silymarin组。2所有数据均以Mean ± S.E.表示,###表示与Control组比较P < 0.001,*表示与CCl4组比较P < 0.05,**表示与CCl4组比较P < 0.01。
Table 5. The effects of GL powder on the pathological change on liver tissue in the CCl4-induced rats
表5. 灵芝粉对CCl4诱发大鼠慢性肝炎肝脏组织的影响
1肝脏纤微化及变性程度,-:正常;+:非常轻微;++:轻度;+++:中度;++++:严重。2 *表示与CCl4组比较纤维化程度P < 0.05,**表示与CCl4组比较纤维化程度P < 0.01。#表示与CCl4组比较变性程度P < 0.05。
 (a)
(a)
 (b)
(b)
 (c)
(c)
 (d)(a):control组,(b):CCl4组,(c):CCl4 + 高剂量灵芝粉组,(d):silymarin组。
(d)(a):control组,(b):CCl4组,(c):CCl4 + 高剂量灵芝粉组,(d):silymarin组。
Figure 1. Hematoxylin-eosin staining of rat liver tissue
图1. 大鼠肝脏组织HE染色图
 (a)
(a)
 (b)
(b)
 (c)
(c)
 (d)(a):control组,(b):CCl4组,(c):CCl4 + 高剂量灵芝粉组,(d):silymarin组。
(d)(a):control组,(b):CCl4组,(c):CCl4 + 高剂量灵芝粉组,(d):silymarin组。
Figure 2. Sirius red staining of rat liver tissue
图2. 大鼠肝脏组织天狼星红染色图
虽是肝脏所有伤害的指标,但其无法估算肝脏还残留多少能力 [24]。血清中的白蛋白主要来自肝脏的合成,因此在慢性肝炎所引起的肝脏纤维化时血清白蛋白下降 [25]。CCl4诱发慢性肝炎,于第六、八周出现白蛋白减少情形,最终肝组织可溶性蛋白也明显下降。灵芝粉能提升血清中白蛋白及肝组织可溶性蛋白质含量,显示灵芝粉能改善CCl4肝脏蛋白质合成功能减退。
肝脏纤维化,使血液进入肝脏受阻,引起门脉高压,连带影响脾脏血流,会使脾脏肿大 [26]。本试验中,灵芝粉能改善脾脏肿大,显示其有减缓肝脏纤维化作用。肝脏受损引起发炎,也会启动再生功能 [27] ,使肝脏重量增加,但严重时肝脏会萎缩 [28]。灵芝粉对增加肝脏重量没有影响,但对肝脏含水量有减少作用,由此可知灵芝粉处理可使肝发炎较轻,肝脏的实质重量较重。而慢性肝炎引发肝纤维化,即结缔组织增生。结缔组织主要由胶原蛋白构成,hydroxyproline是胶原蛋白特有成分,测定其含量可以用来表示纤维化程度 [29]。灵芝粉能使hydroxyproline含量减少,表示其可以减轻肝纤维化的作用。此作用在组织病理检验得到进一步证实。已知肝纤维化与自由基的伤害造成脂质过氧化有关 [30] ,Malondialdehyde (MDA)是脂质过氧化分解的产物之一,常被作为脂质过氧化指标 [31]。灵芝粉能使脂质过氧化程度减轻,显示其可以减轻自由基的伤害。而肝脏中清除自由基伤害的三种酵素SOD、GSH-Px和Catalase,本试验中灵芝粉虽然后者两种酵素的活性无改善作用,但对SOD活性有意义提升。这些结果显示灵芝粉抑制脂质过氧化能力为一直接清除自由基能力,灵芝清除自由基能力已有多数研究证实 [3] [32] [33] [34] ,二为间接提升SOD活性。依照台湾卫福部公告方法使用silymarin为正对照药物,本次试验结果与我们先前多次silymarin的实验同样都未能获得正面意义。
5. 结论
经动物实验结果明确显示本试验之灵芝粉对CCl4诱发大鼠慢性肝炎具改善效果,得到下列结论:
1) 灵芝粉可降低血液中AST、ALT值,显示其有减轻肝损伤作用。
2) 灵芝粉能提升血清中白蛋白,提升肝组织可溶性蛋白质含量,减轻脾脏肿大,降低肝脏脂质过氧化程度及降低肝组织中hydroxyproline值,显示其可降低肝脏纤维化程度。
文章引用
邱婕宁,林定威,林维莉,林文川,陈劲初. 灵芝对四氯化碳诱导大鼠慢性肝炎之护肝功效评估
Hepatoprotective Effects of Ganoderma lucidum on Carbon Tetrachloride-Induced Chronic Liver Disease in Rats[J]. 食品与营养科学, 2018, 07(02): 101-109. https://doi.org/10.12677/HJFNS.2018.72012
参考文献
- 1. Lin, Z.B. (2001) Modern Research of Ganoderalucidum. 2nd Edition, Press of Beijing Medical University, Bei-jing.
- 2. Wang, Y.Y., Khoo, K.H. and Chen, S. (2002) Studies on the Immuno-Modulating and Antitumor Activities of Ganoderma lucidum (Reishi) Polysaccharides: Functional and Proteomic Analyses of a Fucose-Containing Glycoprotein Fraction Responseble for the Activities. Bioorganic & Medicinal Chemistry, 10, 1057-1062. https://doi.org/10.1016/S0968-0896(01)00377-7
- 3. Lin, Z.B., Li, C.H. and Lee, S.S. (2003) Triter-pene-Enriched Extracts from Ganoderma lucidum Inhibit Growth of Hepatoma Cells via Suppressing Protein Kinase C, Activating Mitogen-Activated Protein Kinases and G2-Phase Cell Cycle Arrest. Life Sciences, 72.
- 4. Chiu, H.F., Fu, H.Y., Lu, Y.Y., et al. (2017) Triterpenoids and Polysaccharide Peptides-Enriched Ganoderma lucidum: A Randomized, Double-Blind Placebo Controlled Crossover Study of Its Antioxidation and Hepatoprotective Efficacy in Healthy Volunteers. Pharmaceutical Biology, 55, 1041-1046. https://doi.org/10.1080/13880209.2017.1288750
- 5. Guo, S.S., Cui, X.L. and Rausch, W.D. (2016) Ganoderma lucidum Polysaccharides Protect against MPP+ and Rotenone-Induced Apoptosis in Primary Dopaminergic Cell Cultures through Inhibiting Oxidative Stress. American Journal of Neurodegenerative Disease, 5, 131-144.
- 6. Yegenoglu, H., et al. (2011) Comparison of Antioxidant Capacities of Ganoderma lucidum (Curtis) P. Karst and Funalia trogii (Berk.) Bondartsev & Singer by Using Different in Vitro Methods. Journal of Medicinal Food. https://doi.org/10.1089/jmf.2010.0144
- 7. 何慧, 谢笔钧, 刘扬虎. 灵芝肽在卵磷脂体系中的抗氧化作用研究[J]. 农业工程学报, 2004, 20(增刊): 163-166.
- 8. 衣艳君, 徐承水. 灵芝降血脂作用的实验研究[J]. 安徽师范大学学报(自然科学版), 2001, 24(1): 52-53.
- 9. Ajith, T., Sudheesh, N., Roshny, D., Abishek, G. and Janardhanan, K. (2009) Effect of Ganoderma lucidum on the Activities of Mitochondrial Dehydrogenases and Complex I and II of Electron Transport Chain in the Brain of Aged Rats. Experimental Gerontology, 44, 219-223. https://doi.org/10.1016/j.exger.2008.11.002
- 10. Lin, J.M., Lin, C.C., Chen, M.F., et al. (1993) Evaluation of the Anti-Inflammatory and Liver-Protective Effects of Anoectochilus formosanus, Ganoderma lucidum and Gynostem mapentaphyllim in Rats. The American Journal of Chinese Medicine, 21, 59-69.
- 11. Lin, J.M., Lin, C.C., Chiu, H.F., et al. (1995) Radical Scavenger and Antihepatotoxic Activity of Ganoderma formosanum, Ganoderma lucidum and Ganoderma neo-japonicum. Journal of Ethnopharmacology, 47, 33-41. https://doi.org/10.1016/0378-8741(95)01251-8
- 12. Lin, Z.B., Wang, M.Y., Liu, Q., et al. (2002) Effects of Total Triterpenoids Extract from Ganoderma lucidum (Curt.: Fr.) P. Karst. (Reishi Mushroom) on Experimental Liver Injury Models Induced by Carbon Tetrachloride or D-Galactosaminein Mice. International Journal of Medicine, 4, 337-342.
- 13. 王明宇, 刘强, 车庆明, 林志彬. 灵芝三萜类化合物对3种小鼠肝损伤模型的影响[J]. 药学学报, 2000(35): 326-329.
- 14. Kim, D.H., Shim, S.B., Kim, N.J. and Jang, I.S. (1999) β-Glucuronidase-Inhibitory Activity and Hepatoprotective Effect of Ganoderma lucidum. Biological and Pharmaceutical, 22, 162-164. https://doi.org/10.1248/bpb.22.162
- 15. Park, E.J., Ko, G., Kim, J., et al. (1997) Antifibrotic Effects of a Polysaccharide Extracted from Ganoderma lucidum, Glycyrrhizin, and Pentoxifylline in Rats with Cirrhosis Induced by Biliary Obstruction. Biological and Pharmaceutical Bulletin, 20, 417-420.
- 16. Yang, X.J., Liu, J., Ye, L.B., et al. (2006) In Vitro and in Vivo Protective Effects of Proteoglycan Isolated from Mycelia of Ganoderma lucidum on Carbon Tetrachloride-Induced Liver Injury. World Journal of Gastroenterology, 12, 1379-1385. https://doi.org/10.3748/wjg.v12.i9.1379
- 17. Gao, T., Lin, Z.B., Huang, M., et al. (2003) Hepatoprotective Activity and the Mechanisms of Action of Ganoderma luidum (Curt.:Fr.) P. Karst. (Ling Zhi, Reishi Mushroom) (Aphyllophoromycetideae). International Journal of Medicinal Mushrooms, 5, 111-131.
- 18. 行政部卫生福利部食品药物管理署. 健康食品之护肝保健功效评估方法2016 [Z]. 台北.
- 19. Sedlak, J. and Lindsay, R.H. (1968) Estimation of Total Protein-Bound, and Nonprotein Sulfhydryl Groups in Tissue with Ellman’s Reagent. Analytical Biochemistry, 25, 192-205. https://doi.org/10.1016/0003-2697(68)90092-4
- 20. Ohkawa, H., Ohishi, N. and Yagi, K. (1979) Assay for Lipid Peroxides in Animal Tissues by Thiobarbituric Acid Reaction. Analytical Biochemistry, 95, 351-358.
- 21. Neuman, R.E. and Longan, M.A. (1950) The Determination of Hydroxyproline. The Journal of Biological Chemistry, 184, 299-306.
- 22. Xia, E., Gao, G., Remmen, H.V., et al. (1995) Activities of Antioxidant Enzymes in Various Tissues of Male Fischer 344 Rats Are Altered by Food Restriction. Biochemical and Molecular Roles of Nutrients, 125, 195-201.
- 23. Aebi, H. (1984) Catalase in Vitro. Methods in Enzymology, 105, 121-126. https://doi.org/10.1016/S0076-6879(84)05016-3
- 24. Sturgill, M.G. and Lambert, G.H. (1997) Xenobiot-ic-Induced Hepatotoxicity: Mechanisms of Liver Injury and Methods of Monitoring Hepatic Function. Clinical Chemistry, 43, 1512-1526.
- 25. Vandenberghe, J. (1996) Hepatotoxicology: Mechanisms of Liver Toxicity and Methodological Aspects. In: Toxicology: Principle and Applications, CRC Press, New York, 703-723.
- 26. Gill, M.A. and Kircbain, W.R. (1997) Alcoholic Liver Disease. In: Pharmacotherapy: A Pathophsiogic Approach, 3rd Edition, Appleton & Lange, Stamford, 785-800.
- 27. Yamada, Y. and Fausto, N. (1998) Deficient Liver Regeneration after Carbon Tetrachloride Injury in Mice Lacking Type 1 But Not Type 2 Tumor Necrosis Factor Receptor. American Journal of Pathology, 152, 1577-1589.
- 28. Tamayo, R.P. (1983) Is Cirrhosis of the Liver Experimentally Produced by CCl4 an Adequate Model of Human Cirrhosis? Hepatology, 3, 112-120. https://doi.org/10.1002/hep.1840030118
- 29. Hanauske-Abel, H.M. (1996) Fibrosis: Representative Molecular Elements, a Basic Concept, and Emerging Targets for Suppressive Treatment. In: Zakim, D. and Boyer, T.D., Eds., Hepatology: A Textbook of Liver Disease, 3rd Edition, W.B. Saunders Company, Philadelphia, 465-506.
- 30. Camps, J., Bargallo, L., Gimenez, A., et al. (1992) Relationship between Hepatic Lipid Peroxidation and Fibrogenesis in Carbon Tetrachloride-Treated Rats. Clinical Science, 83, 687-700. https://doi.org/10.1042/cs0830695
- 31. De Zwart, L.L., Meerman, J.H., Commandeur, J.N. and Vermeulen, N.P. (1999) Biomarkers of Free Radical Damage Applications in Experimental Animals and in Humans. Free Radical Biology & Medicine, 26, 202-226. https://doi.org/10.1016/S0891-5849(98)00196-8
- 32. Kim, K.C. and Kim, I.G. (1999) Ganoderma lucidum Extract Protects DNA from Strand Breakage Caused by Hydroxyl Radical and UV Irradiation. International Journal of Molecular Medicine, 4, 273-277.
- 33. Lee, J.M., Kwon, H., Jeong, H., et al. (2001) Inhibition of Lipid Peroxidation and Oxidative DNA Damage by Ganoderma lucidum. Phytotherapy Research, 15, 245-249. https://doi.org/10.1002/ptr.830
- 34. Zhu, M., Chang, Q., Wong, L.K., Chong, F.S. and Li, R.C. (1999) Triterpene Antioxidant from Ganoderma lucidium. Phytotherapy Research, 16, 529-531.
NOTES
*通讯作者。
