Hans Journal of Food and Nutrition Science
Vol.07 No.03(2018), Article ID:26299,9
pages
10.12677/HJFNS.2018.73022
Sarcopenia and Chronic Inflammation
Fujie Wang1, Ting Zhao1, Jin Wang1, Qianqian Dai2, Lujiang Yi3
1Nutritional Department, The First Affiliated Hospital of Nanjing Medical University, Nanjing Jiangsu
2Nutritional Department, Xuzhou Cancer Hospital, Xuzhou Jiangsu
3Clinical Laboratory Department, The First Affiliated Hospital of Nanjing Medical University, Nanjing Jiangsu
Received: Jul. 23rd, 2018; accepted: Aug. 2nd, 2018; published: Aug. 8th, 2018

ABSTRACT
Objective: Chronic inflammation is associated with chronic disease and other age-related diseases, such as muscle atrophy and weakness, and even death. As aging, there are many physiological changes in the body. Sarcopenia is characterized by the gradual reduction of muscle mass and strength in the elderly. Multiple studies have shown a link between sarcopenia and chronic inflammation. The purpose of this paper is to observe weight, skeletal muscle, grip strength, the change of inflammation index in sarcopenia; to investigate the relationship between inflammatory factor and sarcopenia and explore its action mechanism. Methods: From May 2017 to December 2017, this study conducted a randomized, open, parallel and compared clinical observational study in the Nanjing province community. It involves 248 cases in 65 - 85 years old community people according to the diagnostic criteria for low muscle (skeletal muscle quantity below human body composition analysis instrument InbodyS10 bioelectricity impedance calculated based on the height of the subjects of ideal value 90%), so we selected the target groups, gave guidance of diet and exercise, and then we gave the intervention group oral full nutritional supplements (53.8 g bid, Abbott Ensure complete), and then observed the change of skeletal muscle mass and inflammation index (Interleukin-6, C-reactive protein). Results: This study screened 248 cases, 65 - 85 years old community, 78 people in low quantity of skeletal muscle of diagnostic criteria, including 33 people cooperated to test for diagnosis of sarcopenia, and conformed to its diagnosis. The study showed Male: Female = 19:14; the mean age was 77.45 ± 6.52; and the total number of study participants was 20 (for the reason of dissection/withdrawal of 13 persons): 10 persons in the intervention group and 10 in the control group. After 84 ± 7 days, the average weight change of the intervention group VS the control group was 2.4 ± 1.69 kg VS 0.34 ± 1.95 kg. The mean value of skeletal muscle in the intervention group VS control group was 0.21 ± 0.32 kg VS −0.23 ± 0.53 kg. The mean value of Interleukinin-6 in the intervention group VS control group was 15.27 ± 36.16 pg/ml VS 18.80 ± 38.21 pg/ml. The mean value of C-reactive protein in the intervention group VS control group was 1.05 ± 2.80 VS 0.70 ± 1.40. Correlation analysis: Correlation analysis of body weight and grip strength of Sarcopenia p value = 0.00 (<0.05); Correlation analysis of grip strength and skeletal muscle in Sarcopenia p = 0.011 (<0.05); Correlation analysis of body weight and skeletal muscle in Sarcopenia p value = 0.003 (<0.05). Statistical results showed that there was no statistical significance in the correlation analysis of indicators and inflammatory markers, but the results showed that after intervention, the inflammation index has obvious downward trend, whose mechanism needs further exploration. Conclusion: Sarcopenia may be associated with chronic inflammation. Thus to further explore the influence mechanism between the inflammatory mediators and sarcopenia has certain enlightening significance for improving and treating sarcopenia.
Keywords:Sarcopenia, Inflammation, Nutrition Intervention
肌少症与慢性炎症作用
王馥婕1,赵婷1,王瑾1,戴倩倩2,衣鲁江3
1南京医科大学第一附属医院,营养科,江苏 南京
2徐州肿瘤医院,营养科,江苏 徐州
3南京医科大学第一附属医院,临床检验科,江苏 南京
收稿日期:2018年7月23日;录用日期:2018年8月2日;发布日期:2018年8月8日

摘 要
目的:慢性炎症作用与慢性疾病和其他年龄相关的疾病有关,如肌肉萎缩和虚弱,甚至死亡。随着老龄化的发展,机体出现很多生理学的变化。肌少症主要表现为在老年人群中存在肌肉数量及力量逐渐减少的特征变化。多项研究表明肌少症与慢性炎症之间存在着某种联系。本文旨在观察肌少症人群中予以营养干预前后其体重、骨骼肌量、握力等体测指标及炎症指标的变化,探讨肌少症人群干预前后各项指标的变化、体重、骨骼肌量及握力之间的相关性及炎症反应与肌少症的相关性并探索其作用机制。方法:本研究从2017年5月至2017年12月通过对南京社区进行了一项随机分组、开放、平行及前后对照的临床观察性研究,对248例65~85岁社区人群根据低肌骨骼肌量的诊断标准(骨骼肌量低于生物电阻抗人体成分分析仪器InbodyS10根据受试者的身高推算出理想值的90%)筛选出目标人群,予以常规饮食及运动指导,并予以干预组加以口服全营养补充剂(雅培全安素) 53.8 g,一天二次,两餐之间口服,观察干预前后体测指标,如体重、握力及骨骼肌质量等、以及炎症指标(白介素-6,C反应蛋白)的变化。结果:本研究筛选248例65~85岁社区人群中,共78人符合低骨骼肌量的诊断标准,其中33人愿配合进行肌少症相关诊断的检查,并符合其诊断。其中男:女 = 19:14,平均年龄77.45 ± 6.52岁,最终完成研究的共20人(因故中途脱组/退出13人),干预组10人,对照组10人。干预84 ± 7天后,干预组VS对照组体重变化平均值为:2.4 ± 1.69 kg VS 0.34 ± 1.95 kg;干预组VS对照组骨骼肌变化平均值为:0.21 ± 0.32 kg VS −0.23 ± 0.53 kg;干预组VS对照组白介素-6变化平均值为:15.27 ± 36.16 pg/ml VS 18.80 ± 38.21 pg/ml;干预组VS对照组C反应蛋白变化平均值为:1.05 ± 2.80 VS 0.70 ± 1.40;相关性分析:肌少症患者体重与握力的相关性分析p值 = 0.00 (<0.05);肌少症患者握力与骨骼肌的相关性分析p值 = 0.011 (<0.05);肌少症患者体重与骨骼肌的相关性分析p值 = 0.003 (<0.05);统计结果显示体测指标及炎症指标的相关性分析无统计学意义,但研究结果显示干预后炎症指标有明显下降趋势,其中机制需进一步探索。结论:肌少症患者通过营养干预后,体测指标及炎症指标均有一定的变化;肌少症可能与慢性炎症反应有关,因此进一步探索炎症介质与肌少症之间的影响机制,对改善及治疗肌少症人群有一定的启发指导意义。
关键词 :肌少症,炎症,营养干预

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着年龄的增长,机体出现很多生理学的变化。这些变化或直接性的、非直接性的导致生活质量的变化,甚至是生命的缩短。衰老现象与多系统功能衰退有关。老年人的慢性炎症被认为是导致一些与年龄相关的疾病的主要原因,包括肌少症 [1][2][3]。
肌少症在老年人中是一种非常普遍的病症 [4],并且与许多不良事件有关,包括残疾、住院和死亡 [5]。在认识到肌少症的高流行和有害影响的同时,人们正在努力寻找治疗肌少症的新疗法,并致力于在老年人中保持持续的身体机能。肌少症是指在老年人群中存在肌肉数量及力量逐渐减少的特征变化。它是目前主要引起老年朋友身体活动受限的病症,并与包括残疾和死亡在内的各种不良事件相关。随着年龄的增长,慢性炎症或炎症性老化现象被认为是导致许多老年病的主要因素:包括肌少症。
运动锻炼和营养补充是在肌少症的临床治疗中积极实施的两项主要干预措施 [6]。然而,由于这些干预措施的结果在个体之间存在差异,而且可能不是对每个患者都有效,因此没有使用这些干预措施的黄金标准。另一方面,因为他们的老年并发症很广泛,许多老年患者可能无法遵从医生所建议的运动和营养方案。此外,运动和营养干预被发现具有抗炎和抗氧化的压力作用,这反过来又减缓了老年人的肌肉消耗 [6][7][8]。尽管老年人通过这些经典的干预途径可以获益,但是抗炎症反应策略的治疗有一定的意义,因其也许可以增加抗阻力运动及蛋白质补充的代谢反应。
本研究旨在探索肌少症人群中通过营养干预后各项体测指标及炎症指标的变化、体重、骨骼肌量及握力之间的相关性关系,以及炎症反应与肌少症是否存在相关性,炎症因子在其炎症反应中的变化,以对今后探索新的肌少症干预治疗的方法提供新的思路及线索。
2. 资料与方法
2.1. 研究对象
本研究从2017年5月至2017年12月通过对南京社区进行了一项随机分组、开放、平行及前后对照的临床观察性研究,对248例65~85岁社区人群根据低肌骨骼肌量的诊断标准(骨骼肌量低于生物电阻抗人体成分分析仪器InbodyS10根据受试者的身高推算出理想值的90%)筛选出目标人群,本研究筛选的248例65~85岁社区人群中,共78人符合低骨骼肌量的诊断标准,其中33人愿配合进行肌少症相关诊断的检查,并符合其诊断。其中男19例,女14例,平均年龄77.45 ± 6.52岁。所有对象对研究均知情同意书。该研究伦理已通过南京医科大学第一附属医院伦理委员会批准进行。
2.2. 检测内容
1) 体格指标:包括身高、体重、体重指数(body mass index, BMI)、体脂肪量、体脂百分数、内脏脂肪面积、骨骼肌量等;体成分检测采用型号为In Body S-10人体成分分析仪,通过生物电阻抗测试法准确分析出人体成分比例;握力计进行检测优势手的握力(测三次取平均值);2) 血液指标:所有受试者禁食8~12 h,次日凌晨空腹抽血测定白介素-6 (Interleukin-6)、C反应蛋白(C-reactive protein)。
2.3. 诊断标准
低骨骼肌量:骨骼肌量低于生物电阻抗人体成分分析仪器InbodyS10根据受试者的身高推算出理想值的90%。
肌少症的诊断标准:亚洲肌少症工作组(Asian Working Group for Sarcopenia, AWGS)提出在社区老年人或存在以下情况的老年人中筛查是否存在肌少症:如最近出现了日常生活能力下降、未刻意减重时1个月内体质量下降5%,存在抑郁或认知功能障碍,反复跌倒,营养不良,慢性心功能不全,慢阻肺,糖尿病,慢性肾脏病,结缔组织病,结核感染及其他慢性消耗性疾病。其根据各自国家对老年人的定义,选择 > 60岁或者 > 65岁的人群,初筛手段包括:步行试验和握力测量。步速切点为 < 0.8 m/s;握力切点为:男性 < 26kg,女性 < 18 kg;双能X线吸光测定(dual X-ray absorptiometry, DXA)的诊断切点为男性 < 7.0 kg/m2,女性 < 5.4 kg/m2;生物电阻抗测定(bioelectrical impedance, BIA)的诊断切点为男性 < 7.0 kg/m2,女性 < 5.7 kg/m2。
2.4. 分组
将33名受试者随机分为2组,干预组16人(最终完成研究人数10人)、对照组17人(最终完成研究人数10人)。
2.5. 干预方法
33名受试者皆予以常规饮食及运动指导(具体为规律饮食,保证所需每日蛋白质摄入量,适量增加运动),干预组在此基础上加以口服全营养补充剂(雅培全安素) 53.8 gbid。(全安素(S672)将作为干预组的口服营养补充剂,用量为每天12匙(2杯),可提供能量462 kcal、蛋白质17 g、脂肪15 g、碳水化合物62 g、膳食纤维4.6 g、维生素矿物质占全日推荐摄入量25%。2杯全安素粉剂作为干预组研究对象每日能量和营养素推荐摄入量的一部分来源,与其每日膳食摄入食物来源搭配使用。)
2.6. 统计学分析
采用spss统计软件对数据进行统计分析。采用(x ± s)描述计量资料;采用n (%)描述计数资料。计量资料采用t检验,计数资料采用χ2检验。所有分析结果,以p ≤ 0.05有统计学意义。
3. 结果
3.1. 不同组别初始资料比较
3.1.1. 不同组别一般资料比较
随机将已符合肌少症诊断的受试者分为干预组及对照组,分析结果显示两组受试者年龄、身高、体重、骨骼肌、体脂肪、BMI、体脂百分比、腰围、内脏脂肪面积、握力均无明显差异(p > 0.05),见表1。
3.1.2. 不同组别炎症指标比较
随机将已符合肌少症诊断的受试者分为干预组及对照组,共20人完成整项研究(干预组10人,对照组10人),分析结果显示两组受试者白介素-6无明显差异(p > 0.05),C反应蛋白两组之间差异有意义(p < 0.05),见表2。
3.2. 不同组别干预后资料对比
3.2.1. 不同组别干预后一般资料比较
所有受试者在干预84 ± 7天后,复查各项指标,结果显示干预后,干预组及对照组在体重、骨骼肌、体脂肪、腰围、内脏脂肪面积、握力均无明显差异(p > 0.05),观察各项指标在干预前后的变化,其中体重、骨骼肌及腰围的变化在两组之间显示出差异性(p < 0.05),而体脂肪、内脏脂肪面积、握力的变化值在两组之间无明显差异(p > 0.05),见表3。
Table 1. Descriptive statistics analysis of general data of the study subjects (x ± s)
表1. 受试者一般资料的描述性统计分析(x ± s)
Table 2. Descriptive statistics analysis of inflammatory data of the study subjects (x ± s)
表2. 受试者炎症指标的描述性统计分析(x ± s)
Table 3. Descriptive statistics analysis of data of the study subjects (x ± s)
表3. 受试者资料的描述性统计分析(x ± s)
3.2.2. 不同组别干预后炎症指标比较
所有受试者在干预84 ± 7天后,复查各项指标,结果显示干预后,干预组及对照组在白介素-6、C反应蛋白均无明显差异(p > 0.05),观察各项指标在干预前后的变化,其中白介素-6、C反应蛋白的变化在两组之间无明显差异(p > 0.05),见表4。
3.3. 肌少症患者体测指标之间以及体测指标与炎症指标的相关性分析
3.3.1. 肌少症患者体测指标之间的相关性分析
所有受试者,即肌少症患者,在体重、骨骼肌、握力等体测指标间存在一定的联系。分析结果显示:肌少症患者体重与握力的相关性分析p值 = 0.00 (<0.05),R值 = 0.729;肌少症患者握力与骨骼肌的相关性分析p值 = 0.011 (<0.05),R值 = 0.399;肌少症患者体重与骨骼肌的相关性分析p值 = 0.003 (<0.05)。R值 = 0.458,见图1。
3.3.2. 肌少症患者体测指标与炎症指标之间的相关性分析
所有受试者,即肌少症患者,在体重、骨骼肌、握力等体测指标与炎症指标白介素-6、C反应蛋白间存在一定的联系。分析结果显示:肌少症患者体重、骨骼肌、握力等体测指标与炎症指标白介素-6、C反应蛋白之间相关性无统计学差异,见图2。
4. 讨论
肌少症是指在老年人群中存在肌肉数量及力量逐渐减少的特征变化。目前它主要是引起老年朋友身体活动受限,并与包括残疾和死亡在内的各种不良事件相关。肌少症是一种以肌肉量减少、肌力减弱和功能性能降低为特点的综合征 [5][9][10]。但其被广泛忽视并缺少治疗。与恶病质不同,肌少症并不要求存在基础疾病。此外,虽然大多数恶病质患者存在肌少症,但大部分肌少症患者并不会被认定为恶病质 [11]。
Table 4. Descriptive statistics analysis of inflammatory data of the study subjects (x ± s)
表4. 受试者炎症指标的描述性统计分析(x ± s)
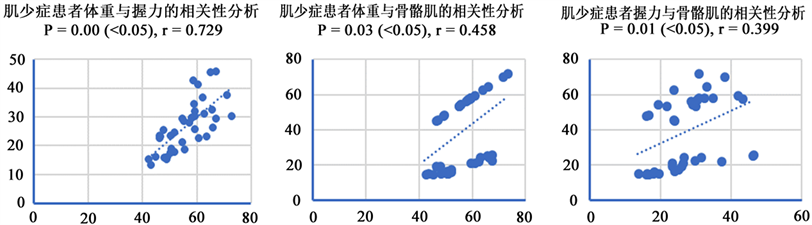
Figure 1. Correlation analysis of somatograph indicators in patients with sarcopenia
图1. 肌少症患者体测指标之间的相关性分析
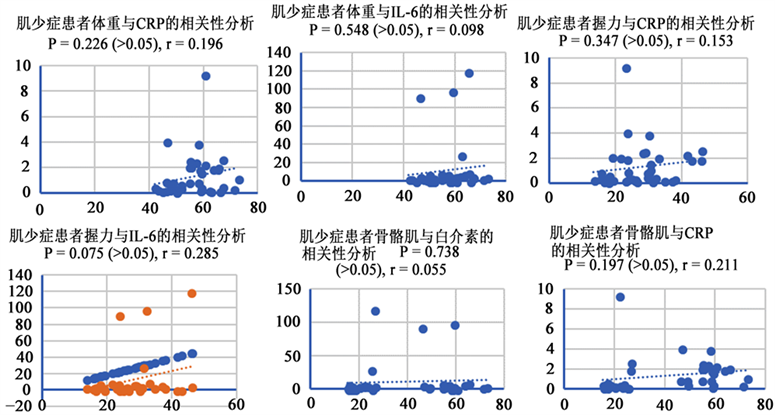
Figure 2. Correlation analysis between physical measurement index and inflammatory index in patients with sacropenia
图2. 肌少症患者体测指标与炎症指标之间的相关性分析
肌少症与机体功能障碍、失能、跌倒、死亡的发生率增加相关 [12]。肌少症与肌肉纤维和运动单位的萎缩和丧失有关,主要影响快速肌纤维及其运动单位。快速肌纤维似乎更容易出现随时间流失相关的功能衰竭。肌少症的病因是多方面的,可能包括肌肉失用、内分泌功能变化、慢性疾病、慢性炎症、胰岛素抵抗和营养缺乏 [10]。
有研究报道指出 [13],在80岁以上的老年人中,肌少症的发生率分别是:男性为53%~57%,女性为43%~60%。我们的研究中,最后纳入肌少症研究范围的人数的男女比例为男:女 = 19:14,平均年龄77.45 ± 6.52岁。
除了久坐不动的生活方式外,不充足的饮食摄入是导致肌肉减少的另一个重要原因 [14][15]。从大约70岁开始,在男、女两种性别中,平均每年体重减少250克 [16]。越来越多的证据证明,充足的营养对于预防肌肉功能衰退是必要的 [16][17]。营养不足和营养不良几乎是由营养摄入不足或营养消化不良引起的 [14][16]。研究表明年龄较大的受试者更容易出现急性和慢性并发症,而且与较年轻的个体相比,由于营养不良而导致的肌肉周期性衰退的影响明显更大 [16]。老年厌食症的发病机制复杂,受很多因素影响:包括内脏、激素、神经学、炎性和心理因素等 [16][18]。首先,随着年龄的增长,食欲的变化会减少饥饿感;其次,老年人与年轻人相比,在如急性疾病阶段,表现出平衡能力的下降,以补偿营养减少的情况;最后,年龄的增长同时伴随着味觉和嗅觉的衰退。与上述因素相互作用的进一步因素是由于激素刺激(特别是睾酮和生长激素)的减少和持续的炎症所导致的代谢效应 [16]。
营养干预在肌少症的干预手段中为一项重要且效果较好的选择。而老年人群因缺乏运动、胃肠功能减弱等原因,导致食欲量通常有所下降,仅仅从食物增加方面来进行营养干预,通常使获得明显效果前所需时间较长,此时考虑适量增加营养补充剂,可帮助肌少症患者尽快取得一定的疗效。一项meta分析评估了55项关于使用含蛋白质及能量的营养补充剂以预防老年高危患者营养不良的随机试验 [19]。这些试验评估的补充剂提供的额外能量为175~1000 kcal/d,蛋白质为10~36 g/d。大多数受试者(45%)因脑卒中住院,16%居住在社区,10%居住在长期护理机构。营养补充剂会使住在家中或长期护理机构中的患者体重变化百分比轻微改善,体重稍有增加。相比对照组,接受营养补充剂的实验组总体死亡率下降,但对住在家中的患者死亡率没有影响,且功能状态也没有改善。死亡率变化最大的人群是接受含较高热量补充剂的75岁及以上的营养不良住院患者。接受营养补充剂的住院患者的并发症发生率较低,但其住院时长没有改变。本研究中,干预组通过营养干预+全营养补充剂补充84 ± 7天后,其中体重、骨骼肌及腰围的变化在干预组和对照组之间显示出差异性,而体脂肪、内脏脂肪面积、握力的变化值在两组之间无明显差异;可以看出即使短期补充营养制剂后,即可表现出骨骼肌的增加,从而使运动功能获益。
除了一些减少合成代谢的因子,如生长激素、雄激素、雌激素,以及身体不活动,炎症因子等代谢因子的增加也可能是肌肉质量和力量损失的重要原因 [20]。研究强调,一个慢性全身炎症状态涉及到骨骼肌功能,而衰老过程伴随着老年人的较高的炎症性活动 [21]。越来越多的证据表明白介素-1β (IL-1)、肿瘤坏死因子(TNF)-α,和白细胞介素-6 (IL-6)在肌少症降解细胞中扮演着一个重要的角色。IL-1和TNF都是支持T细胞重质化和特异性免疫对抗原反应的发展的因素 [20][21]。虽然这些细胞因子在急性败血症等疾病,创伤或手术后,以及在慢性疾病中也扮演着关键角色,如风湿性关节炎等,导致肌肉细胞衰退和加速肌肉蛋白质分解导致肌少症 [21][22]。由于肌少症的发展是多年甚至几十年的长期过程,所以当急性变化导致长期时,肌肉蛋白平衡的微小变化可能会产生很大的影响。分解代谢蛋白的过程是受胰岛素抵抗、食欲不振、营养摄入不足的支持 [23]。
体脂似乎是通过影响肌肉群的激素和细胞因子来影响肌肉组织 [23]。值得注意的是,IL-6的代谢作用在肥胖人群中更为严重,在诸如恶性肿瘤、类风湿性关节炎和衰老等疾病中也更为严重 [5][23]。
本研究中,在干预后,炎症细胞因子白介素-6、C反应蛋白均表现出明显的下降趋势,可推测出营养干预后,影响了肌少症患者的炎症状态,但因此次研究人数较少,干预天数也较短,故得出的结果未显示干预组及对照组间明显的差异;且肌少症与炎症反应之间的相关性也需进一步研究试验证明。介入炎症反应,改善老年人群的炎症状态,或可以成为今后研究改善及治疗肌少症的一个新的方向。
文章引用
王馥婕,赵 婷,王 瑾,戴倩倩,衣鲁江. 肌少症与慢性炎症作用
Sarcopenia and Chronic Inflammation[J]. 食品与营养科学, 2018, 07(03): 186-194. https://doi.org/10.12677/HJFNS.2018.73022
参考文献
- 1. Franceschi, C., Capri, M., Monti, D., et al. (2006) Inflammaging and Anti-Inflammaging: A Systemic Perspective on Aging and Longevity Emerged from Studies in Humans. Mechanisms of Ageing and Development, 128, 92-105. https://doi.org/10.1016/j.mad.2006.11.016
- 2. Schaap, L.A., Pluijm, S.M.F., Deeg, D.J.H., et al. (2005) Inflammatory Markers and Loss of Muscle Mass (Sarcopenia) and Strength. The American Journal of Medicine, 119, 526.e9-526.e17. https://doi.org/10.1016/j.amjmed.2005.10.049
- 3. Visser, M., Pahor, M., Taaffe, D.R., et al. (2002) Relationship of Interleukin-6 and Tumor Necrosis Factor-Alpha with Muscle Mass and Muscle Strength in Elderly Men and Women: The Health ABC Study. The Journals of Gerontology: Series A, 57, M326-M332. https://doi.org/10.1093/gerona/57.5.M326
- 4. Cruz-Jentoft, A.J., Landi, F., Schneider, S.M., et al. (2014) Prevalence of and Interventions for Sarcopenia in Ageing Adults: A Systematic Review. Report of the International Sarcopenia Initiative (EWGSOP and IWGS). Age Ageing, 43, 748-759. https://doi.org/10.1093/ageing/afu115
- 5. Cruz-Jentoft, A.J., Baeyens, J.P., Bauer, J.M., Boirie, Y., Cederholm, T., Landi, F., et al. (2010) Sarcopenia: European Consensus on Definition and Diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing, 39, 412-423. https://doi.org/10.1093/ageing/afq034
- 6. Martone, A.M., Marzetti, E., Calvani, R., et al. (2017) Exercise and Protein Intake: A Synergistic Approach against Sarcopenia. BioMed Research International, 2017, Article ID: 2672435. https://doi.org/10.1155/2017/2672435
- 7. Lambert, C.P., Wright, N.R., Finck, B.N., et al. (1985) Exercise But Not Diet-Induced Weight Loss Decreases Skeletal Muscle Inflammatory Gene Expression in Frail Obese Elderly Persons. Journal of Applied Physiology, 105, 473-478.
- 8. Ziaaldini, M.M., Marzetti, E., Picca, A., et al. (2017) Biochemical Pathways of Sarcopenia and Their Modulation by Physical Exercise: A Narrative Review. Frontiers in Medicine, 4, 167. https://doi.org/10.3389/fmed.2017.00167
- 9. Roubenoff, R. (2001) Origins and Clinical Relevance of Sarcopenia. Canadian Journal of Applied Physiology, 26, 78-89. https://doi.org/10.1139/h01-006
- 10. Janssen, I. (2011) The Epidemiology of Sarcopenia. Clinics in Geriatric Medicine, 27, 355-363. https://doi.org/10.1016/j.cger.2011.03.004
- 11. Muscaritoli, M., Anker, S.D., Argilés, J., et al. (2010) Consensus Definition of Sarcopenia, Cachexia and Pre-Cachexia: Joint Document Elaborated by Special Interest Groups (SIG) “Cachexia-Anorexia in Chronic Wasting Diseases” and “Nutrition in Geriatrics”. Clinical Nutrition, 29, 154-159. https://doi.org/10.1016/j.clnu.2009.12.004
- 12. Janssen, I. (2006) Influence of Sarcopenia on the Development of Physical Disability: The Cardiovascular Health Study. Journal of the American Geriatrics Society, 54, 56. https://doi.org/10.1111/j.1532-5415.2005.00540.x
- 13. Lindle, R.S., Metter, E.J., Lynch, N.A., et al. (1985) Age and Gender Comparisons of Muscle Strength in 654 Women and Men Aged 20-93 Yr. Journal of Applied Physiology, 83, 1581-1587. https://doi.org/10.1152/jappl.1997.83.5.1581
- 14. Burton, L.A. and Sumukadas, D. (2010) Optimal Management of Sarcopenia. Clinical Interventions in Aging, 5, 217-228.
- 15. Sorensen, M.B., Rosenfalck, A.M., Hojgaard, L. and Ottesen, B. (2001) Obesity and Sarcopenia after Menopause Are Reversed by Sex Hormone Replacement Therapy. Obesity Research, 9, 622-626. https://doi.org/10.1038/oby.2001.81
- 16. Bauer, J.M. (2011) Nutrition in Older Persons. Basis for Functionality and Quality of Life. Internist, 52, 946-954. https://doi.org/10.1007/s00108-011-2806-7
- 17. Malafarina, V., Uriz-Otano, F., Iniesta, R. and Gil-Guerrero, L. (2012) Effectiveness of Nutritional Supplementation on Muscle Mass in Treatment of Sarcopenia in Old Age: A Systematic Review. Journal of the American Medical Directors Association, 14, 10-17.
- 18. Mitchell, W.K., Williams, J., Atherton, P., Larvin, M., Lund, J. and Narici, M. (2012) Sarcopenia, Dynapenia, and the Impact of Advancing Age on Human Skeletal Muscle Size and Strength; A Quantitative Review. Frontiers in Physiology, 3, 260. https://doi.org/10.3389/fphys.2012.00260
- 19. Milne, A.C., Avenell, A. and Potter, J. (2006) Meta-Analysis: Protein and Energy Supplementation in Older People. Annals of Internal Medicine, 144, 37. https://doi.org/10.7326/0003-4819-144-1-200601030-00008
- 20. Morley, J.E., Baumgartner, R.N., Roubenoff, R., Mayer, J. and Nair, K.S. (2001) Sarcopenia. Journal of Laboratory and Clinical Medicine, 137, 231-243. https://doi.org/10.1067/mlc.2001.113504
- 21. Krüger, K. (2017) The Increasing Importance of Immune Regulatory Effects by Physical Activity. Deutsche Zeitschrift für Sportmedizin, 68, 277-279. https://doi.org/10.5960/dzsm.2017.308
- 22. Bauer, J.M., Kaiser, M.J. and Sieber, C.C. (2008) Sarcopenia in Nursing Home Residents. Journal of the American Medical Directors Association, 9, 545-551. https://doi.org/10.1016/j.jamda.2008.04.010
- 23. Jones, T.E., Stephenson, K.W., King, J.G., Knight, K.R., Marshall, T.L. and Scott, W.B. (2009) Sarcopenia—Mechanisms and Treatments. Journal of Geriatric Physical Therapy, 32, 83-89. https://doi.org/10.1519/00139143-200932020-00008
