World Journal of Cancer Research
Vol.08 No.01(2018), Article ID:23443,10
pages
10.12677/WJCR.2018.81005
Liposomal Clodronate Enema Ameliorates Dextran Sulfate Sodium-Induced Murine Colitis
Yonghong Yang1,2,3,4, Haibo Li5, Xingmin Wang1
1Gansu BioReax Science & Technology LLC, Lanzhou Gansu
2Gansu Children’s Hospital, Lanzhou Gansu
3Lanzhou University Second Hospital, Lanzhou Gansu
4Key Laboratory of Gastrointestinal Cancer of Gansu Province, Lanzhou Gansu
5Nantong Maternity and Child Health Care Hospital, Nantong Jiangsu

Received: Dec. 27th, 2017; accepted: Jan. 11th, 2018; published: Jan. 18th, 2018

ABSTRACT
Aim: To demonstrate that depletion of colon macrophages using a novel liposomal clodronate enema ameliorates dextran sulfate sodium (DSS)-induced colitis. Methods: Murine colitis was induced by DSS in drinking water and treated with liposomal clodronate enemas or sham liposomal enemas once a week for a total of 10 treatments. Inflammation was evaluated for colon biopsies following hematoxylin and eosin staining. Colon macrophages, cyclooxygenase-2 (COX-2), and proliferating cell nuclear antigen (PCNA) were determined by immunohistochemical staining. Serum TNFα and IL-6, two inflammatory cytokines, were analyzed by enzyme-linked immunosorbent assay. Results: Immunohistochemical staining showed that macrophages were efficiently depleted in colon biopsies from mice treated with liposomal clodronate enemas compared to sham liposomal enemas. In addition, colitis was remarkably ameliorated for mice treated with liposomal clodronate enemas compared to sham liposomal enemas or DSS alone. Finally, the production of TNFα, IL-6, COX-2, and PCNA significantly decreased by depleting colon macrophages using liposomal clodronate enemas compared to sham liposomal enemas or DSS alone. Conclusion: This liposomal clodronate enema is capable of depleting colon macrophages, reducing inflammatory cytokines and COX-2, blocking colon epithelial cell proliferation and colitis. It may be used as an adjuvant therapy for colitis and colorectal cancer prevention.
Keywords:Clodronate, Liposome, Macrophage Depleting Reagent, Apoptosis, DSS Colitis
氯膦酸二钠脂质体灌肠缓解葡聚糖硫酸钠诱导的结肠炎
杨永红1,2,3,4,李海波5,王兴民1
1甘肃博睿生物科技有限公司,甘肃 兰州
2甘肃省儿童医院,甘肃 兰州
3兰州大学第二医院,甘肃 兰州
4甘肃省消化肿瘤重点实验室,甘肃 兰州
5南通市妇幼保健院,江苏 南通
收稿日期:2017年12月27日;录用日期:2018年1月11日;发布日期:2018年1月18日

摘 要
目的:证明一种新型氯膦酸二钠脂质体灌肠剂可清除小鼠肠道巨噬细胞从而缓解葡聚糖硫酸钠诱导的结肠炎。方法:用含葡聚糖硫酸钠的饮用水诱导野生型小鼠结肠炎,结肠炎小鼠每周用氯膦酸二钠脂质体和空脂质体灌肠一次,共灌肠十次。小鼠结肠组织用苏木精–伊红染色后判定炎症程度,用免疫组织化学染色法检测巨噬细胞的数目、环氧合酶2 (COX-2)以及增殖细胞核抗原(PCNA),并用酶联免疫吸附试验检测血清中的炎性细胞因子TNFα和IL-6。结果:免疫组织化学及H&E染色显示,与葡聚糖硫酸钠肠炎小鼠以及空脂质体灌肠的肠炎小鼠相比,氯膦酸二钠脂质体灌肠可有效地清除肠道组织巨噬细胞从而减轻了葡聚糖硫酸钠诱导的结肠炎。另外,用氯膦酸二钠脂质体灌肠剂清除巨噬细胞显著地降低了血清中炎性细胞因子TNFα和IL-6的产生以及肠道组织中COX-2和PCNA的表达。结论:该新型氯膦酸二钠脂质体灌肠剂可有效地清除肠道巨噬细胞从而减少炎性细胞因子和COX-2的表达、抑制肠道上皮细胞的增生和结肠炎,有望用于结肠炎的辅助治疗和结直肠癌的预防。
关键词 :氯膦酸二钠,脂质体,巨噬细胞清除剂,细胞凋亡,DSS结肠炎

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
近年来我国结直肠癌发病率迅速增长,结直肠癌早期诊断率低、死亡率高、治疗费用高昂。慢性结肠炎是结直肠癌的重要诱因之一,约30%的慢性结肠炎患者可发展为结直肠癌,称之为结肠炎相关性结直肠癌(colitis-associated colorectal cancer) [1] ,因此,早期干预并阻断结肠炎发展为结直肠癌是减少结直肠癌发病率的重要的手段之一。
先天免疫细胞在慢性结肠炎的癌变过程中扮演者极为重要的作用 [2] ,例如巨噬细胞、肥大细胞、树突状细胞及辅助性T细胞等都和结直肠癌的发生有着直接或间接的关系 [3] [4] [5] [6] [7] 。在这些先天免疫细胞中巨噬细胞的作用越来越受到关注,我们早期的研究发现肠道微生物可激活并诱导肠道巨噬细胞极性化 [8] ,激活的巨噬细胞释放内源性的诱变剂如4-羟基-2-壬烯醛而导致双链DNA损伤、基因突变、染色体不稳定性并引起正常细胞的癌变 [9] [10] [11] [12] 。另一方面,激活的巨噬细胞还可产生多种炎性细胞因子如肿瘤坏死因子(Tumor necrosis factor alpha,简称TNFα)等,TNFα可诱导肠道上皮细胞表达细胞凋亡抑制蛋白Netrin-1从而导致上皮细胞的增生 [13] 。
研究表明用氯膦酸二钠清除肿瘤相关巨噬细胞(Tumor-associated macrophage)可用于癌症的辅助治疗 [14] [15] 。我们早期的研究表明,在IL-10敲除小鼠结肠炎模型中用市售的氯膦酸二钠脂质体清除肠道巨噬细胞可抑制粪肠球菌诱导的结肠炎 [8] 。用于结直肠癌研究的动物模型很多 [16] ,葡聚糖硫酸钠(Dextran sulfate sodium,简称DSS)可诱导动物的结肠炎,葡聚糖硫酸钠结合氧化偶氮甲烷(Azoxymethane)诱导的动物结直肠癌和人类结直肠癌具有非常相似的病理学特征,是一种很常用的结直肠癌动物模型。
我们最近报道了一种新型氯膦酸二钠脂质体灌肠剂可有效地诱导离体培养的巨噬细胞凋亡 [17] 。为进一步考察该新型氯膦酸二钠脂质体灌肠剂是否可有效地清除活体小鼠的肠道巨噬细胞并预防结肠炎,本研究我们用DSS小鼠结肠炎模型对该氯膦酸二钠脂质体灌肠剂清除活体巨噬细胞并缓解结肠炎的效果进行了进一步探讨。
2. 材料与方法
2.1. 试剂和实验动物
葡聚糖硫酸钠(DSS)购自MP Biochemicals,氯膦酸二钠脂质体灌肠剂为本公司自主研发的产品 [17] ,实验用小鼠为野生型C57BL/6J小鼠。
2.2. 小鼠葡聚糖硫酸钠结肠炎模型和脂质体灌肠
小鼠葡聚糖硫酸钠结肠炎模型的建立参考Thaker等报道的方法略作修改 [18] 。DSS用灭菌自来水溶解后(2.5 g/100ml)用0.22 μm乙酸纤维素过滤器除菌过滤,4℃保存,每周现配。选择6~8周龄的野生型C57BL/6J小鼠,随机分为4组,每组6只小鼠。第一组小鼠作为正常对照组,整个试验过程中均饲喂经高压灭菌的常规饮用水。第二组为结肠炎对照组,只用DSS处理。第一周用2.5% DSS饮用水饲喂一周后改为经高压灭菌的一般饮用水饲喂两周,重复以上循环三次诱导结肠炎。其他两组小鼠除DSS处理外在第0、7、14、21、28、35、42、49、56天分别用100 μL空脂质体或氯膦酸二钠脂质体灌肠处理,每周称体重两次,并注意观察动物健康状况变化。最后一次灌肠结束一周后(第63天)处死小鼠,立即心脏穿刺采集血液用于血清分离,肠道组织用10%福尔马林固定后用于病理切片和染色。
2.3. 病理学评价
小鼠肠道组织经石蜡包埋切片后苏木精–伊红(H&E)染色,在光学显微镜下观察炎性细胞数量、杯状细胞的减少程度、粘膜厚度、粘膜下层浸润程度、反应性异型、以及发育不良等6个方面综合评分:阴性评0分;轻度评1分;中度评2分;重度评3分。以上6项的总评分定义为炎症分值。
2.4. 免疫组织化学染色
免疫组织化学染色参考Yang等报道的方法 [19] 。小鼠肠道组织切片经脱蜡、复水后用柠檬酸缓冲液煮沸法进行抗原修复。用5%正常羊血清封闭后加适当稀释的抗体4℃孵育过夜。所用抗体分别为:巨噬细胞表面标记物F4/80兔单抗购自eBioscience;环氧合酶2 (Cyclooxygenase 2,简称COX-2)兔多抗购自Santa Cruz Biotechnology;增殖细胞核抗原(Proliferating cell nuclear antigen,简称PCNA)兔单抗为Cell Signaling Technology产品;二抗为辣根过氧化物酶标记的羊抗兔IgG (Invitrogen)。
2.5. 细胞因子测定
各组小鼠血清IL-6和TNFα测定采用酶联免疫吸附试验试剂盒(eBioscience),具体方法参照试剂盒使用说明进行,用试剂盒中的标准品制作标准曲线。血清用1×样品稀释剂10倍稀释后求样品中的IL-6和TNFα浓度。
2.6. 统计学分析
统计学分析用GraphPad Prism 5软件进行处理,实验数据以平均值 ± 标准差表示,实验组与对照组的比较用t检验,P ˂ 0.05判定为显著性差异。
3. 结果
3.1. 氯膦酸二钠脂质体灌肠可有效地清除肠道巨噬细胞
为了观察氯膦酸二钠脂质体在活体动物实验中清除巨噬细胞的效果,我们用巨噬细胞特异的表面标记物蛋白F4/80的抗体对巨噬细胞进行免疫组织化学染色,用显微镜观察F4/80阳性细胞。如图1所示,未用DSS处理的小鼠结肠组织切片中巨噬细胞非常少见(图1(a));葡聚糖硫酸钠肠炎小鼠的结肠组织中可见大量的巨噬细胞(图1(b));葡聚糖硫酸钠肠炎小鼠用空脂质体灌肠后未见巨噬细胞数量的改变(图1(c));与此相比,用氯膦酸二钠脂质体每周灌肠一次的小鼠其结肠组织中巨噬细胞数量显著减少(图1(d))。以上结果表明氯膦酸二钠脂质体可有效地清除小鼠肠道组织的巨噬细胞。
3.2. 氯膦酸二钠脂质体缓解葡聚糖硫酸钠诱导的肠炎
小鼠肠道组织切片经H&E染色显示,未经处理的对照组小鼠肠道未见任何病变(图2(a));经葡聚糖硫酸钠处理后小鼠肠道呈现严重的结肠炎特征,如肠粘膜增厚、大量炎性细胞浸润、杯状细胞减少、反应性异型以及上皮细胞发育不良等(图2(b));葡聚糖硫酸钠肠炎小鼠用空脂质体灌肠未见肠炎的改善(图2(c));而葡聚糖硫酸钠肠炎小鼠每周用氯膦酸二钠脂质体灌肠一次,其结肠炎症状得到了明显的改善(图2(d))。根据结肠炎的病理特征对小鼠大肠各段的病理改变进行量化评价,未处理的对照组除一只小鼠直肠有轻微的炎性细胞增多外(炎症分值为1;平均分值 ± SD = 0.17 ± 0.41),其余各肠段(远端结肠、中结肠及近端结肠)的平均炎症分值均为0 (图3(a)~(d))。DSS结肠炎组各肠段的平均炎症分值和空脂质体灌肠组无显著差异,均在11~13之间。而氯膦酸二钠脂质体治疗组的炎症分值和DSS肠炎组相比呈现显著的下降,其平均分值分别为:直肠2.7 ± 1.9;远端结肠4.0 ± 1.4;中结肠3.2 ± 0.9;近端结肠2.0 ± 1.3。以上结果充分证明氯膦酸二钠脂质体可有效地缓解DSS结肠炎。
3.3. 氯膦酸二钠脂质体清除巨噬细胞可减少炎性细胞因子的表达
我们以前用免疫组织化学染色法显示粪肠球菌诱导的IL-10敲除小鼠结肠癌模型中清除巨噬细胞可显著地减少TNFα的表达 [8] 。为了进一步考察用氯膦酸二钠脂质体清除巨噬细胞对DSS结肠炎小鼠的炎性细胞因子的影响,我们定量测定了结肠炎中两种主要的炎性细胞因子IL-6和TNFα [20] 的血清表达水平。如图4所示,未处理的正常小鼠血清中IL-6和TNFα的含量均极低,而DSS结肠炎小鼠血清中的IL-6和TNFα含量显著升高,分别为213.2 ± 78.6 pg/mL和296.8 ± 110.8 pg/mL。DSS肠炎小鼠用空脂质体灌肠后血清中IL-6的含量和DSS肠炎组相比略有增高,为239.0 ± 83.4 pg/mL (P ˂ 0.01);而TNFα含量并无显著差异,为298.9 ± 119.5 pg/mL,IL-6的增高有可能和脂质体成分有关。DSS肠炎小鼠用氯膦酸二

Figure 1. Liposomal clodronate enema efficiently depletes macrophages in DSS-induced murine colitis. (a) Immunohistochemical staining for F4/80, a surface marker of macrophage, in murine colon biopsies shows rare macrophages in colon biopsies from untreated mice. (b) Remarkable macrophage infiltration is observed in colon biopsies from DSS-induced colitis. (c) Sham liposomal enemas are unable to deplete macrophages in colon biopsies of DSS-induced colitis. (d) Liposomal clodronate enemas efficiently reduce number of macrophages in colon biopsies from DSS-treated mice
图1. 氯膦酸二钠脂质体有效地清除小鼠结肠炎中的巨噬细胞。小鼠肠道组织的巨噬细胞表面标志物F4/80的免疫组织化学染色显示:(a) 未经葡聚糖硫酸钠处理的正常对照组小鼠的肠道组织中偶见巨噬细胞;(b) 葡聚糖硫酸钠肠炎小鼠;(c) 空脂质体灌肠的小鼠直肠组织中可见大量巨噬细胞浸润;(d) 经氯膦酸二钠脂质体灌肠的结肠炎小鼠肠道组织中巨噬细胞数显著下降

Figure 2. Representative images of H&E staining for mouse colon biopsies. (a) Colon biopsies from untreated mouse. (b) Colon biopsies from DSS-treated mouse. (c) Colon biopsies from mouse treated with DSS and sham liposomal enemas. (d) Colon biopsies from mouse treated with DSS and liposomal clodronate enemas
图2. 小鼠肠道组织切片的苏木精–伊红染色结果。(a) 对照组;(b) DSS结肠炎;(c) DSS结肠炎小鼠给与空脂质体;(d) DSS结肠炎小鼠用氯膦酸二钠脂质体灌肠治疗

Figure 3. Pathological evaluation for DSS-induced murine colitis. (a) Rectum. (b) Distal colon. (c) Mid colon. (d) Proximal colon
图3. 小鼠结肠炎的病理学评价结果。(a) 直肠;(b) 远端结肠;(c) 中结肠;(d) 近端结肠
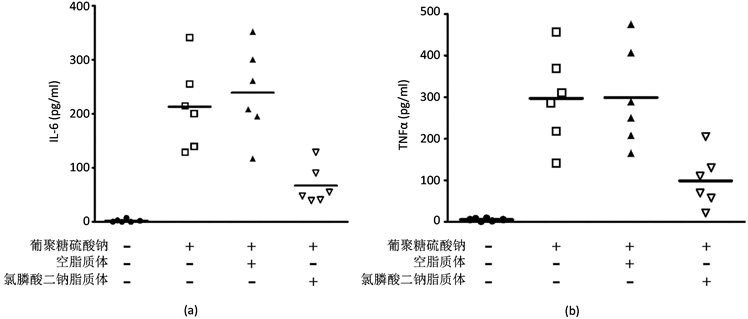
Figure 4. Analysis of IL-6 and TNFα in mouse serum using enzyme-linked immunosorbent assay (ELISA). (a) IL-6. (b) TNFα
图4. 酶联免疫吸附试验测定小鼠血清中白细胞介素6和肿瘤坏死因子α水平。(a) 白细胞介素6;(b) 肿瘤坏死因子α
钠脂质体灌肠后血清IL-6和TNFα含量均显著降低,分别为67.1 ± 35.41 pg/mL和98.9 ± 64.7 pg/mL。虽然用氯膦酸二钠脂质体清除巨噬细胞后的血清IL-6和TNFα含量与未处理的实验小鼠相比仍偏高(P ˂ 0.01),但与其他葡聚糖硫酸钠处理的小鼠相比呈现显著下降(P ˂ 0.01)。以上结果为氯膦酸二钠脂质体治疗DSS结肠炎提供了直接的证据。
3.4. 氯膦酸二钠脂质体清除巨噬细胞减少了环氧合酶2的表达
环氧合酶2在炎症反应和消化道肿瘤发生过程中具有重要的作用,可作为评价炎症反应的指标 [21] ,因此,我们对氯膦酸二钠脂质体灌肠治疗是否影响肠道组织中COX-2的表达进行了评估。用COX-2特异抗体对小鼠肠道组织切片进行免疫组织化学染色的结果表明,正常的肠道组织固有层中极少数细胞呈阳性染色反应(图5(a));葡聚糖硫酸钠诱导的结肠炎小鼠和空脂质体灌肠的结肠炎小鼠肠道组织固有层均有大量的细胞呈现COX-2阳性(图5(b)和图5(c)),表明这两组小鼠均有严重的结肠炎;与这两组相比较,用氯膦酸二钠脂质体每周灌肠一次的DSS结肠炎小鼠其肠道组织中COX-2阳性细胞数显著减少(图5(d)),证明用氯膦酸二钠脂质体清除巨噬细胞可抑制COX-2的表达从而减轻葡聚糖硫酸钠诱导的结肠炎。
3.5. 清除巨噬细胞可抑制肠道上皮细胞增生
增殖细胞核抗原(PCNA)是增殖细胞特异的标记物蛋白,可用于增殖细胞的鉴别。我们用PCNA的特异抗体对小鼠肠道组织切片进行免疫组织化学染色,发现未经DSS处理的正常小鼠的肠道粘膜只有隐窝底部的上皮细胞呈阳性,随着肠道上皮的上移,PCNA染色逐渐减弱并最终消失在上段的上皮细胞中(图6(a))。DSS肠炎小鼠以及空脂质体灌肠的小鼠肠道组织的免疫组织化学染色显示PCNA阳性细胞覆盖了整个肠粘膜(图6(b)和图6(c))。用氯膦酸二钠脂质体灌肠治疗后PCNA阳性细胞数量显著减少、肠粘膜厚度降低(图6(d))。
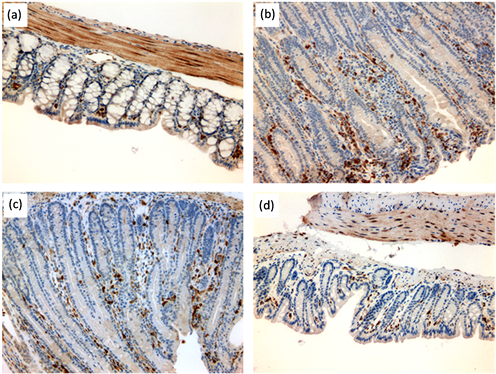
Figure 5. Immunohistochemical staining for COX-2 in murine colon biopsies. (a) Colon biopsies from untreated mouse. (b) Colon biopsies from DSS-treated mouse. (c) Colon biopsies from mouse treated with DSS and sham liposomal enemas. (d) Colon biopsies from mouse treated with DSS and liposomal clodronate enemas
图5. 小鼠肠道组织环氧合酶2的免疫组织化学染色。(a) 未经处理的小鼠肠道组织;(b) 葡聚糖硫酸钠肠炎小鼠肠道组织;(c) 空脂质体灌肠后的葡聚糖硫酸钠肠炎小鼠肠道组织;(d) 葡聚糖硫酸钠肠炎小鼠用氯膦酸二钠脂质体灌肠治疗后的肠道组织切片

Figure 6. Immunohistochemical staining for proliferating cell nuclear antigen (PCNA) in murine colon biopsies. (a) Colon biopsies from untreated mouse. (b) Colon biopsies from DSS-treated mouse. (c) Colon biopsies from mouse treated with DSS and sham liposomal enemas. (d) Colon biopsies from mouse treated with DSS and liposomal clodronate enemas
图6. 小鼠肠道组织增殖细胞核抗原的免疫组织化学染色。(a) 未经处理的小鼠结肠组织;(b) 葡聚糖硫酸钠肠炎小鼠结肠组织;(c) 空脂质体灌肠后的葡聚糖硫酸钠肠炎小鼠结肠组织;(d) 葡聚糖硫酸钠肠炎小鼠用氯膦酸二钠脂质体灌肠治疗后的结肠组织
4. 讨论
我们最近报道了一种新型氯膦酸二钠脂质体灌肠剂能有效地诱导巨噬细胞凋亡 [17] 。本研究用葡聚糖硫酸钠诱导的结肠炎小鼠模型对这种新型氯膦酸二钠脂质体灌肠剂治疗结肠炎的有效性进一步进行了评估,结果显示这种新型脂质体药物可通过清除肠道巨噬细胞而缓解葡聚糖硫酸钠引起的结肠炎。该氯膦酸二钠脂质体可显著地降低小鼠血清中的炎性细胞因子、减少炎症反应中起关键作用的COX-2的表达、抑制肠道上皮细胞的增生,从而抑制炎症反应并阻断结肠炎发展为结直肠癌的途径。
以前的研究证明在IL-10敲除小鼠模型中用市售的氯膦酸二钠脂质体清除肠道巨噬细胞可显著地缓解粪肠球菌诱导的结肠炎和结直肠癌 [8] 。IL-10是一种具有免疫抑制活性的细胞因子,敲除IL-10可导致巨噬细胞被某些肠道菌激活,同时可影响调节T细胞(Treg)和树突状细胞的发育 [22] 。如前所述,除巨噬细胞外,其它的免疫细胞如T细胞、树突状细胞以及肥大细胞等都和肿瘤的发生有关 [3] [4] [5] [6] [7] 。为了观察氯膦酸二钠脂质体灌肠剂在不同的动物模型中的有效性,本研究选用野生型小鼠,用葡聚糖硫酸钠诱导小鼠结肠炎,对我们研发的氯膦酸二钠脂质体灌肠剂的有效性进行评估。因为该模型没有预先存在的基因突变,因此具有其它基因敲除动物模型所不具备的优点。
正常的肠道巨噬细胞处于静止状态,对于维持肠道稳态非常重要。而在某些情况下,如IL-10和TGF-β等基因缺失时,肠道巨噬细胞易被肠道细菌极性化为M1巨噬细胞 [8] [23] ,M1极性化的巨噬细胞呈炎症特征,可释放多种炎性细胞因子如TNFα,IL-6,IL-1,IFN-γ以及炎性趋化因子 [23] [24] 。这些细胞因子在炎症反应和肿瘤发生过程中起着非常重要的作用 [20] 。其中IL-6和TNFα是两种重要的炎性细胞因子,在结肠炎患者中会有明显升高的IL-6和TNFα,本实验结果显示氯膦酸二钠脂质体灌肠可降低这两种炎性细胞因子的产生从而抑制DSS结肠炎。
正常的肠道上皮细胞每4~5天全部更新一次,结肠粘膜隐窝顶部的上皮细胞通过细胞凋亡而被下段的增殖细胞逐渐取代,而肠炎过程中产生的TNF-α会激活调控细胞凋亡的关键蛋白Netrin-1的表达从而抑制细胞凋亡 [13] ,因此结肠隐窝底部的细胞不断增生导致隐窝增长、粘膜增厚。肠道上皮的增生表现在PCNA阳性细胞显著增加,而氯膦酸二钠脂质体清除巨噬细胞后PCNA阳性细胞显著减少,说明氯膦酸二钠脂质体灌肠抑制了上皮细胞的增生。另外,COX-2的表达可产生各种前列腺素(Prostaglandins)如PGE2等,这些前列腺素是重要的信号传导因子可诱导细胞增生 [25] ,由于氯膦酸二钠脂质体处理减少了COX-2的表达、从而抑制了由PGE2引起的细胞增生,因此减轻了DSS诱导的结肠炎。
本研究的目的之一是探讨用灌肠给药的方式取代常规的静脉或腹腔注射给药的可行性。因为灌肠给药法可将药物直接投放到病患部位,具有其它给药方法所不具备的优点。首先,经肛门灌肠直接将药物投放到结肠减少了机体对药物的降解,药物利用效率高;其次,这种投药方式可避免药物经循环系统进入其他脏器从而减少药物对其他脏器的损害。经肛门灌肠易操作,安全性好,无液体反应等隐患,对其他脏器的损害小,为人用脂质体制剂的投药提供了重要的依据。如前所述,尽管DSS诱导的动物结肠炎模型和人类结肠炎的病理学特征非常相似,但毕竟不能完全反映不同类型的人类结肠炎的特性,所以今后的目标是人用制剂的制备和临床试验对该制剂用于治疗人类结肠炎的有效性和安全性进行进一步评估。
本研究用葡聚糖硫酸钠诱导的小鼠结肠炎模型对我们报道的新型氯膦酸二钠脂质体灌肠剂治疗小鼠结肠炎的可行性进行了研究,结果表明我们制备的氯膦酸二钠脂质体灌肠剂可有效地清除小鼠肠道组织巨噬细胞,显著地降低COX-2和血清中炎性细胞因子的表达、抑制肠道细胞增生从而缓解结肠炎的症状,可有效地治疗葡聚糖硫酸钠诱导的小鼠结肠炎。以上结果为氯膦酸二钠脂质体制剂用于人类结肠炎的治疗和结直肠癌的预防提供了充分的动物实验依据,有望开发出一种结肠炎治疗和结直肠癌预防的新药物。
致谢
感谢兰州市人才创新创业项目、人社部及甘肃省人社厅对本研究的资助和支持。
基金项目
本项目受兰州市人才创新创业项目(2014-RC-81)和人社部2015年留学人员回国创业启动支持计划资助。
文章引用
杨永红,李海波,王兴民. 氯膦酸二钠脂质体灌肠缓解葡聚糖硫酸钠诱导的结肠炎
Liposomal Clodronate Enema Ameliorates Dextran Sulfate Sodium-Induced Murine Colitis[J]. 世界肿瘤研究, 2018, 08(01): 26-35. http://dx.doi.org/10.12677/WJCR.2018.81005
参考文献 (References)
- 1. Eaden, J.A., Abrams, K.R., and Mayberry, J.F. (2001) The Risk of Colorectal Cancer in Ulcerative Colitis: A Me-ta-Analysis. Gut, 48, 526-535. https://doi.org/10.1136/gut.48.4.526
- 2. Grivennikov, S.I., Greten, F.R. and Karin, M. (2010) Immunity, Inflammation, and Cancer. Cell, 140, 883-899. https://doi.org/10.1016/j.cell.2010.01.025
- 3. Erdman, S.E., Sohn, J.J., Rao, V.P., Nambiar, P.R., Ge, Z., Fox, J.G. and Schauer, D.B. (2005) CD4+CD25+ Regulatory Lymphocytes Induce Regression of Intestinal Tumors in ApcMin/+ Mice. Cancer Research, 65, 3998-4004. https://doi.org/10.1158/0008-5472.CAN-04-3104
- 4. Garrett, W.S., Punit, S., Gallini, C.A., Michaud, M., Zhang, D., Sigrist, K.S., Lord, G.M., Glickman, J.N. and Glimcher, L.H. (2009) Colitis-Associated Colorectal Cancer Driven by T-Bet Deficiency in Dendritic Cells. Cancer Cell, 16, 208-219. https://doi.org/10.1016/j.ccr.2009.07.015
- 5. Gounaris, E., Erdman, S.E., Restaino, C., Gurish, M.F., Friend, D.S., Gounari, F., Lee, D.M., Zhang, G., Glickman, J.N., Shin, K., Rao, V.P., Poutahidis, T., Weissleder, R., McNagny, K.M. and Khazaie, K. (2007) Mast Cells Are an Essential Hematopoietic Component for Polyp Development. Pro-ceedings of the National Academy of Sciences of the United States of America, 104, 19977-19982. https://doi.org/10.1073/pnas.0704620104
- 6. Qian, B.Z. and Pollard, J.W. (2010) Macrophage Diversity En-hances Tumor Progression and Metastasis. Cell, 141, 39-51. https://doi.org/10.1016/j.cell.2010.03.014
- 7. Wu, S., Rhee, K.J., Albesiano, E., Rabizadeh, S., Wu, X., Yen, H.R., Huso, D.L., Brancati, F.L., Wick, E., McAllister, F., Housseau, F., Pardoll, D.M. and Sears, C.L. (2009) A Human Colonic Commensal Promotes Colon Tumorigenesis via Activation of T Helper Type 17 T Cell Responses. Nature Medicine, 15, 1016-1022. https://doi.org/10.1038/nm.2015
- 8. Yang, Y., Wang, X., Huycke, T., Moore, D.R., Lightfoot, S.A. and Huycke, M.M. (2013) Colon Macrophages Polarized by Commensal Bacteria Cause Colitis and Cancer through the Bystander Effect. Translational Oncology, 6, 596-606. https://doi.org/10.1593/tlo.13412
- 9. Uchida, K. (2003) 4-Hydroxy-2-Nonenal: A Product and Mediator of Oxidative Stress. Progress in Lipid Research, 42, 318-343. https://doi.org/10.1016/S0163-7827(03)00014-6
- 10. Wang, X., Allen, T.D., Yang, Y., Moore, D.R. and Huycke, M.M. (2013) Cyclooxygenase-2 Generates the Endogenous Mutagen trans-4-Hydroxy-2-nonenal in Enterococcus fae-calis-Infected Macrophages. Cancer Prevention Research, 6, 206-216. https://doi.org/10.1158/1940-6207.CAPR-12-0350
- 11. Wang, X., Yang, Y. and Huycke, M.M. (2015) Com-mensal Bacteria Drive Endogenous Transformation and Tumour Stem Cell Marker Expression through a Bystander Effect. Gut, 64, 459-468. https://doi.org/10.1136/gutjnl-2014-307213
- 12. Gasparovic, A.C., Milkovic, L., Sunjic, S.B. and Zarkovic, N. (2017) Cancer Growth Regulation by 4-Hydroxynonenal. Free Radical Biology and Medicine, 111, 226-234. https://doi.org/10.1016/j.freeradbiomed.2017.01.030
- 13. Yang, Y., Wang, X., Moore, D.R., Lightfoot, S.A. and Huycke, M.M. (2012) TNF-Mediates Macrophage-Induced Bystander Effects through Netrin-1. Cancer Research, 72, 5219-5229. https://doi.org/10.1158/0008-5472.CAN-12-1463
- 14. Zeisberger, S.M., Odermatt, B., Marty, C., Zehn-der-Fjallman, A.H., Ballmer-Hofer, K. and Schwendener, R.A. (2006) Clodronate-Liposome-Mediated Depletion of Tumour-Associated Macrophages: A New and Highly Effective Antian-Giogenic Therapy Approach. British Journal of Cancer, 95, 272-281. https://doi.org/10.1038/sj.bjc.6603240
- 15. Dammeijer, F., Lievense, L.A., Kaijen-Lambers, M.E., van Nimwegen, M., Bezemer, K., Hegmans, J.P., van Hall, T., Hendriks, R.W. and Aerts, J.G. (2017) Depletion of Tumor-Associated Macrophages with a CSF-1R Kinase Inhibitor Enhances Antitumor Immunity and Survival Induced by DC Immunotherapy. Cancer Immunology Research, 5, 535-546. https://doi.org/10.1158/2326-6066.CIR-16-0309
- 16. Wang, X., Yang, Y. and Huycke, M.M. (2017) Microbi-ome-Driven Carcinogenesis in Colorectal Cancer: Models and Mechanisms. Free Radical Biology & Medicine, 105, 3-15. https://doi.org/10.1016/j.freeradbiomed.2016.10.504
- 17. 杨永红, 李海波, 王兴民. 新型氯磷酸二钠脂质体灌肠剂诱导小鼠巨噬细胞凋亡[J]. 世界肿瘤研究, 2017, 7(4): 90-98.
- 18. Thaker, A.I., Shaker, A., Rao, M.S. and Ciorba, M.A. (2012) Modeling Colitis-Associated Cancer with Azoxymethane (AOM) and Dextran Sulfate Sodium (DSS). Journal of Visualized Experiments, No. 67, pii: 4100.
- 19. Yang, Y., Huycke, M.M., Herman, T.S. and Wang, X. (2016) Glutathione S-Transferase Alpha 4 Induction by Activator Protein 1 in Colorectal Cancer. Oncogene, 35, 5795-5806. https://doi.org/10.1038/onc.2016.113
- 20. Francescone, R., Hou, V. and Grivennikov, S.I. (2015) Cytokines, IBD, and Colitis-Associated Cancer. Inflammatory Bowel Diseases, 21, 409-418. https://doi.org/10.1097/MIB.0000000000000236
- 21. Bertagnolli, M.M., Eagle, C.J., Zauber, A.G., Redston, M., Solomon, S.D., Kim, K., Tang, J., Rosenstein, R.B., Wittes, J., Corle, D., Hess, T.M., Woloj, G.M., Boisserie, F., An-derson, W.F., Viner, J.L., Bagheri, D., Burn, J., Chung, D.C., Dewar, T., Foley, T.R., Hoffman, N., Macrae, F., Pruitt, R.E., Saltzman, J.R., Salzberg, B., Sylwestrowicz, T., Gordon, G.B. and Hawk, E.T. (2006) Celecoxib for the Prevention of Sporadic Colorectal Adenomas. The New England Journal of Medicine, 355, 873-884. https://doi.org/10.1056/NEJMoa061355
- 22. Moore, K.W., de Waal Malefyt, R., Coffman, R.L. and O’Garra, A. (2001) Interleukin-10 and the Interleukin-10 Receptor. Annual Review of Immunology, 19, 683-765. https://doi.org/10.1146/annurev.immunol.19.1.683
- 23. Ruiz, P.A., Shkoda, A., Kim, S.C., Sartor, R.B. and Haller, D. (2005) IL-10 Gene-Deficient Mice Lack TGF-Smad Signaling and Fail to Inhibit Proinflammatory Gene Expression in Intestinal Epithelial Cells after the Colonization with Colitogenic Enterococcus faecalis. The Journal of Immunology, 174, 2990-2999. https://doi.org/10.4049/jimmunol.174.5.2990
- 24. Cipriani, G., Gibbons, S.J., Kashyap, P.C. and Farrugia, G. (2016) Intrinsic Gastrointestinal Macrophages: Their Phenotype and Role in Gastrointestinal Motility. Cellular and Molecular Gastroenterology and Hepatology, 2, 120-130. https://doi.org/10.1016/j.jcmgh.2016.01.003
- 25. Greenhough, A., Smartt, H.J., Moore, A.E., Roberts, H.R., Wil-liams, A.C., Paraskeva, C. and Kaidi, A. (2009) The COX-2/PGE2 Pathway: Key Roles in the Hallmarks of Cancer and Adaptation to the Tumour Microenvironment. Carcinogenesis, 30, 377-386. https://doi.org/10.1093/carcin/bgp014