Hans Journal of Agricultural Sciences
Vol.05 No.06(2015), Article ID:16633,10
pages
10.12677/HJAS.2015.56030
The Difference in Resistance of Two Mango Cultivars to Anthracnose Disease and Its Physiology Mechanism Involved
Deqiang Gong1,2,3*, Guangping Huang1, Libao Deng1, Xionghui Li1, Xiao Wang1, Qingzhi Liang2, Shijiang Zhu3
1Management Committee of Baise National Agricultural Science and Technology Zone of Guangxi, Baise Guangxi
2South Subtropical Crops Research Institute, CATAS/Hainan Province Key Laboratory for Postharvest Physiology and Technology of Tropical Horticultural Products, Zhanjiang Guangdong
*通讯作者。
3College of Horticulture, South China Agricultural University, Guangzhou Guangdong

Received: Sep. 9th, 2015; accepted: Dec. 25th, 2015; published: Dec. 29th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objectives: The difference in resistance of two mango cultivars to anthracnose and the possible physiology mechanism involved were studied to provide theoretical references for controlling postharvest diseases of mango fruit by using the technology of induced disease resistance. Methods: The difference in the resistance between two mango cultivars (“Zill” and “Keitt”) to postharvest disease was examined by inoculation or non-inoculation with pathogen Colletotrichum gloeosporioides, and the defense enzyme activities of phenylalanine ammonia lyase (PAL), peroxidase (POD), and polyphenol oxidase (PPO) and the contents of hydrogen peroxide (H2O2), total phenolic compounds and lignin during fruit development and storage were determined. Results: The results showed that in fruits inoculated with C. gloeosporioides, the lesion size on “Keitt” fruit was smaller than that on “Zill”; in non-inoculated fruits, the disease index of “Keitt” was lower than that of “Zill”. This indicated “Keitt” was more disease resistant than “Zill”. Compared with “Zill”, “Keitt” showed higher enzymatic activities of PAL, POD, and PPO and the accumulation of more H2O2, total phenolic compounds and lignin content in fruits during fruit development and storage. Conclusions: These results suggest that “Keitt” is more disease resistant than “Zill” to anthracnose and the defense enzymes and antifungal substance probably play an important role in the resistance of mango fruits to anthracnose infection.
Keywords:Mango, Disease Resistance, Anthracnose, Defense Enzymes, Antifungal Substance

2个芒果品种果实对炭疽病的抗性差异及其相关生理基础
弓德强1,2,3*,黄光平1,邓立宝1,李雄辉1,王晓1,梁清志2,朱世江3
1广西百色国家农业科技园区管理委员会,广西 百色
2中国热带农业科学院南亚热带作物研究所/海南省热带园艺产品采后生理与保鲜重点实验室,广东 湛江
3华南农业大学园艺学院,广东 广州

收稿日期:2015年9月9日;录用日期:2015年12月25日;发布日期:2015年12月29日

摘 要
目的:研究2个芒果品种果实对炭疽病的抗性差异及其相关生理基础,为利用抗病性诱导技术防治芒果采后病害提供理论依据。方法:以两个芒果品种“吉禄(Zill)”和“凯特(Keitt)”为试材,通过人工接种和未接种芒果炭疽菌的方式,比较2个品种芒果采后抗病性的差异,并测定了两个芒果品种在果实发育和贮藏过程中苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)等防御酶的活性以及过氧化氢(H2O2)、总酚和木质素等次生抗菌物质含量的变化。结果:对接种炭疽菌的芒果果实,“凯特”芒果的病斑直径显著小于“吉禄”芒果,对未接种炭疽菌的芒果果实,“凯特”芒果的病情指数显著小于“吉禄”芒果,表明“凯特”芒果果实对炭疽病的抗性强于“吉禄”芒果;与“吉禄”芒果相比,在果实发育和贮藏过程中“凯特”芒果果实有较高的苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)等防御酶的活性以及过氧化氢(H2O2)、总酚和木质素等次生抗菌物质的含量。结论:“凯特”芒果对炭疽病的抗性强于“吉禄”芒果,并且这些防御酶和抗性物质可能在芒果果实对炭疽菌侵染的抗性反应中起着重要的作用。
关键词 :芒果,抗病性,炭疽病,防御酶,抗性物质

1. 引言
芒果(Mangifera indica L.)属于呼吸跃变型果实,采后呼吸代谢比较旺盛,容易后熟而变黄变软。随着芒果果实的成熟和衰老,果实对病害的抗性逐渐减弱[1] 。芒果在田间生长过程中容易遭受病原微生物的潜伏侵染,导致果实采后成熟过程中病害的发生,造成严重的经济损失。由Colletotrichum gloeoporioides引起的炭疽病是芒果采后病害中危害最严重的一种病害[2] 。目前,在实际生产中最常采用化学杀菌剂来控制芒果炭疽病。但人们逐渐发现使用化学杀菌剂带来了各种问题如环境污染、农药残留以及病原菌抗药性等,从而开始限制化学杀菌剂的大量使用[3] 。因此,寻求新型环保高效的防病保鲜技术,以取代或减少化学杀菌剂在芒果防腐保鲜上的使用,具有重要的经济意义、生态意义和社会意义。近年来,抗病性诱导技术已经引起越来越多科技人员的重视。由于不同品种的抗病性存在差异,利用不同果蔬自身的固有抗病性是控制采后损失的安全、有效的措施之一[4] 。利用各种诱抗因子提高果实的自身抗病能力可以实现控制芒果采后病害发生的目的[5] 。因此,研究芒果抗病性差异及其相关生理机制,对利用抗病性诱导技术防治芒果采后炭疽病具有重要的理论意义。“吉禄(Zill)”和“凯特(Keitt)”是从国外引进的两个晚熟芒果品种,原产于美国佛罗里达州,在广西、四川和云南有大量种植。尽管这两个品种的抗炭疽病差异在以前已经被研究报道[6] ,即“凯特”抗病性强于“吉禄”,但是采后芒果果实对炭疽病侵染的抗性机理尚未弄清楚。许多研究表明,防御酶系统在果实的抗病性中起着重要的作用。如苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)等防御酶活性的提高与香蕉和桃果实采后抗病性的增强密切相关[4] [7] 。另外,过氧化氢(H2O2)、总酚和木质素等抗性物质的含量与抗病性的强弱密切相关,抗病性强的果实这些物质含量越高[7] -[9] 。目前,防御系统在不同品种芒果的采后抗病性中的作用有待进一步研究。为了能够利用各种诱抗因子诱导芒果果实提高自身的抗病能力,从而有效防止果实采后炭疽病的危害,我们有必要对这两个品种果实采后抗病性的差异及其相关生理机制进行研究。我们以芒果品种“吉禄”和“凯特”为试材,采用人工接种炭疽菌和自然贮藏相结合的方法,研究2个芒果品种对炭疽病的抗性差异及其与抗病性有关的PAL、POD和PPO等防御酶的活性和H2O2、总酚和木质素等抗性物质含量的关系,为利用抗病性诱导技术防治芒果采后炭疽病提供理论依据。
2. 材料与方法
2.1. 试材与处理
试验于2014年在广西百色市田阳县百育镇的一个芒果生产园中进行。试材选树势健壮,生长较为一致,12年生晚熟芒果(Mangifera indica L.)树“吉禄”和“凯特”各5株,进行常规栽培管理。从芒果盛花后第8周(5月30日,此时果实发育已完成膨大期)开始采样,每2周采样1次,共采样6次。每个品种分别在树外围随机选果30个,带果柄采收后运回实验室。剪留果柄约1~2 cm,然后选取大小均匀、无病虫害、无机械损伤、色泽、成熟度基本一致的果实作为试验用果。果实用自来水冲洗后晾干,选取10个芒果果实分离果皮,切成小片后立即用液氮速冻处理,于−80℃冰箱中保存,待测。其中于8月8日最后一次采样(约八成熟)的芒果果实随机分成2组,一组用炭疽菌(Colletotichum gloeosporioides Penz.)接种处理,一组不接菌。接种方法如下:供试芒果炭疽菌菌种分离自腐烂芒果病健交界处,纯化后,用PDA (potato dextrose agar)培养基培养至形成菌落,于4℃冰箱保存。菌种转移至盛有PDA培养基的培养皿28℃的上培养7~10 d,肉眼观察到基质表面形成朱红色的分生孢子团,用消毒过的刀片刮下孢子,用无菌水配成孢子浓度为1 × 106个孢子/mL的悬浮液10 mL。果实洗净晾干后,在每个果实的中部使用3枚组合在一起的梅花状大头针在表面刺伤一个点(深度约2 mm)。待刺伤点不再流出白色汁液时,用移液枪注入10 μL炭疽菌孢子悬浮液。每个品种接种10个果,重复3次。接菌和不接菌的果实均外套厚0.02 mm打孔的聚乙烯薄膜袋,并置于22℃ ± 1℃、85%~95% RH的培养箱中。定期观察发病情况,测量果实接种点的病斑直径(mm),调查未接菌芒果的病情指数。接菌的果实每3 d取果皮样1次,于−80℃冰箱中保存,待测。
2.2. 芒果病情指数计算
参照弓德强等[10] 的方法,将病情按轻重分为5级:0级,不发病;1级,病斑面积占果实面积5%以下;2级,病斑面积占果实面积6%~10%;3级,病斑面积占果实面积11%~20%;4级,病斑面积占果实面积20%以上。病情指数 = [S(病害级值 × 病害果数) × 100]/(病害最高级值 × 总果数)。
2.3. 芒果抗病相关酶活性的测定
PAL活性测定参照Tian等[5] 的方法,以OD290每小时增加0.01作为一个酶活性单位(U);POD活性测定参考Polle等[11] 的方法,以OD470每分钟增加0.01表示一个酶活力单位(U);PPO活性测定参考Galeazzi等[12] 的方法,以OD398每分钟增加0.01表示一个酶活力单位(U)。酶的活性均以U/gFW表示。
2.4. 过氧化氢(H2O2)、总酚和木质素含量的测定
过氧化氢(H2O2)含量的测定参照Prochazkova等[13] 的方法,结果以μmol/gFW表示;总酚含量测定参照Pirie和Mullins [14] 的方法,用没食子酸作标准曲线,结果表示为每克鲜样质量含有没食子酸等效物的毫克数;木质素含量测定参照Lee等[15] 的方法,结果以OD280/mgDW表示。
以上指标测定均重复3次。
2.5. 数据分析
用Excel 2003统计分析所有数据,计算标准误并制图;应用DPS v3.01数据处理系统对数据进行方差分析(ANOVA),利用Duncan’s新复极差法对差异显著性进行分析。
3. 结果与分析
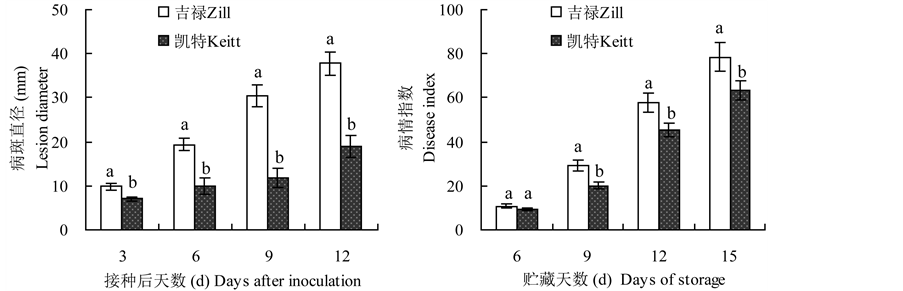
3.1. 芒果果实病斑直径和病情指数的变化
由图1(a)可以看出,对采后接种炭疽菌的芒果果实,在接菌后3~12 d,“凯特”芒果果实的病斑直径均显著小于“吉禄”芒果(P < 0.05)。由图1(b)可以看出,对未接菌的芒果果实,在贮藏及后熟过程中,“凯特”芒果果实的病情指数除贮藏3 d时与“吉禄”芒果无显著差异外,其余时间均显著小于“吉禄”芒果(P < 0.05)。结果表明,“凯特”芒果果实采后对炭疽病的抗性强于“吉禄”芒果。
3.2. 芒果果实发育和贮藏过程中PAL活性的变化
从图2(a)可以看出,在果实发育过程中,“吉禄”芒果PAL活性呈现先下降后上升之后又缓慢下降的趋势;“凯特”芒果PAL活性在发育前期(花后8~10 w)呈快速上升趋势,之后呈缓慢下降趋势,在果实发育的后期(花后18 w),“凯特”芒果PAL活性显著高于“吉禄”芒果,达到显著水平(P < 0.05)。从图2(b)可以看出,在果实采后贮藏过程中,“吉禄”芒果PAL活性呈现先上升后下降的变化趋势,贮藏9 d时达到最大;“凯特”芒果PAL活性在贮藏前期(0~6 d)急剧下降,然后上升至9 d时达到一个峰值,随后又下降,除贮藏6 d和12 d时与“吉禄”芒果无显著差异外,其余时间均显著高于“吉禄”芒果(P < 0.05)。
3.3. 芒果果实发育和贮藏过程中POD活性的变化
从图3(a)可以看出,在果实发育过程中,“吉禄”芒果POD活性呈现先缓慢下降后急速上升又下降的趋势,发育中期(花后14 w) POD活性最高;“凯特”芒果在发育前期(花后8 w~12 w) POD活性急速下降,花后14 w后呈缓慢上升趋势,除花后14 w时与“吉禄”芒果无显著差异外,其余时期均显著高于“吉禄”芒果(P < 0.05)。从图3(b)可以看出,在果实采后贮藏过程中,“吉禄”芒果POD活性变化波动不大,而“凯特”芒果POD活性在贮藏前期(0~3 d)急剧升高,在3 d时达到峰值,随后迅速降低,后期又趋于平缓,在整个采后贮藏中,“凯特”芒果POD活性均显著高于“吉禄”芒果(P < 0.05)。
3.4. 芒果果实发育和贮藏过程中PPO活性的变化
从图4(a)可以看出,在果实发育过程中,两芒果品种果实PPO活性变化趋势基本一致,都呈现先缓
 (a) (b)注:柱状图上不同字母表示品种间差异达5%显著水平。Note: Different letters above the bars are significantly different at the 5% level.
(a) (b)注:柱状图上不同字母表示品种间差异达5%显著水平。Note: Different letters above the bars are significantly different at the 5% level.
Figure 1. Changes of the lesion size in mango fruits inoculated with C. gloeosporioides and the disease index in mango fruits during storage
图1. 芒果果实接菌后病斑直径(a)和贮藏期间病情指数(b)的变化
 (a) (b)注:星号表示品种间差异达5%显著水平,下同。Note: Asterisks indicate statistically significant differences between cultivars at each time-point at the 5% level, the same below.
(a) (b)注:星号表示品种间差异达5%显著水平,下同。Note: Asterisks indicate statistically significant differences between cultivars at each time-point at the 5% level, the same below.
Figure 2. Changes of PAL activity in mango fruits during development (a) and storage (b)
图2. 芒果果实发育(a)和贮藏(b)过程中PAL活性的变化
 (a) (b)
(a) (b)
Figure 3. Changes of POD activity in mango fruits during development (a) and storage (b)
图3. 芒果果实发育(a)和贮藏(b)过程中POD活性的变化
 (a) (b)
(a) (b)
Figure 4. Changes of PPO activity in mango fruits during development (a) and storage (b)
图4. 芒果果实发育(a)和贮藏(b)过程中PPO活性的变化
慢上升后下降的趋势,而“凯特”芒果在整个发育阶段PPO活性均显著高于“吉禄”芒果(P < 0.05)。从图4(b)可以看出,在果实采后贮藏过程中,两芒果品种果实PPO活性变化趋势基本一致,都呈现降-升-降的变化趋势,在采后贮藏前期(0~3 d),“凯特”芒果PPO活性显著高于“吉禄”芒果(P < 0.05)。
3.5. 芒果果实发育和贮藏过程中过氧化氢含量的变化
从图5(a)可以看出,在果实发育过程中,“吉禄”芒果果实H2O2含量变化呈现先缓慢下降后上升的趋势,而“凯特”芒果在整个发育阶段H2O2含量呈缓慢下降的趋势,并且均显著高于“吉禄”芒果(P < 0.05)。从图5(b)可以看出,在果实采后贮藏过程中,“吉禄”芒果果实H2O2含量呈现先缓慢下降后上升的变化趋势,而“凯特”芒果H2O2含量在贮藏前期(0~3 d)急剧升高,在3 d时达到峰值,随后迅速降低,贮藏9 d后又有所回升,在整个采后贮藏中,“凯特”芒果H2O2含量均显著高于“吉禄”芒果(P < 0.05)。
3.6. 芒果果实发育和贮藏过程中总酚含量的变化
从图6(a)可以看出,在果实发育过程中,“吉禄”芒果果实总酚含量呈先上升后缓慢下降最后又上升的趋势,而“凯特”芒果总酚含量总体呈缓慢下降的趋势,并且整个发育阶段均显著高于“吉禄”芒果(P < 0.05)。从图6(b)可以看出,在果实采后贮藏过程中,“吉禄”芒果果实总酚含量呈缓慢下降的变化趋势,而“凯特”芒果总酚含量下降不明显,并且在贮藏后期(9~12 d)显著高于“吉禄”芒果(P < 0.05)。
3.7. 芒果果实发育和贮藏过程中木质素含量的变化
从图7(a)可以看出,在果实发育过程中,“吉禄”芒果果实木质素含量呈先缓慢下降后又缓慢上升的趋势,而“凯特”芒果木质素含量呈上升后下降最后又缓慢上升的趋势,并且整个发育阶段均显著高于“吉禄”芒果(P < 0.05)。从图7(b)可以看出,在果实采后贮藏过程中,芒果果实木质素含量总体呈逐渐上升的变化趋势,并且“凯特”芒果木质素含量在贮藏大部分时期(0~9 d)均显著高于“吉禄”芒果(P < 0.05)。
4. 讨论
不同的芒果品种对炭疽病的抗性差异很大,前期的抗病性鉴定表明,“吉禄”为感病品种(Susceptible, S),凯特为中抗品种(Resistant, R) [6] 。本试验研究也得出了相似的结果,结果显示:对接种炭疽菌的芒果果实,“凯特”芒果的病斑直径显著小于“吉禄”芒果,对未接种炭疽菌的芒果果实,“凯特”芒果
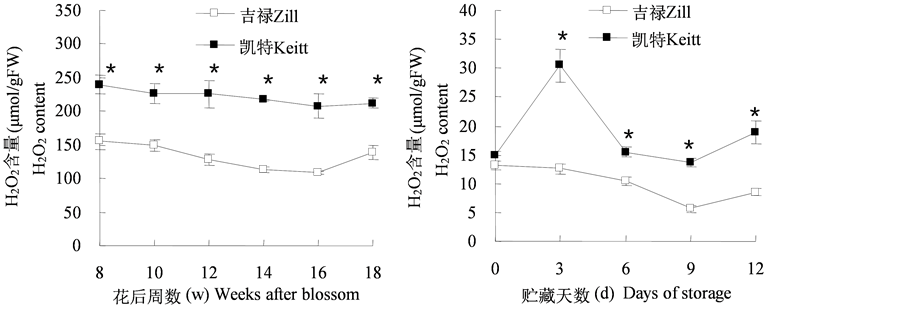 (a) (b)
(a) (b)
Figure 5. Changes of H2O2 content in mango fruits during development (a) and storage (b)
图5. 芒果果实发育(a)和贮藏(b)过程中过氧化氢含量的变化
 (a) (b)
(a) (b)
Figure 6. Changes of total phenolic content in mango fruits during development (a) and storage (b)
图6. 芒果果实发育(a)和贮藏(b)过程中总酚含量的变化
 (a) (b)
(a) (b)
Figure 7. Changes of lignin content in mango fruits during development (a) and storage (b)
图7. 芒果果实发育(a)和贮藏(b)过程中木质素含量的变化
的病情指数显著小于“吉禄”芒果,表明“凯特”芒果果实对炭疽病的抗性强于“吉禄”芒果。因此,“凯特”芒果果实采后对炭疽病的抗性强于“吉禄”芒果,该结论是进一步验证了前人的研究结果。然而,目前关于这两个品种芒果果实采后抗病性差异的生理基础研究很少,深入探讨芒果不同品种的抗病性及其相关机制,对利用抗病性诱导技术控制芒果采后病害的研究和应用具有巨大的推动作用。
已有研究表明,防御酶(如PAL、PPO和POD等)活性的提高与果实采后抗病性的增强密切相关[4] 。PAL是苯丙烷代谢途径中的关键酶和限速酶,参与合成酚类、植保素、黄酮和木质素等抗菌物质,这些物质与植物的防卫反应及抗病性密切相关[16] [17] 。POD和PPO主要参与酚的氧化,形成对病菌毒性较高的醌类物质,并参与木质素的合成,使细胞壁增厚来抵御病菌的侵入和扩展从而抑制发病,其活性与抗病性有密切关系[9] 。在本研究中,“凯特”芒果的防御酶活性(PAL、POD和PPO)在果实发育以及贮藏过程中尤其是贮藏前期显著高于“吉禄”芒果,表明这些防御酶的活性与芒果抗病性密切关系,防御酶活性的升高有利于增强芒果果实对炭疽菌的抗性。这为利用各种诱抗因子诱导芒果果实提高自身的抗病能力提供了很好的借鉴。目前已经有研究表明,利用抗病性诱导剂水杨酸(SA)及其功能类似物苯并噻重氮(BTH)处理均能提高采后芒果果实的抗病性,并且抗病性的增强与诱导这些防御酶活性的升高密切相关[9] [10] [18] 。研究也发现,SA采前喷施和采后浸泡,都能显著增加甜樱桃果实中PAL、POD和(GLU)的活性,提高采后果实的抗病性[19] 。
PAL、POD和PPO都参与了果实内次生代谢物质如酚类物质和木质素的生物合成[16] [20] 。酚类物质(如羟基苯甲酸,羟基肉桂酸派生物,黄酮类等)是产生抗病机制中的一些功能成分。羟基肉桂酸是植物细胞壁高分子如木质素、木栓质和角质等的组成成分,构成了细胞防御病菌入侵的物理障碍[21] 。另外,H2O2作为抗病信号分子在抗病反应中起着重要作用;同时,H2O2本身可参与抗菌物质的合成,并参与POD作用下的细胞壁物质的氧化交联反应,形成结构性屏障以阻止病原菌的进一步扩展[8] [16] 。H2O2含量的积累有助于增强植物组织的抗病性[7] [18] ,H2O2的积累与果实的抗病性密切相关,抗病性强的果实H2O2含量较高[8] 。我们的研究结果表明,“凯特”芒果果实木质素、总酚和H2O2含量在整个果实发育阶段和采后贮藏过程中的大部分时间都显著高于“吉禄”芒果,表明这些次生代谢物质和信号物质H2O2可能参与了芒果果实的抗病性。许多研究也表明,通过诱抗剂诱导果实木质素、总酚和内源H2O2含量的升高,可以激发采后果实的抗病性,并诱导其抗病反应[7] [22] [23] 。汪跃华等[24] 研究表明0.5 g/L β-氨基丁酸(BABA)处理能提高采后砂糖桔对青霉菌的抗病性,不仅诱导果实PAL、PPO、POD等防御酶活性的提高,而且促进了H2O2含量的大量累积。这些结果都表明,防御系统(包括防御酶的激活、活性氧的积累及抗菌物质的合成)与果实抗病性密切相关,在采后果实对病原菌侵染的抗性中起着重要的作用。目前,关于芒果果实采后抗病性及及其诱导机制的研究还相对滞后,在分子水平上研究非常缺乏,从分子生物学的角度了解抗病性的诱导机制以及参与抗性的基因表达有待进一步深入研究。
5. 结论
“凯特”芒果对炭疽病的抗性强于“吉禄”芒果,并且在果实发育和后熟阶段的大部分时期,“凯特”芒果比“吉禄”芒果具有更高的PAL、POD和PPO等防御酶活性和H2O2、总酚和木质素等次生抗菌物质含量,表明防御酶系统可能在采后芒果果实对炭疽菌侵染的抗性中起着重要的作用。
基金项目
海南省自然科学基金项目(314108);中央级公益性科研院所基本科研业务费专项资金(SSCRI 200713,1630062014015);广西科学研究与技术开发计划项目(桂科能1222020-1)。
文章引用
弓德强,黄光平,邓立宝,李雄辉,王 晓,梁清志,朱世江. 2个芒果品种果实对炭疽病的抗性差异及其相关生理基础
The Difference in Resistance of Two Mango Cultivars to Anthracnose Disease and Its Physiology Mechanism Involved[J]. 农业科学, 2015, 05(06): 207-216. http://dx.doi.org/10.12677/HJAS.2015.56030
参考文献 (References)
- 1. Prusky, D. (1996) Pathogen Quiescence in Postharvest Diseases. Annual Review of Phytopathology, 34, 413-434. http://dx.doi.org/10.1146/annurev.phyto.34.1.413
- 2. 梁清志, 文定清, 刘丽琴. 广西芒果主要病虫害及其防治[J]. 中国南方果树, 2014(5): 127-130.
- 3. 刘新华, 潘永贵, 祖鹤, 夏兵. 不同品种芒果采后抗炭疽病最适BTH浓度研究[J]. 西南大学学报(自然科学版), 2009(7): 7-11.
- 4. Zhu, S.J. and Ma, B.C. (2007) Benzothiadiazole or Methyl Jasmonate-Induced Resistance to Colletotrichum musae in Harvested Banana Fruit Is Related to Elevated Defense Enzyme Activities. Journal of Horticultural Science and Biotechnology, 4, 500-506.
- 5. Tian, S.P., Wan, Y.K., Qin, G.Z. and Xu, Y. (2006) Induction of Defense Responses against Alternaria Rot by Different Elicitors in Harvested Pear Fruit. Applied Microbiology and Biotechnology, 70, 729-734. http://dx.doi.org/10.1007/s00253-005-0125-4
- 6. 雷新涛, 赵艳龙, 姚全胜, 何衍彪, 孙光明, 马蔚红, 王松标, 王一承, 罗文杨, 詹儒林. 芒果抗炭疽病种质资源的鉴定与分析[J]. 果树学报, 2006(6): 838-842.
- 7. Jin, P., Zheng, Y.H., Tang, S.S., Rui, H.J. and Wang, C.Y. (2009) Enhancing Disease Resistance in Peach Fruit with Methyl Jasmonate. Journal of the Science of Food and Agriculture, 89, 802-808. http://dx.doi.org/10.1002/jsfa.3516
- 8. Torres, R., Valentines, M.C., Usall, J., Vinas, I. and Larrigaudiere, C. (2003) Possible Involvement of Hydrogen Peroxide in the Development of Resistance Mechanisms in “Golden Delicious” Apple Fruit. Postharvest Biology and Technology, 27, 235-242. http://dx.doi.org/10.1016/S0925-5214(02)00110-2
- 9. Lin, J.H., Gong, D.Q., Zhu, S.J., Zhang, L.J. and Zhang, L.B. (2011) Expression of PPO and POD Genes and Contents of Polyphenolic Compounds in Harvested Mango Fruits in Relation to Benzothiadiazole-Induced Defense against Anthracnose. Scientia Horticulturae, 130, 85-89. http://dx.doi.org/10.1016/j.scienta.2011.06.014
- 10. 弓德强, 谷会, 张鲁斌, 王松标, 詹儒林, 朱世江. 苯并噻重氮对采后芒果抗病性及相关酶活性的影响[J]. 果树学报, 2010(4): 585-590.
- 11. Polle, A., Tilman, T. and Seifert, F. (1994) Apoplastic Peroxidases and Lignification in Needles of Norway Spruce (Picea abies L.). Plant Physiology, 106, 53-60.
- 12. Galeazzi, M.A.M., Sgarbieri, N. and Constantinides, S.M. (1981) Isolation, Purification and Physiochemical Characterization of Polyphenol Oxidase (PPO) from a Dwarf Variety of Banana (Musa cavendishii L). Journal of Food Science, 46, 150-155. http://dx.doi.org/10.1111/j.1365-2621.1981.tb14551.x
- 13. Prochazkova, D., Sairam, R.K., Srivastava, G.C. and Singh, D.V. (2001) Oxidative Stress and Antioxidant Activity as the Basis of Senescence in Maize Leaves. Plant Science, 161, 765-771. http://dx.doi.org/10.1016/S0168-9452(01)00462-9
- 14. Pirie, A. and Mullins, M.G. (1996) The Possibility of Ex-ploiting Some Methods which Protect Beta-Carotene in Stored Leaf Protein. Italian Journal of Food Science, 8, 83-88.
- 15. Lee, B.R., Kim, K.Y., Jung, W.J., Avice, J.C., Ourry, A. and Kim, T.H. (2007) Peroxidases and Lig-nification in Relation to the Intensity of Water-Deficit Stress in White Clover (Trifolium repens L.). Journal of Exper-imental Botany, 58, 1271-1279. http://dx.doi.org/10.1093/jxb/erl280
- 16. Milosevic, N. and Slusarenko, A.J. (1996) Active Oxygen Metabolism and Lignification in the Hypersensitive Response in Bean. Physiological and Molecular Plant Pathology, 49,143-158. http://dx.doi.org/10.1006/pmpp.1996.0045
- 17. 汪开拓, 郑永华, 唐文才, 李廷君, 张 卿, 尚海涛. 茉莉酸甲酯处理对葡萄果实NO和H2O2水平及植保素合成的影响[J]. 园艺学报, 2012(8): 1559-1566.
- 18. Zeng, K.F., Cao, J.K. and Jiang, W.B. (2006) Enhancing Disease Resistance in Harvested Mango (Mangifera indica L. cv. “Matisu”) Fruit by Salicylic Acid. Journal of the Science of Food and Agriculture, 86, 694-698. http://dx.doi.org/10.1002/jsfa.2397
- 19. Yao, H.J. and Tian, S.P. (2005) Effects of Pre- and Post-Harvest Application of Salicylic Acid or Methyl Jasmonate on Inducing Disease Resistance of Sweet Cherry Fruit in Storage. Post-harvest Biology and Technology, 35, 253-262. http://dx.doi.org/10.1016/j.postharvbio.2004.09.001
- 20. Lurie, S., Fallik, E., Handros, A. and Shapira, R. (1997) The Possible Involvement of Peroxidase in Resistance to Botrytis cinerea in Heat Treated Tomato Fruit. Physiological and Molecular Plant Pathology, 50, 141-149. http://dx.doi.org/10.1006/pmpp.1996.0074
- 21. Parr, A.J. and Bolwell, G.P. (2000) Phenols in the Plant and in Man. The Potential for Possible Nutritional Enhancement of the Diet by Modifying the Phenols Content or Profile. Journal of the Science of Food and Agriculture, 80, 985-1012. http://dx.doi.org/10.1002/(SICI)1097-0010(20000515)80:7<985::AID-JSFA572>3.0.CO;2-7
- 22. Zhu, X., Cao, J., Wang, Q. and Jiang, W. (2008) Postharvest Infiltration of BTH Reduces Infection of Mango Fruits (Mangifera indica L. cv. Tainong) by Colletotrichum gloeosporioides and Enhances Resistance Inducing Compounds. Journal of Phytopathology, 156, 68-74. http://dx.doi.org/10.1111/j.1439-0434.2007.01320.x
- 23. 弓德强, 谷会, 张鲁斌, 洪克前, 朱世江.采前BTH处理对芒果果实抗病性的诱导[J]. 热带作物学报, 2012(7): 1250-1255.
- 24. 汪跃华, 徐兰英, 庞学群, 张昭其. BABA处理提高采后砂糖桔对青霉菌的抗病性[J]. 食品科技, 2011(3): 34-37.