Hans Journal of Agricultural Sciences
Vol.07 No.01(2017), Article ID:19721,9
pages
10.12677/HJAS.2017.71005
Optimization of Conditions of Carotenoid Production by Rhodotorula mucilaginosa
Yin-Feng Chen, Yuan-Tay Shyu, Sz-Jie Wu*
Department of Horticulture and Landscape Architecture, National Taiwan University, Taipei Taiwan

Received: Jan. 27th, 2017; accepted: Feb. 13th, 2017; published: Feb. 16th, 2017

ABSTRACT
Carotenoids are natural pigments found in many fruits and vegetables. These important nutrients play significant roles in mental and physical health of humans. The advantages of microbial production of carotenoids are short cycles, easy to retrieve, and not affected by climate. For this study, a colony of pigment-producing red yeast, Rhodotorula mucilaginosa, was screened from fruits and vegetables as a strain of fungi with the potential to produce carotenoids. This study discussed the optimization of carotenoid production in Rhodotorula mucilaginosa. A 0.1% inoculum of the yeast was shaken in a shake flask at 125 rpm. The controlled conditions of culture were the following: temperature, 27.5˚C; pH 5.0; carbon source, 15 g/L glucose; and nitrogen source, 2.5 g/L yeast extract. The optimal time for pigment collection was 24 hours after the yeast had reached the stationary phase of growth. Pigment production was 1469.29 μg·L−1. When a culture is subjected to stress, its biomass and physiological metabolism changes. Therefore, after the culture had reached the stationary phase of growth, different amounts of stress were applied to obtain higher pigment accumulation. The stress conditions tested included a six-hour short-term high temperature of 37˚C, a six-hour short-term low temperature of 10˚C, and cultivation at a sustained low temperature of 22.5˚C. The results showed that short-term temperature changes could not effectively increase pigment accumulation in yeast cells. After 72 hours of incubation, continued cultivation at a sustained low temperature of 22.5˚C could increase pigment production to a maximum of 1533.27 μg·L−1. High pigment production was prolonged and sustained, while degradation of pigment slowed. The results of this study can potentially be used in future in continuous fermentation to extend high pigment yield times and sustain pigment production.
Keywords:Rhodotorula mucilaginosa, Carotenoids
胶红酵母生产类胡萝卜素最适化探讨
陈尹丰,徐源泰,吴思节*
台湾大学园艺暨景观学系,台湾 台北

收稿日期:2017年1月27日;录用日期:2017年2月13日;发布日期:2017年2月16日

摘 要
类胡萝卜素为许多蔬果所具有的天然色素,是重要营养物质并对于人体身心健康扮演重要角色。以微生物生产色素具有短周期、易于回收且不受气候影响等优势。本研究自蔬果中,筛选得一个产色菌落为胶红酵母(Rhodotorula mucilaginosa),为一株具有生产类胡萝卜素潜力之真菌。研究中探讨生产类胡萝卜素最适化探讨,以接种量0.1%、转速125 rpm摇瓶培养,控制条件温度于27.5℃、pH 5.0、碳源为15 g/L Glucose、氮源为2.5 g/L Yeast extract条件下,菌生长到静止期(stationary phase)后24小时为最佳色素收菌时间,可得1469.29 μg/L色素产量。当菌株给予逆境刺激可改变菌株培养的生物量和其生理代谢,待菌体生长至稳定期后,给予不同逆境处理,以期得到较高的色素累积量,试验以短时高温37℃逆境六小时、短时低温10℃逆境六小时和持续低温22.5℃培养。研究得知,短时温度变化无法有效提升菌体色素产量的累积,而培养72小时后,再以22.5℃持续培养,可提升色素产量最高至1533.27 μg/L,并延长维持色素之高产量且减缓菌体色素的降解,此研究结果应用于未来连续发酵生产上,可延长色素高收率时间与维持色素产量的潜力。
关键词 :胶红酵母,类胡萝卜素

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
食用色素为食品添加物功能分类下之重要着色剂,依来源不同可分为两大类:人工色素和天然色素,食用天然色素主要是从动植物细胞和微生物细胞中分离萃取而来。在天然食用色素里类胡萝卜素(Carotenoids)是一类呈现淡黄、橙色至深红色的天然色素。大部分约为四十个碳原子组成的多烯类化合物,主结构单元为异戊二烯,具有抗氧化特性、预防心血管疾病、增强免疫功能等生物活性 [1] ,依不同目的,常添加于动物饲料、保健食品、化妆品中。在目前日益重视食品、药品的天然、无毒、健康等要求下,天然类胡萝卜素的需求于全球市场上占一定重要性。
因近年来消费者对于合成色素的疑虑,使得食品工业渐渐以天然色素来取代合成色素 [2] 。一般情况下,天然色素多由植物材料萃取,而其他如昆虫、藻类、细菌、真菌亦为类胡萝卜素素的萃取来源 [3] 。其中,利用微生物发酵生产类胡萝卜素具营养需求简单、生长周期短、易调控生长条件、不受外在自然环境影响等优点 [4] ,使得利用微生物生产多样化色素之相关研究相继展开 [5] [6] 。故以微生物发酵法生产食用天然色素将可能成为色素食品添加物的重要来源。
目前已商业化生产类胡萝卜素之菌株,为三孢布拉霉菌(Blakeslea trispora) [7] 经研究证实无细胞毒性,是唯一在俄罗斯(Russia)、乌克兰(Ukraine)、西班牙(Spain)等国家先行实施工业化生产的菌株。但因发酵过程复杂在色素生产的过程上难度增加 [8] [9] 。故研究者陆续开发其他具有产类胡萝卜素潜力之微生物,以期降低培养过程中之生产成本和发酵问题。
研究从蔬果中分离纯化具产色能力的胶红酵母菌,以作为类胡萝卜素之生产来源。并进行生产类胡萝卜素最适化条件探讨以确立培养时间、pH值、温度、碳源、氮源,同时探讨变温逆境条件对生物量、色素含量、色素产量的影响。
2. 材料与方法
2.1. 材料
胶红酵母(Rhodotorula mucilaginosa)菌株,本实验室由葡萄柚(Citrus paradisi)果实中纯化分离而得,以基因组中rDNA ITS区域片段设计之引子组ITS1与ITS4,对红色菌株DNA进行扩增。此引子放大片段大小为700 bp,将扩增定序出的DNA序列与GenBank数据库进行比对,与Rhodotorula mucilaginosa菌株达100%相似度。
2.2. 最适化培养
试验采用单因子设计探讨,将基础培养基PDB(Potato Dextrose Broth)的结果作为未调整之原条件,以作后续优化比较。
2.2.1. 最适收菌时间
接种0.1%经48小时活化培养之胶红酵母菌酛(yeast starter)至三角支架摇瓶中,依真菌培养基PDB (Potato Dextrose Broth)进行培养,设置回转式震荡恒温培养箱温度30℃、转速125 rpm,每隔12小时取样一次,进行吸光值OD600测定、菌体干重、培养基终pH值及色素含量测定,经上述分析结果,以求出最适收菌时间。
2.2.2. 最适培养温度
以22.5、25、27.5、30、32.5℃温度范围进行培养,每隔12小时取样一次,进行吸光值OD600测定、菌体干重、培养基终pH值及色素含量(Carotenoids content)测定。
2.2.3. 最适培养碳源
设定液态培养基之总体积为50 mL,分别以蔗糖(Sucrose)、乳糖(Lactose)、麦芽糖(Maltose)、果糖(Fructose)、葡萄糖(Glucose)、半乳糖(Galactose)作为碳源,碳源浓度皆为15 g/L。
2.2.4. 最适培养氮源
设定液态培养基之总体积为50 mL,分别以酵母萃取物(Yeast extract)、硫酸铵(Ammonium sulfate)作为氮源,氮源浓度皆为2.5 g/L。
2.3. 变温逆境探讨
2.3.1. 短时高温
以转速125 rpm,最适温度27.5℃将菌体培养至稳定期,给予6小时37.5℃高温刺激后,回复最适温度27.5℃培养,每隔12小时取样一次,进行吸光值OD600测定、菌体干重、培养基终pH值及色素含量测定。
2.3.2. 短时低温
以转速125 rpm,最适温度27.5℃将菌体培养至稳定期,给予6小时10℃低温刺激后,回复最适温度27.5℃培养,每隔12小时取样一次,进行吸光值OD600测定、菌体干重、培养基终pH值及色素含量测定。
2.3.3. 持续低温
以最适温度 27.5℃将菌体培养至稳定期,持续给予22.5℃低温培养直至收菌完成。
2.4. 生物量测定
菌液进行离心(9,500 rpm, 4℃, 10 min),分离上清液,以ddH2O轻轻润洗菌块,倒去润洗菌块水,注入绝对酒精使菌块表面剩余水分挥发,将菌块放至-80˚C 冷冻隔夜,以冷冻干燥机冻干后秤得菌体干重。
生物量(Biomass)(g/L) = 菌体干重(g)/培养基(L)
2.5. 色素萃取
依据Michelon等人利用DMSO与丙酮进行萃取 [10] 。DMSO可提升细胞通透性,均质震荡一小时,进行离心(10,000 rpm, 4 ℃, 10 min),收集上清液至新的离心管,若胶红酵母细胞沉淀物(pellet)尚有颜色,则再注入新的DMSO。纪录所添加DMSO的量,重复上述步骤直至菌块呈现微白透明。
2.6. 色素含量测定
将所萃取出之色素取200 μL至96 well flat-bottom microtiters plates中,分析475 nm波长下之吸光值,依数值代入公式,即为色素含量
Carotenoid yield (μg/g of dry yeast) = (Aλ𝑚ax) × D × V/E ×W
Aλmax:测定最大吸收波长475 nm之吸光值
D:样本稀释倍数
V:萃取溶液体积(mL)
E:类胡萝卜素莫耳消化系数(molar extinction coefficient) (0.16 mol−1∙cm−1)
W:秤取萃色干菌体质量(g)
2.7. 产量计算
将计算所得总类胡萝卜素含量(μg/g)和生物量(Biomass)(g/L)相乘积,即可得到总类胡萝卜素产量(μg/L)。
Carotenoid content (μg/g) × Biomass (g/L) = production (μg/L)
2.8. 统计分析
实验结果以平均值 ± 平均标准偏差(mean ± SEM)表示,数据以Statistical Analysis System (SAS) V.9.4版软件执行单向变异分析(one-way ANOVA),并以邓肯氏多变域测法(Duncan’s Multiple Range Test)比较各处理组间平均值是否有显著差异。
3. 结果与讨论
3.1. 色素光谱分析
本试验将色素萃取液进行全光谱扫描,在波长287 nm有最高之吸光值,与Von Oppen-Bezalel所研究之各色素在不同波段的吸光值之特性结果相同 [11] (图2),皆在287 nm下有一最高吸收峰,故在定性方面初步判定为八氢西红柿红素(Phytoene)。文献指出,八氢西红柿红素(Phytoene)属于无色类胡萝卜素,可作为SPF促进剂,具有抗紫外线刺激、抗眼部衰老、保护肌肤减少色斑的产生、美白等功效 [12] 。
而实际放入侦测之胶红酵母色素萃取液为红色,故色素除八氢西红柿红素之外,尚有其他色素于其中。文献指出,胶红酵母菌可能包含β-胡萝卜素、圆酵母素、红酵母红素等 [13] 。
3.2. 最适培养条件
胶红酵母菌(Rhodotorula mucilaginosa)在培养初期菌体生长速度较快。当胶红酵母菌被接种至新的培养基中,菌体的生长随时间的变化情形呈现典型的生长曲线。随着培养时间变化培养时间0~3小时即诱导期(Lag phase)结束,随即3~36小时进入对数生长期(Log phase),直至48小时进入平稳期(stationary phase)。在平稳期,菌体生长速率等于死亡速率,呈现动态平衡,胶红酵母菌细胞的总体数量无增加,且平稳期的细胞具有与对数期细胞不同的化学组成,于72小时有一色素累积高峰为最佳收菌时间。将胶红酵母菌(Rhodotorula mucilginosa)于20℃~40℃以5℃为组距的培养实验中可发现,在不同温度下菌落生长结果以温度25℃、30℃生长较旺盛,温度下至20℃则生长缓慢,而上至35℃即停滞生长,40℃以上无生长迹象。故再将适温度设置为25℃~32.5℃组距缩小为2.5℃,进行培养,以期得到最适温度条件。分析结果,以生物量(Biomass) 和类胡萝卜素含量在27.5℃表现较佳,其色素含量为210.93 (μg/g)、生物量4.49 (g/L) (图1),菌体在27.5℃下培养、色素产量934.25 (μg/L) (图2)皆有最佳表现。故后续以27.5℃作为最适温度条件进行试验。
最适碳源研究由图3、图4得知,单醣培养胶红酵母(Rhodotorula mucilaginosa)的色素含量(Carotenoids content)依序为fructose 184.02 (μg/g)、glucose 206.98 (μg/g)、galactose 191.36 (μg/g);双醣的类胡萝卜素
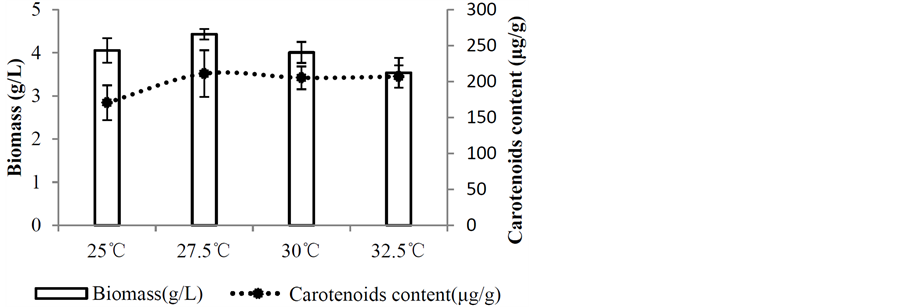
Figure 1. Effect of temperature on carotenoids content and biomass by Rhodotorula mucilaginosa
图1. 温度对胶红酵母生物量及类胡萝卜素含量之影响
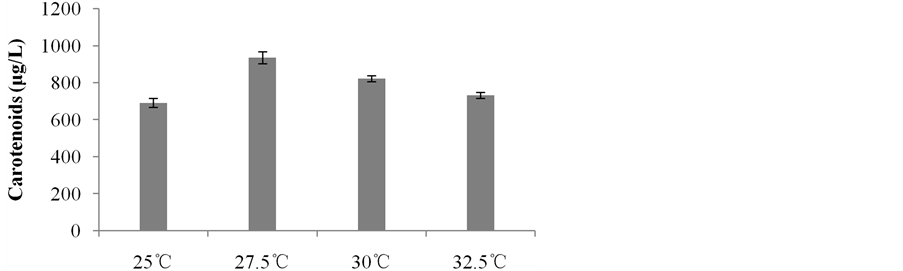
Figure 2. Effect of temperature on production of carotenoids by Rhodotorula mucilaginosa
图2. 温度对胶红酵母类胡萝卜素含量之影响
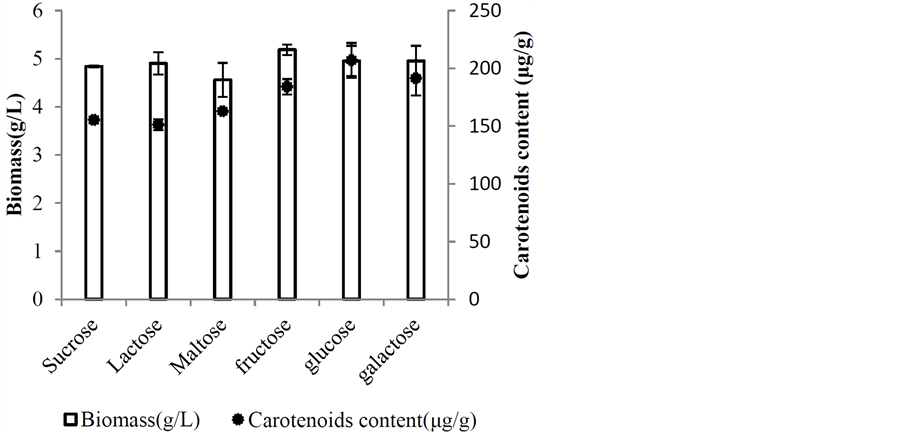
Figure 3. Effect of different carbon sources on carotenoids content and biomass by Rhodotorula mucilaginosa
图3. 不同碳源对胶红酵母生物量和类胡萝卜素含量之影响
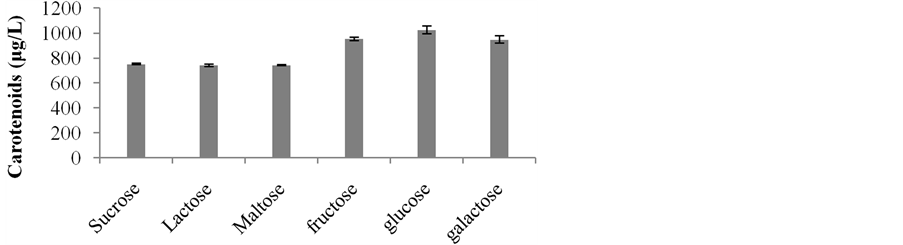
Figure 4. Effect of different carbon sources on production of carotenoids by Rhodotorula mucilaginosa
图4. 不同碳源对胶红酵母类胡萝卜素产量之影响
含量(Carotenoids content)依序为Sucrose 155.34 (μg/g)、Lactose 151.17 (μg/g)、Maltose 162.82 (μg/g),单醣培养在菌体色素含量(Carotenoids content)皆优于双醣,推论碳源在单醣使用上对胶红酵母有较好的利用性。菌体在单醣glucose下培养,其类胡萝卜素含量、生物量(Biomass)表现较佳,且色素产量1025.25 (μg/L)为各碳源中最高。
最适氮源研究由图5、图6得知,菌体在Ammonium sulfate下培养,其色素含量为299.53 (μg/g)、生物量(Biomass) 4.91 (g/L)、色素产量1139.44 (μg/L)皆有中上的表现。而菌体在Yeast extract下培养,其色素含量为231.00 (μg/g)、生物量(Biomass) 4.93 (g/L)、色素产量1469.29 (μg/L)具有比Ammonium sulfate更好的表现。
将最适条件整合后进行动态生长曲线测定(图7),即温度27.5℃、pH 5、葡萄糖(glucose)浓度为15 g/L作碳源、酵母萃取物(Yeast extract)浓度为2.5 g/L作氮源于于84小时有最高色素产量1494.67 (μg/L),与未优化时的最高色素产量1104.63 (μg/L)比较,优化后色素产量有26.1%的增幅。
3.3. 变温逆境条件探讨
于最适条件培养至72小时后,给予37.5℃之短时高温逆境6小时,对胶红酵母之生长无显著变化。
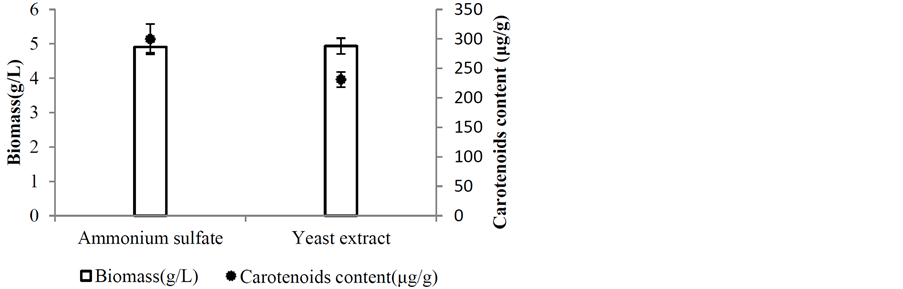
Figure 5. Effect of different inorganic nitrogen and organic nitrogen sources on carotenoids content and biomass by Rhodotorula mucilaginosa
图5. 不同氮源对胶红酵母生物量和类胡萝卜素含量之影响

Figure 6. Effect of inorganic nitrogen and organic nitrogen sources on production of carotenoids by Rhodotorula mucilaginosa
图6. 不同氮源对胶红酵母类胡萝卜素产量之影响
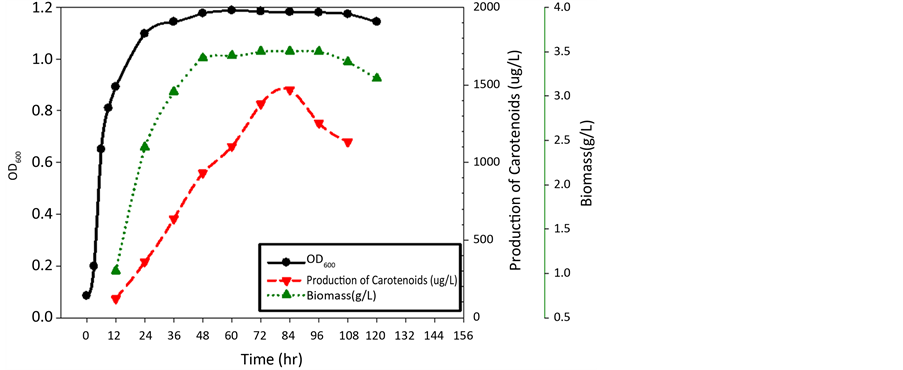
Figure 7. Optimum conditions for dynamic curve
图7. 最适动态生长曲线
降回27.5℃后,其生物量(Biomass)和菌体浓度(OD600)于其生长皆停滞在平稳状态。在最适条件培养至72小时后,给予10℃之短时低温逆境六小时,对胶红酵母之生长无显著变化,其生物量(Biomass)和菌体浓度(OD600)于给予低温后,其生长皆停滞在平稳状态。持续低温系以初始将菌体以最适温度27.5℃培养至72小时稳定期,持续给予22.5℃低温培养直至收菌完成。持续低温动态生长曲线结果显示(图8),经
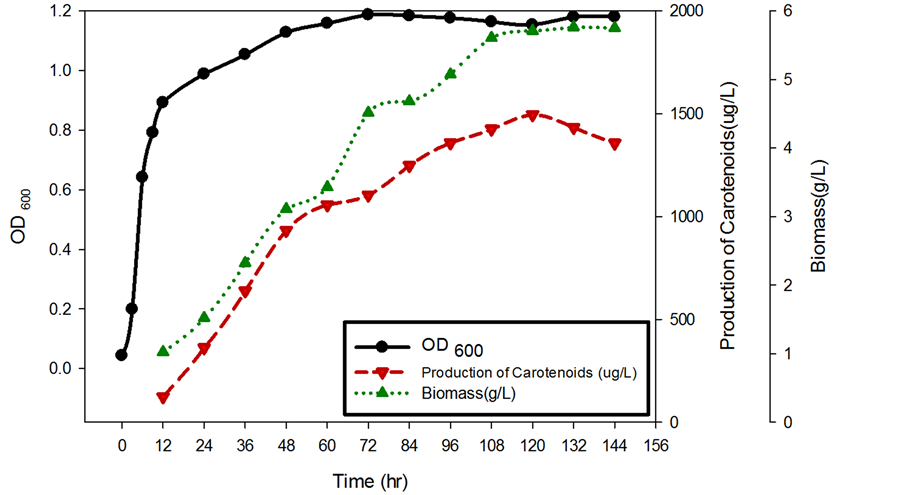
Figure 8. Continued cold growth dynamic curve
图8. 持续低温生长动态曲线
过72小时27.5℃最适条件培养后,菌体经过22.5℃低温适应,生物量(Biomass)于72~84小时生长迟滞,在96小时上升至4.51(g/L),再缓慢上升于108小时达到平衡,可见在菌体生长的部分,于22.5℃仍具有减缓菌体生长速度的效果。从色素产量曲线可得在120小时有最大值1533.27 (μg/L)。
4. 结论
确立本研究室分离培养出之胶红酵母最适培养条件,即温度27.5℃、pH 5、葡萄糖(glucose)浓度为15 g/L作碳源、酵母萃取物(Yeast extract)浓度为2.5 g/L作氮源,于84小时有最高色素产量1494.67 (μg/L)。逆境处理下,经短时低温10℃和短时高温37℃刺激,不会影响色素产量的动态曲线结果,以长时低温22.5℃培养,可将色素产量提升至1533.27 (μg/L),此研究结果应用于未来连续发酵生产上,可延长色素高收率时间与维持色素产量的潜力。
基金项目
本研究经费部分承蒙勇源教育发展基金会支持,谨申谢忱。
文章引用
陈尹丰,徐源泰,吴思节. 胶红酵母生产类胡萝卜素最适化探讨
Optimization of Conditions of Carotenoid Production by Rhodotorula mucilaginosa[J]. 农业科学, 2017, 07(01): 35-43. http://dx.doi.org/10.12677/HJAS.2017.71005
参考文献 (References)
- 1. Rock, C.L. (1997) Carotenoids: Biology and Treatment. Pharmacology & Therapeutics, 75, 185-197. https://doi.org/10.1016/S0163-7258(97)00054-5
- 2. Aberoumand, A. (2011) A Review Article on Edible Pigments Properties and Sources as Natural Biocolorants in Foodstuff and Food Industry. World Journal of Dairy & Food Sciences, 6, 71-78.
- 3. Goodwin, T.W. (1980) Biosynthesis of Carotenoids. In: Goodwin, T.W., Ed., The Biochemistry of the Carotenoids, Springer, Netherlands, 33-76. https://doi.org/10.1007/978-94-009-5860-9_2
- 4. Malik, K., Tokkas, J. and Goyal, S. (2012) Microbial Pigments: A Review. International Journal of Microbial Resource Technology, 1, 361-365.
- 5. Malisorn, C. and Suntornsuk, W. (2008) Optimization of β-Carotene Production by Rhodotorulaglutinis DM28 in Fermented Radish Brine. Bioresource Technology, 99, 2281-2287. https://doi.org/10.1016/j.biortech.2007.05.019
- 6. Dufossé, L. (2006) Microbial Production of Food Grade Pigments. Food Technology and Biotechnology, 44, 313-323.
- 7. 王强、余晓斌. 三孢布拉霉发酵产西红柿红素的研究进展. 微生物学通报, 2015, 42(2): 420-426.
- 8. Sutter, R.P. and Rafelson, M.E. (1968) Separation of β-Factor Synthesis from Stimulated β-Carotene Synthesis in Mated Cultures of Blakesleatrispora. Journal of Bacteriology, 95, 426-432.
- 9. Lampila, L.E., Wallen, S.E. and Bullerman, L.B. (1985) A Review of Factors Affecting Biosynthesis of Carotenoids by the order Mucorales. Mycopathologia, 90, 65-80. https://doi.org/10.1007/BF00436853
- 10. Michelon, M., de Borba, T.D.M., da Silva Rafael, R., Burkert, C.A.V. and de Medeiros Burkert, J.F. (2012) Extraction of Carotenoids from Phaffiarhodozyma: A Comparison between Different Techniques of Cell Disruption. Food Science and Biotechnology, 21, 1-8. https://doi.org/10.1007/s10068-012-0001-9
- 11. Von Oppen-Bezalel, L. (2009) Lightening, Boosting and Protecting with Colorless Carotenoids. Cosmetics and Toiletries, 124, 423-444.
- 12. Rojas, J., LondoÑo, C. and Ciro, Y. (2016) The Health Benefits of Natural Skin UVA Photoprotective Compounds Found in Botanical Sources. International Journal of Pharmacy and Pharmaceutical Sciences, 8, 13-23.
- 13. 郑羽莛. 利用不同废弃基质进行分离酵母菌之类胡萝卜素生产优化[D]. 云林科技大学, 2014: 1-80.