Traditional Chinese Medicine
Vol.
11
No.
04
(
2022
), Article ID:
53493
,
10
pages
10.12677/TCM.2022.114082
丹龙醒脑方对血管性痴呆大鼠Notch信号通路及其下游靶基因的干预作用研究
曾逸笛1,2,3,周小青1,2,3,李金霞1,2,3,郑彩杏1,赖丽娜1,李琳1,2,3*
1湖南中医药大学,湖南 长沙
2湖南中医药大学中医诊断学科,湖南 长沙
3中医诊断学湖南省重点实验室,湖南 长沙
收稿日期:2022年5月23日;录用日期:2022年6月30日;发布日期:2022年7月11日

摘要
目的:多层次地阐明丹龙醒脑方对血管性痴呆大鼠各指标的干预结果,从Notch信号通路及其下游靶基因角度探讨丹龙醒脑方治疗血管性痴呆(Vascular Dementia, VD)的作用机制。方法:60只大鼠通过改良双侧颈总动脉永久阻断法(2-VO)加去势手术法制备VD大鼠模型。将成模大鼠均分为四个大组,即模型组、阳性药物组、DAPT组、丹龙醒脑方组。分别运用干预措施后,光镜下观察HE染色的大鼠海马组织形态学变化,检测给药干预后大鼠血清T水平,及NO和ET-1水平。统计大鼠海马区、皮质区样本增殖活性细胞免疫荧光染色双阳性细胞数,使用免疫组织化学法、Western Blot法定性、定量检测VD大鼠海马组织Notch1、Hes1蛋白表达。结果:干预后各大组大鼠海马组织出现一定变化,与模型组比较,阳性药物组、丹龙醒脑方组T、NO水平均有明显上升,ET-1水平有明显下降(P < 0.01, P < 0.05);与模型组比较,阳性药物组、丹龙醒脑方组大鼠海马区双阳性细胞数均有明显上升(P < 0.01, P < 0.05);假手术组与DAPT组海马区可见Notch1、Hes1蛋白少许表达,模型组表达增强,丹龙醒脑方组、阳性药物组蛋白表达明显增强。结论:丹龙醒脑方能显著改善VD大鼠的学习能力、记忆能力、空间探索能力及脑组织病理损伤;丹龙醒脑方能通过积极调控VD大鼠Notch信号通路及其下游靶基因Hes1的表达,促进了神经干细胞的增殖、分化,从而发挥对VD大鼠的治疗作用。
关键词
丹龙醒脑方,血管性痴呆,神经干细胞,Notch信号通路

Intervention of Danlong Xingnao Recipe on Notch Signaling Pathway and Its Downstream Target Genes in Vascular Dementia Rats
Yidi Zeng1,2,3, Xiaoqing Zhou1,2,3, Jinxia Li1,2,3, Caixing Zheng1, Lina Lai1, Lin Li1,2,3*
1Hunan University of Chinese Medicine, Changsha Hunan
2Department of TCM Diagnosis, Hunan University of Chinese Medicine, Changsha Hunan
3Hunan Provincial Key Laboratory of TCM Diagnosis, Changsha Hunan
Received: May 23rd, 2022; accepted: Jun. 30th, 2022; published: Jul. 11th, 2022

ABSTRACT
Objective: Explain the intervention results of Danlong Xingnao Recipe on various indexes of rats with vascular dementia at multiple levels, and explore the mechanism of Danlong Xingnao recipe in the treatment of VD from the perspective of Notch signal pathway and its downstream target genes. Method: In 60 rats, the VD rat model was prepared by modified bilateral common carotid artery permanent occlusion (2-VO) and castration. The model rats were divided into four groups: Model group, positive drug group, DAPT group and Danlong Xingnao formula group. After the intervention measures were applied respectively, the morphological changes of hippocampus of rats stained with he were observed under light microscope, The levels of serum T, no and ET-1 were detected after administration. Count the number of double positive cells in immunofluorescence staining of proliferative cells in hippocampus, and the expression of Notch1 and Hes1 protein in hippocampal tissue of VD rats was detected by immunohistochemistry and Western blot. Results: After the intervention, the hippocampal tissue of each group showed certain changes occurred in the hippocampus of rats in each group. Compared with the model group, the levels of T and NO in the positive drug group and the Danlong Xingnao formula group increased significantly, and and the level of ET-1 decreased significantly (P < 0.01, P < 0.05); compared with the model group, the number of double positive cells in the hippocampus of rats in the positive drug group and the Danlong Xingnao formula group increased significantly (P < 0.01, P < 0.05); in sham operation group and DAPT group, a little expression of Notch1 and Hes1 protein can be seen in hippocampus, the expression of model group is enhanced, and the expression of Danlong Xingnao formula group and positive drug histone is significantly enhanced. Conclusion: Danlong Xingnao recipe can significantly improve the learning ability, memory ability, space exploration ability and brain pathological damage of VD rats; Danlong Xingnao recipe can promote the proliferation and differentiation of neural stem cells by actively regulating the expression of Notch signal pathway and its downstream target gene Hes1 in VD rats, so as to play a therapeutic role in VD rats.
Keywords:Danlong Xingnao Recipe, Vascular Dementia, Neural Stem Cells, Notch Signaling Pathway

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
血管性痴呆(Vascular Dementia, VD)是一种严重影响生活质量的认知功能障碍综合征,往往伴随着脑部缺血性卒中、出血性卒中等病史,其他造成脑区低灌注的脑血管疾病后期也有一定几率出现此类认知障碍 [1],目前尚无理想疗法。而中医在辨证论治基础上加强活血化瘀、化痰益智能延缓VD进程,提高生活质量,显示出良好的优势 [2]。经过后续研究,内源性神经干细胞(Neural Stemcells, NSCs)被认为具备相当的分化潜能,但这需要在不同的信号分子诱导下进行,这使得改造内源性NSCs的微环境,修复受损脑神经组织、提高大脑认知功能、恢复脑神经功能成为可能,最终达到治疗VD的目的 [3] [4] [5]。在众多调控NSCs增殖、分化的基因信号途径中,能起到旁侧抑制作用的Notch-Hes通路已在学术界获得了较多的关注,而它的重要下游靶基因之一,Hes1基因蛋白表达的振荡在这个过程中具有不可替代的作用,这也是本研究重点关注对象之一 [6]。同时,中医认为肾虚血瘀是VD的基本病机 [7],瘀血阻痹,脑脉不通,肾虚髓空,神经功能下降;瘀血失其常功,濡养作用减弱,进而加重肾虚;精聚为髓,髓化生血,精血同源,肾亏则血虚,血虚则易滞,由此相兼为患。因此,本实验通过改良双侧颈总动脉永久阻断法(2-VO)制备VD大鼠模型,对VD大鼠行为、记忆力、空间探索能力、组织病理表现、血循指标、及Notch信号通路与其下游靶基因Hes1蛋白表达水平等多方面进行研究,多层次地阐明丹龙醒脑方对各指标的干预结果,从Notch信号通路及其下游靶基因角度探讨丹龙醒脑方治疗VD的作用机制。
2. 实验材料
2.1. 动物
选取雄性SPF级SD大鼠60只,体重约180~220 g,由湖南中医药大学实验动物中心提供(合格证编号:430727211100421833);饲养条件:分笼饲养,每笼5只。室温25℃ ± 2℃,相对湿度65% ± 5%;高脂饮食饲养,自由饮水,笼具每2天清洗消毒1次。适应性喂养7天后开始实验(伦理编号:SLBH-202010300001)。
2.2. 试剂与药物
乌拉坦(默克医药生物科技公司);4%多聚甲醛、枸橼酸盐缓冲液、缓冲甘油、PBS (7.2~7.6)、DAPI (Wellbio公司);ET-1 (CSB-E06979r)、T (CSB-E05100r) (武汉华美生物工程有限公司);NO (一氧化氮)测定试剂盒(南京建成生物);尼莫地平片(亚宝药业健康股份有限公司);DAPT (Sigma Aldrich)及DMSO (Sigma)混悬液,现用现配;溴脱氧尿嘧啶核苷(BrdU) (sigma公司);BrdU抗体品(Cell Signaling Technology);GFAP、Nestin、NSE (Thermo Fisher);二步法试剂盒、DAB试剂盒(中杉金桥)。
丹龙醒脑方:丹龙醒脑方由丹参15 g,三七12 g,地龙6 g,石菖蒲12 g,远志15 g,菟丝子12 g,淫羊藿10 g组成。中药饮片购自湖南中医药大学第一附属医院。丹龙醒脑方饮片浸泡30 min加水煎2次,头煎加6倍水,沸后文火慢煎40~60 min;二煎加4倍水,沸后文火慢煎30~40 min;合并2次煎液,滤过,水浴浓缩为含生药1.6 g/mL灭菌分装4℃冰箱冷藏。
2.3. 主要仪器
SLY-WMS Morris水迷宫(北京硕林苑科技有限公司);光学显微镜CH20BIMF200,日本OLYMPUS;全自动酶标洗板机PW-812,深圳市汇松科技发展有限公司;多功能酶标分析仪MB-530,深圳市汇松科技发展有限公司;电热恒温培养箱DHP-500,北京市永光明医疗仪器有限公司。
3. 实验方法
3.1. 实验初分组
造模前称重,用黑色记号笔在大鼠尾部进行数字标记,随机抽取12只为假手术组,剩余为模型制备组48只。
3.2. 模型建立及分组
大鼠采用25%乌拉坦0.6 ml/100 g腹腔注射麻醉,除假手术组外,模型组大鼠以改良2-VO法分两次结扎双侧颈动脉。假手术组组大鼠仅切开颈部皮肤,剥离颈动脉,不进行结扎,其余操作同模型组。
每日观察并记录大鼠精神状态,体态变化等。手术7 d后,各组大鼠进行Morris水迷宫定位航行及空间探索实验。大鼠造模后、给药干预前末次行为学检测后,禁食12 h,眼眶取血2 mL,放入普通采血管中,分离血清,−20℃冰箱保存。采用硝酸还原酶法检测大鼠血清一氧化氮(Nitric Oxide, NO)水平,放免法检测内皮素-1 (Endothelin-1, ET-1)、睾酮(Testosterone, T)水平。以检测模型是否成功。
将成模大鼠按随机数字表法分为四个大组,即模型组、阳性药物组、DAPT组、丹龙醒脑方组,每组12只。再从以上五组(包括假手术组)中各随机平均分为2组,分别记为假手术A组、假手术B组,模型A组、模型B组,阳性药物A组、阳性药物B组,DAPT A组、DAPT B组,丹龙醒脑方A组、丹龙醒脑方B组。用于两种取材方法检测不同指标。
3.3. 给药方式
各大鼠给药频率均为1次/d,连续给药14 d。以70 kg成人为标准按体表面积换算,丹龙醒脑组分别按7.4 g/kg灌胃给药,每天1次;阳性药物组给予尼莫地平(10.8 mg/kg),灌胃给药,每天1次;DAPT组大鼠腹腔注射DMSO混悬液0.4 ml,每天1次,且以丹龙醒脑方7.4 g/kg灌胃给药,每天1次;假手术组和模型组予以等量生理盐水灌胃,每天1次。
3.4. 取材处理及指标检测
给药干预期间每日观察并记录大鼠精神活动,体重变化,体态等。大鼠均于给药14天后,每大组腹腔注射BrdU的半数大鼠经左心室依次灌注生理盐水和4%多聚甲醛溶液,直至动物呈僵硬状态,随后迅速断头取脑、固定。24 h后常规做连续冠状脑切片分别用于病理学检查、免疫组化法、免疫荧光双标法检测。余下B组所有大鼠经麻醉后,不经心脏灌注迅速断头取脑,冰上快速分离海马组织,迅速置于标记冻存管中,液氮快速冷冻,−80℃冰箱保存,以备提取蛋白,留待Western Blot法检测。
免疫荧光染色:测定脑室下区NSCs增殖和皮质区分化为神经元、星形胶质细胞情况。神经干细胞以巢蛋白(Nestin)标记,神经元、星形胶质细胞分别以神经元特异性烯醇化酶(Neuron-Specific Enolase, NSE)、胶质纤维酸性蛋白(Glial Fabrilary Acidic Protein, GFAP)为标记物进行检测。前述步骤完成后,各标本分别做5张切片,各切片随机选取5个视野置于镜下,对所选定区域的阳性结果细胞记录形态等指标,并计算数值,分别计算出各组海马齿状回BrdU+/Nestin+的双阳性细胞数,大脑皮质区BrdU+/NSE+、BrdU+/GFAP+双阳性细胞数,取平均值。
Western Blot:检测海马组织Notch1、Hes1蛋白表达。用常规方法剪取组织,称重,每个样本重量0.025 g左右,用冰预冷PBS洗组织,加入300 uLRIPA裂解液于生物样品均质仪中反复研磨组织直至看不见组织块,离心,将离心后的上清转移倒1.5 mL的离心管中。行SDS-PAGE电泳,转膜2 h,封闭、室温放置90 min,4℃过夜,次日室温放置30 min。一抗、二抗孵育。接着进行曝光、显影、冲洗等步骤,在Quantity One软件中分析自身灰度值,以目的基因条带灰度值与关键条带灰度的比值表示蛋白的表达水平,结合免疫组化Envision法检测结果减少非特异性干扰。
3.5. 统计学处理
实验数据应用SPSS25.0软件进行统计学处理,数据均以均数±标准差表示,对资料进行正态性检验和方差齐性检验,组间比较使用One-way ANOVA法分析,方差齐者,组间比较采用LSD法,方差不齐者,采用Dunnett T3检验;不满足正态分布者,用Wilcoxon秩和检验,P < 0.05 被认为差异有统计学意义。
4. 结果
4.1. 一般行为观察结果
模型组大鼠出现体毛干枯发黄无光泽、体重增长缓慢、精神萎靡、眯眼畏光、对外界刺激反应迟钝、行动迟缓、卷缩拱背、睡眠增多、喜扎堆、进食减少、便稀,提示血管性痴呆样表现形成。
4.2. 造模后干预前Morris水迷宫实验结果
与假手术组比较,模型组大鼠的逃避潜伏期明显延长,与假手术组比较,模型组大鼠穿越原平台次数及停留时间明显缩短,差异具有统计学意义(P < 0.05, P < 0.01);其余比较差异无统计学意义(P > 0.05)。见表1。
Table 1. Results of water maze test in rats after modeling and before intervention ( , n)
表1. 造模后干预前大鼠水迷宫实验结果 ( , n)
Note: compared with sham operation group, **P < 0.01, *P < 0.05.
注:与假手术组比较,**P < 0.01,*P < 0.05。
4.3. 造模后干预前血清T、ET-1、NO结果
与假手术组比较,模型组血清样本T含量降低、ET-1含量升高、NO含量降低,差异具有统计学意义(P < 0.05,P < 0.01)。见表2。
Table 2. Comparison of serum T, ET-1 and NO levels after modeling and before intervention ( )
表2. 造模后干预前血清T、ET-1、NO水平比较( )
Note: compared with sham operation group, *P < 0.05, **P < 0.01; compared with the model group △△P < 0.01, △P < 0.05.
注:与假手术组比较,*P < 0.05,**P < 0.01;与模型组比较,△△P < 0.01,△P < 0.05。
4.4. 大鼠大脑海马组织形态学变化
实验结果显示,假手术组大鼠海马细胞未出现明显异常,细胞数量多,排列较为整齐,形态饱满,染色较为理想、均匀,细胞核着色均匀,核仁清楚;阳性药物组及丹龙醒脑方组大鼠海马细胞数量较多,排列略欠整齐,形态较为饱满,偶出现形态异常、变形、坏死者,染色较为均匀,偶有着色变浅现象,核仁较为清楚,偶有溶解、固缩、深染现象;模型组、DAPT组大鼠正常细胞较少,多出现细胞形态异常、变形、肿胀、边界模糊现象,排列紊乱、疏松,细胞核染色异常较多,固缩、深染较为常见,间有细胞核溶解、胞浆模糊的现象。见图1。
4.5. 各组大鼠脑BrdU+/Nestin+、BrdU+/NSE+、BrdU+/GFAP+双阳性细胞数比较结果
与假手术组比较,模型组、阳性药物组、丹龙醒脑方组大鼠海马齿状回BrdU+/Nestin+、大脑皮质区BrdU+/NSE+、BrdU+/GFAP+双阳性细胞数均有明显上升,与模型组比较,阳性药物组、丹龙醒脑方组、DAPT组大鼠海马齿状回BrdU+/Nestin+、大脑皮质区BrdU+/NSE+、BrdU+/GFAP+双阳性细胞数均有明显上升,与阳性药物组比较,丹龙醒脑方组大鼠海马齿状回BrdU+/Nestin+双阳性细胞数有明显下降,DAPT组大鼠海马齿状回BrdU+/Nestin+、大脑皮质区BrdU+/NSE+、BrdU+/GFAP+双阳性细胞数均有明显降低,与丹龙醒脑方组比较,DAPT组大鼠马齿状回BrdU+/Nestin+、大脑皮质区BrdU+/NSE+、BrdU+/GFAP+双阳性细胞数均有明显下降,差异具有统计学意义(P < 0.05, P < 0.01);其余比较差异无统计学意义(P > 0.05)。见表3。
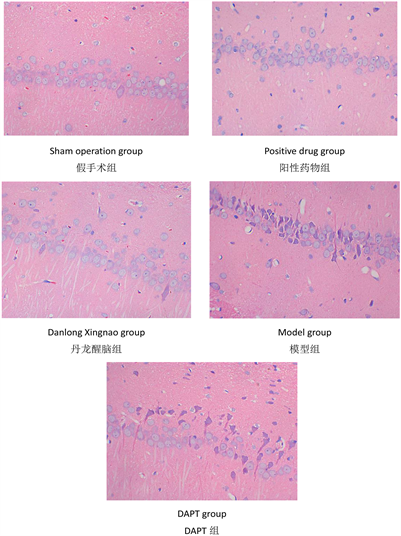
Figure 1. Histomorphology of rat hippocampus (400× microscope)
图1. 大鼠海马组织形态学(400倍镜)
Table 3. BrdU+/Nestin+ in hippocampus, BrdU+/NSE+ and BrdU+/GFAP+ double positive cells in cerebral cortex ( )
表3. 海马区BrdU+/Nestin+、大脑皮质区BrdU+/NSE+、BrdU+/GFAP+双阳性细胞数( )
Note: compared with sham operation group, *P < 0.05, **P < 0.01; compared with the model group, △P < 0.05, △△P < 0.01; compared with the positive drug group, #P < 0.05, ##P < 0.01; compared with Danlong Xingnao recipe group, &P < 0.05.
注:与假手术组比较,*P < 0.05,**P < 0.01;与模型组比较,△P < 0.05,△△P < 0.01;与阳性药物组比较,#P < 0.05,##P < 0.01;与丹龙醒脑方组比较,&P < 0.05。
4.6. 各组大鼠脑组织海马区免疫组化法Notch1、Hes1蛋白表达灰度值比较结果
各组大鼠脑组织海马区免疫组化法Notch1、Hes1蛋白表达灰度值比较结果如下:与假手术组比较,模型组、阳性药物组、丹龙醒脑方组IOD值显著升高,与模型组比较,阳性药物组、丹龙醒脑方组IOD值均显著升高,DAPT组IOD值显著降低,与阳性药物组比较,丹龙醒脑方组、DAPT组IOD值显著降低,与丹龙醒脑方组比较,DAPT组IOD值显著降低,差异具有统计学意义(P < 0.05, P < 0.01);其余比较差异无统计学意义(P > 0.05)。见表4。
Table 4. Expression gray value of Notch1 and Hes1 protein in rat brain by immunohistochemistry ( , IOD)
表4. 大鼠脑组织免疫组化法Notch1、Hes1蛋白表达灰度值( , IOD)
Note: compared with sham operation group, *P < 0.05, **P < 0.01; compared with the model group, △P < 0.05, △△P < 0.01; compared with the positive drug group, #P < 0.05, ##P < 0.01; compared with Danlong Xingnao recipe group, &P < 0.05, &&P < 0.05.
注:与假手术组比较,*P < 0.05,**P < 0.01;与模型组比较,△P < 0.05,△△P < 0.01;与阳性药物组比较,#P < 0.05,##P < 0.01;与丹龙醒脑方组比较,&P < 0.05,&&P < 0.05。
4.7. 各组大鼠海马组织Western Blot法Notch1、Hes1蛋白条带比值比较结果
Notch1与Hes1的反应条带分别位于120 kDa及30 kDa处,内参β-actin反应条带位于42 kDa,结果显示各组呈现强弱不等的阳性条带。与假手术组比较,模型组、阳性药物组、丹龙醒脑方组海马组织Notch1、Hes1蛋白条带比值均显著升高,DAPT组大鼠海马组织Hes1蛋白条带比值显著升高,与模型组比较,阳性药物组、丹龙醒脑方组大鼠海马组织Notch1、Hes1蛋白条带比值均显著升高,DAPT组大鼠海马组织Notch1、Hes1蛋白条带比值显著降低,与阳性药物组比较,DAPT组大鼠海马组织Notch1、Hes1蛋白条带比值均显著降低,与丹龙醒脑方组比较,DAPT组大鼠海马组织Notch1、Hes1蛋白条带比值均显著降低,差异具有统计学意义(P < 0.05, P < 0.01);其余比较差异无统计学意义(P > 0.05)。见图2,表5。
5. 结论
中医利用辨证论治的思想,在治疗血管性痴呆过程中有针对性地使用活血化瘀、补肾填髓治法,在延缓VD进程,提高生活质量,显示出良好的优势。某些传统中药的有效成分在促进NSCs激活、增殖、分化、修复、维持的过程中具有非常重要的优势 [8] [9] [10] [11]。而中药对NSCs的这种作用也许正是中医论治VD的靶点所在,尤以从肾虚血瘀角度治疗为重。本团队在多年治疗脑卒中及其后遗症的临床实践中,研制出了治疗VD的有效方剂——丹龙醒脑方。其中丹参味苦微寒,活血祛瘀,而远志味苦辛性温,开窍醒神,安神益智,两者起重要治疗作用,视作君药;臣药作用应当以辅佐君药为主,放大其治疗效果,此方中该角色由石菖蒲、三七担纲;其余药味,地龙、淫羊藿、菟丝子等各有其佐治作用,如地龙与丹参、三七配伍,活血化瘀,通利经络,相辅相成,相得益彰,使活血通络之力倍增;配伍淫羊藿、菟丝子,取其补肾填精,温阳化气,推动血行之功。全方以活血化瘀为主,温补肾阳为辅,通补兼施,以通为用,开窍醒脑。前期研究表明丹龙醒脑方能促进局灶性脑缺血大鼠海马区NSCs增殖,促进神经再生 [12]。因此我们可认为,丹龙醒脑方是从肾虚血瘀论治VD的代表性方剂。
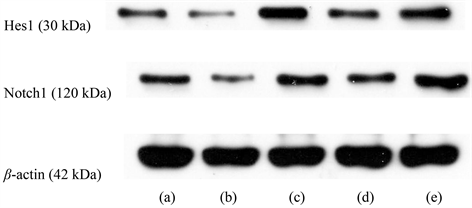
Figure 2. Western blot was used to detect the expression of Notch signal pathway related proteins in hippocampus of each group. Note: (a): model group; (b): sham operation group; (c): positive drug group; (d): DAPT group; (e): Danlong Xingnao group
图2. Western Blot检测各组海马区Notch信号通路相关蛋白表达。注:(a):模型组;(b):假手术组;(c):阳性药物组;(d):DAPT组;(e):丹龙 醒脑组
Table 5. Comparison of Notch1 and Hes1 protein band ratios in hippocampus ( )
表5. 海马组织Notch1、Hes1蛋白条带比值比较( )
Note: compared with sham operation group, *P < 0.05, **P < 0.01; compared with the model group, △P < 0.05, △△P < 0.01; compared with the positive drug group, #P < 0.05, ##P < 0.01; compared with Danlong Xingnao recipe group, &P < 0.05, &&P < 0.05.
注:与假手术组比较,*P < 0.05,**P < 0.01;与模型组比较,△P < 0.05,△△P < 0.01;与阳性药物组比较,#P < 0.05,##P < 0.01;与丹龙醒脑方组比较,&P < 0.05,&&P < 0.05。
VD属于中医病名“痴呆”下属的一种类型,临床表现强调髓减脑消、神机失用的认知障碍状态,常见记忆力、空间探索力等功能下降,具体采用动物模型模拟时,多能观察到大鼠智能水平下降、记忆力减退等现象 [13]。本实验模型组造模后进行一般行为观察时,也出现类似现象;另外,在行为学认知功能评价方面,Morris水迷宫是一类经典的认知功能评价方法,具有常用、敏感度高等特点,常用于各类条件合适的实验动物 [14],本实验中,模型组大鼠与假手术组大鼠比较,逃避潜伏期明显延长,穿越原平台次数及停留时间明显减少,表明模型组大鼠确实出现了学习、记忆能力下降的现象,均符合VD的认知功能障碍表现。肾藏精,虚则髓减,生殖之精随之消损,因此肾虚与大鼠性腺轴功能下降密切相关。睾酮T为反映性腺轴功能的指标之一,同时T水平的异常也影响着记忆力与空间认知力 [15] [16]。本实验采用检测血清中T水平进一步检测大鼠肾虚状态,结果显示,模型组大鼠T水平与假手术组相比,显著降低,具备了中医肾精不足、肾失所养的指标表现。在血瘀的检测方面,本实验采用了血清NO、ET-1等客观指标的方法。其中,NO主要负责血管的正常舒张,通过抗平滑肌细胞分裂、增殖,抗血小板黏附、聚集,抑制血管平滑肌收缩等实现这一功能;ET-1正好与之相反,这种多肽主要起到收缩血管的作用。若这一对调控因子失衡,血管舒张、收缩状态将出现功能异常,且进一步刺激炎症因子产生、局部血小板增多、血管渗透性增加等,从而出现血液高黏滞的结果 [17] [18] [19]。
给药干预后,大鼠标本HE染色结果对比中提示,VD模型组大鼠、DAPT组大鼠大脑中海马区神经元正常细胞较少,多出现细胞形态异常,表明VD病理表现中确有海马神经系统的损伤,而假手术组、阳性药物组、丹龙醒脑方组损伤较轻,说明丹龙醒脑方能有效减轻血管性痴呆海马组织损伤,保护神经元,改善学习记忆功能的效果,与前期的文献研究及实验结果一致 [17]。
VD的临床表现主要为认知能力的损害,这也与神经干细胞功能息息相关。神经干细胞广泛存在于神经系统,生理状态下多安静地“休眠”着,但某些特定地条件可将其“唤醒”而发挥分裂、增殖、分化的功能,如机体脑部受到损伤,其分布的主要部位出现了血液供应不良或严重创伤的情形,NSCs将通过上述过程,修复大脑神经元的功能障碍,完成“神经再生”这一重要步骤 [20] [21],这可以解释本实验结果中与假手术组大鼠相比,模型组大鼠双阳性细胞数均有明显上升但远远不及丹龙醒脑方组、阳性药物组及假手术组的现象。但神经功能的修复与完善所需要的内源性NSCs的数量远远超过它们自身代偿的数量,这意味着VD的治疗仍然需要人为干预以完成神经网络功能的重建,这是VD治疗的重要环节 [22] [23] [24] [25],我们认为这也是丹龙醒脑方对VD治疗作用可能的机制之一。我们观察到,丹龙醒脑方干预后,阳性细胞率明显增加,与阳性药物组结果变化一致,而假手术组、使用了Notch信号通路抑制剂的DAPT组阳性率明显较低,这提示我们丹龙醒脑方有效地改善了VD大鼠神经干细胞的增殖与分化状态。VD脑功能修复过程中NSCs的增殖分化主要受到Notch-Hes信号通路的调控。研究发现造模后海马区Notch信号通路下游靶基因Hes1蛋白表达增多,这说明脑血管疾病后NSCs存在促进增殖、分化的表现。实验结果显示,与模型组相比,丹龙醒脑方组、阳性药物组的各指标均有较强表达,且通路抑制剂DAPT组各项指标均呈现表达减少的效果,有效说明了丹龙醒脑方能激活VD大鼠Notch信号通路,上调大鼠海马区Notch1、Hes1蛋白表达水平。
至此,我们可以得出以下结论:丹龙醒脑方能显著改善VD大鼠的学习能力、记忆能力、空间探索能力及脑组织病理损伤;丹龙醒脑方能通过积极调控VD大鼠Notch信号通路及其下游靶基因Hes1的表达,促进了神经干细胞的增殖、分化,从而发挥对VD大鼠的治疗作用。本实验结论提示我们,丹龙醒脑方切实可在临床治疗血管性痴呆领域发挥一定的疗效,且可能的机制之一得以初步阐明,因此未来对丹龙醒脑方治疗血管性痴呆疾病的探索还有很多发展方向,如可利用该类治疗机制,辅以相似的通路激活药物、避免通路抑制剂干扰;或从中医角度来说,可寻求类似治则治法的方药研究是否可相辅相成,加强作用;甚至进一步地,将该方药物有效部位确定下来,向合成血管性痴呆治疗特效药物的方向进发。因时间有限,本实验尚存不足之处,该治疗机制的进一步探讨还有待今后体外实验进一步研究。
基金项目
湖南省教育厅科学研究项目(18B232)。
文章引用
曾逸笛,周小青,李金霞,郑彩杏,赖丽娜,李 琳. 丹龙醒脑方对血管性痴呆大鼠Notch信号通路及其下游靶基因的干预作用研究
Intervention of Danlong Xingnao Recipe on Notch Signaling Pathway and Its Downstream Target Genes in Vascular Dementia Rats[J]. 中医学, 2022, 11(04): 581-590. https://doi.org/10.12677/TCM.2022.114082
参考文献
- 1. 彭丽霖, 孙景波, 程骁. 血管性痴呆的研究进展[J]. 解剖学研究, 2020, 42(5): 468-471.
- 2. 吴玉秋, 刘颖. 血管性痴呆的中西医研究进展[J]. 山西医药杂志, 2020, 49(14): 1818-1820.
- 3. 房昌运, 吴旭升, 张航, 谷燕苓, 王士兵, 任慧, 等. 内源性神经干细胞促进缺血性脑卒中后神经修复的研究进展[J]. 生理学报, 2019, 71(3): 454-462.
- 4. Wang, J., Chen, W. and Wang, Y. (2013) A Ginkgo Biloba Extract Promotes Proliferation of Endogenous Neural Stem Cells in Vascular Dementia Rats. Neural Regeneration Research, 8, 1655-1662.
- 5. Cui, Z., Liu, S., Hou, L., Sun, Y., Chen, H., Mao, H., et al. (2021) Effect of Tongfu Xingshen Capsule on the Endogenous Neural Stem Cells of Experimental Rats with Intracerebral Hemorrhage. Molecular Medicine Reports, 24, Article No. 624. https://doi.org/10.3892/mmr.2021.12263
- 6. 周剑英, 何思锦, 顾力华, 谢青. 基于Notch信号通路探讨中医药干预缺血性脑卒中的研究进展[J]. 中西医结合心脑血管病杂志, 2021, 19(23): 4099-4101.
- 7. 邓秋媚, 胡跃强, 潘能珍, 吴丽君, 张国辉, 杨文臣. 补肾活血法治疗血管性痴呆研究进展[J]. 辽宁中医药大学学报, 2020, 22(11): 100-105.
- 8. 杜怡斌. 内皮祖细胞诱导内源性神经干细胞神经生发促进脊髓损伤修复的实验研究[D]: [博士学位论文]. 合肥:安徽医科大学, 2015.
- 9. 苏明珠, 马跃文. 放散式冲击波通过Notch1/Hes1通路调节脑缺血后海马组织中神经干细胞的增殖与分化[J]. 中国组织工程研究, 2021, 25(19): 3009-3015.
- 10. 陈娉婷, 周小青, 刘旺华, 曹泽标, 陈昱文, 李花. 丹龙醒脑方对脑缺血再灌注大鼠海马区神经干细胞增殖及Frizzled1、Dvl1、CyclinD1表达的影响[J]. 中药药理与临床, 2016, 32(1): 120-124.
- 11. 白威, 张欣, 苏鑫洪, 孔垂广, 杨永祥, 叶玉勤, 等. 创伤性脑损伤激活miR-124-3p/Notch通路促进大鼠神经干细胞增殖和分化[J]. 细胞与分子免疫学杂志, 2020, 36(1): 49-55.
- 12. 胡卓瑶. 基于HIF1-VEGF-Notch通路夏天无对血管性痴呆大鼠神经行为学的影响及其机制研究[D]: [硕士学位论文]. 南昌: 江西中医药大学, 2021.
- 13. 吕建芳, 周安方, 萧闵. 肾精亏虚对SD雄性大鼠造血功能影响实验研究[J]. 湖北中医药大学学报, 2020, 22(1): 5-8.
- 14. 阿日棍. 热敏灸改善AD模型大鼠认知功能的抗炎症机制研究[D]: [博士学位论文]. 南昌: 江西中医药大学, 2021.
- 15. 刘如秀, 周晟芳, 李慧, 关宣可, 尹琳琳, 罗何维, 等. 滋肾活血方对冠心病心肌缺血肾虚血瘀型大鼠外周血浆中ET、NO及IL-18含量的影响[J]. 中国中医基础医学杂志, 2016, 22(1): 54-56.
- 16. 杨超. 基于炎症反应、氧化应激、miRNA-124/BACE1/Aβ通路探讨涤痰汤治疗血管性痴呆模型大鼠的作用机制[D]: [博士学位论文]. 武汉: 湖北中医药大学, 2020.
- 17. 陈娉婷, 周小青, 刘旺华, 曹泽标, 陈昱文, 李花. 丹龙醒脑方对脑缺血再灌注大鼠侧脑室室管膜下区神经干细胞增殖及Hes1、Hes5表达的影响[J]. 中国中医药信息杂志, 2016, 23(1): 69-73.
- 18. 武鑫, 孙宁宁, 王冬慧, 张松江, 高剑峰. 电针干预对放射线照射小鼠海马区突触蛋白-1表达的影响[J]. 上海针灸杂志, 2020, 39(6): 783-789.
- 19. 沈英杰. 洛他唑对脑卒中后血管性痴呆合并脑白质病变患者血流变的影响[J]. 当代医学, 2020, 26(31): 172-173.
- 20. 梁晓艳, 顾玉, 赵梦, 等. 依达拉奉干预永久性脑缺血大鼠神经干细胞增殖及分化[J]. 解剖学报, 2021, 52(3): 370-376.
- 21. 祝美珍, 武丽, 岑妍慧, 彭岳, 陈炜, 贾微, 等. 基于神经血管单元研究清脑益元汤对大鼠脑缺血损伤神经干细胞增殖分化的影响及其调控机制[Z]. 南宁: 广西中医药大学, 2019-03-28.
- 22. 邢雪松, 吕威力. 气味训练对血管性痴呆大鼠内源性神经干细胞增殖分化及DACH1蛋白表达的影响[J]. 解剖学杂志, 2018, 41(4): 414-417+425.
- 23. 李文, 陈慧, 罗素慧, 王媛, 张美琳, 王璇, 等. 基于神经干细胞增殖分化母体叶酸缺乏对大鼠子代神经发育作用机制的研究[Z]. 天津: 天津医科大学, 2020-04-24.
- 24. 李鑫, 邵瑞, 王彧. 中药调节神经干细胞增殖分化的研究进展[J]. 中国实验方剂学杂志, 2019, 25(9): 221-227.
- 25. 曹泽标, 周小青, 刘旺华, 陈娉婷, 李花, 陈昱文. 丹龙醒脑方对脑缺血再灌注损伤大鼠SVZ区Frizzled3、Dsh1及β-catenin表达的影响与促进神经干细胞增殖的机制[J]. 中华中医药杂志, 2016, 31(10): 4206-4210.
NOTES
*通讯作者。
