Botanical Research
Vol.04 No.03(2015), Article ID:15576,11
pages
10.12677/BR.2015.43009
Nitrogen Metabolism of Arbuscular Mycorrhizal Symbiosis and Its Physiological and Ecological Regulation Mechanism
Min Cao1, Yuan Gao1, Bei Liu1, Ke Chen1, Mi Yu2, Xiaohong Yang1*, Xianzhi Huang3
1Key Laboratory of Horticulture Science for Southern Mountainous Regions, Ministry of Education, College of Horticulture and Landscape Architecture, Department of Agriculture, Southwest University, Chongqing
2College of Animal Science and Technology, Southwest University, Chongqing
3Institute of Sericulture and Systems Biology, Southwest University, Chongqing
*通讯作者。
Email: min1988@swu.edu.cn, *yangxh2@swu.edu.cn
Received: Jun. 10th, 2015; accepted: Jun. 26th, 2015; published: Jun. 30th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The most majority of terrestrial plants have a high dependence on arbuscular mycorrhizal fungi (AMF). When they form a symbiotic relationship plants provide carbon to the fungus to ensure the basic growth demand of fungi. And fungi can promote plants to absorb more nutrients (especially P and N) at the same time. This paper reviews the forms of nitrogen in soil uptake by AMF, the transportation pathway and degradation of nitrogen in AM symbiotic as well as the molecular basis of nitrogen transport and metabolism. The possible factors those can influence external nitrogen absorption were summarized. The external nitrogen transportation and redistribution pro- cesses in AM were analyzed. Arbuscular mycorrhizal symbiosis had physiological and ecological significance in the nitrogen cycling of soil-fungi-plant. And the future research of AMF is prospected.
Keywords:Arbuscular Mycorrhizae (AM), Nitrogen Metabolism, Transportation Pathway, Redistribution

氮在丛枝菌根中的代谢过程及其生理生态调控机制
曹敏1,高媛1,刘贝1,陈珂1,余米2,杨晓红1*,黄先智3
1西南大学农学部园艺园林学院,南方山地园艺学教育部重点实验室,重庆
2西南大学动物科技学院,重庆
3西南大学蚕学与系统生物学研究所,重庆
Email: min1988@swu.edu.cn, *yangxh2@swu.edu.cn
收稿日期:2015年6月10日;录用日期:2015年6月26日;发布日期:2015年6月30日

摘 要
绝大多数陆生植物对丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)有着高度的依赖性,它们形成共生关系后植物为真菌提供光合C满足真菌生长发育基本需求,真菌帮助植物吸收更多的矿质营养(尤其是P和N),促进植物生长发育。本文重点评述了AMF可吸收的土壤氮形态,氮素在丛枝菌根共生体(arbuscular mycorrhizal, AM)内外的传递路径、形态转化和降解过程,及AM中氮素转运和代谢相关的分子基础;分析了影响AMF吸收利用外源氮的可能因素以及AMF促进氮素在相邻植物间的传递和再分配功能,认为丛枝菌根共生体在土壤–真菌–植物氮循环中具有重要的生理生态学意义,并对AMF的未来研究进行了展望。
关键词 :丛枝菌根,氮代谢,转运途径,再分配

1. 引言
丛枝菌根是由丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)与植物根系形成的共生体,是自然界最常见的共生现象。丛枝菌根真菌在地球上存在了4.6亿年之久,可与80%以上的陆生植物共生[1] 。共生体中的宿主植物向AMF提供其生命所需碳源,而AMF则帮助植物吸收水分和矿质营养 [2] (如氮和磷元素),促进植物生长和发育 [3] ,提高生物量;提高植物抗病、抗干旱、抗盐碱、抗重金属毒害等能力,增强植物对各种恶劣环境的适应性 [4] - [7] 。
AMF增强植物对恶劣环境的适应性是通过帮助植物吸收各类营养元素、调节植物体内的相关物质的合成而间接完成的。N作为植物的生命元素之一,不仅是植物有机体的组成成分,还参与叶绿素和一些酶的合成,对植物的生长发育起着至关重要作用。在自然和农业生态系统中,特别是在逆境条件下,氮素往往是限制植物生长的重要因素 [8] 。研究表明AMF对玉米植株的氮贡献率可高达总氮的74% [9] 。随着有机农业的兴起,有关AMF的研究已成为国际热点。近年来关于AMF对植物氮代谢影响的研究很多,但是还有很多存在争议之处,比如对有机氮的吸收,另外,目前还没有文献对影响AM氮代谢的因素进行系统的归纳。因此,本文旨在对AMF可吸收利用的外源氮形态,氮素在AMF与植物间的传递和转运机制、分子基础以及影响AM氮代谢的因素等研究成果进行了系统的综述与评述,旨在为深入研究菌根植物的氮代谢过程提供参考。
2. AMF对氮素的吸收形态
2.1. AMF对土壤中无机氮源的吸收形式及吸收效率
丛枝菌根(arbuscular mycorrhiza, AM)共生体的菌丝包括根内菌丝(intraradical mycelium, IRM)和根外菌丝(extraradical mycelium,ERM),ERM可以生长到根外数十厘米远的土壤环境中吸收水分和无机盐 [10] 。近年来关于AM对植物氮素营养的作用已经引起了广泛的关注和研究。1976年发现接种摩西球囊霉(Glomus mosseae)的胶皮枫香树(Liquidambar styraciflua)具有较强的养分吸收能力,减少了土壤中 、
、 以及
以及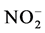 的淋洗损失之后,AM吸收氮素的相关研究陆续开展起来 [11] 。利用稳定性同位素15N标记技术发现,AMF能增加植物对铵态氮的吸收 [12] 。但是植物体内氮素的增加是菌丝体本身吸收氮素引起的,还是由于AMF侵染引起植株吸收能力的改变造成的还无法判断。因此,Hawkins向分室培养系统中的菌丝室添加
的淋洗损失之后,AM吸收氮素的相关研究陆续开展起来 [11] 。利用稳定性同位素15N标记技术发现,AMF能增加植物对铵态氮的吸收 [12] 。但是植物体内氮素的增加是菌丝体本身吸收氮素引起的,还是由于AMF侵染引起植株吸收能力的改变造成的还无法判断。因此,Hawkins向分室培养系统中的菌丝室添加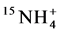 和
和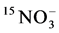 ,培养2 d后,发现叶片中有标记的15N,表明AMF的ERM能直接吸收
,培养2 d后,发现叶片中有标记的15N,表明AMF的ERM能直接吸收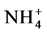 和
和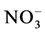 并转移给了植物,进一步分析获知ERM对
并转移给了植物,进一步分析获知ERM对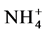 的吸收速率高于
的吸收速率高于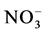 [13] 。Tanaka和Yano使用分室装置对接种聚丛球囊霉(Glomus aggregatum)后的玉米进行研究,计算出ERM从菌丝室吸收的
[13] 。Tanaka和Yano使用分室装置对接种聚丛球囊霉(Glomus aggregatum)后的玉米进行研究,计算出ERM从菌丝室吸收的 是
是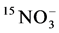 的10倍左右;把铵态氮换成树脂包裹的尿素时,测得玉米地上部氮吸收量的74%来自于15N标记的尿素,而从
的10倍左右;把铵态氮换成树脂包裹的尿素时,测得玉米地上部氮吸收量的74%来自于15N标记的尿素,而从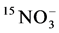 中获得的氮素仅占植物氮吸收量的2.9% [9] 。将分室培养法与15N标记技术相结合以玉米为宿主植物接种摩西球囊霉G. mosseae和根内球囊霉G. intraradices,比较这两种AMF根外菌丝对铵态氮和硝态氮的吸收传递能力差异,发现尽管菌种间有差异,但两种AMF吸收传递
中获得的氮素仅占植物氮吸收量的2.9% [9] 。将分室培养法与15N标记技术相结合以玉米为宿主植物接种摩西球囊霉G. mosseae和根内球囊霉G. intraradices,比较这两种AMF根外菌丝对铵态氮和硝态氮的吸收传递能力差异,发现尽管菌种间有差异,但两种AMF吸收传递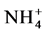 -N的能力均高于
-N的能力均高于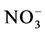 -N [14] 。然而Hawkins和George的研究结果却与之相反,给接种摩西球囊霉的小麦分别供以
-N [14] 。然而Hawkins和George的研究结果却与之相反,给接种摩西球囊霉的小麦分别供以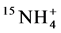 和
和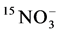 ,结果供以
,结果供以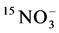 的小麦植株中15N百分比更高 [13] 。其原因可能与宿主植物自身习性有关,也可能是由于
的小麦植株中15N百分比更高 [13] 。其原因可能与宿主植物自身习性有关,也可能是由于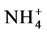 和
和 改变了AMF菌丝的生长情况。目前,大量的研究支持
改变了AMF菌丝的生长情况。目前,大量的研究支持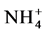 是AMF最容易且最主要的吸收形式 [15] - [17] 。这可能是由于植物利用
是AMF最容易且最主要的吸收形式 [15] - [17] 。这可能是由于植物利用 合成自身物质更节省能量,
合成自身物质更节省能量,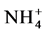 进入细胞内可直接用于合成氨基酸,而
进入细胞内可直接用于合成氨基酸,而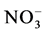 必须经过2个还原反应转化成
必须经过2个还原反应转化成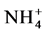 后才能用于氨基酸的合成。
后才能用于氨基酸的合成。
2.2. AMF对土壤中有机氮源的吸收
土壤中除含有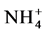 和
和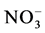 两种小分子无机氮外,绝大部分是植物较难或不能直接吸收利用的有机态氮,如氨基酸 [18] 。Leigh等采用分室培养与同位素标记结合研究了AMF对有机质中的氮素吸收能力,结果显示AMF可以吸收有机质中的氮素并传递给其宿主植物 [19] 。随后Whiteside等利用量子点标记技术(quantum dots)研究了AMF对20中蛋白质氨基酸的吸收作用,发现AMF可以促进其宿主植物吸收苯丙氨酸、赖氨酸、蛋氨酸等8种氨基酸,但是减少了对天冬氨酸的吸收 [20] ;另外,他们还得出结论AMF更能促进其宿主吸收中性和带正电荷的氨基酸,而非带负电荷的氨基酸。金海如等的研究还发现AMF可以分解利用三肽丙氨酸多肽和和牛血清蛋白 [21] 。随后的研究发现G. intraradices中存在可以转运二肽Ala-Leu,Ala-Tyr或Tyr-Ala的寡肽转运蛋白RiPTR2,表明AMF确实可以吸收二肽并传递给其宿主植物 [22] 。
两种小分子无机氮外,绝大部分是植物较难或不能直接吸收利用的有机态氮,如氨基酸 [18] 。Leigh等采用分室培养与同位素标记结合研究了AMF对有机质中的氮素吸收能力,结果显示AMF可以吸收有机质中的氮素并传递给其宿主植物 [19] 。随后Whiteside等利用量子点标记技术(quantum dots)研究了AMF对20中蛋白质氨基酸的吸收作用,发现AMF可以促进其宿主植物吸收苯丙氨酸、赖氨酸、蛋氨酸等8种氨基酸,但是减少了对天冬氨酸的吸收 [20] ;另外,他们还得出结论AMF更能促进其宿主吸收中性和带正电荷的氨基酸,而非带负电荷的氨基酸。金海如等的研究还发现AMF可以分解利用三肽丙氨酸多肽和和牛血清蛋白 [21] 。随后的研究发现G. intraradices中存在可以转运二肽Ala-Leu,Ala-Tyr或Tyr-Ala的寡肽转运蛋白RiPTR2,表明AMF确实可以吸收二肽并传递给其宿主植物 [22] 。
尽管,接种AM真菌可以帮助植物吸收利用有机态的外源氮源,但AMF是如何助其宿主吸收利用有机氮的,研究者们的观点仍然存在分歧。有研究表明 [23] AMF具有降解或促进降解有机质的功能。也有研究表明AMF首先对菌丝际微生物产生直接影响,改变土壤微生物群落组成,导致腐生性微生物增多,加快有机氮的降解,进而促进植物对降解后氮素的吸收 [24] [25] 。近年来,应用量子点标记技术(荧光纳米半导体,fluorescent nanoscale semiconductors)发现AMF可以直接吸收、转运有机氮,在根外菌丝、植物根系和植物茎部观察到量子点标记的有机氮,直接证明了AMF具有直接吸收有机氮的能力 [26] [27] 。总之,关于AM真菌对有机氮源的利用已经引起了人们的重视,但其吸收利用方式和机制有待进一步研究。
3. 氮素在AM共生体内的传递、转化和代谢
已经明了,AMF可以帮助植物吸收土壤中不同形态的氮素,且菌丝对植物氮素吸收的贡献率可高达75% [9] 。这些氮素在菌丝和植物根之间是怎么进行传递和转运的,引起了研究者们极大地兴趣。早期研究表明精氨酸是果树体内主要的氮素贮藏形式 [28] 。Bogo等提出了假设:N素通过AMF从土壤传递给植物,这个过程涉及到尿素循环,而精氨酸是关键的中间转运载体 [29] 。随后的研究实了这一假设,找到了AMF吸收同化外源氮的途径,即谷氨酰胺合成酶-谷氨酸合成酶(glutamine synthetase-glutamate synthase,GS-GOGAT)途径 [30] [31] 。笔者将前人的研究成果进行了总结,根据Jin等的结论 [31] 绘制了AM共生体吸收、传递、转化和代谢氮素的途径。如图1所示,丛枝菌根真菌的ERM首先从土壤中吸收各种形态的氮,并通过GS-GOGAT将其转化为精氨酸,精氨酸再与多聚磷酸盐协同运输到IRM,精氨酸在IRM中通过尿素循环分解得到NH3/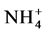 ,最后传递给宿主植物加以利用。同时笔者还补充了精氨酸在AM共生体中更多可能的去向,如精氨酸在一氧化氮合酶的作用下得到NO,也可通过精氨酸脱羧酶途径(ADC)和鸟氨酸脱羧酶(ODC)途径产生腐胺、精胺等多胺 [30] [32] 。一氧化氮是新型的生物信使分子,参与植物体内多种代谢途径,而多胺则与植物的生长发育和抗性有关,推测AMF可能改变了植物体内的NO和多胺的含量,从而改变植物的抗逆性。
,最后传递给宿主植物加以利用。同时笔者还补充了精氨酸在AM共生体中更多可能的去向,如精氨酸在一氧化氮合酶的作用下得到NO,也可通过精氨酸脱羧酶途径(ADC)和鸟氨酸脱羧酶(ODC)途径产生腐胺、精胺等多胺 [30] [32] 。一氧化氮是新型的生物信使分子,参与植物体内多种代谢途径,而多胺则与植物的生长发育和抗性有关,推测AMF可能改变了植物体内的NO和多胺的含量,从而改变植物的抗逆性。
3.1. ERM吸收外源氮合成精氨酸
大量的研究表明,AM利用氮素的第一步是其ERM将不同形态的外源氮整合到精氨酸中。发现AMF的ERM中含有丰富的氨基酸,主要有谷氨酸和精氨酸 [33] 。随后Cruz等给菌丝室标记上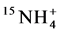 ,发现菌根室中15N精氨酸快速增加,在菌丝间的迁移率高达0.13 µg∙mg−1,认为精氨酸是菌丝体内氮素转移的主要氨基酸,ERM吸收的氮素大部分在菌丝中转化为精氨酸,即精氨酸是AM真菌中氮素吸收利用的有机载体 [34] 。
,发现菌根室中15N精氨酸快速增加,在菌丝间的迁移率高达0.13 µg∙mg−1,认为精氨酸是菌丝体内氮素转移的主要氨基酸,ERM吸收的氮素大部分在菌丝中转化为精氨酸,即精氨酸是AM真菌中氮素吸收利用的有机载体 [34] 。
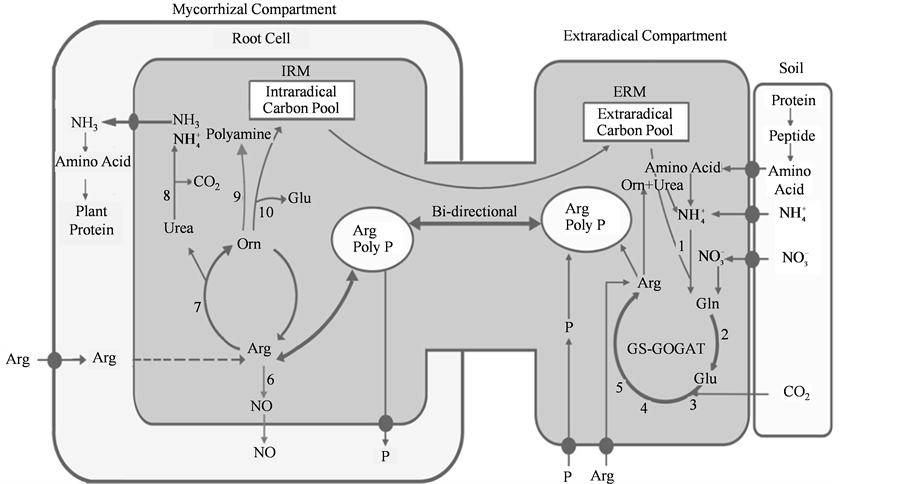
Figure 1.Note: 1: Glutamine synthetase; 2: Glutamate synthetase; 3: Carbamoyl phosphate synthetase; 4: Argininosuccinate synthetase; 5: Argininosuccinate lyase; 6: Nitric oxide synthase; 7: Arginase; 8: Urease; 9: Ornithine decarboxylase; 10: Ornithine aminotransferase.
图1. AMF吸收、转化和传递外源氮途径的菌根模型(仿 [31] )
Bago等人假设ERM吸收的外源氮经谷氨酰胺合成酶–谷氨酸合成酶途径整合入精氨酸,而不是直接转移给宿主植物的 [29] 。Cruz等检测到AM共生体的ERM中精氨酸合成的关键酶谷氨酸合成酶和精氨琥珀酸合成酶活性的升高,证实了Bago等人的推测 [34] 。并把外源氮在ERM中整合入精氨酸可能的途径清楚地描述为:各种形态的外源氮首先都转化为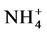 ,然后在谷氨酰胺合成酶的作用下与菌丝内的碳源反应合成谷氨酰胺,经二氧化碳的固定作用合成氨甲酰磷酸,与鸟氨酸反应合成瓜氨酸,瓜氨酸和天冬氨酸在精氨琥珀酸合成酶的作用下反应合成精氨琥珀酸,最后在精氨琥珀酸裂解酶作用下裂解产生精氨酸 [35] 。Tian等报道
,然后在谷氨酰胺合成酶的作用下与菌丝内的碳源反应合成谷氨酰胺,经二氧化碳的固定作用合成氨甲酰磷酸,与鸟氨酸反应合成瓜氨酸,瓜氨酸和天冬氨酸在精氨琥珀酸合成酶的作用下反应合成精氨琥珀酸,最后在精氨琥珀酸裂解酶作用下裂解产生精氨酸 [35] 。Tian等报道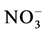 可刺激根内球囊霉与Ri T-DNA转基因胡萝卜根共生体ERM中精氨酸合成途径相关酶基因的上调表达,而IRM中尿素循环过程相关酶上调表达 [36] 。说明,外源氮在ERM中通过GS-GOGAT途径整合到精氨酸后并没有贮藏在ERM,而以精氨酸的形式转运到IRM中进行后续的利用。因此,精氨酸是氮素的转运载体,不是贮藏载体,可以在ERM和IRM间双向转运,期间有多聚磷酸盐参与 [31] [37] ,正是这种双向转运,可实现植物间甚至群落间的氮素平衡。
可刺激根内球囊霉与Ri T-DNA转基因胡萝卜根共生体ERM中精氨酸合成途径相关酶基因的上调表达,而IRM中尿素循环过程相关酶上调表达 [36] 。说明,外源氮在ERM中通过GS-GOGAT途径整合到精氨酸后并没有贮藏在ERM,而以精氨酸的形式转运到IRM中进行后续的利用。因此,精氨酸是氮素的转运载体,不是贮藏载体,可以在ERM和IRM间双向转运,期间有多聚磷酸盐参与 [31] [37] ,正是这种双向转运,可实现植物间甚至群落间的氮素平衡。
3.2. 精氨酸在IRM中的降解与转移
AMF吸收的土壤氮除很少一部分是供给自己生长发育外,绝大部分氮素传递给了其宿主植物利用,但这些氮素并不是以精氨酸的形式直接传递给宿主的。将用13C和15N标记的精氨酸添加到根外菌丝室,菌根组织中只检测到标记13C或同时标记13C和15N的鸟氨酸,宿主植物的根内并未检测到同时被13C和15N标记的精氨酸 [38] 。这说明精氨酸并非是AMF向宿主植物传递氮素的形态,而是在IRM中将精氨酸分解产生的氮素传递给了植物。Govindarajulu等报道精氨酸分解产生的氮素最终通过IRM上的铵输运蛋白以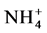 的形式传递给了植物根细胞 [30] 。
的形式传递给了植物根细胞 [30] 。
所以氮素以精氨酸的形式从ERM转运到根内菌丝后,首先在精氨酸酶的的作用下分解为尿素和鸟氨酸,鸟氨酸直接留在了菌丝中参与其他代谢,尿素则在尿素酶的参与下转变为NH3/ ,这两种产物在经由铵输运蛋白快速地转移到宿主植物根细胞内,供植物利用。氮素这种传递模式对丛枝菌根共生体来说是最经济的。
,这两种产物在经由铵输运蛋白快速地转移到宿主植物根细胞内,供植物利用。氮素这种传递模式对丛枝菌根共生体来说是最经济的。
3.3. 氮素在菌根中的双向运输
在AM共生界面检测到大量的运输铵的阵列膜蛋白,证实了AMF与植物间的氮素传递形式是 [39] 。IRM释放的
[39] 。IRM释放的 需要通过主动运输才能转移给宿主植物,这与Govindarajulu等报道的铵输运蛋白基因在IRM中过量表达的发现相一致 [30] 。Pumplin等报道AMF着生在宿主植物细胞内的丛枝和泡囊的膜与植物皮层细胞膜是连续的,是氮素在两者之间传递的重要部位 [40] 。在菌丝中传递和转化为
需要通过主动运输才能转移给宿主植物,这与Govindarajulu等报道的铵输运蛋白基因在IRM中过量表达的发现相一致 [30] 。Pumplin等报道AMF着生在宿主植物细胞内的丛枝和泡囊的膜与植物皮层细胞膜是连续的,是氮素在两者之间传递的重要部位 [40] 。在菌丝中传递和转化为 后,首先通过AMF的铵输运蛋白转运至这个区域,然后再在宿主植物铵离子泵的作用下将这些
后,首先通过AMF的铵输运蛋白转运至这个区域,然后再在宿主植物铵离子泵的作用下将这些 转运到植物细胞内,植物细胞再把这些氮素转移到需要部位加以利用。
转运到植物细胞内,植物细胞再把这些氮素转移到需要部位加以利用。
4. AMF利用氮素的分子基础
AMF能促进植物对外源氮的吸收利用是毋庸置疑的,随着研究的深入,AMF中氮转运和代谢相关的基因已经鉴定出来。AMF能够直接从土壤环境中吸收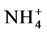 、
、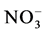 和氨基酸等,说明AMF中存在相应的转运蛋白。López-Pedrosa等首次报道了G. intraradices的ERM中铵转运蛋白基因GintAMT1的存在[41] 。他们以
和氨基酸等,说明AMF中存在相应的转运蛋白。López-Pedrosa等首次报道了G. intraradices的ERM中铵转运蛋白基因GintAMT1的存在[41] 。他们以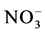 为唯一氮源培养G. intraradices,当添加
为唯一氮源培养G. intraradices,当添加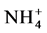 时GintAMT1转录增强;当在高氮条件下培养时,再加入
时GintAMT1转录增强;当在高氮条件下培养时,再加入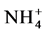 则会引起GintAMT1转录减弱。说明G. intraradices中存在高亲和的铵离子转运蛋白,即GintAMT1。随后Pérez-Tienda等发现了G. intraradices中铵转运蛋白基因的另一成员GintAMT2,与GintAMT1不同的是GintAMT2在IRM中的表达高于在ERM中的表达 [42] 。除了AMF自身存在铵离子转运蛋白基因,AMF还可以诱导宿主植物根细胞中的铵离子转运蛋白基因OsAMT上调表达,促进AM共生体对
则会引起GintAMT1转录减弱。说明G. intraradices中存在高亲和的铵离子转运蛋白,即GintAMT1。随后Pérez-Tienda等发现了G. intraradices中铵转运蛋白基因的另一成员GintAMT2,与GintAMT1不同的是GintAMT2在IRM中的表达高于在ERM中的表达 [42] 。除了AMF自身存在铵离子转运蛋白基因,AMF还可以诱导宿主植物根细胞中的铵离子转运蛋白基因OsAMT上调表达,促进AM共生体对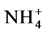 的吸收 [43] 。Tian等报道了
的吸收 [43] 。Tian等报道了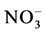 可刺激G. intraradices中蛋白基因GiNT的高效表达,证明了AMF可以吸收
可刺激G. intraradices中蛋白基因GiNT的高效表达,证明了AMF可以吸收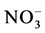 [36] 。此外,还报道在氮限制条件下,增加外源氮浓度G. intraradices的ERM中谷氨酰胺合成酶1) 谷氨酰氨合成酶2) 谷氨酸合成酶、氨甲酰磷酸合成酶、精安琥珀酸合成酶和精胺琥珀酸裂解酶对应基因,以及IRM中精氨酸酶、鸟氨酸转氨酶、鸟氨酸脱羧酶和脲酶对应基因都上调表达。证实了AMF中不同形态的外源氮的转化过程确实是首先在ERM中通过GS-GOGAT途径整合到精氨酸中,传递到IRM中再经尿素循环转化为无机氮的。另外,发现在给G. mosseae供给有机外源氮时氨基酸透性酶的基因GmosAAP1上调表达,说明AMF能直接吸收外源氨基酸 [44] 。总之,上述基因的发现与鉴定促进了AMF吸收同化外源氮分子机理的研究。
[36] 。此外,还报道在氮限制条件下,增加外源氮浓度G. intraradices的ERM中谷氨酰胺合成酶1) 谷氨酰氨合成酶2) 谷氨酸合成酶、氨甲酰磷酸合成酶、精安琥珀酸合成酶和精胺琥珀酸裂解酶对应基因,以及IRM中精氨酸酶、鸟氨酸转氨酶、鸟氨酸脱羧酶和脲酶对应基因都上调表达。证实了AMF中不同形态的外源氮的转化过程确实是首先在ERM中通过GS-GOGAT途径整合到精氨酸中,传递到IRM中再经尿素循环转化为无机氮的。另外,发现在给G. mosseae供给有机外源氮时氨基酸透性酶的基因GmosAAP1上调表达,说明AMF能直接吸收外源氨基酸 [44] 。总之,上述基因的发现与鉴定促进了AMF吸收同化外源氮分子机理的研究。
5. 影响AM氮代谢的因素
目前关于AM吸收土壤氮素的研究很多,但是在一些观点上至今仍存在分歧,导致在AM氮代谢方面的一些结论是矛盾的,比如在AM的N代谢与C、P代谢之间的互惠机制上。这是为什么呢?笔者认为正是因为AM对土壤氮素的吸收不是单独存在,它受到很多因素的影响,这些因素包括生物因素和非生物因素。
5.1. 生物因素
5.1.1. AMF自身特性的影响及其原因分析
接种AMF能促进宿主植物的氮素营养,这是毋庸置疑的。研究表明接种不同的AMF对外源氮的吸收利用能力不同。以大葱为宿主植物分别接种五种AMF (根内球囊霉Glomus intraradices,摩西球囊霉G. mosseae,幼套球囊霉G. etunicatum,聚丛球囊霉G. aggregatum和蜜色无梗囊霉Acaulospora mellea),发现在其他相同的情况下,接种AMF均提高了洋葱的总氮含量,但是相互之间均存在不同程度的差异,其中G. intraradices促进植物吸收利用氮素的能力最强 [45] 。与李侠等以玉米为材料接种G. mosseae和G. intraradices研究AM真菌对氮素的吸收能力的结论类似 [14] 。究其原因,可能是因为不同种类的AMF其遗传特性、生理性状和解剖学构造等自身特性、ERM对宿主的侵染策略及其在土壤中的生长状况不一样所致。
5.1.2. 土壤中其他微生物的影响及其原因分析
土壤中除了AMF外还存在其他的真菌、细菌、放线菌和线虫等微生物。AMF与土壤根际微生物之间的相互作用一直是学者们研究的热点之一。现在普遍认为AMF与有益的土壤微生物如硫氧化细菌、根瘤菌、溶磷菌、自养固氮菌和真菌、有益放线菌之间具有协同作用,能共同促进植物的生长 [10] 。用AMF与硫氧化细菌对洋葱和玉米进行双接种试验,发现双接种后洋葱和玉米干重和N、P、K含量都显著增加 [46] 。AM真菌G. mosseae和重氮营养醋杆菌Pal5 (Acetobacter diazotrophicus)的双接种能够增加超甜玉米地上部分氮含量,显著高于单接种处理的氮含量 [47] 。此外,给西藏沙棘双接种AM真菌和Frankia放线菌,也显著提高了植株的固氮能力,其固氮水平也显著高于各单接种处理 [48] 。
土壤微生物之间的互作对土壤微生物的生物活性会产生深刻的影响。其它有益土壤微生物在一定程度上能够促进AMF的生长发育,促进菌根侵染,因而促进了AMF对土壤氮素的吸收和转运,提高宿主植物的氮含量。以洋葱为宿主对12种放线菌(8种Streptomyces,2种Nocardia,2种未确定)对两种球囊霉G. macrocarpum和G. mosseae的影响进行了研究,发现在没有进行土壤灭菌的前提下,其中4种放线菌能增加AMF的菌丝密度,7种能促进菌根的侵染 [49] 。但是也有研究发现放线菌与AMF混合接种会抑制植物生长 [50] 。目前关于根际微生物与AMF对土壤氮吸收之间的相互作用机制尚不十分明确,土壤微生物与AMF之间的生态学关系仍待进一步研究。
5.2. 非生物因素
5.2.1. 外源氮化合物物化特性的影响及其原因分析
AMF能吸收土壤中不同形态的氮素并传递给宿主植物已经得到证实,包括无机态的铵态氮、硝态氮,和有机态的氨基酸等 [9] [51] 。但AM对不同形态氮素的利用能力和效率是不同的,这与不同形态氮素的分子结构、吸收载体和吸收机制有关。AMF对于有机态氮的利用更为复杂,至今都未明确其机制。已有的研究成果表明复杂的有机氮需经其他细菌降解为无机态后才能被AMF吸收利用,因此,在多形态氮存在的情况下,AMF优先利用铵态氮 [17] [18] 。
研究表明,土壤不缺水的情况下,菌丝一般不发达。铵态氮在土壤中的移动性弱,植物主要靠AMF细长的ERM伸展到比植物根系更远的地方吸收铵态氮。而硝态氮在土壤中的移动性较强,植物根系以外的硝态氮可以随土壤中的水分流向根表面,被根吸收,不用AMF的帮助。只有当土壤干旱缺水时硝态氮在土壤中的移动受阻,AMF才发挥其作用,导致AMF对其宿主植物的硝态氮氮素营养贡献较铵态氮低 [10] 。也有人认为吸收硝态氮比吸收铵态氮更耗能量。从生物进化学的角度来讲,AMF有限利用铵态氮更节能。
5.2.2. 其他环境因素的影响及其原因分析
影响AMF吸收土壤氮素并转移给宿主植物的因素很多,除上述因素外土壤的理化性质、气候因子、地理环境等也是AMF吸收利用氮素的重要因子之一。刘洁 [52] 采用三室分室培养法研究了光照、有机酸、盐胁迫等对AM真菌同化吸收外源氮产生精氨酸的影响,结果表明:以NH4NO3为外源氮,在试验提供的最高光强(17600 lx)下,菌根和菌丝中的精氨酸含量最高,表明强光照提高了菌根侵染率和根外菌丝的量;苹果酸、柠檬酸、酒石酸等有机酸可以促进AM真菌对外源氮的吸收,使得宿主植物茎叶中氮含量有一定的提高,有机酸对AM孢子量没有影响,但能促进ERM的生长,而水杨酸则起相反的作用;盐胁迫对AM共生体的氮代谢有抑制作用,可降低菌根侵染率24%~25%。另外,当以车前草为宿主的何氏球囊霉(G. hoi)的ERM生长在24℃环境中时,其长度是生长在11℃条件下的5倍 [53] ,同时车前草的生物量和N、P含量也显著增加。因此,笔者认为如果其他环境因素对AMF吸收同化外源氮的确产生影响,那么也是通过对AMF生长发育和菌丝的生长状况的改变产生的。
6. 主要代谢过程对AM氮代谢的影响
6.1. 磷代谢对AMF利用氮素的影响
磷是植物生长的限制元素之一,给牧场草地和荒漠土壤进行试验发现AMF可以减少土壤有机和无机N、P的淋溶损失以及N2O的排放,并提高植物体的氮、磷含量 [54] 。有学者认为AM真菌侵染植物后可能首先改善的是植物的磷素营养,然后再改变植物的氮素营养 [55] 。对此,也有研究者持有不同的态度,他们表示给菌根植物提供不同形态的氮素会改变植物对磷素的吸收。Ding XD等 [56] 的研究结果证实了这一点,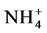 通过降低土壤pH促进菌根植物对肌醇六磷酸盐的吸收;而
通过降低土壤pH促进菌根植物对肌醇六磷酸盐的吸收;而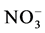 则会增强植物的菌根化程度如菌根侵染率和菌丝的长度、密度,来增加植物对无机磷的吸收。另外,Nasto等调查发现在N充足而P缺乏的低地热带雨林AM共生体的N2固定器是非常丰富的,且这些共生体的磷酸酶活性高于那些没有N2固定器的植物,他们认为N2固定器可以通过生成更多的含N的酶(磷酸酶)获取并矿化土壤中的有机P。因此,他们得出结论磷酸酶和AMF能增强植物N2固定器吸收土壤P的能力 [57] 。王晓伟等人却发现土壤磷浓度的高低会影响AMF吸收同化外源氮的能力,且低磷浓度更有利于AMF的根外菌丝吸收同化外源氮 [58] 。这可能是因为高含量的磷抑制了AMF菌丝的形成和ERM的伸长,从而降低了AMF根外菌丝对外源氮的吸收能力。Jin等也报道AM共生体中多聚磷酸盐参与了氮代谢的过程,并指出多聚磷酸盐可能与ERM中的精氨酸一起螯合后转运到IRM [31] 。其原因可能是精氨酸很容易在相同摩尔无机磷或短链多聚磷酸盐溶液中溶解。
则会增强植物的菌根化程度如菌根侵染率和菌丝的长度、密度,来增加植物对无机磷的吸收。另外,Nasto等调查发现在N充足而P缺乏的低地热带雨林AM共生体的N2固定器是非常丰富的,且这些共生体的磷酸酶活性高于那些没有N2固定器的植物,他们认为N2固定器可以通过生成更多的含N的酶(磷酸酶)获取并矿化土壤中的有机P。因此,他们得出结论磷酸酶和AMF能增强植物N2固定器吸收土壤P的能力 [57] 。王晓伟等人却发现土壤磷浓度的高低会影响AMF吸收同化外源氮的能力,且低磷浓度更有利于AMF的根外菌丝吸收同化外源氮 [58] 。这可能是因为高含量的磷抑制了AMF菌丝的形成和ERM的伸长,从而降低了AMF根外菌丝对外源氮的吸收能力。Jin等也报道AM共生体中多聚磷酸盐参与了氮代谢的过程,并指出多聚磷酸盐可能与ERM中的精氨酸一起螯合后转运到IRM [31] 。其原因可能是精氨酸很容易在相同摩尔无机磷或短链多聚磷酸盐溶液中溶解。
虽然对AMF吸收、利用、转运磷机制的研究已经比较透彻,但是关于磷代谢与氮代谢相互作用的关系还未得出统一的结论,大部分都处于猜想阶段,并未得到实质性的证据。更谈不上对二者的化学计量关系的了解,还有很多难题需要攻克。
6.2. 碳代谢对AMF利用氮素的影响
AMF对植物碳素营养的改善作用是毋庸置疑的,研究发现提高CO2分压可以加速AMF对有机质的降解 [59] 。因此,提高CO2分压可能会促进AMF根外菌丝对土壤外源复杂有机氮的分解和吸收,从而改善宿主植物的氮素营养。试验表明,在相同的条件下接种AMF可以增强植物的光合作用,促进植物生长,增加植物的生物量 [5] 。而AMF作为有机体对碳素的需求也是必不可少的,但AMF不能进行光合作用。AM共生体的出现解决了这一难题,AMF与植物互利共生,宿主植物将自身的光合产物传递给AMF,促进了AMF的菌丝的生长和发育 [60] ,而AMF则帮助植物吸收矿质元素(N、P等)。这说明AM共生体的C代谢和N代谢间一定会存在某种关联。比如,尽管AMF菌丝中氮素转移与转化过程有多种氨基酸合成和分解,但是根外菌丝却不能直接从土壤吸收碳源(如:葡萄糖、甘油、果糖等)为这些氨基酸提供碳骨架 [61] ,除极少部分由AMF中氨基酸分解留下的C骨架提供外,大部分需要靠宿主植物为其源源不断的供给。
Walder等发现宿主植物与AMF之间的营养交换是不平等的,在同一菌丝网络中与C4植物相比,C3植物虽然从AMF那里得到了更多的营养,却给AMF贡献了更少的C源 [62] 。此外,有研究者认为AM共生体中的氮素吸收和转运是由宿主植物向AMF传递C流引起的 [63] 。这与最新的研究结论一致,在与多种植物共生网络中,AMF更倾向于将营养传递给能提供更多C源的宿主 [64] 。也有学者认为是AMF中的氮水平决定了宿主植物向AMF传递碳流量的分配 [65] 。另外,菌根的类型不同宿主植物C的运输方向也是不同的,当N相对充足时宿主植物会将更多的C输送给AMF,而当N相对缺乏时,外生菌根真菌将会得到植物更多的C源 [66] 。总之,虽然AM共生体中碳、氮代谢间的具体作用关系还存在分歧,但二者间确实存在着密切的关系,具体的调控关系还需要进一步探究发现。
7. 双向运输实现氮素在植物间的再分配
大量的研究表明丛枝菌根植物根围并非只存在某一种AMF,而是多种AMF以群落的形式与植物根系形成菌根共生体 [3] [67] [68] 。这些AMF大多被认为是没有宿主专一性的,一种AMF可以侵染多种宿主植物,一种宿主植物也可以被多种AMF侵染 [69] 。即当AMF侵染某种植物后形成的ERM接触到另外一种可以形成菌根的植物根时,这些菌丝也可以侵染这种植物,在二者之间形成菌丝桥。因此,在土壤中往往会形成广泛且致密的菌丝网络,将多种植物根系连接在一起,进行营养传递。肖同建等报道接种苏格兰球囊霉(Glomus caledonium)和光壁无梗囊霉(Acaulospora laevis)改变了绿豆–水稻间作系统的氮素水平 [70] 。艾为党等采用五室培养系统和同位素标记法研究发现,接种摩西球囊霉后间作的玉米与花生之间能形成菌丝桥,这些菌丝桥能传递氮素,且氮素的传递方向是双向的 [71] 。氮素在通过菌丝桥在植物间的相互转移不论是对生态环境还是对农业生产都具有重要的意义,像水稻这样菌根侵染率低的植物若是能与那些高侵染的植物间作在一起,必定会提高产量和品质。因此,AMF促进植物间氮素传递的研究将是未来的重要研究方向。
AMF能促进氮素在固氮植物和非固氮植物间、草本植物与木本植物间的传递。但有报道称固定态氮或土壤中的氮从豆科植物向非豆科植物转移并非是AMF菌丝直接作用的结果 [72] 。可能是根系和菌丝对作物根系释放N素的再吸收或者是菌丝网直接对N的获取和转运而实现的 [73] 。因此,菌根植物菌丝桥间氮素传递的研究具有很好的生态作用,可提高土壤氮素的利用率,加快氮素在植物–AMF–土壤–植物间的循环,减少养分的流失等 [74] 。但对于AMF根外菌丝桥的氮素转移机制尚无定论,有待深入的研究。
8. 展望
AMF帮助植物吸收氮素已经是公认的事实,关于丛枝菌根共生体中氮素吸收和转运的机制也取得了很大的进展,随着分子、生化等技术不断更新,氮素在菌根共生体中的转运特点和载体将逐渐被大家认识。但是目前仍有很多问题亟待解决:第一,虽然AMF能够吸收利用土壤中的有机氮的理论初步建立,但AMF对复杂有机氮的利用机制尚不可知。究竟是AMF直接对这些复杂的有机氮分泌相关酶使之分解为可利用的无机氮加以利用,还是AMF改变了根围土壤中存在的其他微生物的组成和活性,进而加快了复杂有机氮的分解,这些我们都未可知。第二,大量的研究表明,AMF可以改变植物根围的微生物结构和数量,根围微生物的改变也会影响AMF对氮素的吸收,但是二者之间的具体作用关系也是未知的,土壤微生物与AMF之间的生态关系仍需进一步研究。第三,丛枝菌根共生体C、P代谢与AMF氮代谢间有着密不可分的联系,这是毋庸置疑的,但是三者之间具体地调控关系和计量关系至今都未被揭示,仍需深入探讨。
基金项目
现代农业产业技术体系专项(No. CARS-22-ZJ0503)和重庆市研究生教育教学改革项目(yjg143028)资助。
文章引用
曹 敏,高 媛,刘 贝,陈 珂,余 米,杨晓红,黄先智, (2015) 氮在丛枝菌根中的代谢过程及其生理生态调控机制
Nitrogen Metabolism of Arbuscular Mycorrhizal Symbiosis and Its Physiological and Ecological Regulation Mechanism. 植物学研究,03,64-75. doi: 10.12677/BR.2015.43009
参考文献 (References)
- 1. Redecker, D., Kodner, R. and Graham, L.E. (2000) Glomalean fungi from the Ordovician. Science, 289, 1920-1921.
- 2. Treseder, K.K. (2013) The extent of mycorrhizal colonization of roots and its influence on plant growth and phosphorus content. Plant and Soil, 371, 1-13.
- 3. 施松梅, 陈珂, 涂波, 等 (2013) 石漠化地区桑根际 AM 真菌多样性及桑壮苗培育研究. 西南大学学报(自然科学版), 10, 24-30.
- 4. Nahiyan, A.S.M. and Matsubara, Y. (2012) Tolerance to Fusarium root rot and changes in antioxidative ability in mycorrhizal asparagus plants. HortScience, 47, 356-360.
- 5. 唐许, 刘代军, 涂波, 等 (2013) 菌根桑的促生效应及耐旱生理生化机制分析. 西南大学学报(自然科学版), 8, 19-26.
- 6. Kashyap, S. and Sharma, S. (2006) In vitro selection of salt tolerant Morus alba and its field performance with bioinoculants. Horticultural Science—Prague, 33, 77-86.
- 7. de Andrade, S.A.L., da Silveira, A.P.D., Jorge, R.A., et al. (2008) Cadmium accumulation in sunflower plants influenced by arbuscular mycorrhiza. International Journal of Phytoremediation, 10, 1-13.
- 8. Jackson, L.E., Burger, M. and Cavagnaro, T.R. (2008) Roots, nitrogen transformations, and ecosystem services. Annual Review of Plant Biology, 59, 341-363.
- 9. Tanaka, Y. and Yano, K. (2005) Nitrogen delivery to maize via mycorrhizal hyphae depends on the form of N supplied. Plant, Cell & Environment, 28, 1247-1254.
- 10. 刘润进, 李晓林 (2000) 丛枝菌根及其应用. 科学出版社, 北京.
- 11. Haines, B.L. and Best, G.R. (1976) Glomus mosseae, endomycorrhizal with Liquidambar styraciflua L. seedlings retards NO3, NO2 and NH4 nitrogen loss from a temperate forest soil. Plant and Soil, 45, 257-261.
- 12. Ames, R.N., Reid, C.P.P., Porter, L.K. and Cambardella, C. (1983) Hyphal uptake and transport of nitrogen from two 15N-labelled sources by Glomus mosseae, a vesicular-arbuscular mycorrhizal fungus. New Phytologist, 95, 381-396.
- 13. Hawkins, H.J. and George, E. (2001) Reduced 15N-nitrogen transport through arbuscular mycorrhizal hyphae to Triticum aestivum L. supplied with ammonium vs. nitrate nutrition. Annals of Botany, 87, 303-311.
- 14. 李侠, 张俊伶 (2009) 丛枝菌根根外菌丝对铵态氮和硝态氮吸收能力的比较. 植物营养与肥料学报, 3, 683-689.
- 15. 李侠, 张俊伶 (2007) 丛枝菌根根外菌丝对不同形态氮素的吸收能力. 核农学报, 2, 195-200.
- 16. Johansen, A., Finlay, R.D. and Olsson, P.Å.L.A. (1996) Nitrogen metabolism of external hyphae of the arbuscular mycorrhizal fungus Glornus intraradices. New Phytologist, 133, 705-712.
- 17. Toussaint, J.P., St-Arnaud, M. and Charest, C. (2004) Nitrogen transfer and assimilation between the arbuscular mycorrhizal fungus Glomus intraradices Schenck & Smith and Ri T-DNA roots of Daucus carota L. in an in vitro compartmented system. Canadian Journal of Microbiology, 50, 251-260.
- 18. Cliquet, J.B., Murray, P.J. and Boucaud, J. (1997) Effect of the arbuscular mycorrhizal fungus Glomus fasciculatum on the uptake of amino nitrogen by Lolium perenne. New Phytologist, 137, 345-349.
- 19. Leigh, J., Hodge, A. and Fitter, A.H. (2009) Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material. New Phytologist, 181, 199-207.
- 20. Whiteside, M.D., Garcia, M.O. and Treseder, K.K. (2012) Amino acid uptake in arbuscular mycorrhizal plants. PLOS ONE, 7, 1-4.
- 21. 金海如, 张萍华, 蒋冬花 (2011) 同位素示踪研究丛枝菌根真菌吸收不同氮素并向寄主植物输运的机理. 土壤学报, 4, 888-892.
- 22. Belmondo, S., Fiorilli, V., Pérez-Tienda, J., Ferrol, N., Marmeisse, R. and Lanfranco, L. (2014) A dipeptide transporter from the arbuscular mycorrhizal fungus Rhizophagus irregularis is upregulated in the intraradical phase. Frontiers in Plant Science, 5, 1-11.
- 23. Hodge, A., Campbell, C.D. and Fitter, A.H. (2001) An arbuscular mycorrhizal fungus accelerates decomposition and acquires nitrogen directly from organic material. Nature, 413, 297-299.
- 24. Toljander, J.F., Lindahl, B.D., Paul, L.R., Elfstrand, M. and Finlay, R.D. (2007) Influence of arbuscular mycorrhizal mycelial exudates on soil bacterial growth and community structure. FEMS Microbiology Ecology, 61, 295-304.
- 25. Nuccio, E.E., Hodge, A., Pett-Ridge, J., Herman, D.J., Weber, P.K. and Firestone, M.K. (2013) An arbuscular mycorrhizal fungus significantly modifies the soil bacterial community and nitrogen cycling during litter decomposition. Environmental Microbiology, 15, 1870-1881.
- 26. Whiteside, M.D., Treseder, K.K. and Atsatt, P.R. (2009) The brighter side of soils: Quantum dots track organic nitrogen through fungi and plants. Ecology, 90, 100-108.
- 27. Whiteside, M.D., Digman, M.A., Gratton, E. and Treseder, K.K. (2012) Organic nitrogen uptake by arbuscular mycorrhizal fungi in a boreal forest. Soil Biology and Biochemistry, 55, 7-13.
- 28. Titus, J.S. and Kang, S.M. (1982) Nitrogen metabolism, translocation, and recycling in apple trees. Horticultural Reviews, 4, 204-246.
- 29. Bago, B., Pfeffer, P. and Shachar-Hill, Y. (2001) Could the urea cycle be translocating nitrogen in the arbuscular mycorrhizal symbiosis? New Phytologist, 149, 4-8.
- 30. Govindarajulu, M., Pfeffer, P.E., Jin, H.R., Abubaker, J., Douds, D.D., Allen, J.W., et al. (2005) Nitrogen transfer in the arbuscular mycorrhizal symbiosis. Nature, 435, 819-823.
- 31. Jin, H., Pfeffer, P.E., Douds, D.D., Piotrowski, E., Lammers, P.J. and Shachar-Hill, Y. (2005) The uptake, metabolism, transport and transfer of nitrogen in an arbuscular mycorrhizal symbiosis. New Phytologist, 168, 687-696.
- 32. 金海如, 刘洁, 刘静, 黄晓伟 (2012) 丛枝菌根真菌氮吸收, 运转和传递机理的总述. 中国科学: 生命科学, 5, 355-364.
- 33. Bago, B., Pfeffer, P.E., Douds, D.D., Brouillette, J., Bécard, G. and Shachar-Hill, Y. (1999) Carbon metabolism in spores of the arbuscular mycorrhizal fungus Glomus intraradices as revealed by nuclear magnetic resonance spectroscopy. Plant Physiology, 121, 263-272.
- 34. Cruz, C., Egsgaard, H., Trujillo, C., Ambus, P., Requena, N., Martins-Loução, M.A. and Jakobsen, I. (2007) Enzymatic evidence for the key role of arginine in nitrogen translocation by arbuscular mycorrhizal fungi. Plant Physiology, 144, 782-792.
- 35. 金海如, 蒋湘艳 (2009) AM 真菌氮代谢与运转研究新进展. 菌物学报, 3, 466-471.
- 36. Tian, C.J., Kasiborski, B., Koul, R., Lammers, P.J., Bücking, H. and Shachar-Hill, Y. (2010) Regulation of the nitrogen transfer pathway in the arbuscular mycorrhizal symbiosis: Gene characterization and the coordination of expression with nitrogen flux. Plant Physiology, 153, 1175-1187.
- 37. 金海如 (2008) 丛枝菌根菌丝精氨酸双向运转并分解为鸟氨酸. 中国科学: C 辑, 11, 1048-1055.
- 38. Jin, H.R. (2009) Arginine bi-directional translocation and breakdown into ornithine along the arbuscular mycorrhizal mycelium. Science in China Series C: Life Sciences, 52, 381-389.
- 39. Chalot, M., Blaudez, D. and Brun, A. (2006) Ammonia: A candidate for nitrogen transfer at the mycorrhizal interface. Trends in Plant Science, 11, 263-266.
- 40. Pumplin, N. and Harrison, M.J. (2009) Live-cell imaging reveals periarbuscular membrane domains and organelle location in Medicago truncatula roots during arbuscular mycorrhizal symbiosis. Plant physiology, 151, 809-819.
- 41. López-Pedrosa, A., González-Guerrero, M., Valderas, A., Azcón-Aguilar, C. and Ferrol, N. (2006) GintAMT1 encodes a functional high-affinity ammonium transporter that is expressed in the extraradical mycelium of Glomus intraradices. Fungal Genetics and Biology, 43, 102-110.
- 42. Pérez-Tienda, J., Testillano, P.S., Balestrini, R., Fiorilli, V., Azcón-Aguilar, C. and Ferrol, N. (2001) GintAMT2, a new member of the ammonium transporter family in the arbuscular mycorrhizal fungus Glomus intraradices. Fungal Genetics and Biology, 48, 1044-1055.
- 43. Pérez-Tienda, J., Corrêa, A., Azcón-Aguilar, C. and Ferrol, N. (2014) Transcriptional regulation of host NH4+ transporters and GS/GOGAT pathway in arbuscular mycorrhizal rice roots. Plant Physiology and Biochemistry, 75, 1-8.
- 44. Cappellazzo, G., Lanfranco, L., Fitz, M., Wipf, D. and Bonfante, P. (2008) Characterization of an amino acid permease from the endomycorrhizal fungus Glomus mosseae. Plant Physiology, 147, 429-437.
- 45. 田萌萌 (2011) 丛枝菌根真菌吸收同化外源氮产生精氨酸的研究. 硕士论文, 浙江师范大学, 浙江.
- 46. Mohamed, A.A., Eweda, W.E.E., Heggo, A.M. and Hassan, E.A. (2014) Effect of dual inoculation with arbuscular mycorrhizal fungi and sulphur-oxidising bacteria on onion (Allium cepa L.) and maize (Zea mays L.) grown in sandy soil under green house conditions. Annals of Agricultural Sciences, 59, 109-118.
- 47. 蔡宣梅, 张秋芳, 郑伟文 (2004) VA 菌根菌与重氮营养醋杆菌双接种对超甜玉米生长的影响. 福建农业学报, 3, 125-159.
- 48. Tian, C.J., He, X.Y., Zhong, Y. and Chen, J.K. (2002) Effects of VA mycorrhizae and Frankia dual inoculation on growth and nitrogen fixation of Hippophae tibetana. Forest Ecology and Management, 170, 307-312.
- 49. Ames, R.N. (1989) Mycorrhiza development in onion in response to inoculation with chitin-decomposing actinomycetes. New Phytologist, 112, 423-427.
- 50. Krishna, K., Balakrishna, A. and Bagyarajf, D. (1982) Interaction between a vesicular-arbuscular mycorrhizal fungus and Streptomyces cinnamomeous and their effects on finger millet. New Phytologist, 92, 401-405.
- 51. Hawkins, H.J., Johansen, A. and George, E. (2000) Uptake and transport of organic and inorganic nitrogen by arbuscular mycorrhizal fungi. Plant and Soil, 226, 275-285.
- 52. 刘洁 (2012) 不同因素对丛枝菌根真菌吸收同化外源氮产生精氨酸的影响. 硕士论文, 浙江师范大学, 浙江.
- 53. Barrett, G., Campbell, C.D. and Hodge, A. (2014) The direct response of the external mycelium of arbuscular mycorrhizal fungi to temperature and the implications for nutrient transfer. Soil Biology & Biochemistry, 78, 109-117.
- 54. Bender, S.F., Conen, F. and Heijden, M.G.A.V. (2015) Mycorrhizal effects on nutrient cycling, nutrient leaching and N2O production in experimental grassland. Soil Biology & Biochemistry, 80, 283-292.
- 55. Tatsuhiro, E. and Sally, E. (2001) Differentiation of polyphosphate metabolism between the extra- and intraradical hyphae of arbuscular mycorrhizal fungi. New Phytologist, 149, 555-563.
- 56. Ding, X.D., Zhang, L., Zhang, S.R. and Feng, G. (2014) Phytate utilization of maize mediated by different nitrogen forms in a plant-arbuscular mycorrhizal fungus-phosphate-solubilizing bacterium system. Journal of Plant Interactions, 9, 514-520.
- 57. Nasto, M.K., Alvarez-Clare, S., Lekberg, Y., Sullivan, B.W., Townsend, A.R. and Cleveland, C.C. (2014) Interactions among nitrogen fixation and soil phosphorus acquisition strategies in lowland tropical rain forests. Ecology letters, 17, 1282-1289.
- 58. 王晓伟, 左楠楠, 金海如 (2013) 不同磷浓度对丛枝菌根真菌吸收同化外源氮能力的影响. 微生物学杂志, 6, 60- 64.
- 59. Cheng, L., Booker, F.L., Tu, C., Burkey, K.O., Zhou, L., Shew, H.D., et al. (2012) Arbuscular mycorrhizal fungi increase organic carbon decomposition under elevated CO2. Science, 337, 1084-1087.
- 60. Bécard, G. and Piché, Y. (1989) Fungal growth stimulation by CO2 and root exudates in vesicular-arbuscular mycorrhizal symbiosis. Applied and Environmental Microbiology, 55, 2320-2325.
- 61. Pfeffer, P.E., Douds, D.D., Bécard, G. and Shachar-Hill, Y. (1999) Carbon uptake and the metabolism and transport of lipids in an arbuscular mycorrhiza. Plant Physiology, 120, 587-598.
- 62. Walder, F., Niemann, H., Natarajan, M., Lehmann, M.F., Boller, T. and Wiemken, A. (2012) Mycorrhizal networks: Common goods of plants shared under unequal terms of trade. Plant physiology, 159, 789-797.
- 63. Fellbaum, C.R., Gachomo, E.W., Beesetty, Y., Choudhari, S., Strahan, G.D., Pfeffer, P.E., et al. (2012) Carbon availability triggers fungal nitrogen uptake and transport in arbuscular mycorrhizal symbiosis. Proceedings of the National Academy of Sciences, 109, 2666-2671.
- 64. Fellbaum, C.R., Mensah, J.A., Cloos, A.J., Strahan, G.E., Pfeffer, P.E., Kiers, E.T. and Bücking, H. (2014) Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist, 203, 646-656.
- 65. Olsson, P.A., Burleigh, S.H. and Van Aarle, I.M. (2005) The influence of external nitrogen on carbon allocation to Glomus intraradices in monoxenic arbuscular mycorrhiza. New Phytologist, 168, 677-686.
- 66. Brzostek, E.R., Fisher, J.B. and Phillips, R.P. (2014) Modeling the carbon cost of plant nitrogen acquisition: Mycorrhizal trade-offs and multipath resistance uptake improve predictions of retranslocation. Journal of Geophysical Research: Biogeosciences, 119, 1684-1697.
- 67. 王婷婷, 王仁刚, 李咏梅, 王昌江, 任学良, 王云鹏, 郭坚华 (2014) 贵州烟草根围 AM 真菌多样性的初步研究. 菌物学报, 1, 143-151.
- 68. Pivato, B., Mazurier, S., Lemanceau, P., Siblot, S., Berta, G., Mougel, C. and van Tuinen, D. (2007) Medicago species affect the community composition of arbuscular mycorrhizal fungi associated with roots. New Phytologist, 176, 197- 210.
- 69. 冯固, 张福锁, 李晓林, 张俊伶, 盖京苹 (2010) 丛枝菌根真菌在农业生产中的作用与调控. 土壤学报, 5, 995- 1004.
- 70. 肖同建, 杨庆松, 冉炜, 徐国华, 沈其荣 (2010) 接种菌根真菌的旱作水稻-绿豆间作系统养分利用研究. 中国农业科学, 4, 753-760.
- 71. 艾为党, 李晓林 (2000) 玉米, 花生根间丝桥对氮传递的研究. 作物学报, 4, 473-481.
- 72. He, X.H., Critchley, C. and Bledsoe, C. (2003) Nitrogen transfer within and between plants through common mycorrhizal networks (CMNs). Critical Reviews in Plant Sciences, 22, 531-567.
- 73. Johansen, A. and Jensen, E.S. (1996) Transfer of N and P from intact or decomposing roots of pea to barley interconnected by an arbuscular mycorrhizal fungus. Soil Biology and Biochemistry, 28, 73-81.
- 74. 李晓林, 冯固 (2001) 丛枝菌根生态生理. 华文出版社, 北京.