Botanical Research
Vol.05 No.03(2016), Article ID:17721,6
pages
10.12677/BR.2016.53014
Ultrasturctural Studies on Broken Exine Roles for Microspore Embryogenesis in Brassica napus L.cv. Topas
Jinhua Tu1, Jiaxin Wan1, Yuqing He2, Xingchun Tang1,2*
1School of Life and Science, Hubei University, Wuhan Hubei
2School of Life and Science, Wuhan University, Wuhan Hubei

Received: May. 4th, 2016; accepted: May. 23rd, 2016; published: May. 30th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In prior studies, the exine-dehisced microspore could also embryogenesis. Early events in microspore embryogenesis, such as polarity establishment, cell wall development, and the first division plane decision were investigated to reveal the mechanism controlling the process. In this paper, rapeseed exine-dehisced microspores were used to reveal the roles of exine for microspore embryogenesis by ultrastructural observation. The results show that some ultrastructural characteristic of the microspore is comparable to that of zygote, and that the dividing behavior of some exine-de- hisced microspore is similar to that of zygotes which could divide asymmetrically, resulting in two different daughter cells. This observation suggested that broken exine may play an important role in the polarity establishment during microspore embryogenesis.
Keywords:Brassica napus L.cv Topas, Exine-Dehisced Microspore, Embryogenesis, Ultrasturcture

外壁破裂对油菜小孢子胚胎发生影响的显微 观察
涂金华1,万佳馨1,何宇清2,汤行春1,2*
1湖北大学生命科学学院,湖北 武汉
2武汉大学生命科学学院,湖北 武汉

收稿日期:2016年5月4日;录用日期:2016年5月23日;发布日期:2016年5月30日

摘 要
前期研究表明,油菜裂外壁小孢子也能胚胎发生。本研究以油菜裂外壁小孢子为材料,利用超微结构显微观察了破裂的外壁对胚胎发生的影响。结果表明,裂外壁小孢子可表现出与合子相似的某些结构特征;与合子进行不均等分裂而形成形态、结构迥异的顶基细胞类似,裂外壁小孢子也可以进行不均等分裂,形成大小和结构不同的两个子细胞。这些结果暗示破裂的外壁在小孢子极性生长和启动胚胎发生过程中重要作用。
关键词 :油菜,裂外壁小孢子,胚胎发生,超微结构

1. 前言
油菜小孢子离体实验表明,相当一部分裂外壁小孢子具有类似于合子胚的发育途径,在培养过程中形成胚柄 [1] [2] 。研究者认为,外壁的弹性和刚性及其活性成分也许均在胚胎发生过程中发挥作用。烟草合子离体实验也表明,细胞壁存在的不同状态显著影响合子的分裂模式以及发育命运;只有细胞壁相对完整、合子保持纵横比大于2.0的合子,才可基本遵循体内的发育模式,在合适的培养条件下形成与体内模式基本相同的胚 [3] 。
我们所诱导的能够产生胚柄且从第一次分裂似乎就奠定了顶–基轴向的小孢子胚胎发生,其结构和发育过程是否存在与体内合子相似的机制?外壁在其中如何发挥作用?是否与胚胎发生有关?本文就此问题进行探讨。
2. 材料和方法
2.1. 材料
供试材料为油菜 [4] ,2013年九月下旬播种于武汉油料作物研究所田间,十月移栽,次年3~5月开花时取材。
2.2. 裂外壁小孢子的制备与培养
选取小孢子处于单核晚期、长约3 mm的花蕾为材料。直接置于4%的次氯酸钠溶液中消毒10 min,无菌水冲洗3~4次。加入NLN13 [5] 培养基4 mL,用平头玻棒轻轻挤压花蕾,使小孢子游离至培养基中,通过50 μm孔径尼龙筛网除去残渣后,在转速为500转/min条件下离心6 min,加入新鲜NLN13培养基重复三次。最后收集小孢子,用NLN13培养基使小孢子重悬,将小孢子密度调至4*104/mL,32℃恒温暗培养。
2.3. 透射电镜样品制备与观察
在倒置显微镜下,用自制微吸管将目标材料吸出,置于戊二醛终浓度为1%的钱固定液中,在4℃下固定1 h。立即吸一小滴(约20 μL)已融化的35℃~40℃的琼脂(SEAPREP, Catalog No.50302, FMC)覆盖其上,置于4℃冰箱中约10 min。沿皿壁缓缓加入戊二醛终浓度为2%的前固定液于小培养皿中。预包埋块与培养皿底分离后,置于4℃冰箱中继续固定2 h。然后按常规电镜样品制备步骤固定、脱水、渗透、包埋于聚合、切片和染色。样品用Jeol 100 CX电子显微镜观察。
3. 实验结果
3.1. 油菜裂外壁小孢子的超微结构
油菜小孢子在单核晚期时,细胞中央有一个大的液泡,细胞核在中央大液泡的挤压下,位于细胞边缘。培养后,部分裂外壁小孢子开始表现出与合子相似的结构(图1(1)),细胞核、液泡和细胞器均沿着与外壁断裂面垂直的方向呈极性分布。细胞质中细胞器丰富,包括线粒体、质体、造粉体、脂质体、内质网和高尔基器等(图1(1))。质体和造粉体主要分布在细胞核的周围;脂质体的数目因材料而异,有的小孢子中脂质体较多,但也有小孢子中没有发现脂质体。内壁内侧有次生壁形成(图1(1)-(2))。
3.2. 裂外壁小孢子的不均等分裂
与合子进行不均等分裂而形成结构迥异的顶、基细胞相似,有的裂外壁小孢子也进行不均等分裂,形成大小和结构均不同的两个子细胞(图2)。这种小孢子的分裂方向一般与外壁断裂面平行,其中一个子细胞位于外被包被端,另一个子细胞不被外被包裹。一般一个子细胞具有较大液泡,细胞质较少,但染色较深,在液泡的挤压下,沿细胞核和细胞边缘分布(图2(1))。另一个子细胞没有大液泡,只有数个体积较小的液泡;细胞质较多,染色较浅,细胞器丰富,包括线粒体、淀粉和嗜锇颗粒等(图2(2))。这些结果与合子的结构和第一次分裂特征相似。
3.3. 油菜裂外壁小孢子分裂的多样性
相对于第一次分裂方向多表现为与外壁断裂方向重合、平行,裂外壁小孢子第二次分裂的情况比较复杂,存在多种可能(图3);1) 两个子细胞,一个沿与外壁断裂面平行的方向分裂,另一个沿与外壁断裂面垂直的方向分裂(图3(1));2) 两个子细胞的分裂面都垂直于外壁断裂面(图3(2));3) 两个子细胞的分裂面都平行于外壁断裂面。前两种情况出现较多。
3.4. 裂外壁小孢子发育过程中淀粉粒的分布
烟草离体合子在第一次分裂后,淀粉粒明显增多。在油菜裂外壁小孢子胚胎发生过程中也存在类似的现象,淀粉粒在小孢子分裂后明显增多。有的裂外壁小孢子在分裂后,淀粉粒生长旺盛,充满曾哥造粉体的内部空间,发育为复淀粉粒(图4)。
4. 讨论
4.1. 外壁破裂在小孢子发育中的作用
小孢子外壁通常具有如下作用:1) 外壁的弹性对细胞具有一定的束缚作用;2) 外壁的隔离减少与外界交流的表面积;3) 外壁提供一些活性因子对细胞代谢产生影响 [4] [6] 。而外壁的破裂则可能改变了:1) 细胞各个部位承受的机械压力;2) 细胞各个部位与外界接触和交流的程度;3) 表面活性因子的分布。这样,破裂的外壁就作为一种不均一的环境信号因子,决定胚胎发生过程中细胞的定向扩展和极性轴的排列。同时,裂外壁小孢子与具完整外壁小孢子胚胎发生不同,具完整外壁小孢子胚胎发生只有均等分裂,不产生具胚柄的胚,而裂外壁小孢子的分裂模式可以为均等,也可以为不均等两种,大部分裂外壁小孢子所形成的胚能形成与合子胚类似的胚柄结构。
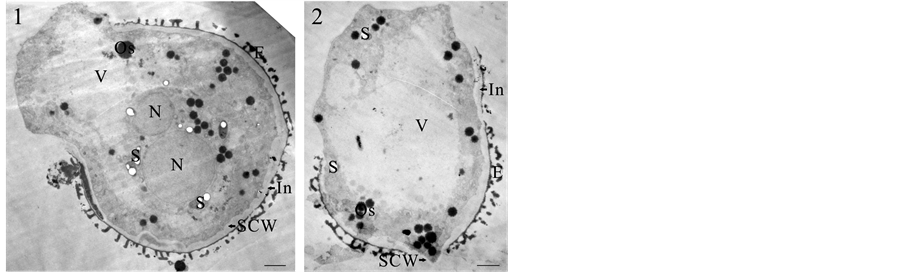 1为结构与合子相似的裂外壁小孢子,示细胞核、淀粉粒等细胞器均沿着与外壁断裂面近似垂直的方向呈极性排列;2为1中所示裂外壁小孢子的另一张超薄切片,示大液泡。V:液泡,N:细胞核,S:淀粉粒,In:内壁,SCW:次生细胞壁,Os:复淀粉粒。Bar = 2 μm
1为结构与合子相似的裂外壁小孢子,示细胞核、淀粉粒等细胞器均沿着与外壁断裂面近似垂直的方向呈极性排列;2为1中所示裂外壁小孢子的另一张超薄切片,示大液泡。V:液泡,N:细胞核,S:淀粉粒,In:内壁,SCW:次生细胞壁,Os:复淀粉粒。Bar = 2 μm
Figure 1. Ultrastructural observation of exine-dehisced microspore
图1. 裂外壁小孢子的超微结构观察
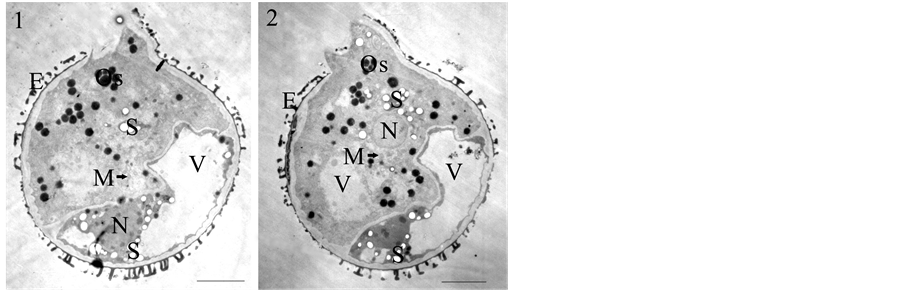 1为发生不均等分裂的裂外壁小孢子,其中一个子细胞含大的液泡,并示细胞核;2为1所示裂外壁小孢子的另一张超薄切片,其中一个子细胞含小液泡,并示细胞核。V:液泡,S:淀粉粒,M:线粒体,N:细胞核,E:小孢子外壁。Bar = 5 μm。
1为发生不均等分裂的裂外壁小孢子,其中一个子细胞含大的液泡,并示细胞核;2为1所示裂外壁小孢子的另一张超薄切片,其中一个子细胞含小液泡,并示细胞核。V:液泡,S:淀粉粒,M:线粒体,N:细胞核,E:小孢子外壁。Bar = 5 μm。
Figure 2. Ultrastructural observation of the first divided exine- dehisced micropsore
图2. 发生一次分裂的裂外壁小孢子的超微结构观察
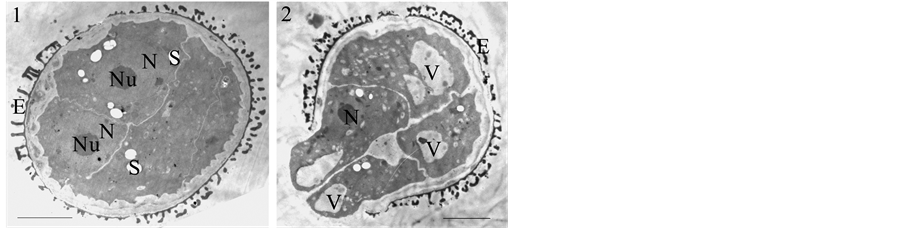 1为已分裂两次的裂外壁小孢子,其中一个子细胞发生的分裂与第一次分裂近似垂直(箭头所示);2为已发生两次分裂的裂外壁小孢子,两个子细胞都发生了分裂。N:细胞核,Nu:核仁,S:淀粉粒,V:液泡。Bar = 5 μm。
1为已分裂两次的裂外壁小孢子,其中一个子细胞发生的分裂与第一次分裂近似垂直(箭头所示);2为已发生两次分裂的裂外壁小孢子,两个子细胞都发生了分裂。N:细胞核,Nu:核仁,S:淀粉粒,V:液泡。Bar = 5 μm。
Figure 3. Ultrastructural observation of the several divided exine-dehisced microspore
图3. 发生几次分裂的裂外壁小孢子的超微结构观察

Figure 4. The exine-dehisced microspore (shown osmiophilic granules). N: nucleus, S: starch grain, Os: osmiophilic granules, V: vacuole. Bar = 0.5 μm
图4. 裂外壁小孢子,示复淀粉粒。N:细胞核,S:淀粉粒,Os:复淀粉粒,V:液泡。Bar = 0.5 μm
裂外壁小孢子胚状体轴向的排列以及取向都与破裂的外壁有关。先前的研究表明,小孢子外壁的破裂诱导了细胞极性的产生 [2] ,这种极性可能决定了胚胎发育的轴向的确定以及细胞命运的抉择。但是,极性的产生与细胞分裂面的排列是解偶联的,细胞分裂面总是与外壁的断裂面平行或重合,推测可能与外壁的机械压力有关。尽管裂外壁小孢子第一次分裂之后在发育过程中分裂方向存在多样性,无论是均等分裂还是不均等分裂,外壁破裂所诱导的极性必然不均等地分布在两个子细胞中。这也可能决定了两个子细胞不同发育命运的物质基础。
4.2. 淀粉粒与裂外壁小孢子胚胎发生
淀粉粒的积累可能是小孢子胚、体细胞胚早期发育的重要标志 [7] ,研究者发现,油菜小孢子在培养2~3 d后,胚性细胞中积累大量淀粉,并随细胞分裂,淀粉的含量有明显变化。Zaki [8] 认为,富含多糖的培养基可能刺激细胞合成淀粉。淀粉在细胞分裂和分化中起着重要作用。Thorpe等 [9] 提出,淀粉作为能量有许多优点,一方面,多糖水解后可以得到大量ATP的合成底物;另一方面,葡萄糖经糖酵解和TCA循环可得到大量ATP。此外,淀粉在调节细胞渗透势方面也具有一定作用。
崔凯荣等 [10] 认为细胞中淀粉和多糖类化合物的积累发生在重要的发育转折时期,为新的发育阶段提供能源。在烟草 [10] 、小麦 [11] 、棉花 [12] 等植物体细胞胚胎发育早期或发育过程中都出现淀粉大量积累。Huang [13] 曾报道,在烟草、芍药等植物的花药培养过程中,小孢子分裂发生于充满淀粉的细胞。可见,淀粉的积累有可能是小孢子发育途径转换和启动胚胎发育的重要指征。
淀粉粒的分布还可能与胚胎轴向的建立有关。正常发育的胚胎中,淀粉的积累和分布具有极性特征。Indrianto等 [14] 和Hause等 [4] 发现,在分裂多次的小孢子中,淀粉粒极性分布于破裂的外壁所依附的原胚团一侧,他们推测,这种现象可能与根的向地性形成有关。对于水稻和台湾芦竹的研究也表明,淀粉粒从胚胎的基部开始积累 [15] [16] ,这也表明淀粉粒分布的位点标记了发育轴向。尽管如此,关于淀粉粒大量出现的机理,是否确实在胚胎发生过程中发挥作用、如何起作用,仍需进一步研究。
致谢
本项目得到国家自然科学基金(30970279; 31270355)资助。
文章引用
涂金华,万佳馨,何宇清,汤行春. 外壁破裂对油菜小孢子胚胎发生影响的显微观察
Ultrasturctural Studies on Broken Exine Roles for Microspore Embryogenesis in Brassica napus L.cv. Topas[J]. 植物学研究, 2016, 05(03): 100-105. http://dx.doi.org/10.12677/BR.2016.53014
参考文献 (References)
- 1. 田辉, 孙蒙祥. 从油菜裂外壁小孢子培育出胚状体与小植株. 作物学报, 2003, 29(01): 49-53.
- 2. Tang, X., Liu, Y., He, Y., Ma, L., Sun, M. X. (2013) Exine Dehiscing Induces Rape Microspore Polarity, which Results in Different Daughter Cell Fate and Fixes the Apical-Basal Axis of the Embryo. Journal of Experimental Botany, 64, 215-228. http://dx.doi.org/10.1093/jxb/ers327
- 3. He, Y.C., He, Y.Q., Qu, L.H., Sun, M.X. and Yang, H.Y. (2007) To-bacco Zygotic Embryogenesis in Vitro: The Original Cell Wall of the Zygote Is Essential for Maintenance of Cell Polarity, the Apical-Basal Axis and Typical Suspensor Formation. Plant Journal, 49, 515-527 http://dx.doi.org/10.1111/j.1365-313X.2006.02970.x
- 4. Hause, B., van Veenendaal, W.L.H., Hause, G. and van Lammeren, A.A.M. (1994) Expression of Polarity during Early Development of Microspore-Derived and Zygote Embryos of Brassica napus L.cv. Topas. Botanica Acta, 6, 369-472.
- 5. Lichter, R. (1982) Induction of haploid plants from isolated pollen of Brassica napus. Zeitschrift für Pflanzenphysiologie, 105, 427-434. http://dx.doi.org/10.1016/S0044-328X(82)80040-8
- 6. Knox, E.B. (1984) The Pollen Grain. In: Johri, B.M., Ed., Embryology of Angiosperms, Springer-Verlag, Berlin, Heidelberg, New York and Tokyo, 197-271. http://dx.doi.org/10.1007/978-3-642-69302-1_5
- 7. 余凤群, 傅丽霞, 刘后利, 翟波, 金晓萍. 油菜小孢子胚胎发生的超微结构和胚状体形态[J]. 西北植物学报, 1997(17): 181-186.
- 8. Zaki, M.A.M. and Dickinson, H.G. (1990) Structural Changes During the First Divisions of Embryos Resulting from Anther and Free Microspore Culture in Brassica napus. Protoplasma, 156, 149-162. http://dx.doi.org/10.1007/BF01560653
- 9. Thorpe, T.A. and Murashige, T. (1970) Some Histochemical Changes Underlying Shoot Initiation in Tobacco Callus Cultures. Canadian Journal of Botany, 48, 277-285. http://dx.doi.org/10.1139/b70-042
- 10. 崔凯荣, 等. 植物体细胞胚胎发生研究的某些现状[J]. 植物学通报, 1993, 10(3): 14-20.
- 11. 王亚馥, 崔凯荣, 汪丽虹. 小麦体细胞胚发生的超微结构研究[J]. 植物学报, 1994(36): 418-422.
- 12. 刘春明. 陆地棉体细胞胚发生及其细胞组织学研究[J]. 植物学报, 1991(33): 378-384.
- 13. Huang, B. (1982) Development Studies of Anther Cultures of Hordeum, Triticum and Paeonia. Ph.D. Thesis, University of East Anglia, Norwich.
- 14. Indrianto, A., Barinova, I., Touraev, A. and Heberle-Bors, E. (2001) Tracking Individual Wheat Microspores in Vitro: Identification of Embryogenic Microspores and Body Axis Formation in the Embryo. Planta, 212, 163-174. http://dx.doi.org/10.1007/s004250000375
- 15. Jane, W.N. (1999) Ultrastructure of Embryo Development in Arundo formosana Hack (Poaceae). International Journal of plant Sciences, 160, 46-63. http://dx.doi.org/10.1086/314101
- 16. Krishnan, H.B. and White, J.A. (1997) Protein Body Formation and Immunocytochemical Localization of Globulins and Glutelins in Developing Rice (Qryza sativa) Embryos. Crop Science, 37, 932-939. http://dx.doi.org/10.2135/cropsci1997.0011183X003700030038x
*通讯作者。