Botanical Research
Vol.
08
No.
03
(
2019
), Article ID:
30186
,
6
pages
10.12677/BR.2019.83028
Differential Impacts of WOX5 Overexpression and Colchicine Treatments on Columella and Lateral Root Cap Cells in Arabidopsis thaliana
Yujie Chen, Huanhuan Yan, Lihua Chen, Tian Wang, Hanma Zhang*
Chongqing Key Laboratory of Molecular Adaptations of Plants, College of Life Science, Chongqing Normal University, Chongqing

Received: Apr. 18th, 2019; accepted: May 2nd, 2019; published: May 14th, 2019

ABSTRACT
Columella and lateral root cap cells are two different cell types in root cap of higher plants. Although they are generated by different stem cells, their division and differentiation are highly coordinated and synchronised. WOX5 is an important regulatory gene for root stem cells in Arabidopsis thaliana and its encoded product can inhibit the differentiation and also promote dedifferentiation of root cap cells, but the relationship between these two functions is currently unclear. In this study, we used colchicine to treat WOX5-overexpressing seedlings and found that the dedifferentiation-promoting function of WOX5 did not depend on cell division. In addition, in the background of WOX5-overexpression, columella and lateral root cap cells displayed differential responses to colchicine treatments. The results provide new experimental data for the regulatory function of WOX5 and also an important entry point and experimental strategy for studying the coordinations of plant cells.
Keywords:Arabidosis, Root Cap, Columella Root Cap Cell, Lateral Root Cap Cell, Colchicine
WOX5过量表达和秋水仙素处理对拟南芥根冠柱细胞与侧根冠细胞的影响差异
陈玉洁,严欢欢,陈丽华,王甜,张汉马*
重庆师范大学,植物环境适应分子生物学重庆市重点实验室,重庆

收稿日期:2019年4月18日;录用日期:2019年5月2日;发布日期:2019年5月14日

摘 要
柱细胞和侧根冠细胞为植物根冠中的两种细胞类型,它们虽然来自不同的干细胞,但分裂与分化活动高度同步。WOX5为拟南芥中根尖干细胞调控的一个重要基因,其所编码的蛋白对根冠细胞有抑制分化和促进脱分化的功能,但这些功能之间是否相互依赖目前并不清楚。本研究利用秋水仙素处理WOX5过表达幼苗后,发现WOX5对脱分化的促进作用不依赖于细胞分裂,且在WOX5过量表达的背景下,柱细胞和侧根冠细胞间对秋水仙素处理呈现出显著差异。研究结果为准确了解WOX5的调控功能提供了新的实验数据,为研究植物细胞间相互协调提供了一个重要切入点和研究思路。
关键词 :拟南芥,根冠,柱细胞,侧根冠细胞,秋水仙素

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
根冠(root cap)是高等植物根中一个特有的结构,位于根的最前端,形如帽状,担负着保护根尖分生组织,减少根与土壤间摩擦和接受向地性信号等重要功能 [1] 。根冠中包含两种细胞类型,即位于静止中心下方中央的柱细胞和围绕在柱细胞及分生组织外侧的侧根冠细胞。在模式植物拟南芥中,根冠中的两种细胞类型来源于不同的干细胞。柱细胞由柱干细胞产生,后者的发育可追溯到受精卵第一次分裂后形成的基细胞。侧根冠细胞由侧根冠/表皮原初细胞(干细胞)产生,后者源自受精卵分裂后所产生的顶细胞。因此,根冠中的两种细胞类型的发育过程在受精卵第一次分裂后就已分道扬镳 [2] 。虽然如此,在正常发育条件下柱干细胞与侧根冠/表皮原初细胞的分裂活动高度同步,以至于所产生的柱细胞和侧根冠子细胞间形成连贯的细胞层。在正常情况下由柱干细胞分裂产生的柱细胞不再进行分裂,侧根冠细胞也只进行垂周分裂,根冠中的连贯细胞层结构可一直维持,根冠细胞最终以层状脱落的方式离开根尖进入土壤 [1] 。
WOX5 (WUSCHEL-RELATED HOMEOBOX5)为拟南芥中根尖干细胞调控的一个重要基因,编码一个同源异型域(homeobox)转录因子家族蛋白 [3] 。WOX5功能缺失导致柱干细胞和侧根冠细胞分化,而该基因的过量表达可导致整个根冠中的细胞处于未分化状态,并可继续分裂 [3] 。研究发现WOX5具有抑制根冠细胞分化和促进细胞分裂两种调控功能 [4] [5] ,但这两种功能是否相互独立目前并不十分清楚。本研究试图用秋水仙素(或称秋水仙碱)抑制细胞分裂,由此分开WOX5的脱分化和细胞分裂调控功能。秋水仙素能与微管蛋白结合,由此抑制微管蛋白亚基组装形成维管,破坏纺锤体的形成,从而抑制细胞分裂。研究结果表明WOX5的脱分化调控功能不依赖于细胞分裂,且在WOX5过量表达的背景下,柱细胞区和侧根冠细胞区中的细胞对秋水仙素的响应有显著差异。
2. 材料与方法
2.1. 实验材料
本实验所用35SSGVG/UAS::WOX5转基因株系 [4] 种子由日本奈良科技大学(Nara Institute of Science and Technology) Keiji Nakajima教授赠与。秋水仙素和地塞米松(英文名dexamethasone,简称DEX)购自天根生化科技有限公司。
2.2. 植物的培养和生长条件
种子用10%次氯酸 + 90%酒精混合溶液浸泡10分钟灭菌消毒,用酒精洗3~4遍,在无菌台吹干后点种于配制在10 cm × 10 cm方形塑料无菌培养皿中固化的1/2 MS琼脂(1%,w/v)培养基上。秋水仙素母液(5 mg/ml)配置时先将25 mg秋水仙素溶于1.0 ml酒精,然后加4.0 ml H2O。地塞米松母液(10 mM)配置于水中。秋水仙素和地塞米松母液均用孔径为0.2微米的过滤膜过滤灭菌,在培养基高温(121℃,20分钟)灭菌后冷却至60˚C左右加入。点种后的培养皿用Nescofilm封口膜密封,在上方封口膜的中央打开1~2个小开口允许培养皿内外空气交换,将培养皿垂直放置于22℃,16 h光照/8 h黑暗周期的培养箱中萌发,光照强度为12,000 LX。
2.3. 显微镜观察
共聚焦显微镜观察:将幼苗根浸于滴加在载玻片上的10 µg/ml碘化丙啶(propidium iodide)溶液中,轻轻盖上盖玻片,用奥林巴斯FV1200共聚焦显微镜观察和拍照,波长设置为激发光488 nm,检测波长510 nm。
光学显微镜观察:(拟南芥)幼苗根用50%乳酸:30% H2O:20%卢戈耳氏溶液(Lugol’s solution)混合液装片,用Nikon ECLIPSE 80i微分干涉相差显微镜观察,以及DS-Ri1数码相机和NIS-Elements软件拍照和进行图像处理。
数据统计分析:细胞层数据来自3次重复实验,平均值,标准误差和p值用Mrcrosoft Excel软件计算中相关功能(即AVERAGE,STDEV和TTEST)计算。
3. 结果与分析
3.1. WOX5对柱细胞脱分化的促进作用不依赖于细胞分裂
WOX5过量表达对根冠细胞具有促进分裂和促进脱分化两种功能,但这两种功能之间的关系目前并不清楚。为了检测WOX5的脱分化调控是否依赖于细胞分裂,我们将在1/2MS培养基上萌发3天后的35S::GVG/UAS::WOX5幼苗转到了以下4种不同培养基上:对照(1/2MS培养基),5 µM DEX,0.04%秋水仙素,0.04%秋水仙素 + 5 µM DEX。在对照培养基上生长的幼苗的主根中,根冠内细胞的结构及分化状况与野生型幼苗中的情况相似(图1(B))。在含DEX的培养基上处理3天后,根冠中所有细胞都不含淀粉粒(图1(C)),表明没有分化,与之前报道结果一致。当培养基中含0.04%秋水仙素时,处理3天后幼苗根部分生组织中大部分细胞膨大(图1(D),图1(E)),而静止中心附近细胞和根冠细胞膨大幅度相对较小(图1(D),图1(E))。当培养基中只含秋水仙素时,静止中心下方只有一层未分化(不含淀粉粒)细胞,为柱干细胞。表明秋水仙素处理本身不影响柱干细胞和柱细胞的分化状态。但当培养基中同时含DEX和秋水仙素时,除最外层细胞外,柱细胞区和侧根冠区的其它细胞均不含淀粉粒,表明原来已经分化了的细胞已经脱分化。这一结果表明WOX5过量表达可以在细胞分裂受到秋水仙素抑制时促进细胞脱分化,即WOX5对根冠细胞脱分化的促进作用不依赖于细胞分裂活动。在正常情况下,由于柱干细胞与侧根冠和表皮原初细胞(干细胞)的分裂高度同步,导致柱细胞区和侧根冠区细胞层数基本相同。有趣的是我们发现在DEX + 0.04%秋水仙素培养基上生长的35S::GVG/UAS::WOX5幼苗的根中,柱细胞区中的细胞层数明显少于侧根冠区中的细胞层数。柱细胞区中的细胞与侧根冠区细胞在形状和细胞大小两方面与在其它培养基上相比差异明显拉大,表明在WOX5过量表达的背景下,秋水仙素对柱细胞区和侧根冠区细胞分裂的影响存在显著差异。
 注:A拟南芥根尖细胞结构示意图,示根冠中的两种细胞类型及其干细胞。B-G 在不同培养基上处理3天的35S::GVG/UAS::WOX5幼苗根尖光学显微镜照片,其中B为1/2MS对照,C含5 µM DEX,D & F含0.04%秋水仙素,E & G含0.04%秋水仙素 + 5 µM DEX。B、C、F、G中静止中心和柱干细胞层分别用*符合和箭头标示。DEX:dexamethasone (5 µM);COL:秋水仙素(colchicine,0.04%);标尺线为10 µm。
注:A拟南芥根尖细胞结构示意图,示根冠中的两种细胞类型及其干细胞。B-G 在不同培养基上处理3天的35S::GVG/UAS::WOX5幼苗根尖光学显微镜照片,其中B为1/2MS对照,C含5 µM DEX,D & F含0.04%秋水仙素,E & G含0.04%秋水仙素 + 5 µM DEX。B、C、F、G中静止中心和柱干细胞层分别用*符合和箭头标示。DEX:dexamethasone (5 µM);COL:秋水仙素(colchicine,0.04%);标尺线为10 µm。
Figure 1. The function of WOX5 in promoting cell differentiation is not dependant on cell division
图1. WOX5的脱分化促进作用不依赖于细胞分裂
3.2. 在WOX5过量表达的背景下,柱细胞区和侧根冠区细胞展示出对秋水仙素的不同敏感度
为了进一步评估秋水仙素对柱细胞区和侧根冠区细胞的不同影响的形成过程及剂量效应,我们将35S::GVG/UAS::WOX5幼苗在含DEX的培养基的基础上进行了不同浓度的秋水仙素处理,并在不同的处理时间节点取样观察和进行数据收集。在秋水仙素浓度为0.02%时,幼苗根尖中柱细胞区和侧根冠区的细胞分裂活动没有被完全抑制,细胞形状无显著膨大(图2,图3)。当秋水仙素浓度上升到0.04%后,柱细胞区中的细胞分裂活动已被完全抑制,细胞显著膨大,细胞层数明显减少(图2,图3)。但侧根冠区中的细胞分裂活动未被完全抑制,细胞无明显膨大,细胞层数明显多于柱细胞区。在含0.06% 秋水仙素的培养基上,柱细胞区中的细胞层数与0.04%秋水仙素处理的幼苗中的情况相同,但侧根冠区仍然有少量细胞分裂活动,其中的细胞层数仍然高于柱细胞区中的细胞层数(图2,图3)。从处理时间的角度看,柱细胞区与侧根冠区细胞对秋水仙素的响应差异在处理2天后就已呈现(图3)。
 注:光学显微镜照片显示经碘液染色的35S::GVG/UAS::WOX5幼苗根尖的细胞结构及分化情况。幼苗在1/2MS培养基萌发3天后转入不同处理的培养基继续培养5天后观察,拍照。上排为在不含DEX培养基上生长的幼苗根尖,下排为在含DEX的培养基上生长的幼苗根尖。−DEX:未经DEX处理;+DEX:含5.0 µM DEX()静止中心用*标注,柱细胞区和侧根冠区的细胞层数分别用黑色和兰色数字标注,未经DEX处理(−DEX)的根尖图片(上排)中柱干细胞层用黑色箭头标示。注意在不含DEX的培养基上(即WOX5没有过量表达)生长的幼苗根尖中静止中心下方只有一层细胞不含淀粉粒(柱干细胞),含不含秋水仙素对此没有影响。在含DEX的培养基上(即WOX5过量表达时),静止中心下方的细胞除最外层外都不含淀粉粒,表明原来已分化的柱细胞在处理后已经脱分化,这一表型同样不受秋水仙素的影响。但随着秋水仙素浓度的增加,柱细胞区的细胞层数逐渐减少,而侧根冠区的细胞层数减少幅度显著低于柱细胞区,表明在WOX5过量表达的前提下,侧根冠区的细胞对秋水仙素相对不敏感。标尺线为10 µm。
注:光学显微镜照片显示经碘液染色的35S::GVG/UAS::WOX5幼苗根尖的细胞结构及分化情况。幼苗在1/2MS培养基萌发3天后转入不同处理的培养基继续培养5天后观察,拍照。上排为在不含DEX培养基上生长的幼苗根尖,下排为在含DEX的培养基上生长的幼苗根尖。−DEX:未经DEX处理;+DEX:含5.0 µM DEX()静止中心用*标注,柱细胞区和侧根冠区的细胞层数分别用黑色和兰色数字标注,未经DEX处理(−DEX)的根尖图片(上排)中柱干细胞层用黑色箭头标示。注意在不含DEX的培养基上(即WOX5没有过量表达)生长的幼苗根尖中静止中心下方只有一层细胞不含淀粉粒(柱干细胞),含不含秋水仙素对此没有影响。在含DEX的培养基上(即WOX5过量表达时),静止中心下方的细胞除最外层外都不含淀粉粒,表明原来已分化的柱细胞在处理后已经脱分化,这一表型同样不受秋水仙素的影响。但随着秋水仙素浓度的增加,柱细胞区的细胞层数逐渐减少,而侧根冠区的细胞层数减少幅度显著低于柱细胞区,表明在WOX5过量表达的前提下,侧根冠区的细胞对秋水仙素相对不敏感。标尺线为10 µm。
Figure 2. Cells in the columella root cap and lateral root cap zones display differential sensiotivity to colchicine
图2. 柱细胞区和侧根冠区的细胞展示对秋水仙素的不同的敏感性
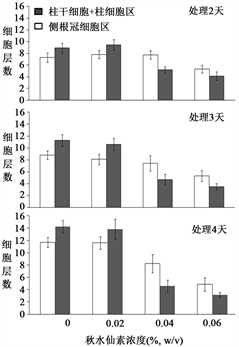 注:柱状图显示在含5.0 µM DEX的培养基中(即在WOX5过量表达的条件下),不同浓度秋水仙素对35S::GVG/UAS::WOX5幼苗根尖柱细胞区和侧根冠区细胞层数的影响的量化数据。幼苗先在1/2MS培养基上萌发,3天后转入不同的培养基继续培养2~5天,用光学显微镜对经碘液染色的根尖进行拍照后对细胞层数进行统计。在不含秋水仙素和含0.02% (w/v)秋水仙素的培养基上,在柱细胞区和侧根冠区细胞层数随着培养时间延长而有所增加,表明有细胞分裂活动。当秋水仙素浓度升高到0.04%和0.06%时,柱细胞区细胞层数不随培养时间延长而增加,表明细胞分裂活动已被完全抑制。但在侧根冠区,细胞层数在秋水仙素浓度升高到0.04%和0.06%时仍然随培养时间延长而有所增加,表明细胞分裂活动并没有没有被完全抑制。且侧根冠区细胞层数显著高于柱细胞区的细胞层数(p < 0.001),表明侧根冠区的细胞对秋水仙素的敏感性相对较弱。图中每个数据点代表20颗幼苗根尖数据,误差线为标准误差。
注:柱状图显示在含5.0 µM DEX的培养基中(即在WOX5过量表达的条件下),不同浓度秋水仙素对35S::GVG/UAS::WOX5幼苗根尖柱细胞区和侧根冠区细胞层数的影响的量化数据。幼苗先在1/2MS培养基上萌发,3天后转入不同的培养基继续培养2~5天,用光学显微镜对经碘液染色的根尖进行拍照后对细胞层数进行统计。在不含秋水仙素和含0.02% (w/v)秋水仙素的培养基上,在柱细胞区和侧根冠区细胞层数随着培养时间延长而有所增加,表明有细胞分裂活动。当秋水仙素浓度升高到0.04%和0.06%时,柱细胞区细胞层数不随培养时间延长而增加,表明细胞分裂活动已被完全抑制。但在侧根冠区,细胞层数在秋水仙素浓度升高到0.04%和0.06%时仍然随培养时间延长而有所增加,表明细胞分裂活动并没有没有被完全抑制。且侧根冠区细胞层数显著高于柱细胞区的细胞层数(p < 0.001),表明侧根冠区的细胞对秋水仙素的敏感性相对较弱。图中每个数据点代表20颗幼苗根尖数据,误差线为标准误差。
Figure 3. Quantitative effect of colchicine on cells in the columella root cap and lateral root cap zones
图3. 秋水仙素对柱细胞区和侧根冠区细胞分裂影响的量化数据
4. 结论与讨论
WOX5家族蛋白在植物发育调控和植物干细胞调控中的调控机理是近年来植物学研究中的热点 [6] 。本研究通过秋水仙素处理,发现WOX5在拟南芥幼苗主根根冠细胞中的脱分化促进作用不依赖于细胞分裂活动,这一结果为准确了解WOX5的调控功能提供了新的实验数据。本研究的另一个发现,即在WOX5过量表达的背景下,柱细胞区和侧根冠细胞区中的细胞对秋水仙素的敏感性呈现出显著差异,对研究植物细胞特性形成机理和细胞间相互协调机理具有一定的指导意义。
由于植物体内的细胞间通过细胞壁相互连接,在器官发育过程中,相邻细胞间的分裂或伸长活动必须相互协调,以保持器官结构的完整性。弄清细胞间的上述协调机理是植物学,植物发育生物学研究的重要内容。
根冠中的两种细胞类型有非常特殊的关系。从发育源头来看它们从受精卵第一次分裂起就已分道扬镳 [2] ,是植物体内细胞间关系最为疏远的两个细胞类型。但从所处的空间位置来看,它们之间的关系又极为紧密。而且近年的研究发现它们之间在细胞分裂和分化活动等方面保持高度同步 [2] 。它们的这种特殊关系,结合根冠细胞易于观察的优点 [1] ,使之成为一个研究植物细胞间相互作用的理想的实验系统。正因如此,本研究的结果对利用该实验系统提供了一个重要的切入点或思路。
基金项目
本研究得到了科技部973前期项目(2014CB160306),重庆师范大学人才基金(12XLR36)的资助。
致谢
感谢日本奈良科技大学(Nara Institute of Science and Technology) Keiji Nakajima教授提供的35SSGVG/UAS::WOX5种子。
文章引用
陈玉洁,严欢欢,陈丽华,王 甜,张汉马. WOX5过量表达和秋水仙素处理对拟南芥根冠柱细胞与侧根冠细胞的影响差异
Differential Impacts of WOX5 Overexpression and Colchicine Treatments on Columella and Lateral Root Cap Cells in Arabidopsis thaliana[J]. 植物学研究, 2019, 08(03): 212-217. https://doi.org/10.12677/BR.2019.83028
参考文献
- 1. Kumpf, R.P. and Nowack, M.K. (2015) The Root Cap: A Short Story of Life and Death. Journal of Experimental Botany, 66, 5651-5662. https://doi.org/10.1093/jxb/erv295
- 2. Dolan, L., Janmaat, K., Willemsen, V., Linstead, P., Poethig, S., Roberts, K. and Scheres, B. (1993) Cellular Organisation of the Arabidopsis thaliana Root. Development, 119, 71-84.
- 3. Sarkar, A.K., Luijten, M., Miyashima, S., Lenhard, M., Hashimoto, T., Nakajima. K., Scheres, B., Heidstra, R. and Laux, T. (2007) Conserved Factors Regulate Signalling in Arabidopsis thaliana Shoot and Root Stem Cell Organizers. Nature, 446, 811-814. https://doi.org/10.1038/nature05703
- 4. Pi, L., Aichinger, E., van der Graaff, E., Llavata-Peris, C.I., Weijers, D., Hennig, L., Groot, E.1. and Laux, T. (2015) Organizer-Derived WOX5 Signal Maintains Root Columella Stem Cells through Chromatin-Mediated Repression of CDF4 Expression. Developmental Cell, 33, 576-588. https://doi.org/10.1016/j.devcel.2015.04.024
- 5. Song, S.K., Hofhuis, H., Lee, M.M. and Clark, S.E. (2008) Key Divisions in the Early Arabidopsis Embryo Require POL and PLL1 Phosphatases to Establish the Root Stem Cell Organizer and Vascular Axis. Developmental Cell, 15, 98-109. https://doi.org/10.1016/j.devcel.2008.05.008
- 6. 赵中华, 南文斌, 梁永书, 张汉马. 植物干细胞调控研究新进展[J]. 中国细胞生物学学报, 2015, 37(7): 1021-1028.
NOTES
*通讯作者。