International Journal of Ecology
Vol.
11
No.
03
(
2022
), Article ID:
54399
,
13
pages
10.12677/IJE.2022.113030
沉水植物和浮游动植物在低光和富营养胁迫 环境下的研究
吴世凯1*,谢平2,倪乐意2,曹特2,王松波3,张敏4,李晓爽1,张颖1,周优美1
1衡水学院生命科学学院,河北 衡水
2中国科学院水生生物研究所,湖北 武汉
3中南民族大学,湖北 武汉
4华中农业大学,湖北 武汉
收稿日期:2022年6月29日;录用日期:2022年7月29日;发布日期:2022年8月5日

摘要
富营养化环境中多种因子会对沉水植物和浮游动植物产生影响,如低光照,高氨氮等,研究其胁迫作用下生物的变化情况对沉水植物、浮游植物和浮游动物的逆境响应机理有重要的意义。本研究探讨弱光环境下,在富营养和超富营养两种营养水平的水泥围隔中,苦草、黄丝草、浮游植物和浮游动物的变化情况。结果表明:1) 低光照环境下沉水植物的生物量不高,并且统计显示在超富营养水平和富营养水平下生长情况差异不显著;2) 虽然超富营养组中混合营养型的裸藻属有一定优势但是浮游植物生物量总体并不高,富营养组中浮游植物受浮游动物胁迫作用更加明显;3) 浮游动物生物量远高于浮游植物生物量,在浮游植物作为食物来源不足时可能主要以细菌类的微生物为食;4) 研究过程未发现轮虫可能与浮游植物生物量较低有关;滤食性较强的枝角类在超富营养池中占优势而主动摄食能力较强的桡足类在富营养池中有一定优势。5) 在环境胁迫条件下,沉水植物、浮游植物和浮游动物都显得很脆弱,种群结构容易变化和更替。
关键词
低光,水体富营养化,沉水植物,浮游植物,浮游动物

Studies on Submerged Macrophytes and Plankton under Low Light and Eutrophic Stress
Shikai Wu1*, Ping Xie2, Leyi Ni2, Te Cao2, Songbo Wang3, Min Zhang4, Xiaoshuang Li1, Ying Zhang1, Youmei Zhou1
1College of Life Science, Hengshui University, Hengshui Hebei
2Institute of Aquatic Sciences, Chinese Academy of Sciences, Wuhan Hubei
3South-Central Minzu University, Wuhan Hubei
4Huazhong Agricultural University, Wuhan Hubei
Received: Jun. 29th, 2022; accepted: Jul. 29th, 2022; published: Aug. 5th, 2022

ABSTRACT
Many factors can affect submerged plants and zooplankton in the eutrophic environment, such as low light, high ammonia nitrogen, etc., it is important to study the changes of submerged macrophytes, phytoplankton and zooplankton under environmental stress for their stress response mechanism. This study was conducted to study the changes of Vallisneria natans, Potamogeton maackianus, phytoplankton and zooplankton under low light conditions and eutrophica, hypereutrophic nutrient levels in cement enclosures. The results showed that: 1) the biomass of submerged macrophytes was not high in low light, and there was no significant difference between hyper- eutrophic level and eutrophic level; 2) although Euglena had some advantages, the total biomass of phytoplankton was low, and the stress of phytoplankton by zooplankton was more obvious in the eutrophic group; 3) the biomass of zooplankton is high, which may because feed mainly on bacteria when the phytoplankton is not enough as food source; 4) no rotifer was found in the study, which may be related to the low biomass of phytoplankton. The filter-feeding cladocera was dominant in hyper-eutrophic ponds, while the active feeding copepods were dominant in eutrophic ponds; 5) under environmental stress conditions, submerged macrophytes, phytoplankton and zooplankton are vulnerable, and the population structure is easy to change and replace.
Keywords:Low Light, Water Eutrophication, Submerged Plants, Phytoplankton, Zooplankton

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
富营养化环境对水生物的胁迫作用是近些年水生态领域研究的热点问题之一 [1] [2] [3] 。富营养化和超富营养化的水环境中多种因素会对水生物产生负面效应,从生理水平抑制对沉水植物产生负反馈进而抑制植物生长,甚至对浮游植物和浮游动物也有抑制作用 [4] [5] [6] 。
光照被认为是富营养化沉水植物恢复的关键因子 [7] [8] [9] 。不同沉水植物不同生长时期对光照的要求不同,要恢复某些植物,需要对光照和透明度进行具体分析。如苦草在低于280 lux、黑藻在低于580 lux的光照条件下难于生存,菹草在低于602 lux、伊乐藻在低于484 lux、狐尾藻在低于793 lux的光照条件下难于生存 [10] [11] 。由于低光照对沉水植物产生显著的胁迫作用,所以使用低于200 lus的弱光可以作为构建水生植物–胁迫模型的很好的一个胁迫因子。
黄丝草是50~60年代东湖水生植被中占绝对优势的沉水植物,后面逐渐演替为苦草、大茨藻和聚草占优势 [12] [13] 。该过程与东湖水体的富营养化相关,之后的Cao等的研究也与之一致,即超富营养环境和富营养环境,可能通过弱光和氨氮等因素限制了大型植物的生长 [14] 。
弱光和富营养化不仅胁迫沉水植物、其对浮游植物和浮游动物也会产生影响,但胁迫环境对沉水植物和浮游动植物的综合研究较少,胁迫环境下这些生物类群变化情况如何?本研究通过模拟弱光和富营养化的胁迫环境,研究沉水植物、浮游植物和浮游动物的变化,尝试回答几个问题:1) 沉水植物在(低光照 + 富营养/超富营养水 + 底泥)环境下的生长情况。2) 浮游动植物的主要类群及变动情况。3) 三者是否存在一定的响应关系问题。通过此研究以期为生物在胁迫环境下的生长情况,对水体污染修复的生物胁迫过程等提供一定的实验依据。
2. 材料与方法
2.1. 实验设计
实验于夏季进行。从汤逊湖和水果湖采集苦草和黄丝草幼苗,用唐林湖和水果湖采集的沉积物和自来水水槽中进行短期室外预培养。然后种植到长宽高均为2 × 1 × 1 m的12个水泥池中,如表1。
Table 1. Experimental groups
表1. 实验分组
表1所显示的是实验的分组情况,共分两大组,分别为超富营养组和富营养组。超富营养水平组采用的水果湖的湖水和水果湖的底泥来种植;富营养水平组采用1/10的湖水 + 9/10的自来水和汤逊湖的底泥来种植。两个营养水平组都做了空白、苦草和黄丝草的平行组,总共12个水泥池。
实验于5月开始,持续了两个月,期间定期添加自来水,以补偿围隔中的蒸发损失。
2.2. 水体理化指标
水体理化指标每周采样一次进行监测。PAR由Li-Cor UWQ-4131传感器和Li-1800数据记录仪(Li-Co,Lincoln,NE,美国)测量,每两周测量一次,在中午水深40厘米处测量。为了分析PO4-P、NH4-N和NO3-N。NH4-N通过纳氏试剂法分析,通过紫外分光光度法测定NO3-N (Eatonetal, 1995) [15] 。PO4-P是根据Golterman (1969) [16] 描述的方法测定的。TN、TP采用国标的方法进行测定。
2.3. 沉水植物、浮游植物和浮游动物
沉水植物栽种后开始第一次采样,每两周采样一次,从实验中收集的苦草和黄丝草在80℃烘箱干燥至恒重,称重。
浮游动植物指标每周采样一次。浮游植物取1 L混合水样采用鲁哥液固定,浮游动物用25#浮游生物网过滤10 L混合水样,然后将浮游动物转移到浮游生物瓶中,用5%福尔马林保存,用于浮游动物的定量测定。
浮游植物和浮游动物根据淡水浮游生物研究方法 [17] 的描述进行鉴定,并用配备校准测微计的显微镜进行计数 [18] 。
2.4. 数据处理与统计
实验中,用Microsoftexcel程序(Redmond, WA)计算重复样品的平均值和标准差(s.d.),并用t检验对两种处理进行比较。
3. 结果
3.1. 光照强度PAR
表2显示了在富营养化和富营养化两种条件下,光照强度的情况。超富营养组水泥池表层光照强于富营养水泥池。在水下40 cm处光照强度衰减到表层光强的一半左右。均低于沉水植物的正常光强(200 lus)左右。
Table 2. Light intensity (n = 36)
表2. 光照强度(n = 36)
3.2. 水体的理化指标
表3中所示为实验期间水泥池水化学数据的平均值。超富营养组中对照组和苦草组的NH4-N平均值差别不大,但黄丝草的平行实验对照组NH4-N平均值比前两者值低0.393、0.378;对照、苦草和黄丝草平行实验对照组TN平均值中,对照组值最大,苦草组和黄丝草组与之相差0.211、0.426。TP水平在0.24~0.27左右,按照富营养化标准划分(TP 0.1 mg/L以上)处在超富营养水平。
Table 3. Physical and chemical data (n = 24)
表3. 水体理化数据(n = 24)
富营养水平组中苦草和黄丝草组比对照组NH4-N平均值高0.112、0.125;TN平均值中,黄丝草组值最大,依次是苦草组和空白组。总磷水平在0.87~0.97左右,属于富营养水平区间(0.05~0.1 mg/L)。
3.3. 弱光环境下,富营养水体、超富营养水体对沉水植物的生长研究
图1显示苦草生物量随时间变化,在超富营养和富营养条件下的变化趋势。C、D两组为超富营养下的苦草组,从时间推移来看,C、D两组的变化途径大致相同;C、D两组苦草生物量出现明显变化趋势的时间段分别为,5月23日至6月6日为小幅度下降趋势,6月6日至7月4日为上升趋势,其生物量明小于富营养组下的IJ组。
I、J两组为富营养下的苦草平行组,I、J两组在5月2日至6月6日的变化趋势和生物量几乎一致,6月6日至6月20日中两组的苦草生物量虽都是上升趋势,但I组的苦草生物量高于J组;6月20日至7月4日中,I组为下降趋势,J组为小幅上升趋势。I、J两组苦草生物量显著高于C、D两组苦草生物量。
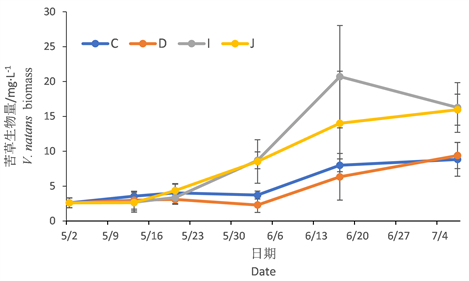
Figure 1. Biomass changes of V. natans
图1. 苦草生物量变化
图2显示黄丝草生物量随时间变化,在超富营养和富营养条件下的变化趋势。E、F两组为超富营养下的黄丝草组,E、F两组的变化途径大致相同,但E组的生物量变化趋势高度要比F组高一点;E、F两组黄丝草生物量出现明显变化趋势的时间段分别为,5月23日至6月20日为上升趋势,6月20日至7月4日为小幅度下降趋势。
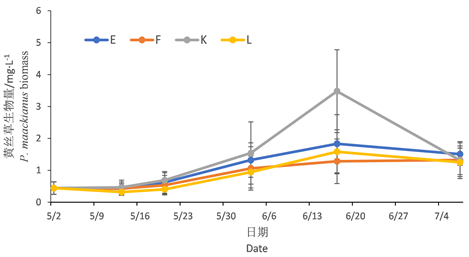
Figure 2. Biomass changes of P. maackianus
图2. 黄丝草生物量变化
K、L两组为富营养下的黄丝草组,从时间推移来看,K、L两组变化途径大致相同,但5月23日至7月4日期间K组的生物量变化趋势高度要比L组高,尤其是6月6日至7月4日中,K组的生物量变化趋势高度要比L组高很多。整体上看富营养组生物量高于超富营养组。
表4中显示在超富营养条件下的苦草的生物量小于富营养条件下的苦草的生物量。
Table 4. Biomass of V. natans (n = 24)
表4. 苦草生物量(n = 24)
表5所示苦草在超富营养水平和富营养水平不同的营养水平下各组差异不显著。
表5. 苦草方差P分析
表6中显示在超富营养条件下的黄丝草的生物量小于富营养条件下黄丝草的生物量。
Table 6. Biomass of P. maackianus (n = 24)
表6. 黄丝草生物量(n = 24)
表7所示在E (超富营养条件下黄丝草培养)和L (富营养条件下黄丝草培养)之间的P值差异小于0.05,差异显著,其它组差异不显著。
Table 7. Variance P analysis of P. maackianus
表7. 黄丝草方差P分析
3.4. 浮游植物和浮游动物主要类群变化情况
图3表示浮游植物生物量随时间变化,在超富营养和富营养条件下各组的变化趋势。
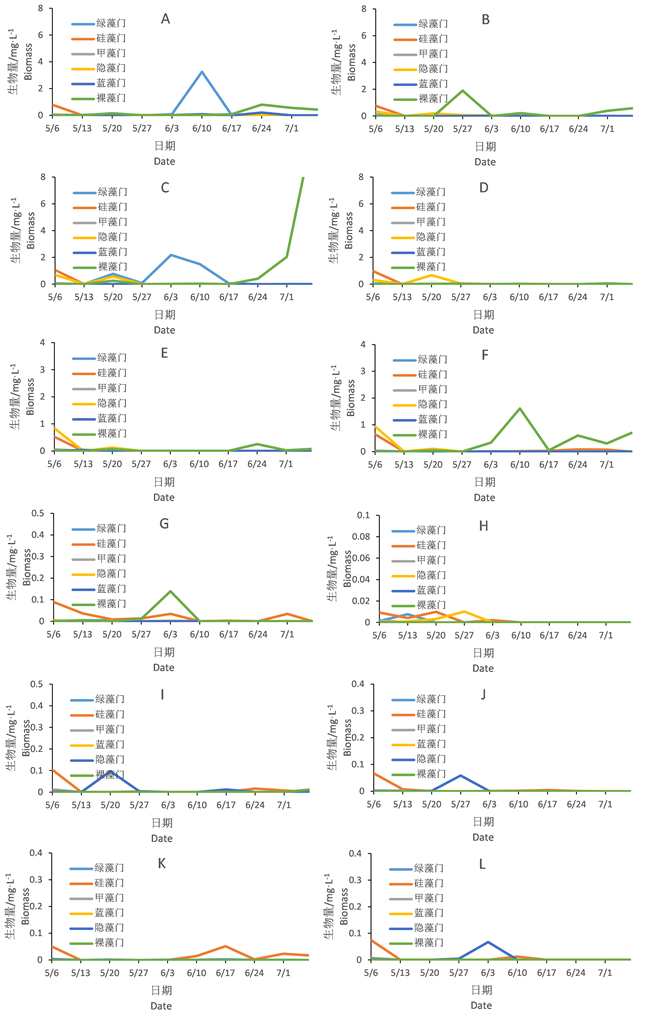
Figure 3. Changes of phytoplankton biomass
图3. 浮游植物变化情况
超富营养组中各组生物量均较富营养组高,A空白组在第6周中绿藻门的生物量出现峰值,后期裸藻门占优势,其平行B组裸藻门在第4周开始到实验结束均为优势类群。两组其它的类群生物量不大。
种植苦草的C组和D组浮游植物群落结构变化差异较大,尤其6月份以后C组绿藻和裸藻先后成为优势,尤其裸藻在实验结束的时候生物量还有上升的趋势。
种植黄丝草的E组和F组浮游植物群落结构变化差异不大,6月份均为裸藻占优势。F组裸藻生物量6月10日出现峰值。
富营养组浮游植物类群生物量均较低。G组H组生物量较低,其中裸藻、硅藻和隐藻先后有优势。种植苦草的IJ组隐藻在5月下旬占优势,其它类群没有明显优势。种植黄丝草的KL组群落差异较大,K组后期硅藻占优势,L组6月初隐藻有短暂优势。而单独对比不同营养状态下的苦草的四个组和黄丝草的四个组的浮游植物群落,其群落结构和变动均较大,虽然种植了相同的沉水植物,不同的营养状态下浮游植物群落结构仍存在巨大差异。
图4显示浮游动物生物量随时间变化,在超富营养和富营养条件下各组的变化趋势。实验过程未观测到轮虫,仅观测到枝角类中的水蚤属和桡足类的剑水蚤属。超富营养组中可以观测到水蚤属在6个水泥池中后期均占有优势,且有较高的生物量。剑水蚤属生物量较水蚤属较低。仅在K、L池中占优势。
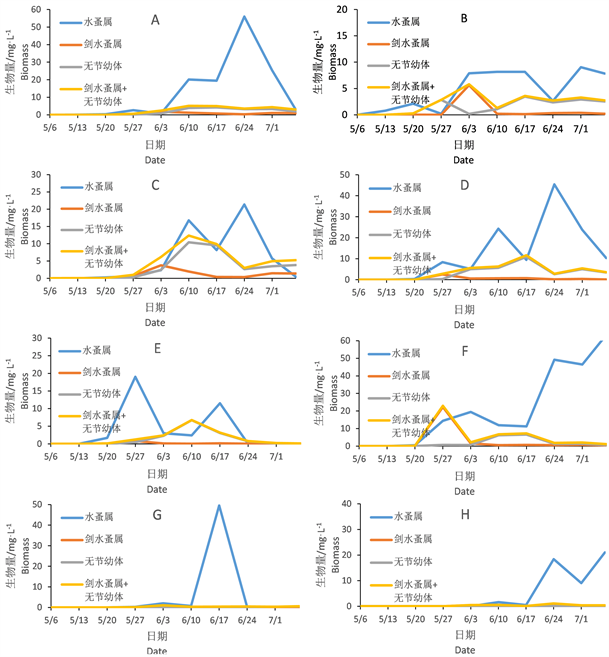
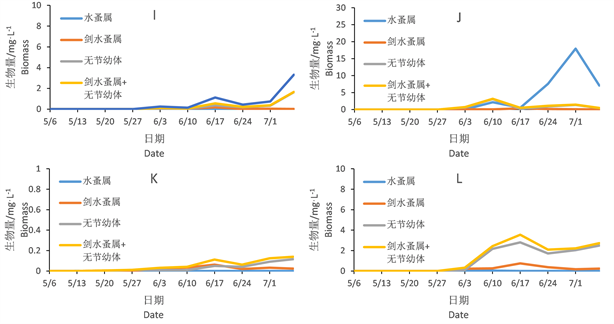
Figure 4. Changes of zooplankton biomass
图4. 浮游动物变化情况
由图5可见,虽然浮游动植物生物量上有着较大差异,但从变化趋势看,浮游植物在试验初的几周生物量比较高,但是浮游动物四月份开始数量增长后浮游植物生物量就处在很低的水平。这种抑制作用富营养水体比超富营养水体更明显。超富营养的B、C池中的后期有优势的浮游植物为裸藻。此外,超富营养水平下的浮游动物的生物量远高于富营养水平。
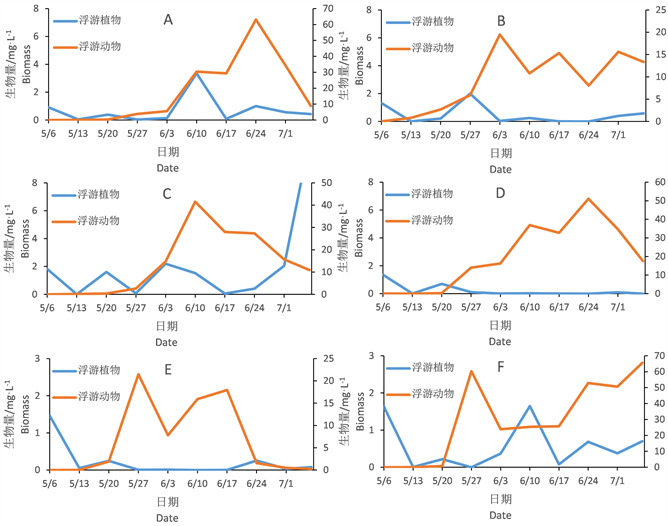
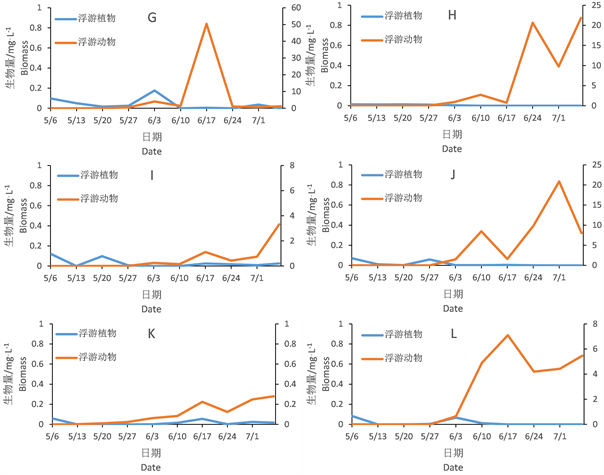
Figure 5. Changes of zooplankton and phytoplankton biomass
图5. 浮游动物和浮游植物种群变化
4. 讨论
4.1. 低光胁迫 + 富营养化对沉水植物的影响
在富营养化水体中,低光和高营养盐含量联合作用的影响远大于两者单独作用,会影响到植物体内碳氮代谢的平衡 [19] 。在低光胁迫下,光合作用合成糖类和ATP的量都很低,用于合成游离氨基酸的能量和糖类的需求会增多。糖类和能量合成与消耗的严重不平衡导致沉水植物处于碳源和能量缺乏的状态,从而导致溶解性蛋白质含量的降低 [20] [21] 。
富营养化条件下,低光会进一步破坏碳氮代谢的平衡而加重氧化压力,从而导致活性氧的积累,SOD和过氧化物酶(POD)的活性显著增强 [19] [22] 。这两种酶相互补充,共同抵制环境压力。在微齿眼子菜(Potamogeton maackianus)中,抗氧化酶活性和游离氨基酸、溶解性糖和蛋白质的浓度有密切联系.低光和高营养盐造成眼子菜碳氮代谢紊乱和氧化压力,是造成眼子菜数量减少的重要原因 [23] 。
植物对铵态氮和硝态氮以及各种盐的吸收也与光照有关 [24] 。在低光和高 浓度下,植物为了转运体内积累过多的 需要合成游离氨基酸,糖类会大量降解以提供充足的碳原料,溶解性糖、淀粉和蛋白质含量会随之减少 [19] [20] 。
本研究中,低光强和氨氮也使苦草和黄丝草的生长受到抑制而导致生物量不高。且苦草组和黄丝草组生物量超富营养水平下明显小于富营养水平下的生物量。说明弱光下,超富营养环境的胁迫作用对沉水植物的抑制作用比富营养环境下更加明显。
4.2. 低光胁迫 + 富营养化对浮游植物和浮游动物的影响
大量研究认为碳水化合物作为单胞藻光合作用的直接产物是藻类生化组成的重要部分与光强变化有密切关系。说明光照对浮游植物的体内物质变化的重要性 [25] [26] 。
在本次实验中,浮游植物类群在不同水质的条件下出现的浮游植物峰值不同,出现峰值的浮游植物种类大都是有鞭毛和混合营养型强的藻类,如隐藻和裸藻,我们认为有下面几个原因:1) 此类浮游植物可以通过混合营养生长的要素,在光合作用受到抑制的时候可以对细菌直接捕食获得食物,所以有着更广的生活物质来源。2) 通过自身的较强运动能力更具趋利避害的主动性。
浮游动物是浮游植物的主要捕食者,特别是中型浮游动物的选择性摄食很大程度上影响着浮游植物种群的变化。据钱树本等 [27] 研究表明,浮游动物的摄食压力可以占到浮游植物现存量的5%~90%,是影响浮游植物生物量的主要因素。在本次实验中,浮游动物的生物量远高于浮游植物,说明浮游动物一方面说明捕食作用强烈地抑制了自养浮游植物的生长,另一方面其食物来源更多是细菌。而且超富营养水平下的细菌数量多于富营养水平 [28] [29] [30] [31] [32] 。而在弱光环境下,不利因素叠加,使浮游植物类群更不稳定,更容易被干扰。
自然水体环境通常是动态变化的,当食物低于阈浓度时,浮游动物的竞争能力取决于其耐饥饿能力,那些耐饥饿能力比较强的种类往往会取得竞争优势,浮游动物里的轮虫、枝角类和桡足类三大类群,耐饥饿能力为轮虫小于枝角类小于桡足类 [33] 。对于浮游甲壳动物中的桡足类和枝角类来说,成体的枝角类和桡足类比幼体有更强的耐饥饿能力 [34] 。本实验中未发现轮虫类,而富营养水平桡足类占优势,枝角类在超富营养组占一定优势,可能由于与上述食物缺乏导致的浮游动物耐饥饿情况有关。即在弱光和低自养浮游植物生物量的条件下,富营养水平下不耐饥饿的轮虫几乎无法生长,最耐饥饿的桡足类成为优势。由于桡足类剑水蚤既可营底栖又能浮游生活,且大多数种类为捕食性,其生长发育有变态现象,从卵到无节幼体到桡足幼体再到成体,均有休眠现象,所以其应对外界不良环境的能力更强 [35] [36] 。
大多数枝角类为滤食性种类,主要滤食水中的细菌,单细胞藻类和原生动物 [37] 。枝角类数量通常随着大型浮游藻类数量的增加而增加,但当藻类达到水华高峰时,由于细菌减少而使枝角类大量死亡。随后大型浮游藻类的死亡以及枝角类本身的死亡,又激起了枝角类再度爆发性的大量生长,可见枝角类与细菌的变动有着紧密的联系 [38] 。
参照太湖富营养化程度评价标准 [28] 的相关指标,对太湖水体中细菌数量与富营养水平进行相关分析表明,太湖中细菌数量随水体富营养水平升高而增加(r = 0.88) (见图4)。对不同类型水体的研究表明,在营养水平较低的湖泊中,无机营养物质含量的大小可能是微生物生长的限制因子 [39] 。而磷含量的高低常常成为水体中细菌数量的限制因素 [28] [29] [30] [31] [32] 。而本研究中超富营养水体中的大量细菌给了枝角类以比较充分的食物来源,从而在超富营养水环境下占据优势。可见,食物是直接引起浮游动物数量变动的主要外界因子之一。
5. 结论
综上所述,低光和富营养化双重胁迫作用下,沉水植物和单一光合作用营养型的浮游植物生长受到明显抑制,这导致富营养和超富营养环境下的初级生产力系统比较脆弱,导致围隔内生物种群结构变动较大。浮游动物主要受食物的影响,以浮游植物为食的轮虫受到明显抑制,富营养环境下的桡足类的耐饥饿能力和选择性捕食能力占很大优势,超富营养环境下枝角类占优势可能与其滤食细菌的能力有关。
文章引用
吴世凯,谢 平,倪乐意,曹 特,王松波,张 敏,李晓爽,张 颖,周优美. 沉水植物和浮游动植物在低光和富营养胁迫环境下的研究
Studies on Submerged Macrophytes and Plankton under Low Light and Eutrophic Stress[J]. 世界生态学, 2022, 11(03): 269-281. https://doi.org/10.12677/IJE.2022.113030
参考文献
- 1. 谢可军, 赵素芬, 苗香雯, 崔绍荣. 富营养化废水胁迫对多年生黑麦草的影响[J]. 农业环境科学学报, 2004, 23(3): 437-440.
- 2. Lee, D. and Lee, C. (2000) Chilling Stress-Induced Changes of Antioxidant Enzymes in the Leaves of Cucumber: In Gel Enzyme Activity Assays. Plant Science, 159, 75-85. https://doi.org/10.1016/S0168-9452(00)00326-5
- 3. Su, H., Feng, Y., Chen, J., Chen, J., Ma, S., Fang, J., et al. (2021) Determinants of Trophic Cascade Strength in Freshwater Ecosystems: A Global Analysis. Ecology, 102, Article ID: e03370. https://doi.org/10.1002/ecy.3370
- 4. 和华龙, 黄华, 薛建辉. 模拟酸雨和富营养化复合胁迫对水葫芦抗氧化酶的影响[J]. 江苏农业科学, 2015, 43(11): 430-432.
- 5. 尚丽, 陈丽, 张涛, 郑昕, 赵帅营, 孔令阳. 长期砷胁迫下大屯海浮游植物群落的季节性特征及其驱动因子[J]. 应用生态学报, 2021, 32(5): 1845-1853. https://doi.org/10.13287/j.1001-9332.202105.032
- 6. 徐吉洋, 张文萍, 李少南. 浮游动物物种构成对于淡水测试系统抗农药胁迫能力的影响[J]. 生态毒理学报, 2020, 15(1): 155-173.
- 7. 曹昀. 江滩湿地植物恢复的影响因子与技术研究[D]: [博士学位论文]. 南京: 南京师范大学, 2007.
- 8. Fu, H., Yuan, G., Cao, T., Ni, L., Zhang, M. and Wang, S. (2012) An Alternative Mechanism for Shade Adaptation: Implication of Allometric Responses of Three Submersed Macrophytes to Water Depth. Ecology Research, 27, 1087- 1094. https://doi.org/10.1007/s11284-012-0991-z
- 9. 黎慧娟. 富营养水体中光照、营养及浮游植物对沉水植物生长和生理影响的研究[D]: [硕士学位论文]. 武汉: 中国科学院研究生院(水生生物研究所), 2006.
- 10. 程南宁. 渐沉式沉床恢复沉水植物的生长条件研究[D]: [硕士学位论文]. 南京: 河海大学, 2005: 1-38.
- 11. 曹昀, 胡红, 时强. 沉水植物恢复的透明度条件研究[J]. 安徽农业科学, 2012, 40(3): 1710-1711.
- 12. 邱东茹, 吴振斌, 周元祥, 等. 武汉东湖水生植物生态学研究-I水生植被现状和演替动态[J]. 水生生物学报, 1995, 19(s1): 103-114.
- 13. 邱东茹, 吴振斌, 邓家齐, 詹发萃. 武汉东湖湖水和底泥对黄丝草生长的影响[J]. 植物资源与环境, 1997, 6(4): 45-49.
- 14. Cao, T., Ni, L., Xie, P., Xu, J. and Zhang, M. (2011) Effects of Moderate Ammonium Enrichment on Three Submersed Macrophytes under Contrasting Light Availability. Freshwater Biology, 56, 1620-1629. https://doi.org/10.1111/j.1365-2427.2011.02601.x
- 15. Eaton, A., Clesceri, L., Greenberg, A., et al. (1995) Standard Methods for the Examination of Water and Wastewater. 19th Edition, American Public Health Association, Washington DC, 1268.
- 16. Golterman, H.L. (1969) Methods for Chemical Analysis of Fresh Waters. Blackwell Sci-entific Publications, Oxford, 172 p.
- 17. 章宗涉, 黄祥飞. 淡水浮游生物研究方法[M]. 北京: 科学出版社, 1991.
- 18. Kotak, B., Lam, A., Prepas, E., Kenefick, S.L. and Hrudey, S.E. (1995) Variability of the Hepatotoxin, Microcystin-LR, in Hypereutrophic Drinking Water Lakes. Journal of Limnology, 31, 248-263. https://doi.org/10.1111/j.0022-3646.1995.00248.x
- 19. Zhang, M., Cao, T., Ni, L., Xie, P. and Li, Z. (2010) Carbon, Nitrogen and Antioxidant Enzyme Responses of Potamogeton crispus to Both Low Light and High Nutrient Stresses. Environmental and Experimental Botany, 68, 44-50. https://doi.org/10.1016/j.envexpbot.2009.09.003
- 20. Cao, T., Xie, P., Ni, L., Zhang, M. and Xu, J. (2009) Carbon and Nitrogen Metabolism of an Eutrophication Tolerative Macrophyte, Potamogeton crispus, under NH4+ Stress and Low Light Availability. Environmental and Experimental Botany, 66, 74-78. https://doi.org/10.1016/j.envexpbot.2008.10.004
- 21. Myers, J. and Kitajima, K. (2007) Carbohydrate Storage Enhances Seedling Shade and Stress Tolerance in a Neotropical Forest. Journal of Ecology, 95, 383-395. https://doi.org/10.1111/j.1365-2745.2006.01207.x
- 22. Kamara, S. and Pflugmacher, S. (2007) Phragmites australis and Quercus robur Leaf Extracts Affect Antioxidative System and Photosynthesis of Ceratophyllum demersum. Ecotoxicology and Environmental Safety, 67, 240-246. https://doi.org/10.1016/j.ecoenv.2006.07.004
- 23. 邹丽莎, 聂泽宇, 姚笑颜, 施积炎. 富营养化水体中光照对沉水植物的影响研究进展[J]. 应用生态学报, 2013, 24(7): 2073-2080.
- 24. Alexandre, A., Silva, J., Bouma, T. and Santos, R. (2011) Inorganic Nitrogen Uptake Kinetics and Whole-Plant Nitrogen Budget in the Seagrass Zostera noltii. Journal of Experimental Marine Biology and Ecology, 401, 7-12. https://doi.org/10.1016/j.jembe.2011.03.008
- 25. 孙晓庆, 董树刚, 汤志宏. 营养盐和光照对浮游植物群落结构的影响[J]. 南方水产, 2008, 4(1): 1-9.
- 26. 龚川, 贡丹丹, 刘德富, 张佳磊, 严广寒. 不同光照强度下香溪河浮游植物演替过程研究[J]. 环境科学研究,2020, 33(5): 1214-1224.
- 27. 钱树本, 刘东艳, 孙军. 海藻学[M]. 青岛: 中国海洋大学出版社, 2005.
- 28. 孙顺才, 黄漪平. 太湖[M]. 北京: 海洋出版社, 1993: 250-262.
- 29. Morris, D. and Lewis, W. (1992) Nutrient Limitation of Bacterioplankton Growth in Lake Dillon, Colorado. Limnology and Oceanography, 37, 1179-1192. https://doi.org/10.4319/lo.1992.37.6.1179
- 30. Toolan, T., Wehr, I.D. and Findlay, S. (1991) Inor-ganic Phosphorus Stimulation of Bacterioplankton Production in a Meso-Eutrophic Lake. Applied and Environmental Microbiology, 57, 2074-2078. https://doi.org/10.1128/aem.57.7.2074-2078.1991
- 31. Wang, L., Miller, T. and Priscu, J. (1992) Bacterioplankton Nutrient Deficiency in a Eutrophic Lake. Archiv fur Hydrobiologie, 125, 423-439. https://doi.org/10.1127/archiv-hydrobiol/125/1992/423
- 32. 冯胜, 秦伯强, 高光. 细菌群落结构对水体富营养化的响应[J]. 环境科学学报, 2007, 27(11):1823 -1829.
- 33. 蔡清洁. pH和盐度对大型溞摄食行为及抗逆响应的影响[D]: [硕士学位论文]. 上海: 上海海洋大学, 2015.
- 34. 杨丽丽. 千岛湖浮游动物群落结构特征及其与环境因子的关系[D]: [硕士学位论文]. 上海: 上海海洋大学, 2012.
- 35. 王延洋, 李晓波, 吴波, 吴琼, 许夏玲, 王全喜. 上海滴水湖浮游动物研究初报[J]. 上海师范大学学报: 自然科学版, 2008, 37(2): 167-172.
- 36. 郭欧阳. 长江下游干流浮游动物群落结构及其与环境因子相关性的研究[D]: [硕士学位论文]. 上海: 上海师范大学, 2018.
- 37. 任文彬. 几种常见大型枝角类对水质的适应性和控藻能力对照研究[D]: [硕士学位论文]. 武汉: 华中师范大学, 2014.
- 38. 贺萌. 气候变暖和水体富营养化对浅水湖泊浮游动物群落结构的影响研究[D]: [硕士学位论文]. 武汉: 中南民族大学, 2016.
- 39. Chrzanowski, T., Sterner, R. and Elser, J. (1995) Nutrient Enrichment and Nutrient Regeneration Stimulate Bacterioplankton Growth. Microbial Ecology, 29, 221-230. https://doi.org/10.1007/BF00164886
NOTES
*通讯作者。
