Advances in Microbiology
Vol.
08
No.
01
(
2019
), Article ID:
29185
,
7
pages
10.12677/AMB.2019.81005
Effects of Virulence-Related Factors EsxH of Mycobacterium avium on Macrophage Apoptosis
Yi Zhang, Shiyi He, Xueping Ning, Shuang Tian, Min Ling*
Key Laboratory of Biological Molecular Medicine Research of Guangxi University, Department of Biotechnology, Guangxi Medical University, Nanning Guangxi

Received: Feb. 14th, 2019; accepted: Feb. 28th, 2019; published: Mar. 8th, 2019

ABSTRACT
Objective: In order to study the role of EsxH in Mycobacterium avium, EsxH protein was expressed in prokaryotic expression system and its effects on U937 cells apoptosis were investigated. Methods: The EsxH coding sequences were amplified by PCR and connected with the expression vector pGEX-4T-3 to construct the recombinant vector pGEX-EsxH. The recombinant expression vector pGEX-EsxH was transformed into E. coli BL21(DE3), and the target proteins were induced by IPTG. The GST-EsxH fusion proteins were purified by glutathione-agarose gel column after the cells were disrupted by ultrasonic disruption. The purified EsxH proteins were applied to U937 cells and the apoptotic rates were measured by flow cytometry. Results: A 294bp EsxH gene was amplified and cloned into the expression vector pGEX-4T-3, after induced by IPTG, a fusion protein GST-EsxH with a molecular weight of 36.5 kd was successfully expressed. Different concentrations of EsxH protein were applied to U937 cells, and the flow cytometry results showed that the apoptotic rate of the treated group was higher than that of the control group, with statistical significance (P < 0.05). Conclusion: EsxH protein could promote the apoptosis of U937 cells, laying the foundation for further study on the pathogenic mechanism of Mycobacterium avium.
Keywords:Mycobacterium avium, EsxH, Cell Apoptosis
鸟分枝杆菌毒力相关因子EsxH对巨噬细胞凋亡的作用
张依,何时义,宁雪萍,田爽,凌敏*
广西医科大学,广西高校生物分子医学研究重点实验室,广西医科大学生物技术教研室,广西 南宁

收稿日期:2019年2月14日;录用日期:2019年2月28日;发布日期:2019年3月8日

摘 要
目的:通过原核表达系统制备鸟分枝杆菌EsxH蛋白,并将其作用于U937细胞,初步探讨其对巨噬细胞凋亡的影响。方法:利用PCR扩增出EsxH编码序列,与表达载体pGEX-4T-3连接,构建重组载体pGEX-EsxH,将重组表达载体pGEX-EsxH转化入E. coli BL21 (DE3),在IPTG作用下诱导表达目的蛋白。用超声破碎仪对菌体进行破碎,取上清通过谷胱甘肽琼脂糖凝胶柱纯化GST-EsxH融合蛋白。将纯化后的蛋白作用于U937细胞,用流式细胞仪检测细胞凋亡率。结果:扩增出基因片段大小为294 bp的EsxH基因,克隆入表达载体pGEX-4T-3,经IPTG诱导后成功表达一个分子量大小为36.5 kDα的融合蛋白GST-EsxH。将不同浓度的EsxH蛋白作用于U937细胞,经流式细胞术检测细胞凋亡率,发现处理组细胞凋亡率高于对照组,其差异具有统计学意义(P < 0.05)。结论:EsxH蛋白能够促进U937细胞的凋亡,为进一步研究鸟分枝杆菌的致病机制奠定了基础。
关键词 :鸟分枝杆菌,EsxH,细胞凋亡

Copyright © 2019 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
鸟分枝杆菌(Mycobacterium avium, MA)是一种细长弯曲,抗酸染色阳性的杆菌,为非结核分枝杆菌(Nontuberculous mycobacteria, NTM)中主要的致病菌,在免疫低下或缺陷的人群中常常容易伴发感染。鸟分枝杆菌作为机会致病性菌,广泛存在于土壤、水、动物和植物表面以及尘埃中 [1] [2] ,可通过呼吸道或者直接摄入被污染的水源和食物而引起感染。尽管鸟分枝杆菌在自然环境中普遍存在,但还未有证据表明它能从人与人或动物到人之间进行传播。近年来,在HIV阳性或艾滋病患者中,NTM感染所占比例不断增大,尤其为鸟分枝杆菌,其所占比例最大 [3] [4] [5] [6]。鸟分枝杆菌感染主要引起肺部的病变,其临床表现、影像学特点和病理检查均与肺结核病相类似,两者容易混淆。此外,鸟分枝杆菌还可侵犯淋巴结、骨髓和皮肤软组织等引起相应的病变,严重情况下还可导致全身播散性感染。由于鸟分枝杆菌与结核分枝杆菌对药物的敏感性不同,治疗鸟分枝杆菌肺病与非结核也有一定差异,且鸟分枝杆菌比结核分枝杆菌对多种药物更容易出现耐药,如对异烟肼和吡嗪酰胺表现为天然耐药,鸟分枝杆菌的临床分离株对利福平等抗结核药也多表现不敏感 [7] [8] ,其治疗难度也较大。
Esat-6 (6 kD early secretory antigenic target)是由结核分枝杆菌DR1区编码并由ESX-1系统分泌的蛋白,是一个重要的毒力因子。ESAT-6可通过免疫细胞调节细胞因子的产生,如诱导巨噬细胞分泌IL-1和抑制T细胞产生IFN-γ,表明它在MTB感染过程中对宿主先天性免疫和适应性免疫反应有极大的影响。EsxH(Cfp-7)为Esat-6样蛋白,与EsxA(Esat-6)、EsxB(Cfp-10)同属Esx家族蛋白。近年来,对Esx家族蛋白的研究主要集中在EsxA(Esat-6)和EsxB(Cfp-10)上,而对该家族其他成员的研究较少,Esat-6家族其它成员在与宿主细胞相互作用过程中发挥着怎样的作用,是否也参与了诱导宿主细胞的凋亡,这些结果尚未清楚。
本文通过克隆与鸟分枝杆菌毒力密切相关的EsxH基因,进行原核表达,并将EsxH蛋白作用于U937细胞,初步探讨EsxH对细胞凋亡的作用。
2. 材料与方法
2.1. 材料
2.1.1. 菌株和质粒
鸟分枝杆菌(Mycobacterium avium 104)临床分离菌株由广西壮族自治区疾病预防与控制中心结核防治所提供;表达载体pGEX-4T-3,E. coli BL21 (DE3)由本课题组保存;巨噬细胞U937从和元生物技术(上海)有限公司购置。
2.1.2. 试剂及仪器
AxyPrep基因组DNA小量试剂盒(Axygen公司);质粒小量抽提试剂盒、DNA胶回收试剂盒(碧云天生物技术有限公司);鸟分枝杆菌培养基为Middle brook 7H9/OADC培养基,大肠杆菌培养基为LB培养基,Biological Industries (BI)胎牛血清购置于南宁乐隽科技有限公司,1640培养基(诺唯赞)购置于南宁阳光试剂有限公司;限制性内切酶EcoR I、BamH I、T4 DNA连接酶、Taq DNA聚合酶、DL5,000 DNA marker,DL2,000 DNA marker均购自大连TaKaRa宝生物工程有限公司;Annexin V-FITC/PI凋亡检测试剂盒购于思政白生物科技有限公司。PCR仪Biometra Tpersonal (Biometra公司);高速冷冻离心机Eppendorf 5810 R (Eppendorf公司);凝胶成像系统UVI-7600Z (UVI公司);生物安全柜ThermoFisher 1300 (赛默飞公司)。
2.2. 方法
2.2.1 .EsxH基因的克隆及在大肠杆菌中的表达
根据GenBank中Mycobacterium avium 104菌株基因组DNA序列,用Primer premie 5.0设计EsxH基因全长克隆引物,EsxH-F:5’-TAAGGATCCCGGGAGGGCTGGCTGTCGCT-3’ (划线部分为BamH I酶切位点);EsxH-R:5’-CGCGAATTCCCACGGTGGTGTGCTGGCCGTGCGG-3’ (划线部分为EcoR I酶切位点),以Mycobacterium avium 104基因组DNA为模板,进行PCR扩增。PCR反应程序:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸45 s,共30个循环;最后72℃延伸10 min。将PCR产物与pGEX-4T-3 表达载体连接后,构建重组表达质粒pGEX-EsxH。
将重组表达质粒转化E. coli BL21(DE3)。挑取单菌落于37℃培养至OD600 = 0.5时,加入20 μl终浓度为1 mmol/L的IPTG 30℃诱导培养2~3 h,4℃,5000 × g离心收集菌体。对菌体总蛋白进行SDS-PAGE检测。
2.2.2. EsxH蛋白表达形式的检测及纯化
菌液用超声破碎仪破碎后,用结晶紫染色观察菌体破碎情况。分别取上清和沉淀进行SDS-PAGE检测,利用谷胱甘肽琼脂糖凝胶珠纯化蛋白。
2.2.3. EsxH蛋白对巨噬细胞U937凋亡的影响
取对数生长期细胞悬液,计数并调节终浓度为1 × 106个/ml,向六孔板各加1 ml细胞悬液,将纯化出来的蛋白加入六孔板中,调整其终浓度分别为0、50、100、150 μg/ml,每个浓度重复5个孔,放置于37℃,5% CO2培养箱培养24 h。按照Annexin V-FITC/PI凋亡检测试剂盒操作步骤将处理好的细胞进行流式检测其凋亡率。
2.2.4. 数据统计与分析
结果数据用均数标准差表示,方差齐时用t检验进行比较,方差不齐时用t’检验进行比较,以P < 0.05为差异具有统计学意义。
3. 结果与分析
3.1. EsxH基因的PCR扩增及在大肠杆菌中的表达和纯化
利用PCR技术扩增EsxH基因,PCR产物经琼脂糖凝胶电泳检测,得到一条大小为294 bp的条带(图1),经测序分析,与GenBank上提供的序列一致。
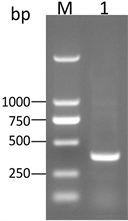 注:M:DNA Marker 2000;1: EsxH基因
注:M:DNA Marker 2000;1: EsxH基因
Figure 1. The PCR amplification of EsxH genes
图1. EsxH基因的PCR扩增结果
将EsxH基因与pGEX-4T-3载体连接构建重组表达质粒pGEX-EsxH。将重组表达质粒转化入E. coli BL21 (DE3)进行诱导表达,收集菌体做SDS-PAGE出现分子量约为36.5 kDa的目标蛋白区带,表明EsxH在大肠杆菌中得到表达。经谷胱甘肽琼脂糖凝胶珠纯化融合蛋白,经SDS-PAGE电泳,结果显示EsxH融合蛋白纯化成功(图2)。
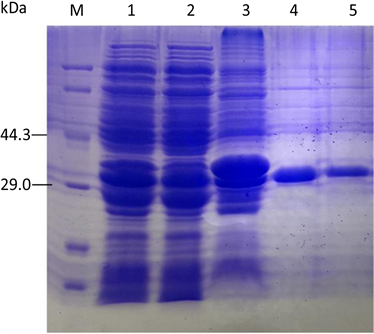 注:M:蛋白Marker;1~2:EsxH上清;3:EsxH沉淀;4~5:纯化后的EsxH融合蛋白
注:M:蛋白Marker;1~2:EsxH上清;3:EsxH沉淀;4~5:纯化后的EsxH融合蛋白
Figure 2. Expression and purification of the EsxH fusion protein
图2. EsxH融合蛋白的表达及纯化
3.2. EsxH蛋白对巨噬细胞U937凋亡的影响
分别用0、50、100、150 μg/ml蛋白处理U937细胞36 h后,流式细胞术检测其凋亡率,结果显示对照组(0 μg/ml)与各处理组间细胞凋亡率差异有统计学意义(P < 0.05),结果见表1,图3。表明EsxH对U937细胞凋亡有促进作用,且凋亡率随着蛋白浓度的增加而增加。
Table 1. Effect of EsxH on U937 cell apoptosis
表1. EsxH对U937细胞凋亡的影响
P < 0.05, treatment groups (10, 25, 50 μg/ml) vs. control group (0 μg/ml).
 A. Control (EsxH 0 μg/ml), B. EsxH 10 μg/ml, C. EsxH 25 μg/ml, D. EsxH 50 μg/ml
A. Control (EsxH 0 μg/ml), B. EsxH 10 μg/ml, C. EsxH 25 μg/ml, D. EsxH 50 μg/ml
Figure 3. Effect of EsxH on apoptosis of U937 cells by flow cytometry
图3. 流式细胞术检测EsxH对U937细胞凋亡的影响
4. 讨论
原核表达系统受目的基因自身结构及蛋白质构造等影响常使表达系统不能进行有效的表达,为提高外源基因表达水平,常采用温度和药物如异丙基——β-D-硫代半乳糖苷(IPTG)进行诱导。pGEX-4T-3为一种高效的表达载体,含有强tac启动子,能够有效消除目的基因带来的在转录或转录后水平对表达系统的负面影响,同时载体上带有较大的GST标签,能够使分子量小的蛋白得到稳定表达,后续纯化步骤可通过凝血酶等将GST-tag切除。
鸟分枝杆菌为胞内寄生菌,其致病性与其在巨噬细胞内的生存机制有关,可通过自身的一系列调控机制以适应巨噬细胞内的生存环境,调控巨噬细胞凋亡。结核分枝杆菌对细胞凋亡的抑制作用是通过抑制细胞凋亡信号通路实现的,在结核分枝杆菌感染巨噬细胞时,使宿主细胞表面TNF-α和fas受体减少,线粒体外膜上抗凋亡基因mcl-1表达水平上调,从而抑制介导细胞凋亡的死亡受体通路和线粒体通路 [9] [10] [11]。此外,结核分枝杆菌对宿主细胞凋亡的抑制作用还可通过其自身编码的多种蛋白如nuoG、PKE等作用于宿主细胞来实现 [12] [13]。然而在结核分枝杆菌感染晚期,宿主细胞的凋亡则有利于结核分枝杆菌的释放,感染新的宿主细胞从而扩大感染的范围。Esat-6为近年来备受研究者关注的一个毒力蛋白,其在诱导宿主巨噬细胞凋亡中发挥着关键作用。Esat-6分泌受阻的结核分枝杆菌,其对宿主巨噬细胞凋亡的作用将减弱,限制了结核分枝杆菌在细胞间的扩散 [14]。Derrick等 [15] 研究发现Esat-6能够上调caspase的表达,利用野生株H37Rv感染THP-1细胞48小时后能使宿主细胞显著凋亡,而不能表达Esat-6的突变株对宿主细胞的凋亡则无明显影响。
EsxA(Esat-6)为结核分枝杆菌分泌的小分子蛋白,能够通过多种途径与宿主细胞相互作用,参与炎症反应、免疫识别和细胞凋亡。研究表明,当改变Esat-6蛋白的个别氨基酸时,不会抑制Esat-6的分泌,但会导致结核分枝杆菌毒力的减弱 [16]。EsxH作为Esat-6家族蛋白的成员之一,通过本研究发现,EsxH也可促进巨噬细胞的凋亡。
5. 结论
EsxH蛋白能够促进U937细胞的凋亡,在一定范围内其凋亡率随着蛋白浓度的增加而增加。
基金项目
广西自然科学基金项目(2015GXNSFAA139077)。
文章引用
张 依,何时义,宁雪萍,田 爽,凌 敏. 鸟分枝杆菌毒力相关因子EsxH对巨噬细胞凋亡的作用
Effects of Virulence-Related Factors EsxH of Mycobacterium avium on Macrophage Apoptosis[J]. 微生物前沿, 2019, 08(01): 33-39. https://doi.org/10.12677/AMB.2019.81005
参考文献
- 1. De Groote, M.A., Pace, N.R., Fulton, K., et al. (2006) Relationships between Mycobacterium Isolates from Patients with Pulmonary Mycobacterial Infection and Potting Soils. Applied and Environmental Microbiology, 72, 7602-7606. https://doi.org/10.1128/AEM.00930-06
- 2. Falkinham 3rd, J.O. (2011) Nontuberculous Mycobacteria from Household Plumbing of Patients with Nontuberculous Mycobacteria Disease. Emerging Infectious Diseases, 17, 419-424. https://doi.org/10.3201/eid1703.101510
- 3. Griffith, D.E., Aksamit, T., Brown-Elliott, B.A., et al. (2007) An Official ATS/IDSA Statement: Diagnosis, Treatment, and Prevention of Nontuberculous Mycobacterial Diseases. American Journal of Respiratory and Critical Care Medicine, 175, 367-416. https://doi.org/10.1164/rccm.200604-571ST
- 4. Mirsaeidi, M., Machado, R.F., Carcia, J.G., et al. (2014) Nontuberculous Mycobacterial Disese Mortality in the Unired States, 1999-2010: A Population-Based Comparative Study. PLoS ONE, 9, e91879. https://doi.org/10.1371/journal.pone.0091879
- 5. Gunaydin, M., Yanik, K., Eroglu, C., et al. (2013) Distribution of Nontuberculous Mycobacteria Strains. Annals of Clinical Microbiology and Antimicrobials, 12, 33. https://doi.org/10.1186/1476-0711-12-33
- 6. 王洪生, 吴勤学. 非结核分枝杆菌感染与艾滋病[J]. 国外医学皮肤性病学分册, 2005, 31(3): 166-168.
- 7. Heifets, L. (1996) Susceptibility Testing of Mycobacterium avium Complex Isolates. Antimicrobial Agents and Chemotherapy, 40, 1759-l767. https://doi.org/10.1128/AAC.40.8.1759
- 8. 段鸿飞, 土井教生, 李琦, 等. 鸟分枝杆菌复合群对16种抗感染药物药敏试验的分析[J]. 中华结核和呼吸杂志, 2010, 33(5): 359-362.
- 9. Keane, J., Balcewicz-Sablinska, M.K., Remold, H.G., et al. (1997) Infection by Mycobacterium tuberculosis Promotes Human Alveolar Macrophage Apoptosis. Infection and Immunity, 65, 298-304.
- 10. Oddo, M., Renno, T., Attinger, A., et al. (1998) Fas Ligand-Induced Apoptosis of Infected Human Macrophages Reduces the Viability of Intracellular Mycobacterium tuberculosis. Journal of Immunology, 160, 5448-5454.
- 11. Sly, L.M., Hingley-Wilson, S.M., Reiner, N.E., et al. (2003) Survival of Mycobacterium Tuberculosis in Host Macrophages Involves Resistance to Apoptosis Dependent upon Induction of Antiapoptotic Bcl-2 Family Member Mcl-1. The Journal of Immunology, 170, 430-437. https://doi.org/10.4049/jimmunol.170.1.430
- 12. Jayakumar, D., Jacobs Jr., W.R. and Narayanan, S. (2008) Protein Kinase E of Mycobacterium Tuberculosis Has a Role in the Nitric Oxide Stress Response and Apoptosis in a Human Macrophage Model of Infection. Cellular Microbiology, 10, 365-374.
- 13. Velmurugan, K., Chen, B., Miller, J.L., et al. (2007) Mycobacterium tuberculosis nuo G Is a Virulence Gene That Inhibits Apoptosis of Infected Host Cells. PLoS Pathogens, 3, e110. https://doi.org/10.1371/journal.ppat.0030110
- 14. Guinn, K.M., Hickey, M.J., Mathur, S.K., et al. (2004) Individual RD1-Region Genes Are Required for Export of ESAT-6/CFP-10 and for Virulence of Mycobacterium tuberculosis. Molecular Microbiology, 51, 359-370. https://doi.org/10.1046/j.1365-2958.2003.03844.x
- 15. Derrick, S.C. and Morris, S.L. (2007) The ESAT6 Protein of Mycobacterium tuberculosis Induces Apoptosis of Macrophages by Activating Caspase Expression. Cellular Microbiology, 9, 1547-1555. https://doi.org/10.1111/j.1462-5822.2007.00892.x
- 16. Brodin, P., de Jonge, M.I., Majlessi, L., et al. (2005) Functional Analysis of Early Secreted Antigenic Target-6, the Dominant T-Cell Antigen of Mycobacterium tuberculosis, Reveals Key Residues Involved in Secretion, Complex Formation, Virulence, and Immunogenicity. The Journal of Biological Chemistry, 280, 33953-33959. https://doi.org/10.1074/jbc.M503515200
NOTES
*通讯作者
