Advances in Microbiology
Vol.
08
No.
03
(
2019
), Article ID:
32212
,
6
pages
10.12677/AMB.2019.83017
Research Progress on Nitrite-Dependent Anaerobic Methane Oxidation and Its Flora
Ke Cheng
Shaanxi Provincial Land Engineering Construction Group Co., Ltd. Northwest Branch, Xi’an Shaanxi
Received: Aug. 29th, 2019; accepted: Sep. 11th, 2019; published: Sep. 18th, 2019

ABSTRACT
Nitrite-dependent anaerobic methane oxidation (N-DAMO) is a key step in coupling the nitrogen cycle with the carbon cycle. It was found that N-DAMO process is widely distributed in many types of natural ecosystems, which indicates that N-DAMO process is a neglected methane sink, which may play a very important role in global greenhouse gas emission reduction. In this paper, the characteristics and reaction mechanism of M. oxyfera were introduced, the environmental factors influencing the distribution and the distribution characteristics of M. oxyfera in different natural ecosystems were summarized, and the contribution of N-DAMO reaction in reducing greenhouse gas emissions was preliminarily discussed.
Keywords:Nitrite-Dependent Anaerobic Methane Oxidation (N-DAMO), Methane Sink, Environmental Factor, Distribution
亚硝酸盐型甲烷厌氧氧化及其菌群的研究进展
程科
陕西省土地工程建设集团有限责任公司西北分公司,陕西 西安
收稿日期:2019年8月29日;录用日期:2019年9月11日;发布日期:2019年9月18日

摘 要
亚硝酸盐型甲烷厌氧氧化(nitrite-dependent anaerobic methane oxidation, N-DAMO)是耦联氮循环和碳循环的关键环节。研究发现N-DAMO反应广泛分布于多种类型的自然生态系统中,这表明N-DAMO反应是被忽视的甲烷汇,其可能在全球温室气体减排中起着非常重要的作用。本文介绍了M. oxyfera菌的特性和反应机理,总结了影响M. oxyfera菌在自然生境中分布的环境因子和M. oxyfera菌在不同自然生态系统中的分布特征,并初步探讨了N-DAMO反应在减少温室气体排放中的贡献。
关键词 :亚硝酸盐型甲烷厌氧氧化,甲烷汇,环境因子,分布

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
甲烷(CH4)的年排放量约为500~600 Tg,其产生的温室效应是二氧化碳(CO2)的20多倍 [1] 。在自然界中微生物氧化是CH4消耗的主要途径,通过微生物需氧和厌氧氧化来完成,是生态系统中物质及能量循环的重要内容之一。最早,Raghoebarsing等 [2] 在实验室内富集培养中获得了该反应的富集培养产物,证实了CH4氧化可耦合亚硝酸盐( )还原,此过程就是亚硝酸盐型甲烷厌氧氧化(nitrite-dependent anaerobic methane oxidation,N-DAMO)。
2. 亚硝酸盐型甲烷厌氧氧化菌的特性及其生化反应机理
2.1. M. oxyfera菌的特性
Candidatus Methylomirabilis oxyfera (M. oxyfera)是催化N-DAMO反应的微生物,其隶属于NC10门。M. oxyfera菌属于革兰氏阴性菌(G_) [3] ,透射电镜的结果显示,M. oxyfera菌具有罕见的星状多边形结构,目前仍未在其他微生物中发现该结构,因此星状多边形结构被认为是鉴定M. oxyfera菌的形态学特征 [4] 。Kool等 [5] 研究还发现M. oxyfera菌富集培养物中的主要脂肪酸成分是10-甲基十六烷酸(10MeC16:0)。M. oxyfera菌是自养型微生物,将CH4氧化为CO2获得能量来源,反应方程式如下: [6] 。
2.2. M. oxyfera菌的生化反应机理
Ettwig等 [3] 通过稳定性同位素示踪技术,发现了M. oxyfera菌具有内产氧功能。Wu等 [7] 通过CH4氧化和 还原这两个方面进一步研究了M. oxyfera菌的能量代谢途径,如图1所示。图中的橙色区域代表CH4氧化途径:首先CH4在颗粒状甲烷单加氧酶(particulate methane monooxygenase, pMMO)的催化下转化为甲醛,甲醛之后再转化为甲酸,最后甲酸在甲基脱氢酶(FDH)的作用下转化为CO2,产生的CO2可以实现碳的固定。图中的紫色区域代表 还原途径:首先 在亚硝酸盐还原酶(Nir)的作用下还原为NO,然后NO歧化酶(NOD)将两分子NO转化为N2和O2,其中生成的O2有1/4用于呼吸代谢,剩余的3/4参与CH4的氧化。M. oxyfera菌的能量代谢通过上述两个途径的同步进行来完成。
3. 影响自然生境中亚硝酸盐型甲烷厌氧氧化过程的主要环境因子
3.1. pH值
Cai等 [8] 研究发现M. oxyfera菌在pH值为6.0~8.0之间均可以生长,赵荣等 [9] 以M. oxyfera菌的富集培养物作为研究对象,发现M. oxyfera菌的最适pH值为7.5,可进一步提高N-DAMO反应的发生速率。
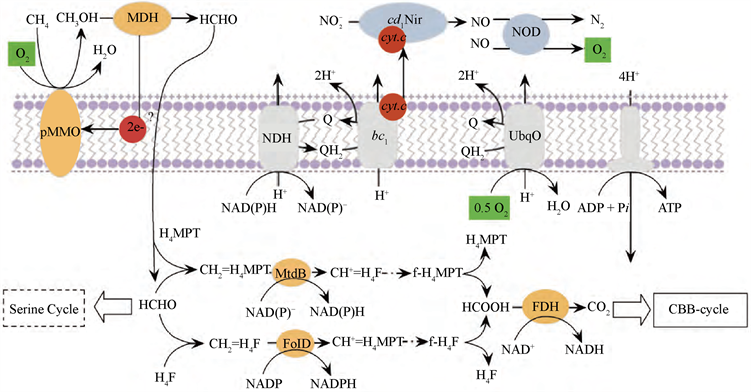 注:橙色区域为CH4氧化途径;紫色区域为
还原途径。
注:橙色区域为CH4氧化途径;紫色区域为
还原途径。
Figure 1. Energy metabolism pathway diagram of M. oxyfera [7]
图1. M. oxyfera能量代谢途径示意图 [7]
3.2. 温度
Chen等 [10] 在南海沉积物中研究发现,温度与M. oxyfera菌16S rRNA基因的多样性呈显著正相关关系,随着温度由2℃上升为2.8℃,M. oxyfera菌16S rRNA基因的多样性明显增加,M. oxyfera菌16S rRNA基因的OTU数由9个增加到14个,Shannon指数也由1.8053增加到2.0136。
3.3. 甲烷/有机碳含量(CH4/OC)
CH4是M. oxyfera菌的唯一能量来源,N-DAMO反应以CH4作为电子供体,通过将CH4氧化为CO2获得能量,自然生境中CH4的浓度决定了N-DAMO反应能否发生。Shen等 [11] 研究表明OC含量与钱塘江沉积物中M. oxyfera菌丰度呈显著的正相关关系。
3.4. 硝酸盐和亚硝酸盐( / )
N-DAMO反应以
作为电子受体,缺氧条件下
大多来自于
还原。因此自然生境中
的浓度有可能对N-DAMO反应过程产生影响。Shen等 [12] 在杭州湾近海岸的研究中发现,
浓度与M. oxyfera菌丰度和活性均呈现显著的正相关关系。Chen等 [10] 对南海沉积物的研究中也发现M. oxyfera菌的丰度与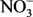 浓度呈显著正相关关系。Wang等 [13] 在稻田土壤中发现了相似的结果。
浓度呈显著正相关关系。Wang等 [13] 在稻田土壤中发现了相似的结果。
3.5. 氧气
M. oxyfera菌属于厌氧微生物。Hu等 [14] 研究发现,较高的M. oxyfera菌丰度及N-DAMO反应活性均分布于较低氧气含量的深层土壤中。Zhou等 [15] 在水稻田土壤中也发现了类似的结果。
3.6. 含盐量
现阶段有少数研究报道了海洋中存在N-DAMO反应过程。Shen等 [12] 发现杭州湾近海岸沉积物中M. oxyfera菌的活性和群落结构与含盐量呈现显著的负相关关系。
4. 自然生态系统中的亚硝酸盐型甲烷厌氧氧化过程
4.1. 海洋生态系统
近年来,关于海洋生态系统中N-DAMO反应的研究逐渐兴起。Shen等 [16] 研究发现在椒江河口沉积物中存在N-DAMO反应,表明M. oxyfera菌在近海区域广泛分布。Chen等 [10] 也发现M. oxyfera菌存在于南海沉积物中。
4.2. 湿地生态系统
N-DAMO反应在减少湿地CH4排放方面发挥了重要作用,Hu等 [14] 和Shen [17] 等发现深层湿地沉积物中M. oxyfera菌数量明显高于浅层沉积物。研究表明湿地深层沉积物中更有利于N-DAMO反应的发生。
4.3. 淡水生态系统
N-DAMO反应在淡水生态系统广泛分布,Deutzmann等 [18] 和Kojima等 [19] 分别在德国的康斯坦茨湖(Lake Constance)和日本的琵琶湖(Lake Biwa)中检测到了M. oxyfera菌的分布。Wang等 [20] 和Ding等 [21] 也分别在三峡水库沉积物中和鄱阳湖沉积物中检测到了M. oxyfera菌的分布。最近,Liu等 [22] 和Zhang等 [23] 在北运河和戈壁沙漠巴丹湖(Lake Badain)中也分别检测到了M. oxyfera菌的分布。
4.4. 稻田生态系统
稻田生境被认为是CH4的重要排放源之一。据估算,稻田的CH4年排放量约占到全球的10%。Hu等 [14] 通过稳定性同位素示踪手段证明在稻田中普遍存在N-DAMO反应过程。随后,Shen等 [24] 也得到了一致的结果,由于稻田需定期施氮肥来提高土壤肥力,从而更进一步促进了N-DAMO反应的发生。Shi等 [25] 对人工改造的泥炭地稻田进行了13C同位素示踪试验,发现该地区广泛存在N-DAMO反应。
5. 展望
N-DAMO反应属于微生物反应过程,现阶段,对于N-DAMO反应中发挥功能的主要微生物进行了生理生化特性和生态学分布规律的研究,并有研究提出N-DAMO反应的内产氧机制。现有的研究在多种自然生境中均发现了N-DAMO反应的存在,并指出了pH值、温度、CH4/OC、 / 、氧气和含盐量是影响M. oxyfera菌分布和活性的环境因子,但M. oxyfera菌对所述环境因子的响应机制仍有待阐明。自然界中多种环境因子对M. oxyfera菌的复合作用及其与相关微生物类群间的相互作用或共进化机制可能是将来研究的重点,单细胞和基因组学技术的发展极大推动了环境微生物生态学的研究,有助于探明多重环境因子对M. oxyfera菌的群落结构和功能活性的作用机理,发挥N-DAMO反应在控制温室气体甲烷排放和氮素污染过程中的作用。目前,对于N-DAMO反应的研究还有许多方面需要提升,主要包括如下几方面:
1) 自然生态系统中的N-DAMO反应研究方面,N-DAMO反应在淡水湖泊、湿地和稻田生境中被发现广泛存在并发挥着潜在甲烷汇的作用,但在海洋生境尤其是在远洋海域中N-DAMO反应过程的报道还比较缺乏,其对海洋区域碳氮循环贡献及其作用机制仍然需要深入地进行研究。此外,通过构建微宇宙培养实验体系,用同位素13C标记的CH4气体在厌氧条件下培养原位取得的待处理土壤,对不同生境中M. oxyfera菌活性进行实时跟踪测定,对所获得的数据进行统计分析后,了解不同生境中M. oxyfera菌的多样性分布规律及其在不同生境中对于甲烷氧化所做出的贡献,为自然生态系统的碳氮循环研究提供理论依据。
2) 目前实验室条件下尚未获得N-DAMO反应的主要功能微生物M. oxyfera菌的纯培养产物,N-DAMO反应过程中功能微生物的作用机理方面,尚有众多问题待解决和探讨,尤其是关键的反应因子NO歧化酶(NOD)还未被检测发现。
3) 对于N-DAMO反应的富集培养物研究方面,N-DAMO反应的功能微生物M. oxyfera菌富集培养比较缓慢,富集培养物的活性较低,这已经成为限制N-DAMO反应投入生产环节的最大瓶颈。目前已有的研究表明可通过调节富集反应的运行参数或配比适宜的富集底物的方法来提高N-DAMO反应的富集效率。
总之,N-DAMO反应可实现碳氮循环的耦联,在生态循环和污水处理中,都具有显著的效益。因此,N-DAMO反应过程的相关研究仍是未来的研究热点,并且应着力推进其相关工艺在实际中的应用和发展。
文章引用
程 科. 亚硝酸盐型甲烷厌氧氧化及其菌群的研究进展
Research Progress on Nitrite-Dependent Anaerobic Methane Oxidation and Its Flora[J]. 微生物前沿, 2019, 08(03): 139-144. https://doi.org/10.12677/AMB.2019.83017
参考文献
- 1. IPCC (2014) Climate Change 2014: Impacts, Adaptation, and Vulnerability. Part A: Global and Sectoral Aspects. Contribution of Working Group II to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge and New York, 1-32.
- 2. Raghoebarsing, A.A., Pol, A., van de Pas-Schoonen, K.T., et al. (2006) A Microbial Consortium Couples Anaerobic Methane Oxidation to Denitrification. Nature, 440, 918-921. https://doi.org/10.1038/nature04617
- 3. Ettwig, K.F., Butler, M.K., Le Paslier, D., et al. (2010) Nitrite-Driven Anaerobic Methane Oxidation by Oxygenic Bacteria. Nature, 464, 543-548. https://doi.org/10.1038/nature08883
- 4. Wu, M.L., Teeseling, M.C.F., Van Willems, M.J.R., et al. (2012) Ultrastructure of the Denitrifying Methanotroph “Candidatus Methylomirabilis Oxyfera”, a Novel Polygon-Shaped Bacterium. Journal of Bacteriology, 194, 284-291. https://doi.org/10.1128/JB.05816-11
- 5. Kool, D.M., Zhu, B., Rijpstra, W.I., et al. (2012) Rare Branched Fatty Acids Characterize the Lipid Composition of the Intra-Aerobic Methane Oxidizer “Candidatus Methylomirabilis Oxyfera”. Applied & Environmental Microbiology, 78, 8650-8656. https://doi.org/10.1128/AEM.02099-12
- 6. Rasigraf, O., Kool, D.M., Jetten, M.S., et al. (2014) Autotrophic Carbon Dioxide Fixation via the Calvin-Benson-Bassham Cycle by the Denitrifying Methanotroph “Candidatus Methylomirabilis Oxyfera”. Applied & Environmental Microbiology, 80, 2451. https://doi.org/10.1128/AEM.04199-13
- 7. Wu, M.L., Ettwig, K.F., Jetten, M.S., et al. (2011) A New Intra-Aerobic Metabolism in the Nitrite-Dependent Anaerobic Methane-Oxidizing Bacterium Candidatus “Methylomirabilis Oxyfera”. Biochemical Society Transactions, 39, 243-248. https://doi.org/10.1042/BST0390243
- 8. Cai, C., Hu, S.H., Guo, J.H., et al. (2015) Nitrate Reduction by Denitrifying Anaerobic Methane Oxidizing Microorganisms Can Reach a Practically Useful Rate. Water Research, 87, 211-217. https://doi.org/10.1016/j.watres.2015.09.026
- 9. 赵荣, 朱雷, 吴箐, 等. 亚硝酸盐型甲烷厌氧氧化过程影响因素研究[J]. 环境科学学报, 2017, 37(1): 178-184.
- 10. Chen, J., Zhou, Z.C. and Gu, J.D. (2014) Occurrence and Diversity of Nitrite-Dependent Anaerobic Methane Oxidation Bacteria in the Sediments of the South China Sea Revealed by Amplification of Both 16S rRNA and pmoA Genes. Applied Microbiology and Biotechnology, 98, 5685-5696. https://doi.org/10.1007/s00253-014-5733-4
- 11. Shen, L.D., Liu, S., Zhu, Q., et al. (2014) Distribution and Diversity of Nitrite-Dependent Anaerobic Methane Oxidising Bacteria in the Sediments of the Qiantang River. Microbial Ecology, 67, 341-349. https://doi.org/10.1007/s00248-013-0330-0
- 12. Shen, L.D., Hu, B.L., Liu, S., et al. (2016) Anaerobic Methane Oxidation Coupled to Nitrite Reduction Can Be a Potential Methane Sink in Coastal Environments. Applied Microbiology & Biotechnology, 100, 7171-7180. https://doi.org/10.1007/s00253-016-7627-0
- 13. Wang, Y., Zhu, G., Harhangi, H.R., et al. (2012) Co-Occurrence and Distribution of Nitrite-Dependent Anaerobic Ammonium and Methane-Oxidizing Bacteria in a Paddy Soil. FEMS Microbiology Letters, 336, 79-88. https://doi.org/10.1111/j.1574-6968.2012.02654.x
- 14. Hu, B.L., Shen, L.D., Lian, X., et al. (2014) Evidence for Nitrite-Dependent Anaerobic Methane Oxidation as a Previously Overlooked Microbial Methane Sink in Wetlands. Proceedings of the National Academy of Science of the United States of America, 111, 4495-4500. https://doi.org/10.1073/pnas.1318393111
- 15. Zhou, L., Wang, Y., Long, X.E., et al. (2014) High Abundance and Diversity of Nitrite-Dependent Anaerobic Methane-Oxidizing Bacteria in a Paddy Field Profile. FEMS Microbiology Letters, 360, 33-41. https://doi.org/10.1111/1574-6968.12567
- 16. Shen, L.D., Zhu, Q., Liu, S., et al. (2014) Molecular Evidence for Nitrite-Dependent Anaerobic Methane-Oxidising Bacteria in the Jiaojiang Estuary of the East Sea (China). Applied Microbiology and Biotechnology, 98, 5029-5038. https://doi.org/10.1007/s00253-014-5556-3
- 17. Shen, L.D., Huang, Q., He, Z.F., et al. (2015) Vertical Distribution of Nitrite-Dependent Anaerobic Methane-Oxidising Bacteria in Natural Freshwater Wetland Soils. Applied Microbiology and Biotechnology, 99, 349-357. https://doi.org/10.1007/s00253-014-6031-x
- 18. Deutzmann, J.S. and Schink, B. (2011) Anaerobic Oxidation of Methane in Sediments of Lake Constance, an Oligotrophic Freshwater Lake. Applied and Environmental Microbiology, 77, 4429-4436. https://doi.org/10.1128/AEM.00340-11
- 19. Kojima, H., Tsutsumi, M., Ishikawa, K., et al. (2012) Distribution of Putative Denitrifying Methane Oxidizing Bacteria in Sediment of a Freshwater Lake, Lake Biwa. Systematic & Applied Microbiology, 35, 233. https://doi.org/10.1016/j.syapm.2012.03.005
- 20. Wang, Y., Huang, P., Ye, F., et al. (2015) Nitrite-Dependent Anaerobic Methane Oxidizing Bacteria along the Water Level Fluctuation Zone of the Three Gorges Reservoir. Applied Microbiology and Biotechnology, 100, 1977-1986. https://doi.org/10.1007/s00253-015-7083-2
- 21. Ding, X., Peng, X.J., Jin, B.S., et al. (2015) Spatial Distribution of Bacterial Communities Driven by Multiple Environmental Factors in a Beach Wetland of the Largest Freshwater Lake in China. Frontiers in Microbiology, 6, 129. https://doi.org/10.3389/fmicb.2015.00129
- 22. Liu, Y., Chen, Y.J., Wang, X.Y., et al. (2018) Influences of Anthropogenic Activities on the Community Structure of N-DAMO Bacteria in the North Canal. Environmental Science, 39, 3677-3688.
- 23. Zhang, X.W., Liu, K., Li, P., et al. (2019) Molecular Existence and Diversity of Nitrite-Dependent Anaerobic Methane Oxidizing (n-Damo) Bacteria in the Lakes of Badain of the Gobi Desert. Geomicrobiology Journal, 36, 522-532. https://doi.org/10.1080/01490451.2019.1578441
- 24. Shen, L.D., Liu, S., Huang, Q., et al. (2014) Evidence for the Cooccurrence of Nitrite-Dependent Anaerobic Ammonium and Methane Oxidation Processes in a Flooded Paddy Field. Applied & Environmental Microbiology, 80, 7611-7619. https://doi.org/10.1128/AEM.02379-14
- 25. Shi, Y., Wang, Z., He, C., et al. (2017) Using 13C Isotopes to Explore Denitrification-Dependent Anaerobic Methane Oxidation in a Paddy-Peatland. Scientific Reports, 7, Article No. 40848. https://doi.org/10.1038/srep40848