Mine Engineering
Vol.
06
No.
04
(
2018
), Article ID:
27111
,
9
pages
10.12677/ME.2018.64031
Interactions between Different Energy Sources Adapted Acidithiobacillus ferrooxidans and Chalcopyrite Simulated by Extended-DLVO
Qianfen Wang
Hualan Biological Bacterin Co., LTD., Xinxiang Henan

Received: Sep. 19th, 2018; accepted: Oct. 5th, 2018; published: Oct. 12th, 2018

ABSTRACT
In this paper, interactions between FeSO4·7H2O, sulfur or chalcopyrite adapted Acidithiobacillus ferrooxidans and chalcopyrite were studied. Contact angle and zeta potential experiments were used to analyze the surface properties of bacteria and minerals. Interaction energies between bacteria and minerals were calculated by thermodynamics and extended-DLVO theories; attachment behaviors of bacteria to minerals were monitored within two hours. The differences of interactions between bacteria and minerals were used to reveal the nature of bacterial attachment, and provide more favorable conditions for bioleaching.
Keywords:Acidithiobacillus ferrooxidans, Chalcopyrite, Extend-DLVO, Attachment, Interaction
Extended-DLVO模拟不同能源适应的Acidithiobacillus ferrooxidans与黄铜矿之间的相互作用
王乾芬
华兰生物疫苗有限公司,河南 新乡

收稿日期:2018年9月19日;录用日期:2018年10月5日;发布日期:2018年10月12日

摘 要
本文研究了FeSO4·7H2O、硫及黄铜矿适应的Acidithiobacillus ferrooxidans分别与黄铜矿之间的相互作用。通过接触角和Zeta电位来分析细菌及矿物的表面性质,使用热力学方法和extended-DLVO理论来计算和预测细菌与矿物之间的相互作用能,监测2小时内细菌在矿物表面的吸附行为。对比细菌与矿物之间相互作用的差异来揭示细菌在矿物表面吸附的本质,为后续生物浸出创造更加有利的条件。
关键词 :Acidithiobacillus ferrooxidans,黄铜矿,Extend-DLVO,吸附,相互作用

Copyright © 2018 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
微生物与矿物表面相互作用依赖于若干物理及生化参数。有研究显示微生物通过各种方法吸附在矿物表面:蛋白结合受体,粘液层的分泌,通过静电、疏水相互作用,使用多糖–蛋白质复合物或借助于菌毛吸附 [1] [2] [3] [4]。微生物的种类、矿物的类型、溶液的环境、矿浆的浓度等对整体吸附是非常重要的 [5] [6]。M. Afzal Ghauri等 [5] 发现不同嗜酸细菌之间,甚至同一个种不同菌株之间吸附到固体材料表面时表现出不同的性质。Cindy-Jade Africa等 [7] 提出相对于脉石材料,细菌选择性的吸附到硫化矿表面。不同底物生长的At. ferrooxidans的EPS最主要的差别就是络合三价铁离子或其他阳离子的基团。这就意味着细菌能够根据生长底物调整组分和EPS的量 [2] [8]。因此,细菌的生长条件在很大程度上影响细菌表面性质,进而影响细菌的吸附行为。目前,已经提出了实际吸附机制依赖于系统离子键、化学键、氢键或蛋白质结合的微观性质特异性相互作用和宏观性质非特异性相互作用。
在各类相互作用机制中,extended-DLVO理论对吸附机制的范德华、静电、疏水相互作用进行了较好的阐述。Mohsen Farahat等 [9] 利用扩展DLVO理论来评估Ferroplasma acidiphilum在黄铁矿表面的吸附情况,根据扩展DLVO理论,在研究的所有pH条件下,细菌与矿物之间总的相互作用能主要由静电能贡献,其次是酸碱相互作用能和范德华能。酸碱相互作用比静电相互作用和范德华相互作用影响大,但是酸碱相互作用是短程的。扩展DLVO理论可以解释不同pH条件下Ferroplasma acidiphilum–黄铁矿的吸附行为。
本文通过检测不同能源适应的Acidithiobacillus ferrooxidans、黄铜矿的接触角和Zeta电位等指标来反应细菌及矿物的部分表面性质,使用extended-DLVO理论对细菌与黄铜矿之间的相互作用进行模拟,对不同能源适应的细菌吸附到矿物表面的吸附曲线进行绘制,结果表明extended-DLVO理论对细菌与黄铜矿之间的相互作用可以较好的预测细菌与矿物之间的吸附情况。根据本文研究结果,结合模拟的细菌与矿物之间相互作用情况来调节细菌与矿物的相互作用体系条件使细菌更好地吸附到矿物表面,以利于后续矿物的浸出。
2. 实验材料与方法
2.1. 菌株及其生长条件
Acidithiobacillus ferrooxidans ATCC23270 (本文简称A.f)为本研究使用的细菌。细菌分别以七水合硫酸亚铁、单质硫、黄铜矿为唯一能源适应,于30℃、170 r/min的摇床中培养。
2.2. 矿块的制备
将矿块切割成直径10 mm、厚度2 mm左右的圆片,圆片在抛光布上分别用6、3和0.5 μm粒度的液体金刚石研磨膏抛光,抛光后的矿物圆片使用70%的无水乙醇洗涤,最后将矿物圆片浸入丙酮中。剩下的矿物分别研磨成直径小于75 μm的粉末,以用于吸附实验。
2.3. Zeta电位的测量
收集对数生长期中期的细菌,矿物粉末粒度为−5 μm,采用Nano-2s MPT-2 纳米粒度及Zeta电位分析仪测定矿物和细菌的Zeta电位。将细菌悬浮于pH 2.0的无铁9 K培养基中,并控制细菌浓度为2 × 108 cells/ml;矿粉悬浮于pH 2.0的无铁9K培养基中,矿粉浓度为0.1 g/100ml。测量五次,五次数据的平均值为文中所示的Zeta电位数据。
2.4. 接触角的测量
收集对数生长期中期的细菌,使用JJC-1型润湿角测量仪测量细菌和矿物的接触角。取标准溶液滴于矿物样片上,测量仪所读的数值即为矿物的接触角。细菌体积微小,因此细菌的接触角要取标准溶液滴于细菌菌苔上才能进行测量。菌苔制备方法:使用双面胶将0.22 μm的薄膜贴于盖玻片上,取细菌悬液垂直地滴在薄膜上,无菌环境下菌悬液自然干燥成菌苔。测量十次,十次数据的平均值为本文所示的接触角数据。
2.5. 热力学理论
矿物与细菌体系中,比较两个表面吸附前后的自由能变化用热力学公式表述为:
(1)
γmb,γml,γbl分别是矿物与细菌,矿物与溶液以及细菌与溶液的界面自由能。该体系是向总能量降低的方向进行,即如果ΔGadh < 0,细菌会吸附到矿物表面,如果ΔGadh > 0,热力学上将不支持这种吸附行为。
通过测量矿物和细菌分别与已知表面能参数的三种标准液的接触角来计算γml和γbl的值,使用Lifshitz-van der Waals’ acid-base (LW-AB)法计算γmb的值。
1) 矿物和细菌表面能参数的计算
通过extended Young’s方程计算矿物的表面能参数( )及细菌的表面能参数( )。本文以蒸馏水、甲酰胺和二碘甲烷为标准液,它们的表面能参数见表1。Extended Young’s方程表述如下:
(2)
或
(3)
式中θ为接触角, 为任一标准液的表面能参数。
Table 1. Parameters of surface energy of three standard liquid
表1. 标准液的表面能参数(引自P. K. Sharma et al. [10] )
2) LW-AB法状态方程
LW-AB吸附的总自由能被分为Lifshitz-van der Waals和酸碱(acid-base)两部分,公式描述为:
(4)
(5)
(6)
式中γ+和γ−分别为电子受体和电子供体参数。
2.6. Extended-DLVO理论
浸矿细菌微小可近似看做球体,矿物可近似看做平板,细菌–矿物相互作用体系可看做球体–平板相互作用体系。根据extended-DLVO理论,细菌与矿物之间的总相互作用能(Gtotal)可描述为
(7)
式中GEL为静电势能,是由细菌和矿物表面的双电层叠加引起的,GAB为酸碱相互作用能,GLW为Lifshitz-van der Waals相互作用能。下面对各相互作用能进行详细描述:
细菌和矿物之间的静电势能GEL可用公式描述为:
(8)
酸碱相互作用能GAB可用公式描述为:
(9)
Lifshitz-van der Waals相互作用能GLW可通过以下计算公式求出
(10)
式中α是细菌细胞半径,一般取1 μm。ε是溶液的介电常数。 和
分别为细菌和矿物的Zeta电位。κ−1双电层厚度,取值
。I为溶液的离子强度。H是细菌和矿物之间的相对距离。λ是分子在溶液中的衰减长度。d0是细菌和矿物之间的最小相互作用距离,一般取作6.57Å。А是有效Hamaker常数。本文公式引自P.K. Sharma et al. [10]。
和
分别为细菌和矿物的Zeta电位。κ−1双电层厚度,取值
。I为溶液的离子强度。H是细菌和矿物之间的相对距离。λ是分子在溶液中的衰减长度。d0是细菌和矿物之间的最小相互作用距离,一般取作6.57Å。А是有效Hamaker常数。本文公式引自P.K. Sharma et al. [10]。
2.7. 细菌吸附实验
将收集好的细菌悬浮于矿浆浓度为1%的无铁9K培养基中,细菌的浓度为1 × 108 cells/ml,30℃、170 r/min处理2 h。期间,定时取样,对上清液中游离细菌进行显微计数,吸附到矿粉上的细菌数为总细菌数减去游离细菌数的值 [11]。吸附实验做3组平行,取其平均值。
3. 结果与讨论
3.1. 细菌及矿物表面性质的分析
在pH为2.0的无铁9K培养基中,细菌带正电荷,矿物带负电荷。因此,细菌和矿物之间会出现静电引力。黄铜矿适应的细菌Zeta电位最大(4.56 ± 0.48 mV),硫适应的细菌Zeta电位(3.41 ± 0.62 mV)最小(见表2)。硫适应的细菌其适应环境中缺乏EPS可以络合的三价铁离子,所以,其电位比FeSO4∙7H2O、黄铜矿适应的细菌电位都低。
对细菌与矿物的接触角进行了测量。数据表明黄铜矿疏水性较强(见表3)。黄铜矿适应的细菌的接触角最大(25.8˚ ± 1.8˚),FeSO4∙7H2O适应的细菌的接触角最小(20.3˚ ± 1.1˚)。分析认为当可溶性的二价铁离子不存在时,细菌要吸附到底物表面才能获得生长所需的能源,因此,固体底物适应的细菌表面疏水性要强一些 [8] [12] [13]。
数据表明不同能源适应的细菌的表面电荷不同,且细菌表面电荷依赖于其适应环境。EPS组成不同导致细菌表面带电荷量、疏水性质等发生变化,而EPS的组成是细菌生长条件诱导的结果,有研究表明以黄铁矿或者硫酸亚铁为底物的At. ferrooxidans,它们的EPS成分相似,有糖、饱和脂肪酸、糖醛酸和三价铁离子。以硫为底物的At. ferrooxidans的EPS中检测出比黄铁矿为底物的细菌更大量的脂肪酸、更少量的糖和糖醛酸,所以,以硫为底物的At. ferrooxidans的疏水性更强。有研究表明硫底物生长的At. ferrooxidans在吸附到硫表面时主要是通过疏水相互作用 [2]。
3.2. 细菌与矿物的表面能分析
使用LW-AB方法计算细菌及矿物的表面能,详细数据见表4。由表中数据可知,矿物及微生物的γ+电子受体值在1.0687~1.7182 mJ/m2之间,γ−值在5.1176~57.3239 mJ/m2之间,且γ−电子供体值之间存在
Table 2. Zeta potentials of bacteria and minerals
表2. 不同能源适应的细菌表面及矿物表面的Zeta电位
Table 3. Contact angles of bacteria and minerals
表3. 不同能源适应的细菌表面及矿物表面的接触角
Table 4. Parameters of surface energy of bacteria and minerals
表4. 不同能源适应的细菌以及矿物的表面能参数
差异。已有文献提出γ+值在确定基体条件下没有亲水性或疏水性作用,电子供体组分γ−值决定了表面性质。如果物质的γ−值 ≥ 28.3 mJ/m2,那么该物质是亲水性的;如果γ−值 < 28.3 mJ/m2,那么该物质是疏水性的 [14]。根据表中数据,细菌表面具有亲水特性,矿物表面具有疏水特性。
黄铜矿的表面能是47.7541 mJ/m2。黄铜矿适应的细菌(50.8210 mJ/m2)比硫适应的细菌(50.3554 mJ/m2)稍大,最小的是FeSO4∙7H2O适应的细菌(49.7664 mJ/m2)。由于高的电子供体(γ−)性质,不同能源适应的细菌的表面能要比矿物的表面能要高,因此细菌显得更加亲水。Van Oss [15] 曾建议,大量细菌的γLW值通常在40 mJ/m2左右变化。在本研究中,细菌的γLW值在31~33 mJ/m2的范围内(表4),所研究的细菌表现出单极表面(γ−至少要比γ+大一个数量级),所有细菌的γ−的值都在51至58 mJ/m2的范围内。
用LW-AB方法计算的不同能源适应的Acidithiobacillus ferrooxidans与矿物之间的吸附能见表5。不同能源适应的细菌与黄铜矿之间的范德华相互作用能和酸碱作用能是负的,且不同能源适应的细菌与黄铜矿之间的总作用能为负值,因此,热力学方法预测不同能源适应的细菌可以吸附到黄铜矿表面。总体来说,矿物适应的细菌与矿物之间的总作用能大于硫适应的细菌与矿物之间的总作用能,FeSO4∙7H2O适应的细菌与矿物之间的总作用能最小。
通过扩展DLVO计算了不同能源适应的Acidithiobacillus ferrooxidans与黄铜矿之间随距离变化的总相互作用势能,结果见图1。从图中可以看出,细菌与黄铜矿之间总势能的主要贡献来自于范德华相互作用势能(GLW),黄铜矿适应的细菌和硫适应的细菌与黄铜矿之间的酸碱相互作用势能(GAB)均比静电相互作用势能(GEL)大,而FeSO4∙7H2O适应的细菌则相反。酸碱相互作用是相对短距离的,并且在这些力变得有效之前相互作用表面必须接近或小于5 nm。不同能源适应的细菌与黄铜矿之间的GLW、GAB和GEL均为负值,所以Gtotal为负值,且黄铜矿适应的细菌与黄铜矿之间的Gtotal值最小,FeSO4∙7H2O适应的细菌与黄铜矿之间的Gtotal值最大,即扩展DLVO理论预测黄铜矿适应的细菌最容易吸附到黄铜矿表面,硫适应的细菌次之,FeSO4∙7H2O适应的细菌最难。由以上数据可知,矿物适应的细菌最容易吸附到矿物表面,硫适应的细菌次之,FeSO4∙7H2O适应的细菌最难吸附到矿物表面。
顾帼华等 [16] 通过扩展DLVO理论建立的范德华力、疏水相互作用和静电作用自由能与作用距离(H)之间的势能曲线准确地预言了Acidithiobacillus ferrooxidans在黄铁矿表面的吸附现象。
3.3. 细菌与矿物之间吸附情况分析
不同能源适应的Acidithiobacillus ferrooxidans在黄铜矿表面的吸附情况见图2。由图可知,固体底物适应的细菌比水溶性铁离子适应的细菌对矿物表现出更强的吸附能力。这可能是固体底物适应的细菌只有吸附到底物表面后才能利用固体底物,FeSO4∙7H2O适应的细菌不必吸附到固体底物上,可直接利用可溶性二价铁离子 [12] [17]。
由于蛋白在提高细菌和矿物表面之间的吸附方面有非常重要的作用,硫或矿物适应的细菌比

Figure 1. Curves of interfacial free energy between different energy sources adapted Acidithiobacillus ferrooxidans and chalcopyrite. Total interfacial free energy between FeSO4∙7H2O, element sulfur or chalcopyrite adapted bacteria and chalcopyrite (a); interfacial free energy between FeSO4∙7H2O adapted bacteria and chalcopyrite (b); interfacial free energy between element sulfur adapted bacteria and chalcopyrite (c); interfacial free energy between chalcopyrite adapted bacteria and chalcopyrite (d)
图1. 不同能源适应的Acidithiobacillus ferrooxidans与黄铜矿之间相互作用势能曲线。(a) 为FeSO4∙7H2O,单质硫或黄铜矿适应的细菌与黄铜矿之间相互作用总势能的对比;(b) 为FeSO4∙7H2O适应的细菌与黄铜矿之间相互作用势能曲线;(c) 为单质硫适应的细菌与黄铜矿之间相互作用势能曲线;(d) 为黄铜矿适应的细菌与黄铜矿之间相互作用势能曲线
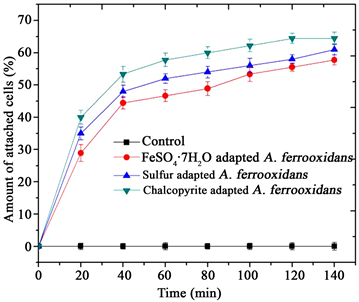
Figure 2. Attachment of different energy sources adapted bacteria to chalcopyrite
图2. 不同能源适应的细菌在黄铜矿上吸附情况
Table 5. Interfacial free energy between bacteria and mineral
表5. 细菌–矿物界面相互作用自由能(mJ/m2)
FeSO4∙7H2O适应的细菌具有更高的蛋白质含量导致了细菌更迅速和大量地吸附到矿物表面 [7] [12] [18]。黄铜矿适应的细菌在黄铜矿表面的吸附量为64.44%;硫适应的细菌在黄铜矿表面的吸附量为61.04%;FeSO4∙7H2O适应的细菌在黄铜矿表面的吸附量为57.78%。总体来说,黄铜矿适应的细菌在黄铜矿表面的吸附量最大,硫适应的细菌次之,FeSO4∙7H2O适应的细菌最小,该结果与扩展DLVO理论预测的结果一致。
4. 结论
1) 黄铜矿适应的细菌的表面能最大,其次是硫适应的细菌,最小的是FeSO4∙7H2O适应的细菌。
2) 热力学方法计算的不同能源适应的细菌与矿物之间的总相互作用能均为负值,且矿物适应的细菌最容易吸附到矿物表面,其次是硫适应的细菌,最难吸附的是FeSO4∙7H2O适应的细菌。
3) 根据extend-DLVO理论,不同能源适应的细菌与矿物之间Gtotal为负值,且矿物适应的细菌最容易吸附到矿物表面,硫适应的细菌次之,FeSO4∙7H2O适应的细菌最难。细菌与黄铜矿之间的总势能的主要贡献来自于范德华相互作用势能(GLW)。
4) 根据吸附曲线,黄铜矿适应的细菌在黄铜矿表面的吸附量最大,硫适应的细菌次之,FeSO4∙7H2O适应的细菌最小。
5) 总体来说,热力学方法及extend-DLVO理论预测的不同能源适应的细菌与黄铜矿之间的吸附情况均与吸附曲线表现一致。Extend-DLVO理论可以更好地预测不同能源适应的Acidithiobacillus ferrooxidans与黄铜矿之间的吸附情况。
文章引用
王乾芬. Extended-DLVO模拟不同能源适应的Acidithiobacillus ferrooxidans与黄铜矿之间的相互作用
Interactions between Different Energy Sources Adapted Acidithiobacillus ferrooxidans and Chalcopyrite Simulated by Extended-DLVO[J]. 矿山工程, 2018, 06(04): 231-239. https://doi.org/10.12677/ME.2018.64031
参考文献
- 1. Devasia, P., Natarajan, K.A., Sathyanarayana, D.N.., et al. (1993) Surface Chemistry of Thiobacillus ferrooxidans Relevant to Adhe-sion on Mineral Surfaces. Applied and Environmental Microbiology, 59, 4051-4055.
- 2. Gehrke, T., Telegdi, J., Thierry, D., et al. (1998) Importance of Extracellular Polymeric Substances from Thiobacillus ferrooxidans for Bioleaching. Applied and Environmental Microbiology, 64, 2743-2747.
- 3. Gonzalez, A., Bellenberg, S., Mamani, S., et al. (2013) AHL Signaling Molecules with a Large Acyl Chain Enhance Biofilm Formation on Sulfur and Metal Sulfides by the Bioleaching Bacterium Acidithiobacillus ferrooxidans. Applied Microbiology and Biotechnology, 97, 3729-3737. https://doi.org/10.1007/s00253-012-4229-3
- 4. Sampson, M.I., Phillips, C.V. and Ball, A.S. (2000) Investigation of the Attachment of Thiobacillus ferrooxidans to Mineral Sulfides Using Scanning Electron Microscopy Analysis. Minerals Engineering, 13, 643-656. https://doi.org/10.1016/S0892-6875(00)00046-7
- 5. Ghauri, M.A., Okibe, N. and Johnson, D.B. (2007) Attachment of Aci-dophilic Bacteria to Solid Surfaces: The Significance of Species and Strain Variations. Hydrometallurgy, 85, 72-80. https://doi.org/10.1016/j.hydromet.2006.03.016
- 6. Ohmura, N., Kitamura, K. and Saiki, H. (1993) Selective Adhesion of Thiobacillus ferrooxidans to Pyrite. Applied and Environmental Microbiology, 59, 4044-4050.
- 7. Africa, C.J., van Hille, R.P. and Harrison, S.T. (2013) Attachment of Acidithiobacillus ferrooxidans and Leptospirillum ferriphilum Cultured under Varying Conditions to Pyrite, Chalcopyrite, Low-Grade Ore and Quartz in a Packed Column Reactor. Applied Microbiology and Biotechnology, 97, 1317-1324. https://doi.org/10.1007/s00253-012-3939-x
- 8. Sharma, P. (2003) Surface Characterization of Acidithiobacillus ferrooxidans Cells Grown under Different Conditions. Hydrometallurgy, 71, 285-292. https://doi.org/10.1016/S0304-386X(03)00167-1
- 9. Farahat, M., Hirajima, T. and Sasaki, K. (2010) Adhesion of Ferroplasma acidiphilum onto Pyrite Calculated from the Extended DLVO Theory Using the van Oss-Good-Chaudhury Approach. Journal of Colloid and Interface Science, 349, 594-601. https://doi.org/10.1016/j.jcis.2010.05.091
- 10. Sharma, P.K. and Hanumantha Rao, K. (2003) Adhesion of Paenibacillus polymyxa on Chalcopyrite and Pyrite: Surface Thermodynamics and Extended DLVO Theory. Colloids and Surfaces B: Biointerfaces, 29, 21-38. https://doi.org/10.1016/S0927-7765(02)00180-7
- 11. Yu, R.-L., Ou, Y., Tan, J.-X., et al. (2011) Effect of EPS on Adhesion of Acidithiobacillus ferrooxidans on Chalcopyrite and Pyrite Mineral Surfaces. Transactions of Nonferrous Metals Society of China, 21,407-412. https://doi.org/10.1016/S1003-6326(11)60729-2
- 12. Xia, L.X., Liu, X.X., Zeng, J., et al. (2008) Mechanism of Enhanced Bi-oleaching Efficiency of Acidithiobacillus ferrooxidans after Adaptation with Chalcopyrite. Hydrometallurgy, 92, 95-101. https://doi.org/10.1016/j.hydromet.2008.01.002
- 13. Vu, B., Chen, M., Crawford, R.J., et al. (2009) Bacterial Extracellular Polysaccharides Involved in Biofilm Formation. Molecules, 14, 2535-2554. https://doi.org/10.3390/molecules14072535
- 14. Farahat, M., Hirajima, T., Sasaki, K., et al. (2009) Adhesion of Escherichia coli onto Quartz, Hematite and Corundum: Extended DLVO Theory and Flotation Behavior. Colloid Surface B, 74, 140-149. https://doi.org/10.1016/j.colsurfb.2009.07.009
- 15. Oss, C.J.V. (1994) Interfacial Forces in Aqueous Media. Marcel Dekker Inc., New York.
- 16. Gu, G.H., Wang, H., Suo, J., et al. (2008) Interfacial Interaction of Bio-Leaching of Pyrite Mineral. Journal of Central South University, 15, 49-53. https://doi.org/10.1007/s11771-008-0011-1
- 17. Boonaert, C.J.P., Dufrene, Y.F., Derclaye, S.R., et al. (2001) Adhesion of Lactococcus lactis to Model Substrata: Direct Study of the Interface. Colloid Surface B, 22, 171-182. https://doi.org/10.1016/S0927-7765(01)00196-5
- 18. Zhu, J., Li, Q., Jiao, W., et al. (2012) Adhesion Forces between Cells of Acidithiobacillus ferrooxidans, Acidithiobacillus thiooxidans or Leptospirillum ferrooxidans and Chalcopyrite. Colloids and Surfaces B, Biointerfaces, 94, 95-100. https://doi.org/10.1016/j.colsurfb.2012.01.022
