Journal of Organic Chemistry Research
Vol.04 No.02(2016), Article ID:17900,5
pages
10.12677/JOCR.2016.42008
Synthesis of Hydrazone Derivatives of N-(4- aryl-thiazol-2-yl)-Benzyloxy-Acetophenone
Mamateli Obul*, Zeynepgul Esmayil, Xiabing Ma
College of Chemistry and Chemical Engineering, Xinjiang University, Urumqi Xinjiang

Received: May 24th, 2016; accepted: Jun. 25th, 2016; published: Jun. 29th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
This paper mainly described the synthesis of hydrazone derivatives of N-(4-aryl-thiazol-2-yl)- benzyloxy-acetophenone. All compounds were confirmed by 1HNMR and IR spectrography. This method can operate simply and is economical and environment-friendly.
Keywords:Synthesis, Hydrazone, Thiazole

N-(4-芳基噻唑-2-基)-对苄氧基苯乙酮腙的合成
麦麦提艾力·奥布力*,再乃普古丽·伊斯马伊力,马夏冰
新疆大学化学化工学院,新疆 乌鲁木齐

收稿日期:2016年5月24日;录用日期:2016年6月25日;发布日期:2016年6月29日

摘 要
本文主要介绍了合成一系列N-(4-芳基噻唑-2-基)-对苄氧基苯乙酮腙类化合物的简单方法,这些化合物已得到1HNMR和IR光谱确证。该方法具有操作简便,经济和环保等优点。
关键词 :合成,酮腙,噻唑

1. 引言
噻唑环是一个具有广泛生理活性的结构单元,具有如消炎、抗菌、抗病毒抗肿瘤及降糖 [1] - [3] 的作用。腙类试剂是一类理想的荧光分析试剂,用其测Al3+、Zn2+、Cu2+等已显示出灵敏度高、选择性好的优点,腙类试剂是众多Schiff碱中的一种,它形成配合物后其生物活性比配位前明显增强,其配合物有着广泛的生物活性和抗癌活性 [4] ,因此腙类试剂受到人们的重视。腙类化合物因具有特殊的生物活性和强配位能力,在农药、医药、材料和分析试剂等方面而备受关注 [5] ,所以将噻唑环和其它基团引入到腙类化合物分子中,很可能由于骈和作用产生更强的生物活性 [6] 。
2. 实验部分
2.1. 试剂与仪器
产物的熔点用瑞士BUCHIB2540型熔点仪测定(温度计未校正);质谱用API 2000质谱仪测定;核磁共振用VARIAN INOVA 400型核磁共振仪测定(CDC13,DMSO-d6为溶剂,TMS为内标);红外光谱用BRUKER-EQUINOX55红外光谱仪测定(KBr压片);元素分析用EA-1110元素分析仪测定。甲醇,乙醇,POCl3经过干燥,重蒸处理,其它试剂及溶剂均属于高纯度商品,使用前未经处理。
2.2. ω-溴代芳基乙酮(2a~2g)的制备
参照文献 [7] 方法,在装有温度计,冷凝管的100 mL的三口烧瓶中,加入取代苯乙酮5.0 g,无水乙醚40 mL,磁力搅拌混合均匀,冰浴控制温度在5℃。通过恒压滴液漏斗缓慢滴加溴素6.5 g。开始时逐滴滴加,等第一滴溴素颜色退去,再进行滴加,勿使发生颜色累积。溴素、滴加完毕后,撤去冰浴,溶液呈现淡黄色,室温反应1.5 h后,反应结束,加入30 mL乙醚,5%氢氧化钠溶液冲洗(5 mL × 3次),饱和食盐水冲洗(5 mL × 3次),冰水冲洗(5 mL × 3次)。减压脱溶至5 mL,加入2 mL石油醚,于冰箱内静置过夜,得到片状晶体(2a~2g) (图1)。
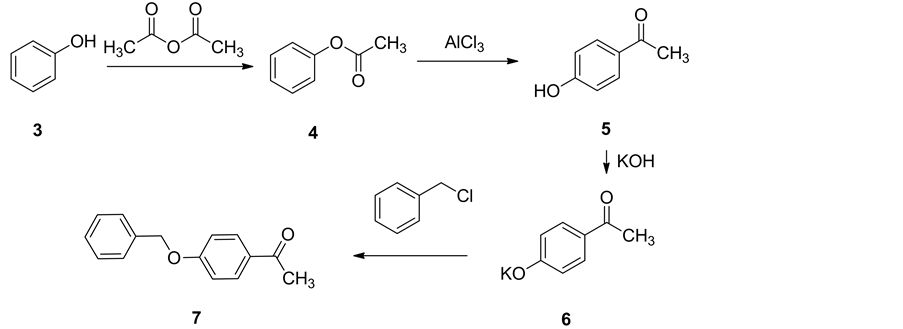
2.3. 乙酸苯酯(4)的制备
在烘干的装有回流冷凝器的单口烧瓶中依次加人苯酚3 (40 g, 0.425 mo1),乙酐(48 g, 0.47 mol),小心混台,缓慢加热至沸腾。回流3 h后冷却至室温。分出有机相,蒸馏水洗至近中性,无水硫酸钠干燥后常压蒸馏收集190℃~196℃馏分得无色透明液体乙酸苯酯4 (图2)。
2.4. 对羟基苯乙酮(5)的制备
参照文献 [8] 方法装有电动搅拌器、温度计和加料漏斗的三口烧瓶中加人乙酸苯醋4 (10 g, 0.073 mol),剧烈搅拌下分数次缓慢加人无水三氯化铝(12 g, 0.090 mol),加完后开始升温至反应温度反应3 h,停止加热,搅拌下加入适量的蒸馏水分解多余的无水三氯化铝。将反应液倾人敞开的容器中,冷却至室温析出棕黄色针状结晶,过滤得对羟基苯乙酮5粗品。m.p. 108℃~109℃ (图2)。

Scheme 1. Preparation of w-bromo aryl-ethanone (2a~2g)
图1. w-溴代芳基乙酮(2a~2g)的制备
Scheme 2. Synthesis of benzyloxy acetophenone (7)
图2. 对苄氧基苯乙酮(7)的合成
2.5. 对羟基苯乙酮的钾盐(6)的制备
在室温搅拌条件下,向氢氧化钾的乙醇溶液(5.4 g, 72 mL),加入对羟基苯乙酮(10 g)。继续搅拌1 h,反应结束后,旋干蒸去溶液,然后加入乙醚(40 mL),抽虑,用乙醚洗,干燥,得到对羟基苯乙酮的钾盐6粗饼(11 g) (图2)。
2.6. 对苄氧基苯乙酮(7)的合成
将10 g对羟基苯乙酮的钾盐7的DMF (20 mL)溶液中加入8.7 mL氯苄,在80℃~90℃左右,通氮气回流18 h,用TLC跟踪反应。反应完毕后,加入正己烷,等粗产品生成,抽虑,然后正己烷洗涤,干燥,用乙醇重结晶(图2)。
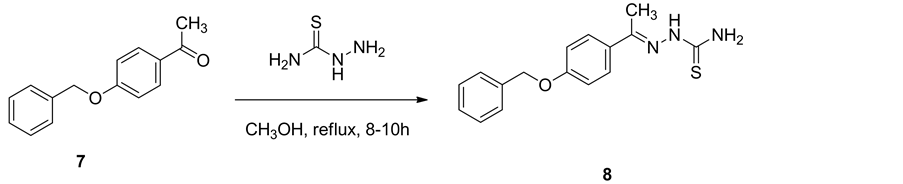
2.7. 对苄氧基苯乙酮缩氨基硫脲(8)的合成
将0.0088 mol对苄氧基苯乙酮2和氨基硫脲(0.0088 mol)溶于20 mL甲醇中,搅拌下加入几滴冰醋酸,回流8~10 h,冷却至室温,放置析晶,抽滤,用乙醇重结晶,得到对苄氧基苯乙酮缩氨基硫脲8 (图3)。
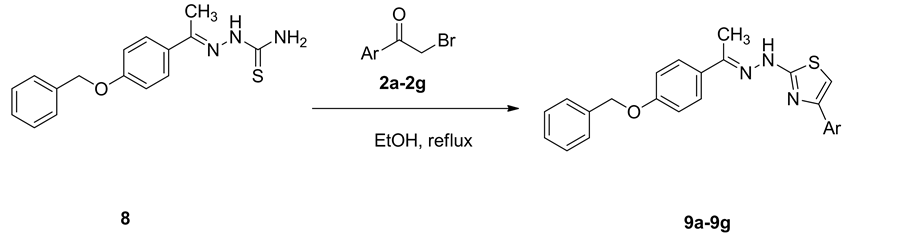
2.8. N-(4-芳基噻唑-2-基)-对苄氧基苯乙酮腙(9a-9g)的合成
将2 mmol对苄氧基苯乙酮缩氨基硫脲8溶于20 mL无水乙醇醇中,等反应开始回流,加入2 mmol ω-溴代苯乙酮(2a~2g),继续回流2 h。冷却至室温,放置析出晶体,抽滤,用DMF-乙醇重结晶(图4)。
9a: 黄色晶体, 产率68%, m.p. 226℃~228℃; 1H NMR (CDC13, 400 MHz) δ: 12.23 (s, 1H, NH), 6.90~7.95 (m, 14H, ph-H), 7.07 (s, 1H, thiazole-H), 5.17 (s, 2H, CH2O), 2.31 (s, 3H, CH3); IR(KBr) ν: 3283 (NH), 3092, 2910 (C-H); 1600, 1594 (C=C, C=N); 838 (C6H4) cm−1; (+)ESI-MS m/z (%): 422 (M+Na, 100),
Scheme 3. Synthesis of benzyloxy acetophenone thiosemicarbazone (8)
图3. 对苄氧基苯乙酮缩氨基硫脲(8)的合成
Scheme 4. Synthesis of hydrazone derivatives of N-(4-aryl-thiazol-2-yl)-benzyloxy-acetophenone (9a~9g)
图4. N-(4-芳基噻唑-2-基)-对苄氧基苯乙酮腙(9a~9g)的合成
400 (M+1, 75), 136 (23). Ana1. calcd for C24H21N3OS: C 72.15, H 5.3, N 10.52; found C 72.25, H 5.34, N 10.58.
9b: 土黄色晶体, 产率84%, m.p. 256℃~258℃; 1H NMR (CDC13, 400 MHz) δ: 11.49 (s, 1H, NH), 6.95~7.85 (m, 13H, ph-H), 7.06 (s, 1H, thiazole-H), 5.15 (s, 2H, CH2O), 3.08 (s, 3H, CH3O), 2.27 (s, 3H, CH3); IR(KBr) ν: 3293 (NH), 3112, 2990 (C-H); 1640, 1614 (C=C, C=N); 832 (C6H4) cm−1; (+)ESI-MS m/z (%): 452 (M+Na, 100), 430 (M+1, 18), 136 (18). Ana1. calcd for C25H23N3O2S: C 69.91, H 5.4, N 9.78; found C 69.96, H 5.47, N 9.83.
9c: 土黄色晶体, 产率72%, m.p. 238℃~241℃; 1H NMR (CDC13, 400 MHz) δ: 11.67 (s, 1H, NH), 7.06~7.77 (m, 13H, ph-H), 7.2 (s, 1H, thiazole-H), 5.13 (s, 2H, CH2O), 2.49 (s, 3H, CH3), 2.26 (s, 3H, CH3); IR(KBr) ν: 3311 (NH), 3182,2960 (C-H); 1656, 1590 (C=C, C=N); 828 (C6H4) cm−1; (+)ESI-MS m/z (%): 436 (M+Na, 100), 414 (M+1, 68), 136 (17). Ana1. calcd for C25H23N3OS: C 72.61, H 5.61, N 10.16; found C 72.64, H 5.65, N 10.19.
9d: 土黄色晶体, 产率62%, m.p. 250℃~254.5℃; 1H NMR (CDC13, 400 MHz) δ: 11.23 (s, 1H, NH), 7.06~7.90 (m, 13H, ph-H), 7.06 (s, 1H, thiazole-H), 5.15 (s, 2H, CH2O), 2.82 (s, 3H, CH3); IR(KBr) ν: 3280 (NH), 3097,2919 (C-H); 1648, 1597 (C=C, C=N); 842 (C6H4) cm−1; (+)ESI-MS m/z (%): 456 (M+Na, 40), 434 (M+1, 55), 378 (100). Ana1. calcd for C24H20ClN3OS: C 66.43, H 4.65, N 9.68; found C 66.46, H 4.67, N 9.71.
9e: 淡红色晶体, 产率42%, m.p. 284℃~289℃; 1H NMR (CDC13, 400 MHz) δ: 12.56 (s, 1H, NH),7.06~8.35 (m, 13H, ph-H), 7.07 (s, 1H, thiazole-H), 5.15 (s, 2H, CH2O), 2.29 (s, 3H, CH3); IR(KBr) ν: 3317 (NH), 3125,2967 (C-H); 1618, 1589 (C=C, C=N); 837 (C6H4) cm−1; (+)ESI-MS m/z (%): 367 (M+Na, 100), 345 (M+1, 28), 136 (12). Ana1. calcd for C24H20N4O3S: C 64.85, H 4.54, N 12.60; found C 64.87, H 4.56, N 12.65.
9f: 米色晶体, 产率58%, m.p. 246℃~251℃; 1H NMR (CDC13, 400 MHz) δ: 11.89 (s, 1H, NH), 7.04~8.84 (m, 13H, ph-H), 7.05 (s, 1H, thiazole-H), 5.17 (s, 2H, CH2O), 2.3 (s, 3H, CH3); IR(KBr) ν: 3284 (NH), 3095,2917 (C-H); 1609, 1598 (C=C, C=N); 834 (C6H4) cm−1; (+)ESI-MS m/z (%): 378 (M+Na, 100), 500 (M+1, 18), 274 (45), 136 (20). Ana1. calcd for C24H21N3O: C 60.26, H 4.21, N 8.78; found C 60.29, H 4.25, N 8.80.
9g: 土黄色晶体, 产率42%, m.p. 233℃~236℃; 1H NMR (CDC13, 400 MHz) δ: 11.78 (s, 1H, NH),7.07~8.35 (m, 13H, ph-H), 7.07 (s, 1H, thiazole-H), 5.15 (s, 2H, CH2O), 2.3 (s, 3H, CH3); IR(KBr) ν: 3292 (NH), 3096,2913 (C-H); 1627, 1587 (C=C, C=N); 827 (C6H4) cm−1; (+)ESI-MS m/z (%): 472 (M+Na, 12), 450 (M+1, 100), 136 (8). Ana1. calcd for C28H23N3OS: C 74.81, H 5.16, N 9.35; found C 74.83, H 5.19, N 9.38.
3. 结果与讨论
以苯酚(3)为原料,与乙酐进行反应得到乙酸苯酯(4),然后通过Fries-crafts重排反应制备对羟基苯乙酮(5),对羟基苯乙酮进一步与氢氧化钾进行反应得到对羟基苯乙酮的钾盐(6),对羟基苯乙酮的钾盐与氯苄在氮气保护条件下进行反应得到对苄氧基苯乙酮(7)。对苄氧基苯乙酮和氨基硫脲反应合成对苄氧基苯乙酮缩氨基硫脲(8)。最终,对苄氧基苯乙酮缩氨基硫脲和7种不同的ω-溴代芳基乙酮反应合成7种N-(4-芳基噻唑-2-基)-对苄氧基苯乙酮腙(9a~9g)。目标产物的合成条件温和且时间较短,所得化合物的产率较高,一般均在60%以上。产物结构经MS、1H NMR、IR和元素分析确证。
4. 结论
本文对苄氧基苯乙酮缩氨基硫脲和7种不同的ω-溴代芳基乙酮反应合成了一系列N-(4-芳基噻唑-2-基)-对苄氧基苯乙酮腙类化合物。该方法操作简便,经济环保,符合绿色合成化学的要求。
致谢
新疆教育部研究生科研创新项目基金(No. XJGRI2014019)。
文章引用
麦麦提艾力•奥布力,再乃普古丽•伊斯马伊力,马夏冰. N-(4-芳基噻唑-2-基)-对苄氧基苯乙酮腙的合成
Synthesis of Hydrazone Derivatives of N-(4- aryl-thiazol-2-yl)-Benzyloxy-Acetophenone[J]. 有机化学研究, 2016, 04(02): 56-60. http://dx.doi.org/10.12677/JOCR.2016.42008
参考文献 (References)
- 1. 袁开基, 夏鹏编. 有机杂环化学[M]. 北京: 人民教育出版社, 1984: 1-2.
- 2. Beccalli, E.M., Gelmi, M.L. and Marchesini, A. (1998) Trisubstituted Isoxazoles from 3,4-Disubstituted-(2H)-isox- azol-5-ones. Tetrahedron, 54, 14401-14406. http://dx.doi.org/10.1016/S0040-4020(98)00891-6
- 3. Kizhner, N. (1913) Decomposition of Pyrazoline Bases Convertion of Cinnamic Aldehydeinto Phenyl-Cyclopropane. Physical Chemistry Society, 45, 949-957.
- 4. 马骥. 1,5-二芳基-3-羟基吡唑的合成及生物活性研究[D]: [硕士学位论文]. 南京: 南京工业大学, 2004.
- 5. Saikia, A., Barthakur, M.G., Borthakur, M., Saikia, C.J., Bora, U. andBoruah, R.C. (2006) Conjugate Base Catalysed One-Pot Synthesis of Pyrazoles from β-Formyl Enamides. Tetrahedron Letters, 47, 43-46. http://dx.doi.org/10.1016/j.tetlet.2005.10.145
- 6. 田官荣, 房立真, 吴明根, 朴仁哲, 金炳武. 稻田除草剂吡唑特的合成和除草效果[J]. 农药, 2005, 44(5): 205-207.
- 7. 乔仁忠, 张自义, 赵玉芬. 3-氨基-6/8-取代-1H-吡唑[4,3-C]喹啉类化合物的合成[J]. 高等学校化学学报, 2005, 26(2): 250-253.
- 8. 鲍继明, 戴淑昌. 对羟基苯乙酮的合成[J]. 合成化学, 2002, 10(3): 281-282.
*通讯作者。