Journal of Organic Chemistry Research
Vol.
12
No.
01
(
2024
), Article ID:
83448
,
14
pages
10.12677/jocr.2024.121005
合成OCF3化合物的研究进展
梁燕
浙江师范大学,化学与材料科学学院,浙江 金华
收稿日期:2023年12月17日;录用日期:2024年3月20日;发布日期:2024年3月28日

摘要
在以生命科学为研究重点的相关领域中,氟的受欢迎程度仅次于氮杂原子。因为氟是电负性最强的元素,在当今的医药、农业化学和材料科学中起着关键作用。而三氟甲氧基(OCF3)是一种关键的氟化结构,具有独特的物理化学特性。将OCF3基团引入有机分子中,对于设计和开发生物活性化合物具有重要价值。本篇综述主要讲关于合成三氟甲氧基化合物的一些令人印象深刻的策略。
关键词
三氟氧甲氧基化,三氟氧甲氧化物的合成方法,含氟药物分子

Research Progress in the Synthesis of OCF3 Compounds
Yan Liang
College of Chemistry and Materials Science, Zhejiang Normal University, Jinhua Zhejiang
Received: Dec. 17th, 2023; accepted: Mar. 20th, 2024; published: Mar. 28th, 2024

ABSTRACT
In related fields with a focus on life sciences, fluorine is second only to nitrogen heteroatoms in popularity. Because fluorine is the most electronegative element, it plays a crucial role in today's medicine, agricultural chemistry, and materials science. And trifluoromethoxy (OCF3) is a key fluorinated structure with unique physical and chemical properties. Introducing OCF3 groups into organic molecules is of great value for the design and development of bioactive compounds. This review mainly discusses some impressive strategies for synthesizing trifluoromethoxy compounds.
Keywords:Trifluoromethoxylation, Synthetic Methods Trifluoromethoxide, Fluorinated Drug Molecules

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
引入含氟官能团以微调候选药物的物化性质是药物发现和开发过程中的重要目的。在含氟取代基中,三氟甲氧基(OCF3)已成为药物领域中越来越常见的一个结构单元 [1] [2] [3] ,因为它的引入对有机分子的稳定性、亲油性和膜渗透性产生了深远的影响 [4] 。由于其特殊的物化性质,三氟甲氧基在药物分子、天然产物、农药和有机材料领域发挥着极其重要的作用 [5] [6] [7] 。比如心脏保护Celikalim是一种特定的降压药,他莫西芬的衍生物被开发为钙激活的K+通道开放剂,以及利鲁唑(抗惊厥药)、Triflumuron (杀虫剂)、Flurprimidol (植物生长调节剂)和Thifluzamide (杀真菌剂) (图1)。这些生物分子也显示出在某些领域对OCF3基团的热衷程度,同时也公认为它是一个很重要的新兴氟化基团。但与报道的用于合成光学活性的含F和CF3的化合物的方法相比 [8] [9] [10] [11] [12] ,用于制备合成OCF3分子的方法还远远落后 [13] [14] ,这可能归因于OCF3阴离子容易分解的性质 [15] [16] [17] 和有限的OCF3试剂 [18] [19] [20] [21] [22] 。
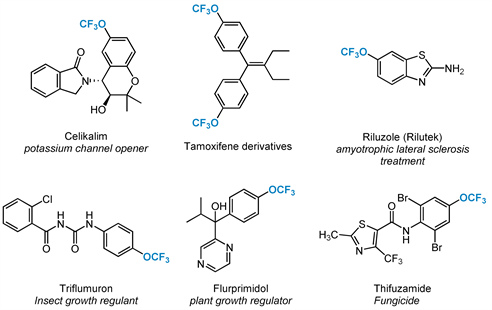
Figure 1. Drugs and agricultural chemicals containing OCF3
图1. 含OCF3的药品和农用化学品
尽管OCF3基团具有良好的特性,在药物、农产品方面有着不可估量的前景。相反,它们的制备通常需要费力的官能团互变、底物预官能化、有毒试剂和苛刻的反应条件 [23] [24] [25] 。此外,许多传统方法还表现出有限的底物范围和官能团耐受性。所以,本篇综述重在论述传统的合成OCF3的方法和近年来合成OCF3化合物的新发展。综述各部分按转化类型分类:1) OCF3基团的重新构造;2) 直接氧三氟甲基化反应;3) 可见光氧化还原催化氧三氟甲基化反应;4) 过渡金属催化氧三氟甲基化反应。
2. OCF3化合物的合成
2.1. OCF3基团的重新构造
在过去的几十年里,OCF3基团的重新构建已经成为合成有机氟化物的一种有效策略。但是,只发展了少数几种转化,其中包括:(a) 三氯前体的Cl-F交换 [26] ;(b) 酚和CCl4的一步转化 [27] ;(c) O-芳基取代的硫代氯甲酸酯氟化 [28] ;(d) 氟甲酸盐的脱氧氟化 [29] ;(e),(f) 氧化氟化脱硫 [30] [31] [32] [33] [34] (图2)。
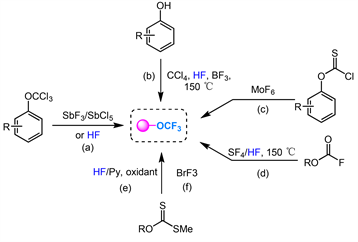
Figure 2. Early synthesis methods for obtaining OCF3 aromatics
图2. 早期获取OCF3芳烃的合成方法
20世纪50年代末,Yagupolskii小组提出了利用氯氟交换策略合成三氟甲氧基的开创性方法,该方法可用于将OCF3片段引入芳香环中(图2(a))。1979年,Feiring报道了用酚、四氯化碳和HF一步合成潜在有用的芳基三氟甲基醚的新方法,但是这种方法底物范围仅限于芳香族底物,并且与其他官能团相容性很差(图2(b))。1973年,Mathey和Bensoam报道了O-芳基取代的硫代氯甲酸酯与MoF6作为氟化剂组装ArOCF3的反应(图2(c))。同年,Sheppard小组开发了一种新的反应,用HF作为催化剂,用气态SF4对氟甲酸进行脱氧氟化。然而,SF4的强腐蚀限制了该方法的进一步发展(图2(d))。2000年左右,研究开始集中在氧化脱硫-氟化反应上(图2(e),图2(f))。该方法构建三氟甲氧基官能团相容性较好,产率较高。并且所用到的BrF3既当氧化剂也作为氟化剂,可以很容易地制备出二硫代碳酸盐。虽然其中一些策略,如氯氟交换,已在工业界大规模使用。但很明显,这些方法所用的试剂都是有毒或者腐蚀性极强的,并且有些需要两步或多步工艺,这大大阻碍了它们的合成应用。
2016年,Hu课题组 [35] 报道了一种从酚类合成芳基三氟甲基醚(ArOCF3)的便利方法(图3),该方法结合O-羧基二氟甲基化和银催化的脱羧,这两步方法利用容易获得的试剂溴二氟乙酸钠和SelectFluor II,操作简单,是一种廉价的合成路线,可以以中等至良好的产率合成有价值的芳基三氟甲基醚。
2019年,Xiao及其同事 [36] 开发了一种重新构造OCF3策略,使用烷基卤或苄基卤,与二苯亚砜、 和AgF反应构建一系列三氟甲氧基衍生物(图4)。提供了直接、多功能的途径获得具有良好官能团相容性和应用价值的三氟甲氧基化合物。

Figure 3. De novo trifluoromethylation of phenols
图3. 苯酚的从头三氟甲基化
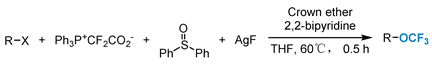
Figure 4. Trifluoromethoxylation of alkyl halides or benzyl halides
图4. 烷基卤化物或苄基卤化物的三氟甲氧基化
2.2. 直接氧三氟甲基化反应
众所周知,重新构造OCF3是一种开创性的策略,但其应用也受限于反应条件苛刻、操作麻烦以及步骤经济效益低等问题。因此,需要探索出温和、简单以及底物适用性强的方法。接下来将讨论近年来直接氧三氟甲基化反应的方法,它们大多用醇或者酚作为底物构建O-CF3键,常用三氟甲基化试剂来引入OCF3基团,比如Togni试剂、TMSCF3和TFMS、TFBO、高价碘亚磺酰亚胺试剂等。这些反应具有良好的官能团相容性,还可以用于天然产物的结构修饰。
2009年,Togni小组 [37] 开发了一种新的方案,以伯醇为底物,使用Togni I和Zn(NTf)2对醇进行亲电三氟甲基化反应(图5)。高价碘试剂作为亲电性CF3转移试剂,Zn(NTf)2 为催化剂。在易于操作的反应条件下可以得到三氟甲氧基烷基醚,从而可以合成有用的有机氟化物骨架。与伯醇的反应中,三氟甲醚的产率可达99%。

Figure 5. Zn(NTf2)2-assisted direct trifluoromethylation of alcohols
图5. Zn(NTf2)2辅助的醇直接三氟甲基化
2015年,Qing课题组 [38] 报道了一种高效且通用的方法(图6)。使用CF3SiMe3作为CF3源和外源氧化剂,通过银介导的交叉偶联反应对未受保护的酚进行直接氧三氟甲基化。这种新颖的方法可以从简单的酚类中获得多种芳基三氟甲基醚。该策略还应用于医学相关药物分子的后期三氟甲基化修饰。
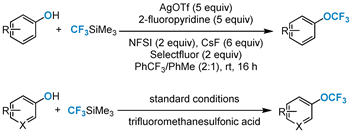
Figure 6. Silver-mediated direct O-trifluoromethylation
图6. 银介导的直接O-三氟甲基化
同年,该小组 [39] 报道了一种高效实用的烷基三氟甲基醚的制备方法(图7)。在温和的反应条件下,建立了银介导的伯醇、仲醇和叔醇与TMSCF3的氧化O-三氟甲基化反应,以中等至良好的产率提供了有价值的结构单元,并具有优异的官能团相容性,为广泛的烷基三氟甲基醚提供了一种新的方法。
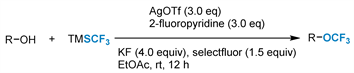
Figure 7. Silver-mediated trifluoromethylation of aliphatic alcohols
图7. 银介导的脂肪醇三氟甲基化
2016年,Wu课题组 [40] 利用羟基化N-杂环和Togni试剂一步合成N-杂芳三氟甲氧基衍生物的方法(图8)。该方法能够合成含有一个或两个杂原子的五元或六元三氟甲氧基化合物。该策略反应条件温和,避免金属或有毒试剂,与多种官能团兼容。机理是2-羟基吡啶与Togni II进行质子交换后,形成新的离子对A。然后单电子转移(SET)提供自由基B和C,它们在重组后形成O-CF3键。该反应虽然受到底物的限制,但是在不使用金属或苛刻条件的情况下获得了含OCF3的N-杂环。

Figure 8. Synthesis of N-heterocycles containing OCF3
图8. 含OCF3的N-杂环的合成
2018年,Tang及其合作者 [41] 报告了第一个在温和反应条件下以三氟甲基芳基磺酸酯(TFMS)作为三氟甲氧基化试剂对醇进行直接脱羟基三氟甲氧基化的例子。该方法能够将各种伯醇和仲醇转化为相应的三氟甲氧基化产物,并耐受多种官能团。由于该反应的高效性和实用性,该方法将在医药和农药领域的烷基三氟甲基醚的制备中得到广泛的应用(图9)。
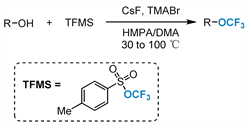
Figure 9. Synthesis of N-heterocycles containing OCF3
图9. 含OCF3的N-杂环的合成
2020年,该课题组 [42] 报道的无银烷基卤化物的亲核三氟甲氧基化,他们开发了一种新的三氟甲氧基化试剂氧三氟甲基苯甲醛肟(TFBO)。在温和的反应条件且不用银的情况下,用TFBO对烷基卤化物进行实用的亲核三氟甲氧基化(图10)。三氟甲氧基化试剂TFBO制备简单,热稳定,并且可以在碱存在下释放CF3O−阴离子。

Figure 10. The method for nucleophilic trifluoromethoxylation of alkyl halides
图10. 卤化烷基的亲核三氟甲氧基化方法
2021年,Togni课题组 [43] 开发了脂肪醇的直接三氟甲基化反应,使用新开发的高价碘亚磺酰亚胺试剂,在催化量的Zn(NTF2)2存在下,以中等至良好的收率(14%~72%)提供相应的三氟甲基醚(图11)。该方案具有良好的官能团耐受性,底物包括伯醇、仲醇甚至叔醇,而且可以获得很多有价值的生物相关的药物分子。
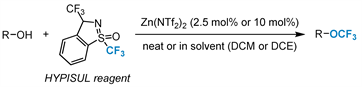
Figure 11. Trifluoromethylation reaction of aliphatic alcohols
图11. 脂肪醇的三氟甲基化反应
2.3. 可见光氧化还原催化氧三氟甲基化反应
在过去的几十年里,可见光光氧化还原催化已经成为一种重要的合成工具 [44] [45] [46] [47] ,已开发大量的构造C-C和C-X键的反应。这些光氧化催化的转化通过温和的反应条件下产生自由基中间体进行,与涉及单电子转移(SET)过程的传统化学方法相比,光催化策略不需要自由基引发剂和强氧化剂或还原剂。近年来,已经报道了几种基于光氧化还原催化形成三氟甲氧基化化合物的方法。
2018年,Togni小组 [48] 报道了新开发的N-O吡啶鎓试剂III光催化(杂)芳烃三氟甲氧基化的研究成果(图12)。在350 W蓝光led照射下,广泛的芳烃和杂芳烃的三氟甲氧基化率达到21%~66%。同样,该反应可耐受一系列常见的官能团,如卤化物、醛、酮、酯、苯基和亚胺。该策略可以提供后期合成多样化的途径,并在获得具有区域选择性的三氟甲基芳醚方面发挥关键作用。
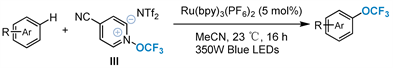
Figure 12. Visible-light photoredox-catalyzed formation of aryl trifluoromethyl ether
图12. 可见光光氧化还原催化形成芳基三氟甲基醚
同年,该课题组 [49] 又报道了一种氧化还原活性阳离子试剂I的设计和开发,该试剂能够以可控、有选择性和催化的方式在可见光催化条件下形成OCF3自由基(图13)。更重要的是,该试剂可以催化多种(杂)芳烃和生物相关化合物进行分子间C-H三氟甲氧基化。该方法适用于含有官能团的简单芳烃,包括卤化物、羧酸、酮、酯、醚、腈、碳酸盐和氧化膦。此外,含有苯基基团的底物以及杂芳烃,如吡啶、嘧啶和噻吩,都具有良好的耐受性。

Figure 13. Selective trifluoromethoxylation of (hetero)arenes
图13. (杂)芳烃的选择性三氟甲氧基化
2018年,Tang等人 [50] 开发了一种新型的Ag和可见光介导的光氧化还原双催化体系,并将其应用于三氟甲基芳基磺酸盐(TFMS)和Zdankin试剂对苯乙烯的叠氮三氟甲氧基化反应中(图14)。这种新方法利用可见光光氧化还原催化在温和的条件下生成叠氮自由基,并将其与银催化的三氟甲氧基化反应相结合。该方法对官能团的容忍度很广,适用于复杂小分子的后期叠氮三氟甲氧基化反应。此外,它还是第一个将有机金属和光氧化还原催化相结合来实现三氟甲氧基化反应的例子,这可能会导致未来开发一系列新型的双催化新的三氟甲氧基化反应。
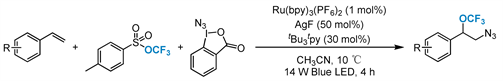
Figure 14. Visible-light-mediated azidotrifluoromethoxylation of styrenes
图14. 可见光介导的苯乙烯的叠氮三氟甲氧基化反应
2019年,该课题组 [51] 报告以三氟甲基芳基磺酸盐(TFMS)为三氟甲氧基化试剂,光氧化还原催化和铜促进芳基重氮四氟硼酸盐三氟甲氧基化反应的进展(图15)。该方法利用可见光光氧化还原催化在温和条件下生成芳基自由基,并结合铜促进选择性三氟甲氧基化反应。该反应具有官能团相容性好、区域选择性高、扩张性好等特点。提供了一条合成有价值的三氟甲氧基衍生物的通用、直接的途径。
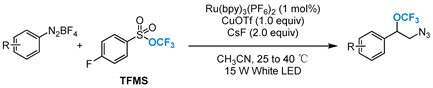
Figure 15. Visible-light photoredox-catalyzed and copper-promoted trifluorom-ethoxylation
图15. 可见光光氧化还原催化和铜促进的三氟甲氧基化
2021年,Togni小组 [52] 首次报道了光驱动酮的α-三氟甲氧基化方法(图16)。烯醇式碳酸酯与N-三氟甲氧基-4-氰基吡啶在光氧化还原催化剂4-CzIPN的作用下,在456 nm的光源下反应,得到分离产率 ≤ 50%的α-三氟甲酰基酮,具有完全的化学选择性。

Figure 16. Light-driven assembly of trifluoromethoxy ketones
图16. 三氟甲氧基酮的光驱动组装
同2021年,Hopkinson小组 [53] 介绍了双(三氟甲基)过氧化物(BTMP, CF3OOCF3)作为一种实用、高效的三氟甲氧基化试剂,易于从廉价的化学品中获得。该方案采用[Ru(bpy)3](PF6)2作为光氧化还原催化剂,在温和的条件下以中等至高收率提供了有价值的三氟甲氧基化芳烃(图17)。

Figure 17. Visible-light-induced trifluoromethoxylation of arenes with BTMP
图17. 可见光诱导芳烃与BTMP的三氟甲氧基化反应
2.4. 过渡金属催化氧三氟甲基化反应
可见光诱导的一些三氟甲氧基化反应由于产生的自由基活性高,其化学选择性和区域选择性较差。而过渡金属催化的串联反应用途广泛,在芳香和脂肪族化合物中三氟甲氧基化的选择性表现良好 [54] [55] [56] [57] 。近几十年来,Liu、Qin、Zhang、Tang等人在芳烃、杂芳烃、烯烃等的直接三氟甲氧基化方面做出了巨大贡献。
2015年,Liu和他的同事 [58] 首次实现了未活化烯烃的三氟甲氧基化反应(图18),其中Pd(CH3CN)2Cl2为催化剂,AgOCF3为三氟甲氧基源,Selectflu-BF4为氧化剂。这种钯催化的分子内氨基三氟甲氧基化方案,具有优异的区域选择性和部分非对映选择性,导致了带有三氟甲氧基取代基的哌啶的组装。
2016年,Qin和Zhang的小组 [59] 报道了α-重氮酯衍生物的亲核三氟甲氧基化反应(图19)。烷基α-重氮芳基乙酸酯与AgOCF3或CF3SO2OCF3/AgF在约30℃~108℃、N2气氛下反应得到α-三氟甲氧基芳基乙酸酯,收率高达90%,各种带有取代苯环或杂芳基的α-重氮羰基化合物已被成功使用。而烷基α-重氮乙烯基乙酸酯提供相应的γ-三氟甲氧基α,β-不饱和酯,产率高达94%。关于反应机理,首先,CF3SO2OCF3与AgF原位反应形成离子AgOCF3。然后Ag+阳离子与a-重氮酯结合,生成关键中间体Ia或Ib。Ia或Ib通过游离的OCF3阴离子进行亲核加成,分别产生银物种IIa或IIb,其在三氟甲氧基化后用水(或湿气)淬灭,得到所需产物。
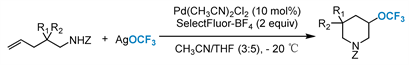
Figure 18. Pd-catalyzed trifluoromethoxylation of unactivated alkenes
图18. 钯催化未活化烯烃的三氟甲氧基化
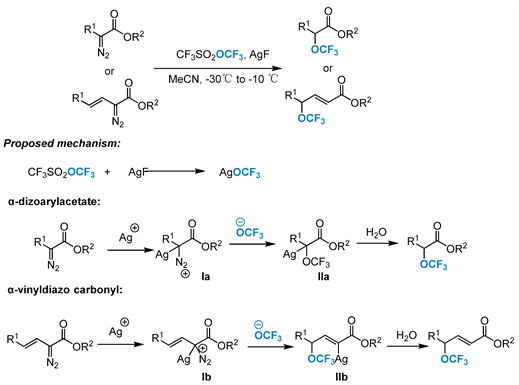
Figure 19. α-Nucleophilic trifluoromethoxy of diazo esters and their mechanism
图19. α-重氮酯的亲核三氟甲氧基化及其机理
2018年Liu课题组 [60] 开发了一种新型钯催化未活化烯烃的分子间二三氟甲氧基化反应,以新型亲电试剂SelectfluorCN为强氧化剂,AgOCF3为三氟甲氧基源(图20)。该反应本身具有官能团耐受性高、底物范围广、反应条件温和的特点。初步机理研究表明,分子间反应可能是由具有强路易斯酸性的高价Pd(IV)催化剂引发的,该催化剂使得分子间顺式三氟甲氧基化(FOP)过程在非常温和的条件下进行,避免了三氟甲氧基氧化物的分解。
2018,Tang小组 [61] 首次报道了银促进的氧化苄基C-H三氟甲氧基化反应。以AgOTf为催化剂,1,10-菲咯啉-5,6-二酮为配体,TFMS为三氟甲氧基化试剂,在温和的反应条件下,具有不同官能团的各种芳烃的苄基C-H键发生三氟甲氧基化,形成三氟甲基醚(图21)。此外,还实现了富电子芳烃的三氟甲氧基化和甲基氟化,一步合成了α-氟苄基三氟甲醚。该方法适用于克级合成,从而证明了该反应的潜在实用性。
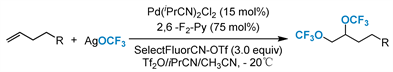
Figure 20. Pd-catalyzed intermolecular ditrifluoromethoxylation of alkenes
图20. Pd催化烯烃分子间双三氟甲氧基化反应
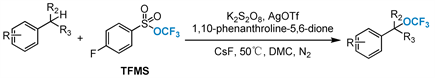
Figure 21. Silver-promoted oxidative benzylic C-H trifluoromethoxylation
图21. 银促进的氧化苄基C-H三氟甲氧基化反应
同年,该小组 [62] 在钴催化剂的基础上,开发了TFMS的亲核三氟甲氧基化催化环氧化物开环反应(图22)。该反应为在温和条件下直接构建一系列邻位三氟甲氧基醇供了一种有效、简单的途径。此外,该方法可以将末端环氧化物转化为具有良好化学选择性和区域选择性的目标产物。
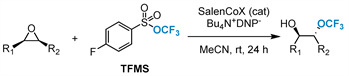
Figure 22. Cobalt-catalyzed trifluoromethoxylation of epoxides
图22. 钴催化的环氧化物三氟甲氧基化反应
2020年,Tang及其合作者 [63] 首次探索了在NIS存在下,采用AgF作为催化剂,TFMS为三氟甲氧基化试剂,建立了烯烃的分子间碘三氟甲氧基化反应(图23)。良好的官能团耐受性和可扩展性使得该反应成为合成三氟甲氧基化碘化物有效方案。末端烯烃是适用性很广的底物,并以中等至良好的收率提供相应的对映异构体或非对映异构体。
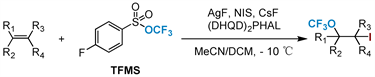
Figure 23. Intermolecular iodotrifluoromethoxylation of alkenes
图23. 烯烃的分子间碘三氟甲氧基化
2021年,Tang课题组 [64] 开发了银催化的末端炔烃二溴三氟甲氧基化反应,在温和的反应条件下以良好的收率和高区域选择性提供了相应的1,1-二溴-2(三氟甲氧基)烯烃(图24)。该反应具有广泛的底物范围,适用于复杂小分子的最新三氟甲氧基化。此外,产物还可以进行进一步修饰,为含OCF3基团化合物的合成提供了便捷的方法。
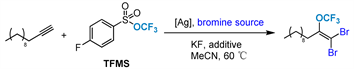
Figure 24. Silver-catalyzed dibromotrifluoromethoxylation of terminal alkynes
图24. 银催化末端炔烃的二溴三氟甲氧基化
2022年,该课题组 [65] 报告了银催化的对甲苯磺酰氮杂环丙烷与TFMS的三氟甲氧基化反应(图25)。该方法具有条件温和、操作简单、化学选择性和区域选择性好等特点。此外,三取代氮杂环丙烷的三氟甲氧基化还可以构建C-OCF3四元中心,这是非常罕见的策略。这种方法揭示了一种合成β-三氟甲氧基胺的新途径,具有良好的化学选择性和区域选择性。
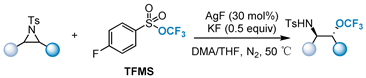
Figure 25. Silver-catalyzed trifluoromethoxylation of N-tosyl aziridines
图25. 银催化的对甲苯磺酰氮杂环丙烷的三氟甲氧基化反应
3. 结论
随着过去几年氟化学的重大发展,毫无疑问,含氟药物、农用化学品、功能材料和生物活性化合物越来越受到关注,OCF3基团变得比以往任何时候都更令人着迷,与其他氟化基团相一致,三氟甲氧基早已为人所知。尽管文章提到了一些新策略来合成OCF3化合物,但它仍处于起步阶段,因为迄今为止尚未报道通用方法进行三氟甲氧基化。此外,缺乏安全、实用且易于获得的试剂仍然阻碍了高效的合成策略的开发。探索新的原始试剂以及新的化学转化这个目标将继续激发化学家的创造力,以提供直接获取含有OCF3的分子的方法,所以对于三氟甲氧基的探索还有很长的路要走。
文章引用
梁 燕. 合成OCF3化合物的研究进展
Research Progress in the Synthesis of OCF3 Compounds[J]. 有机化学研究, 2024, 12(01): 60-73. https://doi.org/10.12677/jocr.2024.121005
参考文献
- 1. Purser, S., Moore, P.R., Swallow, S. and Gouverneur, V. (2008) Fluorine in Medicinal Chemistry. Chemical Society Reviews, 37, 320-330. https://doi.org/10.1039/B610213C
- 2. Ojima, I. (2009) Fluorine in Medicinal Chemistry and Chemical Biology. Blackwell Publishing Ltd., Hoboken. https://doi.org/10.1002/9781444312096
- 3. Liang, T., Neumann, C.N. and Ritter, T. (2013) Introduction of Fluorine and Fluorine-Containing Functional Groups. Angewandte Chemie International Edition, 52, 8214-8264. https://doi.org/10.1002/anie.201206566
- 4. Müller, K., Faeh, C., & Diederich, F. (2007) Fluorine in Pharmaceuticals: Looking beyond Intuition. Science, 317, 1881-1886. https://doi.org/10.1126/science.1131943
- 5. Jiang, X. and Tang, P. (2021) Recent Advances of Trifluoromethoxylation Reactions Using TFMS and TFBO. Chinese Journal of Chemistry, 39, 255-264. https://doi.org/10.1002/cjoc.202000465
- 6. Wang, Q., Yu, X., Jin, J., Wu, Y. and Liang, Y. (2018) Difunctionalization of Alkynes: Synthesis of Novel Fluoropolymer Materials. Chinese Journal of Chemistry, 36, 223-226. https://doi.org/10.1002/cjoc.201700630
- 7. Mamada, M., Shima, H., Yoneda, Y., Shimano, T., Yamada, N., Kakita, K. and Tokito, S. (2015) A Unique Solution-Processable N-Type Semiconductor Material Design for High-Performance Organic Field-Effect Transistors. Chemistry of Materials, 27, 141-147. https://doi.org/10.1021/cm503579m
- 8. Ma, J.A. and Cahard, D. (2004) Asymmetric Fluorination, Trifluoromethylation, and Perfluoroalkylation Reactions. Chemical Reviews, 104, 6119-6146. https://doi.org/10.1021/cr030143e
- 9. Ma, J.A. and Cahard, D. (2008) Update 1 of: Asymmetric Fluorination, Trifluoromethylation, and Perfluoroalkylation Reactions. Chemical Reviews, 108, PR1-PR43. https://doi.org/10.1021/cr800221v
- 10. Alonso, C., MartÍnez De Marigorta, E., Rubiales, G. and Palacios, F. (2015) Carbon Trifluoromethylation Reactions of Hydrocarbon Derivatives and Heteroarenes. Chemical Reviews, 115, 1847-1935. https://doi.org/10.1021/cr500368h
- 11. Yang, X., Wu, T., Phipps, R.J. and Toste, F.D. (2015) Advances in Catalytic Enantioselective Fluorination, Mono-, Di-, and Trifluoromethylation, and Trifluoromethylthiolation Reactions. Chemical Reviews, 115, 826-870. https://doi.org/10.1021/cr500277b
- 12. Chen, C., Fu, L., Chen, P. and Liu, G. (2017) Recent Advances and Perspectives of Transition Metal-Catalyzed Asymmetric Fluorination Reactions. Chinese Journal of Chemistry, 35, 1781-1788. https://doi.org/10.1002/cjoc.201700489
- 13. Huang, W., Wan, X. and Shen, Q. (2017) Enantioselective Construction of Trifluoromethoxylated Stereogenic Centers by a Nickel-Catalyzed Asymmetric Suzuki—Miyaura Coupling of Secondary Benzyl Bromides. Angewandte Chemie International Edition, 56, 11986-11989. https://doi.org/10.1002/anie.201706868
- 14. Kondo, H., Maeno, M., Hirano, K. and Shibata, N. (2018) Asymmetric Synthesis of α-Trifluoromethoxy Ketones with a Tetrasubstituted α-Stereogenic Centre via the Palladium-Catalyzed Decarboxylative Allylic Alkylation of Allyl Enol Carbonates. Chemical Communications, 54, 5522-5525. https://doi.org/10.1039/C8CC03131B
- 15. Huang, C., Liang, T., Harada, S., Lee, E. and Ritter, T. (2011) Silver-Mediated Trifluoromethoxylation of Aryl Stannanes and Arylboronic Acids. Journal of the American Chemical Society, 133, 13308-13310. https://doi.org/10.1021/ja204861a
- 16. Zhang, C.P. and Vicic, D.A. (2012) Oxygen-Bound Trifluoromethoxide Complexes of Copper and Gold. Organometallics, 31, 7812-7815. https://doi.org/10.1021/om3002747
- 17. Chen, S., Huang, Y., Fang, X., Li, H., Zhang, Z., Hor, T.S.A. and Weng, Z. (2015) Aryl-BIAN-Ligated Silver(I) Trifluoromethoxide Complex. Dalton Transactions, 44, 19682-19686. https://doi.org/10.1039/C5DT02078F
- 18. Besset, T., Jubault, P., Pannecoucke, X. and Poisson, T. (2016) New Entries toward the Synthesis of OCF3-Containing Molecules. Organic Chemistry Frontiers, 3, 1004-1010. https://doi.org/10.1039/C6QO00164E
- 19. Hojczyk, K.N., Feng, P., Zhan, C. and Ngai, M.Y. (2014) Trifluoromethoxylation of Arenes: Synthesis of Ortho-Trifluoromethoxylated Aniline Derivatives by OCF3 Migration. Angewandte Chemie International Edition, 53, 14559-14563. https://doi.org/10.1002/anie.201409375
- 20. Zhou, M., Ni, C., Zeng, Y. and Hu, J. (2018) Trifluoromethyl Benzoate: A Versatile Trifluoromethoxylation Reagent. Journal of the American Chemical Society, 140, 6801-6805. https://doi.org/10.1021/jacs.8b04000
- 21. Zheng, W., Morales-Rivera, C.A., Lee, J.W., Liu, P. and Ngai, M.Y. (2018) Catalytic C—H Trifluoromethoxylation of Arenes and Heteroarenes. Angewandte Chemie International Edition, 57, 9645-9649. https://doi.org/10.1002/anie.201800598
- 22. Jelier, B.J., Tripet, P.F., Pietrasiak, E., Franzoni, I., Jeschke, G. and Togni, A. (2018) Radical Trifluoromethoxylation of Arenes Triggered by a Visible-Light-Mediated N—O Bond Redox Fragmentation. Angewandte Chemie International Edition, 57, 13784-13789. https://doi.org/10.1002/anie.201806296
- 23. Leroux, F.R., Manteau, B., Vors, J.P. and Pazenok, S. (2008) Trifluoromethyl Ethers—Synthesis and Properties of an Unusual Substituent. Beilstein Journal of Organic Chemistry, 4, Article 13. https://doi.org/10.3762/bjoc.4.13
- 24. Lee, K.N., Lee, J.W. and Ngai, M.Y. (2016) Synthesis of Trifluoromethoxylated (Hetero)Arenes via OCF3 Migration. Synlett, 27, 313-319. https://doi.org/10.1055/s-0035-1560516
- 25. Tlili, A., Toulgoat, F. and Billard, T. (2016) Synthetic Approaches to Trifluoromethoxy-Substituted Compounds. Angewandte Chemie International Edition, 55, 11726-11735. https://doi.org/10.1002/anie.201603697
- 26. Yagupolskii, L.M. (1987) Aromatic Compounds with New Fluorine-Containing Substituents. Journal of Fluorine Chemistry, 36, 1-28. https://doi.org/10.1016/S0022-1139(00)82050-3
- 27. Feiring, A.E. (1979) Chemistry in Hydrogen Fluoride. 7. A Novel Synthesis of Aryl Trifluoromethyl Ethers. The Journal of Organic Chemistry, 44, 2907-2910. https://doi.org/10.1021/jo01330a017
- 28. Mathey, F. ad Bensoam, J. (1973) Reaction De MoF6 Avec Chlorothioformiates D’aryle Nouvelle Synthese Des Aryl Trifluoromethylethers ArOCF3. Tetrahedron Letters, 14, 2253-2256. https://doi.org/10.1016/S0040-4039(01)87608-5
- 29. Sheppard, W.A. (1964) α-Fluorinated Ethers. I. Aryl Fluoroalkyl Ethers1. The Journal of Organic Chemistry, 29, 1-11. https://doi.org/10.1021/jo01024a001
- 30. Kuroboshi, M., Suzuki, K. and Hiyama, T. (1992) Oxidative Desulfurization-Fluorination of Xanthates. A Convenient Synthesis of Trifluoromethyl Ethers and Difluoro(Methylthio)Methyl Ethers. Tetrahedron Letters, 33, 4173-4176. https://doi.org/10.1016/S0040-4039(00)74681-8
- 31. Kanie, K., Tanaka, Y., Suzuki, K., Kuroboshi, M. and Hiyama, T. (2001) A Convenient Synthesis of Trifluoromethyl Ethers by Oxidative Desulfurization-Fluorination of Dithiocarbonates. Bulletin of the Chemical Society of Japan, 73, 471-484. https://doi.org/10.1246/bcsj.73.471
- 32. Kuroboshi, M., Kanie, K. and Hiyama, T. (2001) Oxidative Desulfurization-Fluorination: A Facile Entry to a Wide Variety of Organofluorine Compounds Leading to Novel Liquid-Crystalline Materials. Advanced Synthsis & Catalysis, 343, 235-250. https://doi.org/10.1002/1615-4169(20010330)343:3<235::AID-ADSC235>3.0.CO;2-0
- 33. Shimizu, M. and Hiyama, T. (2005) Modern Synthetic Methods for Fluorine-Substituted Target Molecules. Angewandte Chemie International Edition, 44, 214-231. https://doi.org/10.1002/anie.200460441
- 34. Ben-David, I., Rechavi, D., Mishani, E. and Rozen, S. (1999) A Novel Synthesis of Trifluoromethyl Ethers via Xanthates, Utilizing BrF3. Journal of Fluorine Chemistry, 97, 75-78. https://doi.org/10.1016/S0022-1139(99)00031-7
- 35. Zhou, M., Ni, C., He, Z. and Hu, J. (2016) O-Trifluoromethylation of Phenols: Access to Aryl Trifluoromethyl Ethers by O-Carboxydifluoromethylation and Decarboxylative Fluorination. Organic Letters, 18, 3754-3757. https://doi.org/10.1021/acs.orglett.6b01779
- 36. Yu, J., Lin, J.H., Yu, D., Du, R. and Xiao, J.C. (2019) Oxidation of Difluorocarbene and Subsequent Trifluoromethoxylation. Nature Communications, 10, Article No. 5362. https://doi.org/10.1038/s41467-019-13359-z
- 37. Koller, R., Stanek, K., Stolz, D., Aardoom, R., Niedermann, K. and Togni, A. (2009) Zinc-Mediated Formation of Trifluoromethyl Ethers from Alcohols and Hypervalent Iodine Trifluoromethylation Reagents. Angewandte Chemie International Edition, 48, 4332-4336. https://doi.org/10.1002/anie.200900974
- 38. Liu, J.B., Chen, C., Chu, L., Chen, Z.H., Xu, X.H. and Qing, F.L. (2015) Silver-Mediated Oxidative Trifluoromethylation of Phenols: Direct Synthesis of Aryl Trifluoromethyl Ethers. Angewandte Chemie International Edition, 54, 11839-11842. https://doi.org/10.1002/anie.201506329
- 39. Liu, J.B., Xu, X.H. and Qing, F.L. (2015) Silver-Mediated Oxidative Trifluoromethylation of Alcohols to Alkyl Trifluoromethyl Ethers. Organic Letters, 17, 5048-5051. https://doi.org/10.1021/acs.orglett.5b02522
- 40. Liang, A., Han, S., Liu, Z., Wang, L., Li, J., Zou, D. and Wu, Y. (2016) Regioselective Synthesis of N-Heteroaromatic Trifluoromethoxy Compounds by Direct O—CF3 Bond Formation. Chemistry: A European Journal, 22, 5102-5106. https://doi.org/10.1002/chem.201505181
- 41. Jiang, X., Deng, Z. and Tang, P. (2018) Direct Dehydroxytrifluoromethoxylation of Alcohols. Angewandte Chemie International Edition, 57, 292-295. https://doi.org/10.1002/anie.201711050
- 42. Li, Y., Yang, Y., Xin, J. and Tang, P. (2020) Nucleophilic Trifluoromethoxylation of Alkyl Halides Without Silver. Nature Communications, 11, Article No. 755. https://doi.org/10.1038/s41467-020-14598-1
- 43. Kalim, J., Duhail, T., Pietrasiak, E., Anselmi, E., Magnier, E. and Togni, A. (2021) Direct Trifluoromethylation of Alcohols Using a Hypervalent Iodosulfoximine Reagent. Chemistry: A European Journal, 27, 2638-2642. https://doi.org/10.1002/chem.202005104
- 44. Kärkäs, M.D., Porco Jr., J.A. and Stephenson, C.R.J. (2016) Photochemical Approaches to Complex Chemotypes: Applications in Natural Product Synthesis. Chemical Reviews, 116, 9683-9747. https://doi.org/10.1021/acs.chemrev.5b00760
- 45. Romero, N.A. and Nicewicz, D.A. (2016) Organic Photoredox Catalysis. Chemical Reviews, 116, 10075-10166. https://doi.org/10.1021/acs.chemrev.6b00057
- 46. Skubi, K.L., Blum, T.R. and Yoon, T.P. (2016) Dual Catalysis Strategies in Photochemical Synthesis. Chemical Reviews, 116, 10035-10074. https://doi.org/10.1021/acs.chemrev.6b00018
- 47. Matsui, J.K., Lang, S.B., Heitz, D.R. and Molander, G.A. (2017) Photoredox-Mediated Routes to Radicals: The Value of Catalytic Radical Generation in Synthetic Methods Development. ACS Catalysis, 7, 2563-2575. https://doi.org/10.1021/acscatal.7b00094
- 48. Jelier, B.J., Tripet, P.F., Pietrasiak, E., Franzoni, I., Jeschke, G. and Togni, A. (2018) Radical Trifluoromethoxylation of Arenes Triggered by a Visible-Light-Mediated N—O Bond Redox Fragmentation. Angewandte Chemie International Edition, 57, 13784-13789. https://doi.org/10.1002/anie.201806296
- 49. Zheng, W., Lee, J.W., Morales-Rivera, C.A., Liu, P. and Ngai, M.Y. (2018) Redox-Active Reagents for Photocatalytic Generation of the OCF3 Radical and (Hetero)Aryl C—H Trifluoromethoxylation. Angewandte Chemie International Edition, 57, 13795-13799. https://doi.org/10.1002/anie.201808495
- 50. Cong, F., Wei, Y. and Tang, P. (2018) Combining Photoredox and Silver Catalysis for Azidotrifluoromethoxylation of Styrenes. Chemical Communications, 54, 4473-4476. https://doi.org/10.1039/C8CC01096J
- 51. Yang, S., Chen, M. and Tang, P. (2019) Visible-Light Photoredox-Catalyzed and Copper-Promoted Trifluoromethoxylation of Arenediazonium Tetrafluoroborates. Angewandte Chemie International Edition, 58, 7840-7844. https://doi.org/10.1002/anie.201901447
- 52. Duhail, T., Bortolato, T., Mateos, J., Anselmi, E., Jelier, B., Togni, A. and Dell’Amico, L. (2021) Radical α-Trifluoromethoxylation of Ketones Under Batch and Flow Conditions by Means of Organic Photoredox Catalysis. Organic Letters, 23, 7088-7093. https://doi.org/10.1021/acs.orglett.1c02494
- 53. Dix, S., Golz, P., Schmid, J.R., Riedel, S. and Hopkinson, M.N. (2021) Radical C—H Trifluoromethoxylation of (Hetero)Arenes with Bis(Trifluoromethyl)Peroxide. Chemistry: A European Journal, 27, 11554-11558. https://doi.org/10.1002/chem.202101621
- 54. Wu, S., Song, H.X. and Zhang, C.P. (2020) Fluoroalkylation of Diazo Compounds with Diverse Rfn Reagents. Chemistry: An Asian Journal, 15, 1660-1677. https://doi.org/10.1002/asia.202000305
- 55. Xia, Y. and Wang, J. (2020) Transition-Metal-Catalyzed Cross-Coupling with Ketones or Aldehydes via N-Tosylhydrazones. Journal of the American Chemical Society, 142, 10592-10605. https://doi.org/10.1021/jacs.0c04445
- 56. Zhang, M., Xie, J. and Zhu, C. (2018) A General Deoxygenation Approach for Synthesis of Ketones from Aromatic Carboxylic Acids and Alkenes. Nature Communications, 9, Article No. 3517. https://doi.org/10.1038/s41467-018-06019-1
- 57. Song, B. and Xu, B. (2017) Metal-Catalyzed C—H Functionalization Involving Isocyanides. Chemical Society Reviews, 46, 1103-1123. https://doi.org/10.1039/C6CS00384B
- 58. Chen, C., Chen, P. and Liu, G. (2015) Palladium-Catalyzed Intramolecular Aminotrifluoromethoxylation of Alkenes. Journal of the American Chemical Society, 137, 15648-15651. https://doi.org/10.1021/jacs.5b10971
- 59. Zha, G.F., Han, J.B., Hu, X.Q., Qin, H.L., Fang, W.Y. and Zhang, C.P. (2016) Silver-Mediated Direct Trifluoromethoxylation of α-Diazo Esters via the −OCF3 Anion. Chemical Communications, 52, 7458-7461. https://doi.org/10.1039/C6CC03040H
- 60. Chen, C., Luo, Y., Fu, L., Chen, P., Lan, Y. and Liu, G. (2018) Palladium-Catalyzed Intermolecular Ditrifluoromethoxylation of Unactivated Alkenes: CF3O-Palladation Initiated by Pd(IV). Journal of the American Chemical Society, 140, 1207-1210. https://doi.org/10.1021/jacs.7b11470
- 61. Yang, H., Wang, F., Jiang, X., Zhou, Y., Xu, X. and Tang, P. (2018) Silver-Promoted Oxidative Benzylic C—H Trifluoromethoxylation. Angewandte Chemie International Edition, 57, 13266-13270. https://doi.org/10.1002/anie.201807144
- 62. Liu, J., Wei, Y. and Tang, P. (2018) Cobalt-Catalyzed Trifluoromethoxylation of Epoxides. Journal of the American Chemical Society, 140, 15194-15199. https://doi.org/10.1021/jacs.8b10298
- 63. Huang, Q. and Tang, P. (2020) Silver-Mediated Intermolecular Iodotrifluoromethoxylation of Alkenes. The Journal of Organic Chemistry, 85, 2512-2519. https://doi.org/10.1021/acs.joc.9b03206
- 64. Wang, F., Guo, Y., Zhang, Y. and Tang, P. (2021) Silver-Catalyzed Dibromotrifluoromethoxylation of Terminal Alkynes. ACS Catalysis, 11, 3218-3223. https://doi.org/10.1021/acscatal.1c00090
- 65. Xin, J., Deng, X. and Tang, P. (2022) Silver-Catalyzed Trifluoromethoxylation of Aziridines. Organic Letters, 24, 881-885. https://doi.org/10.1021/acs.orglett.1c04226