Hans Journal of Medicinal Chemistry
Vol.
11
No.
03
(
2023
), Article ID:
70281
,
7
pages
10.12677/HJMCe.2023.113021
展萼金丝桃化学成分及其抗氧化活性研究
张潘潘,周英,梁嘉俊,梁婷,刘爽,余欢,魏鑫*
贵州中医药大学药学院,贵州 贵阳
收稿日期:2023年6月21日;录用日期:2023年7月4日;发布日期:2023年8月9日

摘要
目的:对展萼金丝桃(Hypericum lancasteri N. Robson)的化学成分进行分离鉴定;对其单体化合物进行抗氧化活性评价。方法:展萼金丝桃干燥地上部分经粉碎,95%甲醇回流提取得总提取物,使用硅胶、凝胶、MCI、ODS柱色谱、高效液相色谱(HPLC)等多种分离技术对总提取物进行分离纯化,结合核磁共振氢谱(1H NMR)、碳谱(13C NMR)以及质谱(MS)等解析手段,通过文献数据分析确定所得化合物结构。采用DPPH自由基清除法对化合物1-4进行抗氧化活性评价。结果:共分离得到3个xanthone类化合物和2个其他类化合物,分别鉴定为1,7-dihydroxyxanthone (1), 2-hydroxyxanthone (2), 2,3-二甲氧基口山酮(3), hyperdioxanes B (4) 和2-methyl-6-isopropyl-7-hydroxymethyl naphthalene (5),化合物1-5均为首次从该植物中分离得到。化合物1-4在400 µmol/L浓度下的DPPH自由基清除率分别为11.44%,9.68%,11.04%,9.72%。结论:从展萼金丝桃地上部分分离得到5个单体化合物,均为首次从该植物中分离得到,丰富了该植物的物质基础,同时生物活性研究为展萼金丝桃在抗氧化活性方面的药物应用提供了线索。
关键词
展萼金丝桃,抗氧化活性,化学成分,DPPH,Xanthone

Study on the Chemical Constituents from Hypericum lancasteri and Their Antioxidant Activities
Panpan Zhang, Ying Zhou, Jiajun Liang, Ting Liang, Shuang Liu, Huan Yu, Xin Wei*
School of Pharmacy, Guizhou University of Traditional Chinese Medicine, Guiyang Guizhou
Received: Jun. 21st, 2023; accepted: Jul. 4th, 2023; published: Aug. 9th, 2023

ABSTRACT
Objective: To isolate and identify the chemical composition of Hypericum lancasteri N. Robson; evaluate the antioxidant activity of its monomer compounds. Methods: The dried aerial part of H. lancasteri was crushed, and the total extract was extracted by 95% methanol reflux. The total extract was separated and purified by silica gel column chromatography, MCI column chromatography, ODS column chromatography, high performance liquid chromatography (HPLC) and other separation technologies. The structure of the isolated monomers was determined by 1H and 13C nuclear magnetic resonance (NMR) as well as mass spectrometry (MS). The antioxidant activity for compounds 1-4 was evaluated using DPPH radical scavenging method. Results: A total of three xanthones together with two other compounds were isolated and identified as 1,7-dihydroxyxanthone (1), 2-dihydroxyxanthone (2), 2,3-dimethoxyxanthone (3), hyperdioxanes B (4), and 2-methyl-6-isopropyl-7-hydroxymethyl naphthalene (5) respectively. Compounds 1-5 were isolated from this plant for the first time. The DPPH radical scavenging rates of compounds 1-4 (400 µmol/L) were 11.44%, 9.68%, 11.04% and 9.72%, respectively. Conclusion: Five monomeric compounds were isolated from the aerial part of the H. lancasteri, all of which were the first to be isolated from the plant, enriching the material foundation of the plant. At the same time, biological activity research provided clues for the drug application of the plant in terms of antioxidant activity.
Keywords:Hypericum lancasteri, Antioxidant Activity, Chemical Composition, DPPH, Xanthones

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
金丝桃属(Hypericum L.)为藤黄科(Guttiferae)植物,多为草本和灌木,全世界大约400余种,在我国主要分布于贵州、四川、广西、重庆等地,资源十分丰富 [1] [2] 。该属中多个植物为药用植物,在国内外民间均具有悠久的药用历史,常用于治疗肝炎 [3] [4] ,跌打损伤,疮毒 [5] ,调经止血 [6] 等疾病,有研究发现金丝桃属植物中具代表性的次生代谢产物苯并二蒽酮类,黄酮类,Xanthones,多环多异戊烯基取代的间苯三酚类(polycyclic polyprenylated acylphloroglucinol, PPAP)类等 [7] [8] ,是抗肿瘤 [9] 、抗菌 [10] 、抗氧化 [3] 、抗炎 [9] 、抗抑郁 [11] 、抗HIV [12] [13] 的主要活性成分。特别是金丝桃属植物贯叶连翘(Hypericum perforatum)近年来已经成为国内外用于治疗抑郁症的热点植物药之一,从贯叶连翘中分离得到的金丝桃苷、金丝桃素、贯叶金丝桃素是其主要的活性成分 [14] [15] ,然而随着我国对贯叶连翘粗提物的大量出口,导致国内贯叶连翘资源紧缺。
展萼金丝桃(Hypericum lancasteri)为金丝桃属(Hypericum)常见植物,分布于云南的西部(漾濞、大理)、中部(昆明)及东北部(东川)和四川西南部,国内外对于展萼金丝桃的化学成分和生物活性研究报道较少,在前期的HPLC指纹图谱研究中发现展萼金丝桃(H. lancasteri)中指标成分贯叶金丝桃素的含量高于贯叶连翘(H. perforatum) [16] ,有望成为贯叶连翘的替代品,为了丰富其化学物质基础,从而进一步开发展萼金丝桃的药用价值,为展萼金丝桃的药用资源开发提供理论支持,本文采用硅胶、凝胶、MCI、ODS柱色谱、高效液相色谱(HPLC)等多种分离技术从展萼金丝桃二氯甲烷萃取部位进行分离纯化,结合核磁共振氢谱(1H NMR)、碳谱(13C NMR)以及质谱(MS)等解析手段,分离得到3个Xanthones类化合物、2个其他类化合物,均为首次从该植物中分离得到,并采用DPPH自由基清除法对化合物1-4进行了抗氧化活性筛选。
2. 材料与方法
2.1. 仪器与试剂
半制备高效液相色谱仪 LC-52 (Separation (Beijing)科技公司);核磁共振共振仪(AVANCE NEO 600 MHz) (德国Bruker公司),RE-2000A旋转蒸发器(上海亚荣生化仪器厂),SB-600DTY超声波多频清洗机(宁波新芝生物科技股份有限公司),酶标仪(赛默飞世尔科技有限公司,Multiskan Sky),移液枪(赛默飞世尔科技有限公司,SZ89685),96孔板(洁特生物,210420-078),GF254硅胶板、柱层析硅胶(80~100目、200~300目、300~400目)购于青岛海洋化工有限公司,MCI (GEL-CHP 20P) (Mitsubishi Chemical Co., Ltd. Japan),DMSO (北京索莱宝科技有限公司);DPPH (北京索莱宝科技有限公司,批号:SD9360);抗坏血酸(天津市科密欧化学试剂有限公司);石油醚、甲醇、乙酸乙酯、二氯甲烷均为分析纯购于天津市富宇精细化工有限公司。展萼金丝桃(Hypericum lancasteri)地上部位于2021年6月在云南省保山市龙陵县采摘,购于昆明植分生物技术有限公司,经该公司植物鉴定师张君鉴定为藤黄科Glusiaceae金丝桃属Hypericum展萼金丝桃Hypericum lancasteri N. Robson。药材标本(NO.20210601)存放于贵州中医药大学。
2.2. 提取与分离
将20 kg干燥的展萼金丝桃地上部分用药材粉碎机进行粉碎,粉碎后的药材粉末用95%甲醇进行回流提取4次,每次3 h,得到浸膏(2457 g)。将粗提物(2457 g)加2 L蒸馏水充分溶解,用等体积二氯甲烷萃取,减压浓缩得到二氯甲烷萃取部位(867 g)。二氯甲烷萃取部位,采用干法上样,湿法装柱,通过硅胶柱色谱石油醚–乙酸乙酯(v/v 100:0→0:1)梯度洗脱,将其划分为27 (Fr. A~Q)个不同极性部分。
Fr. I (35.0 g)通过反相ODS柱色谱甲醇–水(v/v 40:60→100:00)梯度洗脱,得到14 (I-1~14)个组分。I-2采用HPLC制备色谱甲醇–水(v/v 79:21)等度洗脱得到化合物1 (8.0 mg)。I-7采用凝胶色谱(100%甲醇)等度洗脱得到6 (I-7-1~6)个组分,I-7-5采用HPLC制备色谱甲醇–水(v/v 78:22)等度洗脱得到化合物5 (3.5 mg)
Fr. J (25.9 g)通过反相ODS柱色谱甲醇–水(v/v 40:60→100:00)梯度洗脱,得到(J-1~14) 14个组分。所的组分J-3通过硅胶柱石油醚–乙酸乙酯(v/v 7:1)等度洗脱得到2 (J-3-1~2)个组分,J-3-2采用HPLC制备色谱甲醇–水(v/v 70:30)等度洗脱得到化合物2 (6.0 mg)。J-4通过硅胶柱石油醚–乙酸乙酯(v/v 8:1)等度洗脱得到3 (J-4-1~3)个组分。J-4-2采用HPLC制备色谱甲醇–水(v/v 75:25)等度洗脱得到化合物3 (4.6 mg)。J-5通过硅胶柱石油醚–乙酸乙酯(v/v 8:1)等度洗脱得到J-5-1~3等3个组分。J-5-2采用HPLC制备色谱甲醇–水(v/v 75:25)等度洗脱得到化合物4 (3.5 mg)。
2.3. DPPH自由基清除测试
1,1-二苯基-2-三硝基苯肼(DPPH)溶液的制备:精密称取2.4 mg DPPH,用无水乙醇定容至30 mL,使其浓度为0.2 mmol·L−1,避光保存备用 [17] 。
阳性对照溶液配制:称取L(+)-抗坏血酸1 mg,先用100 µL的DMSO溶解,再加入适量的无水乙醇配制成1 mmol·L−1的母液,置于4℃保存备用,使用前用无水乙醇稀释至所需浓度。
样品母液的制备:称取化合物1-4各1 mg,先加入100 µL的DMSO溶解,再加入适量的无水乙醇配制成1 mmol·L−1的母液,置于4℃保存备用,使用前用无水乙醇稀释至所需浓度。
DPPH自由基清除法:将提前配置好的样品母液和L(+)-抗坏血酸母液(阳性对照)用无水乙醇稀释为400 µmol/L的样品溶液。取400 µmol/L的样品溶液100 µL加入96孔板,再加100 µL DPPH (0.2 mmol·L−1)溶液,设有3个复孔。空白组用无水乙醇代替DPPH溶液,对照组用无水乙醇代替样品溶液。在15℃~25℃的温度下避光30 min。使用酶标仪测量517 nm处的吸光度(A)值。按照以下公式计算清除率。
3. 结果
3.1. 提取分离与结构鉴定结果
金丝桃属植物中特征性的Xanthones、黄酮类、PPAPs类化合物,具有抗肿瘤,抗氧化,酶抑制,抗阿尔兹海默症、抗血管生成等药理活性 [18] [19] 。然而国内对金丝桃属植物的化学成分研究,特别是生物活性方面局限于少数明星植物的抗神经退行性疾病的研究,包括元宝草,黄海棠,地耳草等 [20] 。本文为了深入开发展萼金丝桃的药用价值,为展萼金丝桃的药用资源开发提供理论支持,结合多种分离手段首次从展萼金丝桃中分离得到5个化合物,采用核磁共振波谱(NMR)和质谱(MS)手段对其结构进行了详细的分析鉴定,明确了化合物1-5的结构分别为1,7-dihydroxyxanthone (1), 2-hydroxyxanthone (2), 2,3-二甲氧基口山酮(3), hyperdioxanes B (4) 和2-methyl-6-isopropyl-7-hydroxymethyl naphthalene (5),具体数据和鉴定过程如下。
化合物1:黄色固体,ESI-MS m/z: 229.05 [M+H]+,分子式C13H8O4. 1H NMR (600 MHz, CD3OD): δ 7.63 (1H, t, J = 8.3 Hz, H-3), 7.52 (1H, d, J = 3.1 Hz, H-8), 7.44 (1H, d, J = 9.0 Hz, H-5), 7.32 (1H, dd, J = 9.0, 3.1 Hz, H-6), 6.95 (1H, d, J = 8.4 Hz, H-4), 6.74 (1H, d, J = 8.2 Hz, H-2). 13C NMR (150 MHz, CD3OD, δ, ppm) 162.9 (C-1), 110.7 (C-2), 137.9 (C-3), 108.1 (C-4), 157.9 (C-4a), 151.5 (C-4b), 120.3 (C-5), 126.4 (C-6), 155.6 (C-7), 109.2 (C-8), 122.2 (C-8a), 109.2 (C-8a), 183.5 (C-9)。数据与文献中1,7-dihydroxyxanthone的数据一致 [21] ,故鉴定其为1,7-dihydroxyxanthone (见图1)。
化合物2:黄色固体,ESI-MS m/z: 213.06 [M+H]+,分子式C13H8O3. 1H NMR (600 MHz, CD3OD): δ 8.25 (1H, dd, J = 8.0, 1.7 Hz, H-8), 7.81 (1H, ddd, J = 8.7, 7.0, 1.7 Hz, H-6), 7.57 (1H, m, H-5), 7.56 (1H, m, H-1), 7.49 (1H, d, J = 9.0 Hz, H-4), 7.42 (1H, ddd, J = 8.0, 7.0, 1.1 Hz, H-7), 7.32 (1H, dd, J = 9.0, 3.0 Hz, H-3)。13C NMR (150 MHz, CD3OD, δ, ppm): δ109.8 (C-1), 155.5 (C-2), 125.9 (C-3), 120.5 (C-4), 151.6 (C-4a), 157.7 (C-4b), 119.2 (C-5), 136.3 (C-6), 124.4(C-7), 127.2 (C-8), 122.0 (C-8a), 123.2 (C-8b), 178.9 (C-9)。以上数据与参考文献相符 [22] ,故鉴定其为2-hydroxyxanthone (见图1)。
化合物3:黄色固体,ESI-MS m/z: 257.0 [M+H]+,分子式C15H12O4. 1H NMR (400 MHz, CD3OD): δ 8.25 (1H, dd, J = 8.0, 1.8 Hz, H-8), 7.79 (1H, ddd, J = 8.6, 7.1, 1.8 Hz, H-6), 7.60 (1H, s, H-1), 7.57 (1H, d, J = 8.6, H-5), 7.44 (1H, ddd, J = 8.0, 7.1, 1.1 Hz, H-7), 7.12 (1H, s, H-4), 4.00 (3H, s, 2-OCH3), 3.94 (3H, s, 3-OCH3). 13C NMR (100 MHz, CD3OD, δ, ppm): δ 105.9 (C-1), 157.6 (C-2), 157.8 (C-3), 101.0 (C-4), 154.2 (C-4a), 148.5 (C-4b), 119.0 (C-5), 135.7 (C-6), 125.2(C-7), 127.0 (C-8), 115.4 (C-8a), 122.2 (C-8b), 177.9 (C-9), 57.0 (C-2-OCH3), 56.6 (C-3-OCH3)。数据和参考文献相符 [23] ,故其鉴定为2,3-二甲氧基口山酮(见图1)。
化合物4:白色固体,ESI-MS m/z: 291.1 [M+H]+,分子式C15H14O6. 1H NMR (600 MHz, CD3OD): δ 7.07 (1H, d, J = 8.8 Hz, H-9), 6.70 (1H, d, J = 2.7 Hz, H-6), 6.67 (1H, dd, J = 8.8, 2.7 Hz, H-8 ), 5.79 (1H, d, J = 2.2 Hz, H-4 ), 5.45 (1H, d, J = 2.2 Hz, H-2), 3.89 (3H, s, 3-OCH3 ), 3.78 (3H, s, 7-OCH3), 3.29 ( 3H, s, 10a-OCH3). 13C NMR (150 MHz, CD3OD): δ 189.3 (C-1), 95.5 (C-2), 175.2 (C-3), 100.8 (C-4), 155.0 (C-4a), 143.4 (C-5), 102.8 (C-6), 157.5 (C-7), 110.9 (C-8), 119.6 (C-9), 133.6 (C-10), 87.7 (C-10a), 57.6 (C-3-OCH3), 56.3 (C-7-OCH3), 50.2 (C-10a-OCH3)。数据和参考文献相符 [24] ,故鉴定为Hyperdioxanes B (见图1)。
化合物5:白色固体,ESI-MS m/z: 215.14 [M+H]+,分子式 C15H18O. 1H NMR (600 MHz, CD3OD): δ8.05 (1H, d, J = 8.0 Hz, H-9), 7.96 (1H, s, H-1), 7.41 (1H, d, J = 8.0 Hz, H-8), 7.37 (2H, m, H-3,4), 5.02 (2H, d, J = 0.7 Hz, H-14), 3.75 (1H, m,H-11), 2.54 (3H, s, H-15), 1.39 (3H, s, H-12), 1.38 (3H, s, H-13). 13C NMR (150 MHz, CD3OD, δ, ppm): δ123.9 (C-1), 136.1 (C-2), 128.5 (C-3), 122.2 (C-4), 135.6 (C-5), 145.2 (C-6), 131.4 (C-7), 125.5 (C-8), 125.5 (C-9) 133.1 (C-10), 29.5 (C-11), 24.0 (C-12), 24.0 (C-13), 63.6 (C-14), 22.1 (C-15)。数据和参考文献相符 [25] ,故鉴定其为2-methyl-6-isopropyl-7-hydroxymethyl naphthalene (见图1)。
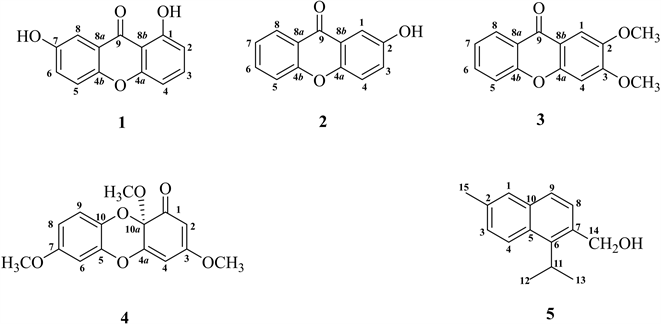
Figure 1. Structures of compounds 1-5
图1. 化合物1-5的结构图
3.2. 抗氧化活性评价测定
金丝桃属植物常被用于治疗多种中枢神经系统疾病,如失眠、精神类疾病,特别是近年来发病率逐年升高的轻度至中度抑郁症 [14] 。在其机制研究中发现,氧自由基作为生理上的第二信使,可能在中枢神经系统(CNS)的多种病理状态中发挥重要作用,氧自由基过度产生与抗氧化作用失衡定义的氧化应激可显著加重急性损伤,如缺血和慢性神经退行性疾病,包括肌萎缩侧索硬化症(ALS)和帕金森病 [26] [27] 。因此,在细胞水平上筛选对氧自由基具有清除活性的化学成分,对于缺血和慢性神经退行性疾病治疗具有较大的现实意义。
金丝桃属植物中特征性的Xanthones类衍生物防治疾病的过程与其抗氧化活性息息相关,有研究发现α-Mangostin,Gartanin,Garcinone C和γ-Mangostin等Xanthones类衍生物对DPPH自由基的清除能力优于水溶性维生素E,并且通过清除活性氧,从而对谷氨酸诱导的HT22细胞死亡具有有效的神经保护作用 [28] 。为了从金丝桃属植物展萼金丝桃中探寻新的天然抗氧化剂,我们以L(+)-抗坏血酸为阳性对照,采用DPPH自由基清除法测定化合物1-4的抗氧化活性,结果表明化合物1-4在400 µmol/L的浓度下显示出微弱的抗氧化活性,其DPPH自由基清除率分别为11.44%,9.68%,11.04%,9.72% (见表1)。
Table 1. The DPPH radical scavenging rate of compounds 1-4
表1. 化合物1-4的DPPH自由基清除率
a阳性对照药aPositive control medicine。
4. 总结
金丝桃属植物中的化学成分丰富,结构骨架新颖,具有抗菌、抗肿瘤、抗病毒、抗抑郁等多种生物活性,已经成为国内外的研究热点之一,然而目前对展萼金丝桃的化学成分和生物活性研究报道较少,在一定程度上限制了展萼金丝桃的进一步开发和应用。本研究对展萼金丝桃地上部位的二氯甲烷萃取物进行了系统的分离纯化,结合核磁共振波谱(NMR)以及质谱(MS)等结构鉴定手段确定了所得单体成分结构,从展萼金丝桃地上部分共计分离得到5个单体化合物,均为首次从该植物中分离得到,分别鉴定为1,7-dihydroxyxanthone (1),2-hydroxyxanthone (2),2,3-二甲氧基口山酮(3),Hyperdioxanes B (4),2-Methyl-6-isopropyl-7-hydroxymethyl naphthalene (5)。此外基于前期Xanthones类衍生物已报道的抗氧化活性 [28] ,我们试图从展萼金丝桃中探寻新的天然抗氧化剂,因此分别测定了化合物1-4的抗氧化活性,DPPH自由基清除实验发现化合物1-4在400 µmol/L的浓度下显示出微弱的抗氧化活性,其DPPH自由基清除率分别为11.44%,9.68%,11.04%,9.72%。本文研究结果丰富了该植物的化学物质基础,为合理有效利用该植物提供了科学依据,同时为展萼金丝桃在抗氧化活性方面的药物应用奠定基础。
致谢
感谢贵州省天然产物研究中心对本实验过程中化合物核磁数据检测提供的帮助。
基金项目
贵州省基础研究(自然科学)项目(黔科合基础-ZK[2023]一般430)。
文章引用
张潘潘,周 英,梁嘉俊,梁 婷,刘 爽,余 欢,魏 鑫. 展萼金丝桃化学成分及其抗氧化活性研究
Study on the Chemical Constituents from Hypericum lancasteri and Their Antioxidant Activities[J]. 药物化学, 2023, 11(03): 167-173. https://doi.org/10.12677/HJMCe.2023.113021
参考文献
- 1. 陈玉菡, 刘旭, 慕泽泾, 等. 重庆华蓥山山脉金丝桃属药用植物资源调查[J]. 中国现代中药, 2011, 13(9): 12-14.
- 2. 吕洪飞, 初庆刚, 胡正海. 金丝桃属植物的化学成分研究进展[J]. 中草药, 2002, 33(12): 82-85.
- 3. 纪圆圆, Adam N., Edward J.K., 等. 星萼金丝桃的化学成分和抗氧化活性研究[J]. 中国中药杂志, 2018, 43(18): 3701-3707.
- 4. 肖会泉, 杨子峰, 刘妮, 等. 贯叶金丝桃提取物抗乙型肝炎病毒的体外实验研究[J]. 中药材, 2005, 28(3): 213-214.
- 5. 辛义周, 张希成, 唐文照. 地耳草的化学成分及药理作用研究进展[J]. 山东医药工业, 2003, 22(2): 28-29.
- 6. 谢孟姣, 郭勇秀, 李芳婵, 等. 元宝草的化学成分、药理作用研究进展和质量标志物分析预测[J]. 中医药学报, 2021, 49(10): 40-44.
- 7. Yang, X.W., Grossman, R.B. and Xu, G. (2018) Research Progress of Polycyclic Polyprenylated Acylphloroglucinols. Chemical Reviews, 118, 3508-3558. https://doi.org/10.1021/acs.chemrev.7b00551
- 8. 殷志琦, 王英, 张冬梅, 等. 金丝桃属植物化学成分研究进展[J]. 中国野生植物资源, 2004, 23(1): 6-7+11.
- 9. 宋萍, 郝吉, 王岩, 等. 金丝桃属植物中多环多异戊烯基间苯三酚类成分和生物活性的研究进展[J]. 中国中药杂志, 2021, 46(19): 4881-4890.
- 10. 谢婷婷, 孙隆儒, 娄红祥, 等. 金丝桃属植物抗菌作用的研究进展[J]. 中药材, 2010, 33(1): 146-149.
- 11. Sarris, J., Panossian, A., Schweitzer, I., et al. (2011) Herbal Medicine for Depression, Anxiety and Insomnia: A Review of Psychopharmacology and Clinical Evidence. European Neuropsychopharmacology, 21, 841-860. https://doi.org/10.1016/j.euroneuro.2011.04.002
- 12. Barnes, J., Anderson, L.A. and Phillipson, J.D. (2001) St John’s Wort (Hypericum perforatum L.): A Review of Its Chemistry, Pharmacology and Clinical Properties. Journal of Pharmacy and Pharmacology, 53, 583-600. https://doi.org/10.1211/0022357011775910
- 13. Fobofou, S.A.T., Franke, K., Brandt, W., et al. (2023) Bichro-monol, a Dimeric Coumarin with Anti-HIV Activity from the Stem Bark of Hypericum roeperianum. Natural Product Research, 37, 1947-1953. https://doi.org/10.1080/14786419.2022.2110094
- 14. Zirak, N., Shafiee, M., Soltani, G., et al. (2019) Hypericum perforatum in the Treatment of Psychiatric and Neurodegenerative Disorders: Current Evidence and Potential Mecha-nisms of Action. Journal of Cellular Physiology, 234, 8496-8508. https://doi.org/10.1002/jcp.27781
- 15. 唐锋, 田元新, 黎旭, 等. 基于网络药理学的贯叶连翘抗抑郁活性成分作用机制研究[J]. 时珍国医国药, 2019, 30(8): 1844-1847.
- 16. 郑清明, 秦路平, 郑汉臣, 等. 金丝桃属植物的HPLC指纹谱研究[J]. 中草药, 2003, 36(4): 80-85.
- 17. 屠万倩, 张留记, 夏曼玉, 等. 杜仲叶清除DPPH自由基动力学特性及抗氧化活性成分筛选[J]. 中国药学杂志, 2022, 57(4): 264-268.
- 18. 连双双. 氧杂蒽酮类化合物的研究进展[J]. 广东化工, 2014, 41(2): 46-47.
- 19. 席天伦, 李晓秀, 刘波. 山竹果皮的化学成分及其药理活性研究进展[J]. 天然产物研究与开发, 2018, 30(5): 888-899.
- 20. 肖志勇, 穆青. 金丝桃属植物化学成分研究进展[J]. 天然产物研究与开发, 2007, 19(2): 344-355.
- 21. 刘健, 肖朝江, 崔淑君, 等. 匙萼金丝桃化学成分及镇痛与抗疟活性研究[J]. 中国药学杂志, 2019, 54(8): 614-619.
- 22. Frahm, A.W. and Chaudhuri, R.K. (1979) 13C NMR Spectroscopy of Substituted Xanthones-II. 13C NMR Spectral Study of Polyhydroxy Xanthones. Tetrahedron, 35, 2035-2038. https://doi.org/10.1016/S0040-4020(01)88974-2
- 23. 罗蕾, 李祖强, 马国义. 近无柄金丝桃中的口山酮类成分[J]. 云南大学学报(自然科学版), 2004, 26(1): 56-60.
- 24. Niwa, K., Tanaka, N., Kim, S.Y., et al. (2018) Hyperdiox-ane A, a Conjugate of Dibenzo-1,4-dioxane and Sesquiterpene from Hypericum ascyron. Organic Letters, 20, 5977-5980. https://doi.org/10.1021/acs.orglett.8b02739
- 25. Hou, L., Ding, G., Guo, B., et al. (2015) New Ses-quiterpenoids and a Diterpenoid from Alpinia oxyphylla. Molecules (Basel, Switzerland), 20, 1551-1559. https://doi.org/10.3390/molecules20011551
- 26. Facchinetti, F., Dawson, V.L. and Dawson, T.M. (1998) Free Radicals as Mediators of Neuronal Injury. Cellular and Molecular Neurobiology, 18, 667-682. https://doi.org/10.1023/A:1020685903186
- 27. Peuchen, S., Bolaños, J.P., Heales, S.J., et al. (1997) Interrelation-ships between Astrocyte Function, Oxidative Stress and Antioxidant Status within the Central Nervous System. Progress in Neurobiology, 52, 261-281. https://doi.org/10.1016/S0301-0082(97)00010-5
- 28. Wang, S.N., Li, Q., Jing, M.H., et al. (2016) Natural Xan-thones from Garcinia mangostana with Multifunctional Activities for the Therapy of Alzheimer’s Disease. Neurochem-ical Research, 41, 1806-1817. https://doi.org/10.1007/s11064-016-1896-y
NOTES
*通讯作者。
