Advances in Clinical Medicine
Vol.
12
No.
07
(
2022
), Article ID:
53566
,
14
pages
10.12677/ACM.2022.127917
大鼠皮肤生前和死后切创EⅢA-FN的 比较性研究
米书娟1,2,杜鹃3,赵杰4,唐立冈5,赵鹏1,6*,贾广都2,宋昊2
1青岛大学基础医学院,山东 青岛
2山东金剑司法鉴定中心,山东 枣庄
3河北医科大学人体解剖学教研室,河北 石家庄
4河北省公安厅物证鉴定中心,河北 石家庄
5山东省公安厅物证鉴定研究中心,山东 济南
6青岛大学附属医院病理科,山东 青岛
收稿日期:2022年6月11日;录用日期:2022年7月3日;发布日期:2022年7月13日

摘要
目的:通过比较大鼠生前和死后短时间内,皮肤切创创缘皮肤EIIIA-FN的表达量变化,探讨EIIIA-FN在鉴别生前伤和死后伤的应用价值。方法:选取3月龄SD大鼠45只,随机分为生前15 min、0.5 h、1 h、2 h、4 h、8 h损伤组和死后即刻、15 min损伤组及正常对照组,每组5只;大鼠四肢上段外侧行切创,对应时间点处死大鼠后2 h、4 h、8 h、24 h取切创创缘及背部皮肤,利用免疫组织化学染色方法检测EIIIA-FN的表达,比较切创创缘和背部皮肤EIIIA-FN表达量的差异、生前伤和死后伤引起的EIIIA-FN表达量差异。结果:生前损伤组切创创缘和背部皮肤EIIIA-FN表达量差异有统计学意义(P < 0.05),生前0.5 h、1 h、2 h、4 h、8 h损伤组与死后损伤组切创创缘皮肤EIIIA-FN表达量差异有统计学意义(P < 0.05),死后2 h、4 h、8 h、24 h皮肤EIIIA-FN表达量差异无统计学意义(P > 0.05)。结论:皮肤局部损伤不会引起全身皮肤EIIIA-FN变化,皮肤早期损伤时间与EIIIA-FN表达量之间存在一定的正相关关系,EIIIA-FN可以鉴别生前损伤时间在0.5 h以上的损伤和死后15 min内损伤,且死后24 h内不同时间对皮肤EIIIA-FN的表达量无影响,EIIIA-FN有望成为法医病理实践中鉴别生前伤和死后伤的指标。
关键词
法医病理学,生前伤,死后伤,纤维连接蛋白额外结构域A

Comparative Study of EIIIA-FN in Rat Skin Excision before and after Death
Shujuan Mi1,2, Juan Du3, Jie Zhao4, Ligang Tang5, Peng Zhao1,6*, Guangdu Jia2, Hao Song2
1School of Basic Medical Sciences, Qingdao University, Qingdao Shandong
2Shandong Jinjian Judicial Appraisal Center, Zaozhuang Shandong
3Department of Human Anatomy, Hebei Medical University, Shijiazhuang Hebei
4Institute of Forensic Science of Public Security Bureau of Hebei Province, Shijiazhuang Hebei
5The Institute of Criminal Science and Technology, Shandong Public Security Bureau, Jinan Shandong
6Epartment of Pathology, Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Jun. 11th, 2022; accepted: Jul. 3rd, 2022; published: Jul. 13th, 2022

ABSTRACT
Objective: To investigate the value of EIIIA-FN in differentiating antemortem injury from postmortem injury in rats, the expression of EIIIA-FN was compared between antemortem injury and postmortem injury in rats. Methods: Forty-five 3-month-old SD rats were randomly divided into the injury group of 15 min, 0.5 h, 1 h, 2 h, 4 h and 8 h before death, the injury group of 15 min immediately after death and the normal control group, with 5 rats in each group. The upper lateral segment of the limbs of rats were incised, and the skin of the incised margin and back was incised 2 h, 4 h, 8 h and 24 h after the rats were sacrificed at corresponding time points. Immunohistochemical staining was used to detect the expression of EIIIA-FN in the incised margin and back skin, and to compare the expression of EIIIA-FN in the incised margin and back skin, and the difference of the expression of EIIIA-FN caused by antemortem injury and postmortem injury. Results: There were statistically significant differences in the expression level of EIIIA-FN in the wound margin and back skin of the injury group before death (P < 0.05), and there were statistically significant differences in the expression level of EIIIA-FN in the injury group at 0.5 h, 1 h, 2 h, 4 h and 8 h before death and in the injury group after death (P < 0.05). There was no significant difference in the expression of EIIIA-FN at 2 h, 4 h, 8 h and 24 h after death (P > 0.05). Conclusion: Local skin injury did not cause the change of skin EIIIA-FN in whole body. There was a positive correlation between the time of early skin injury and the expression of EIIIA-FN. The expression of EIIIA-FN could distinguish the injury with the time of antemortem injury more than 0.5 h from the injury within 15 min after death. The expression of EIIIA-FN in skin was not affected by different time within 24 h after death, and EIIIA-FN is expected to be used as an indicator to distinguish antemortem injury from postmortem injury in forensic pathology practice.
Keywords:Forensic Pathology, Antemortem Injuries, Postmortem Injuries, EIIIA-FN

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在暴力性死亡中,机械性损伤发生率和死亡率很高,是最常见的暴力性致死原因之一 [1]。在机械性损伤案件中,推断损伤时间有助于缩小嫌疑人的划定范畴、推断作案意图、重建案情经过、判断死亡方式,对案件的侦查、重建和诉讼均具有重要意义。然而,由于个体差异及损伤程度、类型、部位等多种因素影响,损伤时间的判断一直是法医病理学领域尚未完全解决的难题之一,特别是濒死伤与死后短时间内造成的死后伤的鉴别。纤维连接蛋白(fibronectin, FN)是一种分布在血浆、体液、细胞表面、细胞外基质的高分子量糖蛋白,分为血浆型纤维连接蛋白(plasma fibronectin, p-FN)和细胞型纤维连接蛋白(cellular fibronectin, c-FN),其每个单体由三种重复单元组成:I型、Ⅱ型和Ⅲ型,至少有20种变异体存在,这些变异体在于可变剪接的一个预处理mRNA,主要类型的剪接发生在Ⅲ型重复的中央集合,包括或排除两种Ⅲ型重复额外结构域A (也称为EⅢA或EDI)和额外结构域B (也称为EⅢB或EDⅡ)。p-FN缺少EⅢA和EⅢB结构域,c-FN含有EⅢA和EⅢB结构域,有研究发现 [2] [3],损伤后此两片段表达逐渐增强,在同样条件下,EⅢA-FN比EⅢB-FN更为敏感。本研究通过对大鼠皮肤生前和死后不同时间切创在死后不同时间EⅢA-FN表达量的研究,探讨EⅢA-FN在法医实践中鉴别生前伤与死后伤的研究价值。
2. 材料与方法
2.1. 实验动物及其分组
雄性3月龄SD大鼠45只(2020年济南朋悦实验动物繁育有限公司提供),随机分为生前损伤组、死后损伤组和正常对照组。生前损伤组按照生前损伤时间分为生前15 min、0.5 h、1 h、2 h、4 h、8 h损伤组,死后损伤组按照死后损伤时间分为死后即刻和15 min损伤组,每组5只。
2.2. 大鼠皮肤切创制作及取材
将大鼠腹腔注射麻醉后,用脱毛膏对四肢及背部脱毛。损伤组在四肢上段外侧分别用无菌手术刀制作长1.0 cm纵行切创,深达筋膜,按照上述各时相点断颈法处死实验动物,在处死后2 h、4 h、8 h、24 h分别取左前肢、右前肢、左后肢、右后肢切创创缘皮肤1.0 cm × 0.5 cm,背部脊柱旁1.0 cm处取皮肤1.0 cm × 0.5 cm作为自身空白对照。正常对照组大鼠在断颈法处死后2 h、4 h、8 h、24 h取与损伤组切创部位相同部位皮肤。设置免疫组织化学染色对照,取成年大鼠肝组织作为阴性 [4] 染色组织、幼鼠(<3 d)肾组织 [5] 作为阳性染色组织。以上检材用10%中性福尔马林溶液固定,常规石蜡包埋、切片。
2.3. 免疫组织化学染色
石蜡切片脱蜡、抗原修复,内源性过氧化物酶阻断剂灭活内源性过氧化物酶,山羊血清室温封闭15 min,小鼠抗大鼠Fibronectin [IST-9]单克隆抗体(1:200,英国abcam公司) 4℃孵育过夜DAB显色。以磷酸盐缓冲液(phosphate buffered saline, PBS)代替一抗作为空白对照。
2.4. 统计学分析
IPP软件进行图像分析、IBM SPSS25.0软件进行统计学分析。各组数值采用均数 ± 标准差( ± s)表示,组内切创创缘与自身空白对照区域、死后损伤组间切创创缘皮肤EⅢA-FN表达量比较行独立样本t检验;损伤组切创创缘与正常对照组、生前损伤组间切创创缘、生前损伤组与死后损伤组间切创创缘皮肤EⅢA-FN表达量比较行单因素方差分析(one-way ANOVA),方差齐性行LSD检验,方差不齐行Tamhane T2检验;死后2 h、4 h、8 h、24 h皮肤EⅢA-FN表达量比较按随机区组资料分析,各组为区,死后各时间点取材为处理因素,数值采用中位数(四分位数间距) [M(IQR)]表示,比较行多相关样本的非参数检验(Friedman秩和检验),以P < 0.05为差异有统计学意义。
3. 结果
3.1. 免疫组织化学染色对照结果
肾组织有棕黄色颗粒着色,EⅢA-FN呈强阳性表达,肝组织未见棕黄色或黄色颗粒着色,EⅢA-FN呈阴性表达(见图1)。
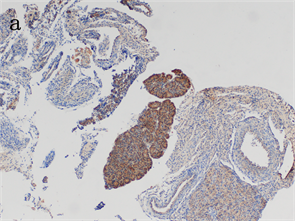
Figure 1. EⅢA-FN immunohistochemical staining and control results (Bar = 100 μm). (a) The kidney tissue of young mice was stained with brownish yellow granules; (b) Liver tissue of adult rats
图1. EⅢA-FN免疫组织化学染色对照结果(Bar = 100 μm)。(a) 幼鼠肾组织有棕黄色颗粒着色;(b) 成年大鼠肝组织
3.2. 对照组染色结果
正常对照组及自身空白对照皮肤均有少量黄色颗粒分布于部分皮脂腺。
3.3. 生前损伤组染色结果
各组在死后2 h切创创缘皮肤EⅢA-FN表达:生前15 min损伤组有黄色颗粒分布于皮脂腺,生前0.5 h损伤组分布于皮脂腺的黄色颗粒逐渐增多,且有黄色颗粒分布于部分毛囊、表皮,随损伤时间延长分布于皮脂腺、毛囊的黄色颗粒逐渐增多,分布于表皮的黄色颗粒变化不明显(见图2)。各组大鼠切创创缘与自身空白对照皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05) (见表1)。除生前15 min损伤组外,其余各组切创创缘与正常对照组皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05);损伤组间切创创缘皮肤EⅢA-FN表达量差异有统计学意义(P < 0.05) (见表2)。
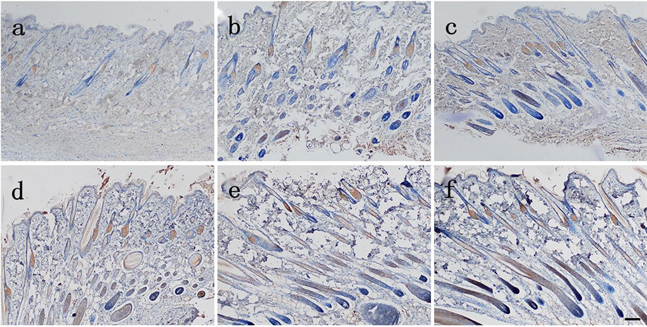
Figure 2. The expression of EⅢA-FN in the skin of the injured group was observed 2 hours after death (Bar = 100 μm). (a) Yellow particles were distributed in sebaceous glands in the injured group 15 min before death; (b) Yellow granules were distributed in some hair follicles and epidermis of the injured group at 0.5 h before death; (c) Injury group 1 h before death; (d) Injury group 2 h before death; (e) Injury group 4 h before death; (f) Injury group 8 h before death
图2. 生前损伤组在死后2 h切创创缘皮肤EⅢA-FN表达(Bar = 100 μm)。(a) 生前15 min损伤组有黄色颗粒分布于皮脂腺;(b) 生前0.5 h损伤组有黄色颗粒分布于部分毛囊、表皮;(c) 生前1 h损伤组;(d) 生前2 h损伤组;(e) 生前4 h损伤组;(f) 生前8 h损伤组
Table 1. Comparison of the expression of EⅢA-FN in the skin of the injury group and the blank control group at 2 h after death (n = 5, )
表1. 大鼠生前损伤组在死后2 h切创创缘与自身空白对照皮肤EIIIA-FN表达量比较(n = 5, )
Table 2. Comparison of the expression of EⅢA-FN in the skin of the injury group, the normal control group and the skin of the injury group at 2 h after death (n = 5, )
表2. 大鼠生前损伤组在死后2 h切创创缘与正常对照组皮肤、组间切创创缘皮肤EⅢA-FN表达量比较(n = 5, )
各组在死后4 h切创创缘皮肤EⅢA-FN表达:生前15 min损伤组有黄色颗粒分布于皮脂腺,生前0.5h损伤组有黄色颗粒分布于部分表皮,分布于皮脂腺的黄色颗粒逐渐增多,生前1 h损伤组有黄色颗粒分布于部分毛囊,随损伤时间延长分布于皮脂腺、毛囊的黄色颗粒逐渐增多,分布于表皮的黄色颗粒变化不明显(见图3)。各组切创创缘与自身空白对照皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05) (见表3)。除生前15 min损伤组外,其余各组切创创缘与正常对照组皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05);损伤组间切创创缘皮肤EⅢA-FN表达量差异有统计学意义(P < 0.05) (见表4)。
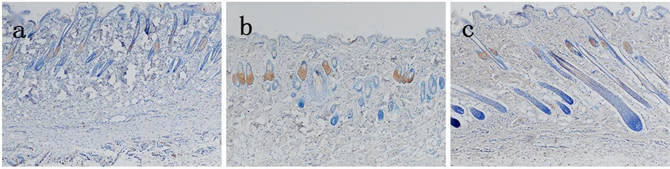
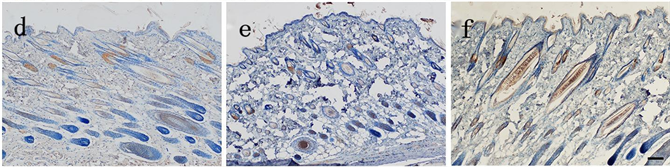
Figure 3. The expression of EⅢA-FN in the skin of the injured group was observed 4 hours after death (Bar = 100 μm). (a) Yellow particles were distributed in sebaceous glands in the injured group 15 min before death; (b) Yellow particles were distributed in the epidermis of the injured group at 0.5 h before the death; (c) There were yellow hairs distributed in part of hair follicles in the injured group 1 h before death; (d) Injury group 2 h before death; (e) Injury group 4h before death; (f) Injury group 8 h before death
图3. 生前损伤组在死后4 h切创创缘皮肤EⅢA-FN表达(Bar = 100 μm)。(a) 生前15 min损伤组有黄色颗粒分布于皮脂腺;(b) 生前0.5 h损伤组有黄色颗粒分布于表皮;(c) 生前1 h损伤组有黄色颗分布于部分毛囊;(d) 生前2 h损伤组;(e) 生前4 h损伤组;(f) 生前8 h损伤组
Table 3. Comparison of the expression of EⅢA-FN in the skin of the injury group and the blank control group at 4 h after death (n = 5, )
表3. 大鼠生前损伤组在死后4 h切创创缘与自身空白对照皮肤EIIIA-FN表达量比较(n = 5, )
Table 4. Comparison of the expression of EⅢA-FN in the skin of the injury group, the normal control group and the skin of the injury group at 4 h after death (n = 5, )
表4. 大鼠生前损伤组在死后4 h切创创缘与正常对照组皮肤、组间切创创缘皮肤EⅢA-FN表达量比较(n = 5, )
各组在死后8 h切创创缘皮肤EⅢA-FN表达:生前15 min损伤组有黄色颗粒分布于皮脂腺,生前2 h损伤组有黄色颗粒分布于毛囊、表皮,随损伤时间延长分布于皮脂腺、毛囊的黄色颗粒逐渐增多,分布于表皮的黄色颗粒变化不明显(见图4)。各组切创创缘与自身空白对照皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05) (见表5)。除生前15 min损伤组外,其余各组切创创缘与正常对照组皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05);损伤组间切创创缘皮肤EⅢA-FN表达量差异有统计学意义(P < 0.05) (见表6)。
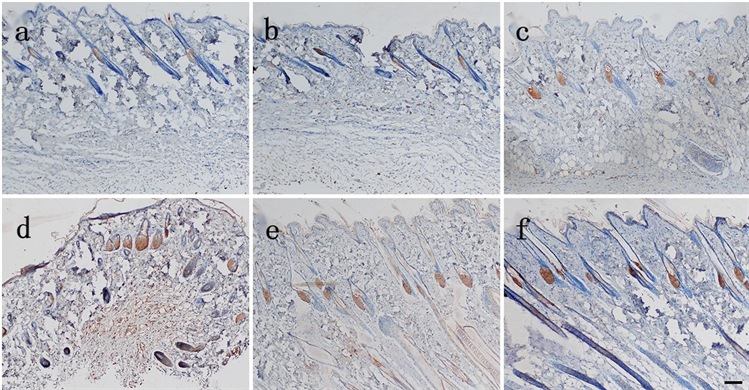
Figure 4. The expression of EⅢA-FN in the skin of the injured group was observed 8 hours after death (Bar = 100 μm). (a) Yellow particles were distributed in sebaceous glands in the injured group 15 min before death; (b) Injured group 0.5 h before death; (c) Injured group 1 h before death; (d) Yellow particles were found in hair follicles and epidermis in the injured groupInjury group 2 h before death; (e) Injury group 4 h before death; (f) Injury group 8 h before death
图4. 生前损伤组在死后8 h切创创缘皮肤EⅢA-FN表达(Bar = 100 μm)。(a) 生前15 min损伤组有黄色颗粒分布于皮脂腺;(b) 生前0.5 h损伤组;(c) 生前1 h损伤组;(d) 生前2 h损伤组有黄色颗分布于毛囊、表皮;(e) 生前4 h损伤组;(f) 生前8 h损伤组
Table 5. Comparison of the expression of EⅢA-FN in the skin of the injury group and the blank control group at 8 h after death (n = 5, )
表5. 大鼠生前损伤组在死后8 h切创创缘与自身空白对照皮肤EⅢA-FN表达量比较(n = 5, )
Table 6. Comparison of the expression of EⅢA-FN in the skin of the injury group, the normal control group and the skin of the injury group at 8 h after death (n = 5, )
表6. 大鼠生前损伤组在死后8 h切创创缘与正常对照组皮肤、组间切创创缘皮肤EⅢA-FN表达量比较(n = 5, )
各组在死后24 h切创创缘皮肤EⅢA-FN表达:生前15 min损伤组有黄色颗粒分布于皮脂腺,生前1 h损伤组有黄色颗粒分布于部分毛囊、表皮,随损伤时间延长分布于皮脂腺、毛囊的黄色颗粒逐渐增多,分布于表皮的黄色颗粒变化不明显(见图5)。各组切创创缘与自身空白对照区域皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05) (见表7)。各组切创创缘与正常对照组皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05);损伤组间切创创缘皮肤EⅢA-FN表达量差异有统计学意义(P < 0.05) (见表8)。
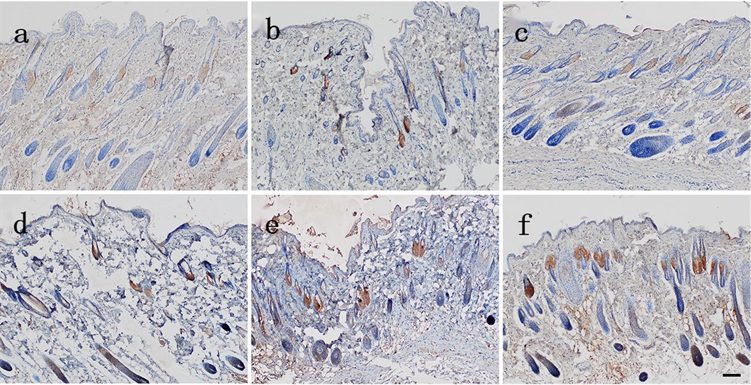
Figure 5. The expression of EⅢA-FN in the skin of the injured group was observed 24 hours after death (Bar = 100 μm). (a) Yellow particles were distributed in sebaceous glands in the injured group 15 min before death; (b) Injured group 0.5 h before death; (c) Yellow granules were found in some hair follicles and epidermis in the injured group 1 h before death; (d) Injury group 2 h before death; (e) Injury group 4 h before death; (f) Injury group 8 h before death
图5. 生前损伤组在死后24 h切创创缘皮肤EⅢA-FN表达(Bar = 100 μm)。(a) 生前15 min损伤组有黄色颗粒分布于皮脂腺;(b) 生前0.5 h损伤组;(c) 生前1 h损伤组有黄色颗粒分布于部分毛囊、表皮;(d) 生前2 h损伤组;(e) 生前4 h损伤组;(f) 生前8 h损伤组
Table 7. Comparison of the expression of EⅢA-FN in the skin of the injury group and the blank control group at 24 h after death (n = 5, )
表7. 大鼠生前损伤组在死后24 h切创创缘与自身空白对照皮肤EⅢA-FN表达量比较(n = 5, )
Table 8. Comparison of the expression of EⅢA-FN in the skin of the injury group, the normal control group and the skin of the injury group at 24 h after death (n = 5, )
表8. 大鼠生前损伤组在死后24 h切创创缘与正常对照组皮肤、组间切创创缘皮肤EⅢA-FN表达量比较(n = 5, )
3.4. 死后损伤组染色结果
在死后2 h、4 h、8 h、24 h,死后损伤组切创创缘皮肤均有黄色颗粒分布于皮脂腺。
皮肤EⅢA-FN表达量比较:除在死后2h死后即刻损伤组切创创缘与自身空白对照皮肤EⅢA-FN表达量差异有统计学意义(P < 0.05)外,余各组均无统计学意义(P > 0.05) (见表9)。除在死后2 h死后即刻损伤组切创创缘与正常对照组皮肤EⅢA-FN表达量差异有统计学意义(P < 0.05)外,余各组均无统计学意义(P > 0.05);除在死后2 h死后损伤组间切创创缘皮肤EⅢA-FN表达量差异无统计学意义(P > 0.05)外,余各组均有统计学意义(P < 0.05) (见表10)。
3.5. 生前损伤组和死后损伤组比较
在死后2 h、4 h、8 h、24 h,生前0.5 h、1 h、2 h、4 h、8 h损伤组与死后损伤组切创创缘皮肤EⅢA-FN表达量的差异均有统计学意义(P < 0.05);在死后8 h、24 h,生前15 min损伤组与死后15 min损伤组切创创缘皮肤EⅢA-FN表达量差异均有统计学意义(P < 0.05) (见表11~14)。
Table 9. Comparison of the expression of EⅢA-FN in the skin of the injured rats at 2 h, 4 h, 8 h and 24 h after death with that of the blank control (n = 5, )
表9. 大鼠死后损伤组在死后2 h、4 h、8 h、24 h切创创缘与自身空白对照皮肤EIIIA-FN表达量比较(n = 5, )
Table 10. Comparison of the expression of EⅢA-FN in the skin and the skin of the injured group at 2 h, 4 h, 8 h and 24 h after death with that of the normal control group (n = 5, )
表10. 大鼠死后损伤组在死后2 h、4 h、8 h、24 h切创创缘与正常对照组皮肤、切创创缘皮肤间EⅢA-FN表达量比较(n = 5, )
Table 11. Comparison of the expression of EⅢA-FN in perioperative skin of rats with antemortem injury group and postmortem injury group at 2 h after death (n = 5, )
表11. 大鼠生前损伤组与死后损伤组在死后2 h切创创缘皮肤EⅢA-FN表达量比较(n = 5, )
Table 12. Comparison of the expression of EⅢA-FN in perioperative skin of rats with antemortem injury group and postmortem injury group at 4 h after death (n = 5, )
表12. 大鼠生前损伤组与死后损伤组在死后4 h切创创缘皮肤EⅢA-FN表达量比较(n = 5, )
Table 13. Comparison of the expression of EⅢA-FN in perioperative skin of rats with antemortem injury group and postmortem injury group at 8 h after death (n = 5, )
表13. 大鼠生前损伤组与死后损伤组在死后8 h切创创缘皮肤EⅢA-FN表达量比较(n = 5, )
Table 14. Comparison of the expression of EⅢA-FN in perioperative skin of rats with antemortem injury group and postmortem injury group at 24 h after death (n = 5, )
表14. 大鼠生前损伤组与死后损伤组在死后24 h切创创缘皮肤EⅢA-FN表达量比较(n = 5, )
3.6. 死后2 h、4 h、8 h、24 h皮肤EⅢA-FN表达量比较
死后2 h、4 h、8 h、24 h取材的皮肤EⅢA-FN表达量比较按随机区组资料分析,各组为区,死后各时间点取材为处理因素。死后2 h、4 h、8 h、24 h皮肤EⅢA-FN表达量差异无统计学意义(P > 0.05),表明死后2 h、4 h、8 h、24 h取材对EⅢA-FN的表达无影响(见表15)。
Table 15. Comparison of skin EⅢA-FN expression in rats at 2 h, 4 h, 8 h and 24 h after death [n = 45, M(IQR)]
表15. 大鼠死后2 h、4 h、8 h、24 h皮肤EⅢA-FN表达量比较[n = 45, M(IQR)]
4. 讨论
既往,国内外部分学者对EⅢA-FN的表达与损伤时间判断进行了一定研究 [4] [6] [7] [8] [9]。但对生前损伤与死后0.5 h内损伤在死后2 h以上EⅢA-FN蛋白质水平的研究相对较少,而尸检工作一般在案发5~6 h后展开,因此,本研究通过对大鼠生前及死后不同时间点切创,利用免疫组织化学图像分析技术方法,观察分析EⅢA-FN表达量的变化情况,探讨EⅢA-FN对于鉴别生前伤与死后伤的研究价值。本实验设计同一只大鼠四肢分别做切创,在死后2 h、4 h、8 h、24 h各时间点分别对应取四肢皮肤检材,目的为了避免因动物个体差异对死后2 h、4 h、8 h、24 h EⅢA-FN表达的影响。法医病理检案中常遇到同一机体遭受多处损伤,需判断各处损伤的先后形成顺序,或同一机体既有生前伤又有死后伤,需判断何者为生前伤何者为死后伤,不同时间内的生前伤或既有生前伤又有死后伤,生化指标测定无法发挥作用,因此,本研究设置损伤组有自身空白对照。
本实验免疫组织化学染色结果显示,大鼠皮肤生前切创在皮肤表皮层、皮脂腺、毛囊均表达EⅢA-FN,其分布与以往研究 [3] [5] 一致。与其他研究结果 [5] 稍有不同的是,EⅢA-FN在表皮层的表达量随损伤时间的延长未见明显增多,考虑大鼠四肢皮肤表皮层较背部皮肤表皮层薄、角质形成细胞较少。人体皮肤损伤后,组织内干细胞进入受损部位并分化成熟以修复损伤的组织结构及功能,皮肤干细胞分布在表皮基底层、毛囊膨大区 [10]。皮肤组织表皮层含有角质形成细胞,EⅢA-FN刺激角质形成细胞增生 [11],且在细胞周期刺激中是高效的 [12],有研究表明银屑病与EIIIA-FN增多有关 [11] [13] [14] [15]。EⅢA-FN在皮脂腺和毛囊部位的表达随损伤时间延长逐渐增多,EⅢA片段可以增强FN促进细胞黏附、迁移、分化和增值的功能,研究发现在发育过程中,神经外胚层细胞形成上皮、皮脂腺、毛囊 [16],此三种上皮细胞系中的每种皆含有自身的干细胞,均参与损伤后表皮的修复 [17];皮脂腺上皮细胞在细胞增殖周期中处于静止期,当组织受到损伤刺激时,进入DNA合成前期,此外,毛囊干细胞,即隆起细胞,表面有大量微绒毛,其可能是毛母质细胞、皮脂腺基底细胞和表皮基底细胞的祖细胞 [18],而EⅢA-FN能促进小鼠和人胚胎干细胞的增殖 [19]。正常对照组大鼠皮肤有少量EⅢA-FN表达,认为脱毛时脱毛膏对大鼠皮肤产生一定的刺激,在刺激的作用下,产生了微量的EⅢA-FN,贺盟 [8] 在培养的成纤维细胞未损伤时,EⅢA-FN也有微量表达。
统计结果显示,生前损伤组切创创缘与自身空白对照皮肤EⅢA-FN表达量差异有统计学意义,表明局部损伤不会引起全身EⅢA-FN表达,即在涉及同一机体多处损伤时EⅢA-FN可以鉴别某一部位损伤时间在生前15 min至8 h的损伤,此外,除在死后2 h死后即刻组损伤组切创创缘与自身空白对照皮肤 EⅢA-FN表达量差异有统计学意义外,在死后4 h、8 h、24 h皮肤EⅢA-FN表达量差异均无统计学意义,死后15 min损伤组切创创缘与自身空白对照皮肤在死后2 h、4 h、8 h、24 h EⅢA-FN表达量差异均无统计学意义,因此,通过同一机体损伤部位和自身未受伤部位皮肤EⅢA-FN表达有无差异来判断生前损伤时间在15 min以上的损伤和死后损伤时间在15 min以上的损伤。
在死后2 h、4 h、8 h、24 h,生前15 min损伤组与死后即刻损伤组切创创缘皮肤EⅢA-FN表达量的差异无统计学意义,在死后8 h、24 h,生前15 min损伤组与死后15 min损伤组切创创缘皮肤EⅢA-FN表达量的差异有统计学意义,但在死后8 h,生前15 min损伤组与正常对照组EⅢA-FN表达量的差异无统计学意义,考虑生前15 min时间较短,死后EⅢA-FN不表达,生前15 min损伤组与死后损伤组EⅢA-FN表达均是脱毛膏作用所致,故尚不能认为生前15 min造成的损伤与死后伤可以区分。生前损伤时间在0.5 h以上的损伤与正常对照组、死后损伤组皮肤EⅢA-FN表达量的差异均有统计学意义,表明可以区分生前损伤时间在0.5 h以上的损伤和死后伤,且死后2 h、4 h、8 h、24 h取材皮肤EⅢA-FN表达量的差异无统计学意义,因此EⅢA-FN有望作为法医病理实践中判断生前伤和死后伤的诊断指标。
结果表明,皮肤局部损伤不会引起全身皮肤EⅢA-FN变化,皮肤早期损伤时间与皮肤EⅢA-FN表达量之间存在一定的正相关关系,EⅢA-FN可以鉴别生前损伤时间在0.5 h以上的损伤和死后15 min内损伤,且死后24 h内不同时间对皮肤EⅢA-FN的表达无影响。此外,EⅢA本身是高度保守的,几乎在所有哺乳动物中,与其他灵长类目的Ⅲ型FN结构域相比,具有几乎相同的序列 [20] [21] [22],EⅢA-FN的研究更有可能从动物实验应用于法医病理学实践中。
本实验大鼠切创模型是在冬季室内环境下进行,其他不同的环境对EⅢA-FN的影响有待于进一步研究,此外,本实验停留在动物水平对EⅢA-FN在皮肤切创的变化进行了初步探讨,对于人体检案的实用性还存在一定的差距,需要进一步探讨和完善。
文章引用
米书娟,杜 鹃,赵 杰,唐立冈,赵 鹏,贾广都,宋 昊. 大鼠皮肤生前和死后切创EⅢA-FN的比较性研究
Comparative Study of EIIIA-FN in Rat Skin Excision before and after Death[J]. 临床医学进展, 2022, 12(07): 6353-6366. https://doi.org/10.12677/ACM.2022.127917
参考文献
- 1. 丛斌. 法医病理学[M]. 第5版. 北京: 人民卫生出版社, 2016: 86.
- 2. 陈忆九, 刘宁国, 黄晓华, 李莉. 大鼠Fn剪接异型体分布及皮肤损伤后表达研究[J]. 法医学杂志, 2001, 17(4): 193-195.
- 3. 刘宁国, 赵子琴, 陈忆九, 顾云菊. 大鼠皮肤损伤后纤维连接蛋白剪接异型体的表达[J]. 法医学杂志, 2000, 16(2): 70-71+74.
- 4. 刘宁国, 陈忆九, 黄晓华, 张建华, 李莉. FN-EIIIA肽段表达与皮肤损伤时间推断研究[J]. 中国司法鉴定, 2002(4): 26-28.
- 5. 贺盟, 赵海, 沈忆文, 薛爱民, 陈龙, 顾云菊, 等. EIIIA+纤维连接蛋白在大鼠皮肤切创的表达[J]. 法医学杂志, 2014, 30(6): 409-412.
- 6. 刘宁国, 陈忆九, 黄晓华, 张建华, 李莉. 大鼠皮肤创伤后EⅢA-FN mRNA表达与损伤时间推断研究[J]. 法医学杂志, 2002(3): 129-131.
- 7. 余松, 薛爱民, 贺盟, 赵子琴, 沈忆文, 顾云菊. 皮肤成纤维细胞纤维连接蛋白及其EDA、EDB表达与损伤时间的关系[J]. 法医学杂志, 2007, 23(3): 188-190.
- 8. 贺盟, 余松, 薛爱民, 沈忆文, 陈龙, 顾云菊, 等. 人皮肤成纤维细胞早期损伤后EDA-FN表达与损伤时间的关系[J]. 法医学杂志, 2007, 23(2): 94-96+封4.
- 9. 薛爱民, 赵子琴, 沈忆文, 顾云菊. 人体皮肤切创纤维连接蛋白EDA、EDB的表达与损伤时间关系的研究[J]. 法医学杂志, 2003, 19(3): 140-142.
- 10. 步宏, 李一雷. 病理学[M]. 第9版. 北京: 人民卫生出版社, 2018: 32.
- 11. McFadden, J.P., Basketter, D.A., Dearman, R.J. and Kimber, I.R. (2011) Extra Domain A-Positive Fibronectin-Positive Feed Back Loops and Their Association with Cutaneous Inflammatory Disease. Clinics in Dermatology, 29, 257-265. https://doi.org/10.1016/j.clindermatol.2010.11.003
- 12. Danen, E.H., Sonneveld, P., Sonnenberg, A. and Yamada, K.M. (2000) Dual Stimulation of Ras/Mitogen-Activated Protein Kinase and RhoA by Cell Adhesion to Fibronectin Supports Growth Factor-Stimulated Cell Cycle Progression. Journal of Cell Biology, 151, 1413-1422. https://doi.org/10.1083/jcb.151.7.1413
- 13. McFadden, J.P., Baker, B.S., Powles, A.V. and Fry, L. (2010) Psoria-sis and Extra Domain A Fibronectin Loops. British Journal of Dermatology, 163, 5-11. https://doi.org/10.1111/j.1365-2133.2010.09737.x
- 14. McFadden, J., Fry, L., Powles, A.V. and Kimber, I. (2012) Concepts in Psoriasis: Psoriasis and the Extra Cellular Matrix. British Journal of Dermatology, 167, 980-986. https://doi.org/10.1111/j.1365-2133.2012.11149.x
- 15. Gubán, B., Vas, K., Balog, Z., Manczinger, M., Bebes, A., Groma, G., et al. (2016) Abnormal Regulation of Fibronectin Production by Fibroblasts in Soriasis. British Journal of Dermatology, 174, 533-541. https://doi.org/10.1111/bjd.14219
- 16. Blanpain, C. and Fuchs, E. (2006) Epidermal Stem Cells of the Skin. Annual Review of Cell and Developmental Biology, 22, 339-373. https://doi.org/10.1146/annurev.cellbio.22.010305.104357
- 17. Tumbar, T., Guasch, G., Greco, V., Blanpain, C., Lowry, W.E., Rendl, M., et al. (2004) Defining the Epithelial Stem Cell Niche in Skin. Science, 303, 359-363. https://doi.org/10.1126/science.1092436
- 18. 高英茂, 李和. 组织学与胚胎学[M]. 第2版. 北京: 人民卫生出版社, 2010: 167.
- 19. Losino, N., Waisman, A., Solari, C., Luzzani, C., Espinosa, D.F., Sassone, A., et al. (2013) EDA-Containing Fibronectin Increases Proliferation of Embryonic Stem Cells. PLOS ONE, 8, Article ID: e80681. https://doi.org/10.1371/journal.pone.0080681
- 20. Pankov, R. and Yamada, K.M. (2002) Fibronectin at a Glance. Journal of Cell Science, 115, 3861-3863. https://doi.org/10.1242/jcs.00059
- 21. Schwarzbauer, J.E. and DeSimone, D.W. (2011) Fibronectins, Their Fibril-logenesis, and in Vivo Functions. Cold Spring Harbor Perspectives in Biology, 3, Article ID: a005041. https://doi.org/10.1101/cshperspect.a005041
- 22. Santas, A.J., Peterson, J.A., Halbleib, J.L., Craig, S.E., Hum-phries, M.J. and Peters, D.M. (2002) Alternative Splicing of the IIICS Domain Infibronectingoverns the Role of the Heparin II Domain in Fibrillogenesis and Cell Spreading. Journal of Biological Chemistry, 277, 13650-13658. https://doi.org/10.1074/jbc.M111361200
NOTES
*通讯作者Email: qyzhaopeng@sina.com
