Traditional Chinese Medicine
Vol.
12
No.
10
(
2023
), Article ID:
74440
,
14
pages
10.12677/TCM.2023.1210472
基于网络药理学方法研究“黄芪–当归”药对治疗非小细胞肺癌的潜在机制
颜乐1,张继先2*
1湖北中医药大学第一临床学院,湖北 武汉
2湖北省中西医结合医院呼吸与危重症医学科,湖北 武汉
收稿日期:2023年9月8日;录用日期:2023年10月17日;发布日期:2023年10月27日

摘要
目的:通过网络药理学的方法探讨“黄芪–当归”药对治疗非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)的潜在机制。方法:通过在线生物信息学工具获得黄芪–当归药对的活性成分和其相对应的靶点,以及NSCLC相关靶点,进而获得黄芪–当归药对与NSCLC的共有靶点,用以构建蛋白–蛋白相互作用(PPI)网络和筛选出核心靶点,并进行基因本体论(GO)分析和京都基因和基因组百科全书(KEGG)通路富集分析,最终建立药对–成分–靶点–通路网络。结果:筛选出黄芪–当归药对治疗NSCLC的主要活性成分和核心靶点。黄芪–当归药对治疗NSCLC的主要活性成分为槲皮素、紫花前胡醇当归酯和前胡素,其核心靶点为SRC、STAT3、AKT1、TP53、HSP90AA1、PIK3CA等。此外,黄芪–当归药对在NSCLC治疗中可能作用于PI3K/Akt和JAK/STAT信号通路。结论:黄芪–当归药对可能通过多成分、多靶点、多途径在NSCLC的治疗中发挥作用,为进一步的实验验证提供了思路与思考。
关键词
网络药理学,黄芪–当归,非小细胞肺癌(NSCLC),作用机制

Study on the Potential Mechanisms of Huangqi-Danggui Drug Pair in the Treatment of Non-Small Cell Lung Cancer Based on Network Pharmacology Approach
Le Yan1, Jixian Zhang2*
1First Clinical Medical College of Hubei University of Chinese Medicine, Wuhan Hubei
2Department of Respiratory and Critical Care Medicine, Hubei Provincial Hospital of Integrated Chinese and Western Medicine, Wuhan Hubei
Received: Sep. 8th, 2023; accepted: Oct. 17th, 2023; published: Oct. 27th, 2023

ABSTRACT
Objective: This paper aims to study on the potential mechanisms of Huangqi-Danggui (HQ-DG) drug pair in the treatment of Non-Small Cell Lung Cancer (NSCLC) by methods of network pharmacology. Approach: Through online bioinformatics tools the active components of HQ-DG drug pair and their corresponding targets, as well as NSCLC related targets, were obtained, and then the common targets of HQ-DG drug pair and NSCLC were obtained to construct protein-protein interaction (PPI) networks and screen out core targets, and perform gene ontology (GO) analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment analysis to establish the drug-component-target-pathway network. Results: The capital active components and core targets of HQ-DG drug pair for the treatment of NSCLC were selected. The capital active components of HQ-DG drug pair for the treatment of NSCLC are quercetin, Decursinol angelate (DA), and Decursin (D); the core targets are SRC, STAT3, AKT1, TP53, HSP90AA1, PIK3CA and so on. Besides, HQ-DG drug pair is likely to act on PI3K/AKT signal pathway and JAK/STAT signal pathway in the treatment of NSCLC. Conclusion: The study indicates that HQ-DG drug pair might play a role in the treatment of NSCLC through multi-components, multi-targets, and multi-pathways, and provides ideas and thoughts for further experimental verification.
Keywords:Network Pharmacology, Huangqi-Danggui (HQ-DG), Non-Small Cell Lung Cancer (NSCLC), Potential Mechanisms

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
根据2020年全球癌症统计数据,当年大约有200多万人被新诊断为癌症,并且大约180多万人死于癌症,其中肺癌是第二常见的癌症,也是癌症死亡的最常见原因 [1] 。肺癌的主要组织学亚型包括非小细胞肺癌(NSCLC)和小细胞癌症(SCLC),其中,非小细胞肺癌是最常见的亚型,占85% [2] [3] 。由于早期症状不明显,大多数肺癌患者进展为晚期疾病,预后较差。据报道,肺癌患者的5年相对生存率仅为19%,非小细胞肺癌(23%)高于小细胞肺癌的(6%) [4] 。严重的不良反应和耐药性使化疗不再是晚期和转移性NSCLC患者的最佳选择 [5] 。靶向治疗和免疫检查点抑制剂的出现改善了晚期非小细胞肺癌的长期生存结果,但因治疗周期长、需要相应护理支持以及治疗成本高昂使得只有一小部分人群从这些药物中受益 [6] 。因此,发现疗效更好、毒性更低、耐药性更小的治疗方法仍是迫切需要关注的方向。
中医药具有资源丰富、毒性低、多靶点等特点,是治疗恶性肿瘤的常用药物 [7] 。中药可以通过提高机体免疫力或抑制肿瘤细胞生长、增殖来抑制NSCLC的进展、入侵和迁移 [8] 。NSCLC在中医古籍中无明确记载,但根据其病症表现可归属于“肺积”“肺痿”“胸痛”等范畴。其发生发展与机体邪盛正虚相关,主要证候要素为气虚、血瘀证,其次为阴虚、痰湿、水饮等 [9] 。对此,中医学常以“扶正、祛邪”为治疗原则。“黄芪–当归”药对是常用的气血双补药对,黄芪味甘、性温,具有益气升阳、补中祛邪等功效;当归味甘辛、性温,有补血活血的作用,二者配伍,益气养血之效更加显著 [10] 。现代药理学研究表明,黄芪、当归及其有效成分在抑制恶性肿瘤生长及侵袭、转移,诱导肿瘤细胞凋亡,增强免疫调节作用等方面发挥了重要作用 [11] [12] [13] 。然而“黄芪–当归”药对治疗NSCLC潜在作用机制的研究鲜有报道。
随着系统生物学、生物信息学和高通量组织学的发展,集药理学和信息网络于一体的网络药理学技术越来越受到人们的关注。中医的主要特点(整体观念,辨证论治)和中药的特点(多成分、多靶点、多通道)与新兴的网络药理学概念的主要观点一致 [14] [15] [16] 。因此,我们通过网络药理学层面进行研究,筛选出黄芪–当归药对治疗NSCLC的潜在药效成分和分子机制,为进一步研究“黄芪–当归”药对治疗NSCLC的潜在作用机制提供科学依据。
2. 方法
2.1. 黄芪–当归药对活性成分和靶点的收集和筛选
本研究利用中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)来收集药物的活性成分 [17] ,分别以“黄芪”和“当归”为检索词,从TCMSP数据库检索并获得黄芪和当归的化学成分,并根据OB ≥ 30%和DL ≥0 05的标准筛选,获得符合条件的化学成分,并查阅相关文献加以补充,即为活性成分 [18] [19] [20] 。再结合TCMSP和SwissTargetPrediction数据库(http://swisstargetprediction.ch)预测各活性成分的作用靶点。最后,将上述2个数据库获得的成分靶点通过UniProt数据库 (https://www.uniprot.org/)对各成分靶点所对应的基因名称进行标准化处理。在整合重复的基因名后,我们获得了黄芪–当归相关靶点。
2.2. 药物–活性成分–靶点网络构建
Cytoscape是一种可视化软件,用于通过构建网络图来表示网络关系 [21] 。将收集到的药物活性成分导入Cytoscape_v3.9.1中并使用其进行可视化。
2.3. NSCLC相关靶点的获取
以“Non-Small Cell Lung Cancer”为关键词,从以下数据库中获取NSCLC相关GeneCards (https://www.genecards.org), OMIM (http://www.omim.org), TTD (https://db.idrblab.net/ttd/)。本研究根据相关性评分值来筛选GeneCards数据库中的靶点,因为相关性评分值越高,目标与疾病的相关性就越近。最后,将来自3个数据库的基因靶点合并,删除重复的靶点后,我们获得了NSCLC相关靶点。
2.4. 药物和疾病共同靶点的获取
将“1.1”和“1.3”获得的基因靶点导入“Venny 2.0”在线工具生成Venn图并得到“黄芪–当归”药对和NSCLC的共同靶点。
2.5. 蛋白质–蛋白质相互作用网络图(PPI)的构建
为了进一步分析目标之间的相互作用关系,将先前获得的共同基因靶点数据导入STRING数据库 [22] (https://cn.string-db.org/)。STRING数据库允许检索蛋白质相互作用关系——表示为蛋白质相互作用的置信度分数。所有蛋白质相互作用数据都经过加权和积分,并具有计算的可靠性值。为了创建PPI网络图,我们选择了“智人”物种,设置“最高可信度(0.900)”及“隐藏网络中断开连接的节点”,并将数据结果导出为“tsv”文件。该文件被输入Cytoscape_v3.9.1以生成PPI网络图。
2.6. 核心靶点网络的构建及Hub靶点获取
针对“1.5”中构建的PPI网络,我们在Cytoscape_v3.9.1中使用了CytoHubba插件 [23] ,通过Degree 算法对PPI网络中的节点进行计算,获得排名前10位的节点即为核心靶点PPI网络中的Hub靶点。接下来,使用分子复合物检测(MCODE)插件进一步细化PPI网络图,从中获得核心网络用于后续分析。
2.7. 核心靶点功能注释和通路富集分析
我们使用Metascape平台(https://metascape.org/gp/index.html#/main/step1)进行基因本体论(GO)分析和京都基因与基因组百科全书(KEGG)通路富集分析。Metascape平台是一款基因功能注释分析的强大工具 [24] 。我们把“黄芪–当归”药对与NSCLC的共同靶点数据导入Metascape平台中,并将“作为物种输入”和“分析物种”项目均设置为“智人”(P < 0.01)。然后进行GO分析和KEGG通路富集分析,并且通过微生信平台(http://www.bioinformatics.com.cn/) 进行可视化处理,结果显示为条形图或气泡图。
3. 结果
3.1. “黄芪–当归”药对活性成分、相关靶点的筛选
首先,采用TCMSP数据库从黄芪、当归2味中药中分别检索到87和125个化学成分,基于OB ≥ 30%、DL ≥ 0.05的筛选标准,共获得“黄芪–当归”药对潜在活性成分57个,其中黄芪潜在活性成分32个,当归潜在活性成分26个,二者共有潜在活性成分1个。此外,结合相关文献报道补充黄芪、当归的主要药效成分,最终共获得“黄芪–当归”药对潜在活性成分66个,活性成分信息见表1。其次,使用TCMSP和SwissTargetPrediction预测获得的活性成分的靶点,经过高可能性筛选和删除重复基因靶点,我们最终获得了568个活性成分的相关靶点。最后,将获得的活性成分及靶点信息导入Cytoscape3.9.1软件进行可视化分析,构建“黄芪–当归”药对活性成分–靶点网络,网络包含636个节点(2个药物节点、66个活性成分节点和568个靶点节点)和1875条边,见图1。根据网络各节点的相关拓扑参数发现,Degree值排名前五点的生物活性化合物分别是H2 (槲皮素,Degree = 150),D31 (紫花前胡醇当归酯,Decursinol angelate, DA, Degree = 108),H16 (二氢异黄酮,Degree = 107),D30 (前胡素,Decursin, D, Degree = 107)。这些活性成分被认为是“黄芪–当归”药对治疗NSCLC的主要生物活性成分。
Table 1. Basic information of active ingredients in Astragali Radix and Angelicae Sinensis Radix
表1. “黄芪–当归”药对活性成分的基本信息
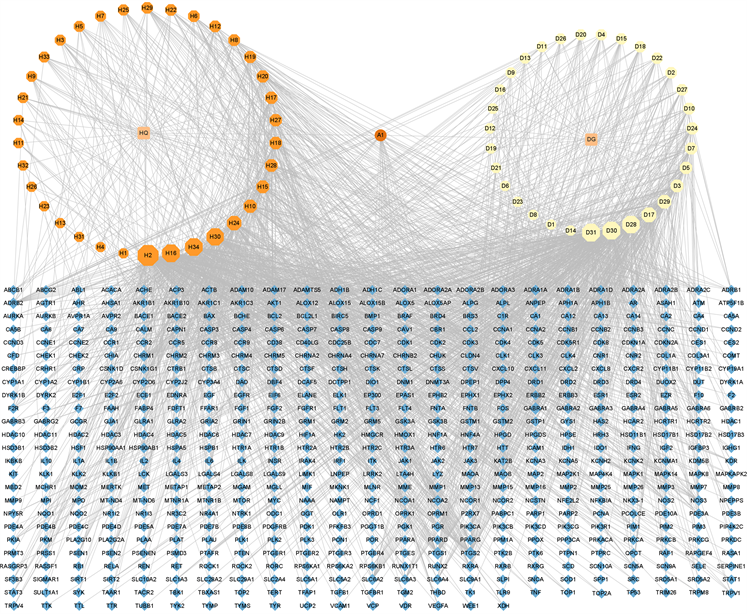
Figure 1. Ingredients-targets network of Astragali Radix and Angelicae Sinensis Radix
图1. “黄芪–当归”药对活性成分–靶点网络图
3.2. “黄芪–当归”药对治疗NSCLC靶点的筛选
通过检索GeneCards、OMIM和TTD数据库,我们获得了1947个NSCLC相关靶点。再采用“Venny 2.0”在线工具获得NSCLC与“黄芪–当归”药对活性成分的交集靶点共249个,见图2。
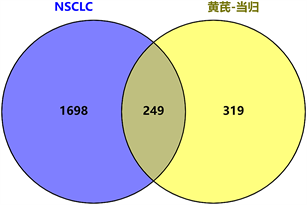
Figure 2. Screening of related targets of ingredients in Astragali Radix and Angelicae Sinensis Radix for NSCLC
图2. “黄芪–当归”药治疗NSCLC潜在作用靶点的筛选
3.3. “黄芪–当归”药对治疗NSCLC核心靶点PPI网络分析及重要靶点筛选
对导入STRING数据库的249个交集靶点的分析表明,PPI网络中涉及231个节点,涉及1182条边,将这些导入到Cytoscape中以获得,见图3(a)。在使用CytoHubba中的Degree算法进行分析后,获得前10个重要靶点,如SRC、STAT3、AKT1、TP53、HSP90AA1、PIK3CA、PIK3R1等,显示为气泡图,见图3(b),较深的颜色代表靶点在蛋白质相互作用关系中的更关键影响。
使用MCODE插件选择得分为10分的核心网络。该核心网络包含46个具有渐变颜色的节点,并涉及224条边,见图3(c)。这些节点是根据黑暗颜色深浅程度设置的,可以得出结论,STAT3、HSP90AA1、PIK3CA等深色节点是“黄芪–当归”有效作用于NSCLC的关键靶点。

Figure 3. PPI network (a), the top 10 important targets in the PPI network (b), and core network (c)
图3. PPI网络(a),PPI网络中前10位重要靶点(b),核心网络(c)
3.4. “黄芪–当归”药对治疗NSCLC核心靶点GO注释和KEGG通路分析
在Metascape平台上对核心靶点进行GO分析和KEGG通路富集分析,并在微生信平台的帮助下对结果进行可视化。GO分析包括三个维度,即分子功能分析、生物过程分析和细胞成分分析。核心靶点的GO分析结果见图4,结果显示其分子功能主要涉及激酶结合、激酶活性、细胞因子受体结合、磷酸酶结合等;生物过程主要关注调节激酶活性、磷酸化的正向调节、蛋白质磷酸化、细胞迁移的积极调节等;核心靶点主要作用于转移酶复合物、受体复合物、膜的外在成分、基底质膜等细胞成分。KEGG通路富集分析表明,核心靶点涉及的主要途径包括PI3K/AKT信号通路和JAK/STAT信号通路,见图5。
3.5. “黄芪–当归”药对治疗NSCLC“药对–核心成分–核心靶点–通路”网络分析
根据核心靶点所富集到的与NSCLC密切相关的信号通路,利用Cytoscape 3.9.1构建“药对–活性成分–核心靶点–通路”网络,涉及有92个节点和411条边,见图6。并通过其中的网络分析工具对网络拓扑参数进行分析,推测该网络的核心通路和核心靶点。“黄芪–当归”药对治疗NSCLC核心靶点分布与不同的信号通路,进一步体现了“黄芪–当归”药对多成分、多靶点及多通路的作用特点。

Figure 4. Functional enrichment analysis of core targets of Astragali Radix and Angelicae Sinensis Radix for NSCLC
图4. “黄芪–当归”药对治疗NSCLC核心靶点GO注释分析结果
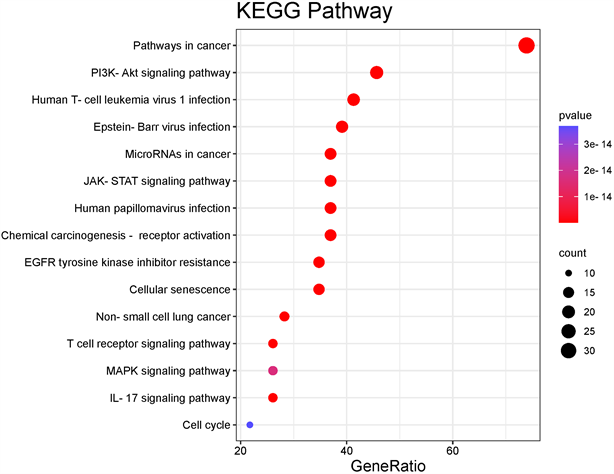
Figure 5. Pathway enrichment analysis of core targets of Astragali Radix and Angelicae Sinensis Radix for NSCLC
图5. “黄芪–当归”药对抗 NSCLC核心靶点KEGG通路分析结果

Figure 6. Herb pairs-active ingredients-core targets-pathways network of Astragali Radix and Angelicae Sinensis Radix for NSCLC
图6. “黄芪–当归”药对治疗NSCLC“药对–活性成分–核心靶点–通路”的网络
4. 讨论
尽管综合治疗给NSCLC患者带来了巨大的生存收益,但NSCLC患者的总体治愈率和生存率仍然难以让人满意,特别是在转移性疾病中。因此,需要继续研究新的治疗方法,以期将临床益处扩大到更广泛的患者群体,并改善NSCLC的预后 [25] 。药对是根据中医基础理论,经过临床应用并被证明有效且符合一定组合法度的2味药物的配对组合,通过这样的组成简单却具备中药配伍的基本特点的配伍组合,从而发挥协同增效或配伍减毒等作用 [26] 。中药具有多成分、多靶点、多通路的治疗特点而在改善肺癌患者临床症状、提高生存质量以及延长患者生存期等方面具有独特的优势。“黄芪–当归”药对为中医临床常用的气血双补药对,现代药理学研究表明,此药对具有抑制肺癌的进展,对抗癌症恶病质和癌症炎症的作用 [27] 。然而“黄芪–当归”药对协同治疗NSCLC的作用机制仍未见系统研究。本研究采用网络药理学的方法,研究“黄芪–当归”药对成分–靶点–通路间的相互作用,从整体角度出发系统揭示“黄芪–当归”药对抗NSCLC的复杂分子机制。
根据“黄芪–当归”药对治疗NSCLC“药对–活性成分–核心靶点–通路”网络,槲皮素是最显著的化合物,其次相关性较强的化合物还有紫花前胡醇当归酯和前胡素。槲皮素是一种类黄酮类化合物,可以特异性地延缓癌细胞的生长,并作为一种有效的癌症化学预防药物,其可以通过调节细胞周期、细胞增殖、凋亡、血管生成、转移和自噬来发挥抗肿瘤活性 [28] 。据报道,槲皮素对微丝、微管和波形蛋白的分解作用及其对波形蛋白和N-钙粘蛋白表达的抑制作用可能是其抑制肺癌A549细胞迁移的原因 [29] 。同时,槲皮素作为肺癌的肿瘤抑制因子和化学增敏剂也已被广泛发现 [30] [31] 。DA和D都属于吡喃香豆素类化合物,其中,DA是D的同分异构体,它们都大量存在于当归中,并且具有良好的抗癌特性 [32] 。据报道,DA可导致癌细胞生长抑制和细胞周期阻滞,并可通过调低活性氧(ROS)水平和线粒体膜电位来促进癌细胞凋亡 [33] 。DA亦可通过抑制谷氨酸脱氢酶1分解来诱导具有多重耐药性的结直肠癌细胞死亡 [34] 。D可抑制内皮祖细胞(EPC)分化和功能,从而抑制早期肿瘤发生的肿瘤血管生成 [35] 。D也可抑制NF-κB转录活性,来降低P-糖蛋白的水平,最终增强对多柔比星具有耐药性的癌细胞的化学敏感性,并且诱导在多柔比星存在下的细胞凋亡 [36] 。因此,“黄芪–当归”药对可能是通过这些主要化合物来抑制NSCLC的进展。
根据分析PPI网络获取的Hub靶点及核心网络靶点,我们选择STAT3、AKT1、PIK3CA作为研究对象。STAT3 (信号转导器和转录激活剂3)是一种信号转录蛋白,其异常激活与许多生物过程相关,包括细胞凋亡、增殖、转移、血管生成、免疫抑制和耐药性 [37] [38] [39] 。AKT是一种丝氨酸/苏氨酸蛋白激酶,被认为是一种原癌基因 [40] 。而AKT1作为AKT的一个亚型,可能在非小细胞肺癌的发生和发展中发挥促进作用 [41] 。据相关文献报道,沉默AKT1和靶向AKT通路的抑制剂可有效促进肺腺癌细胞增殖、迁移和侵袭 [42] 。PI3K (磷脂酰肌醇3-激酶)是一种具有特异性的磷酸化磷脂酰肌醇的激酶,而PIK3CA是属于PI3K三种亚型之一,与肿瘤密切相关 [43] 。PIK3CA基因可以降低非小细胞肺癌细胞对生长因子的依赖,并且抑制癌细胞的凋亡和促进肿瘤的侵袭 [44] 。
再根据KEGG通路富集分析,PI3K/AKT信号通路和JAK/STAT信号通路可能是“黄芪–当归”药对的主要通路。据相关报道,PI3K/AKT信号通路在哺乳动物细胞的多种功能中起着核心作用,如细胞的生长、迁移、增殖和代谢 [45] [46] 。PI3K/AKT通路的过度激活在不同的肿瘤中被观察到,并与肿瘤的发生、免疫微环境和癌细胞的化疗耐药性密切相关 [47] 。JAK/STAT信号通路可推动一系列生理和病理过程,包括细胞增殖、代谢、免疫反应、炎症和恶性肿瘤 [48] 。JAK/STAT转导激活促炎细胞因子信号传导,影响免疫平衡,进而有助于自身免疫性疾病的发展和癌症进展 [49] [50] [51] 。
综上所述,此研究通过网络药理学系统分析了“黄芪–当归”药对可能通过多成分、多靶点、多通路治疗非小细胞肺癌的潜在作用机制,为进一步的实验验证提供了思路与思考。
文章引用
颜 乐,张继先. 基于网络药理学方法研究“黄芪–当归”药对治疗非小细胞肺癌的潜在机制
Study on the Potential Mechanisms of Huangqi-Danggui Drug Pair in the Treatment of Non-Small Cell Lung Cancer Based on Network Pharmacology Approach[J]. 中医学, 2023, 12(10): 3161-3174. https://doi.org/10.12677/TCM.2023.1210472
参考文献
- 1. Sung, H., Ferlay, J., Siegel, R.L., et al. (2021) Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 71, 209-249. https://doi.org/10.3322/caac.21660
- 2. Zhang, Q., Tang, L., Zhou, Y., He, W.B. and Li, W.M. (2021) Immune Checkpoint Inhibitor-Associated Pneumonitis in Non-Small Cell Lung Cancer: Current Understanding in Characteristics, Diagnosis, and Management. Frontiers in Immunology, 12, Article 663986. https://doi.org/10.3389/fimmu.2021.663986
- 3. Bodor, J.N., Boumber, Y. and Borghaei, H. (2020) Biomarkers for Immune Checkpoint Inhibition in Non-Small Cell Lung Cancer (NSCLC). Cancer, 126, 260-270. https://doi.org/10.1002/cncr.32468
- 4. Schabath, M.B. and Cote, M.L. (2019) Cancer Progress and Priorities: Lung Cancer. Cancer Epidemiology Biomarkers & Prevention, 28, 1563-1579. https://doi.org/10.1158/1055-9965.EPI-19-0221
- 5. Yuan, M., Huang, L.L., Chen, J.H., Wu, J. and Xu, Q. (2019) The Emerging Treatment Landscape of Targeted Therapy in Non-Small-Cell Lung Cancer. Signal Transduction and Targeted Therapy, 4, Article No. 61. https://doi.org/10.1038/s41392-019-0099-9
- 6. Shokoohi, A., Al-Hashami, Z., Moore, S., et al. (2022) Effect of Targeted Therapy and Immunotherapy on Advanced Nonsmall-Cell Lung Cancer Outcomes in the Real World. Cancer Medicine, 11, 86-93. https://doi.org/10.1002/cam4.4427
- 7. Xiang, Y., Guo, Z., Zhu, P., Chen, J. and Huang, Y.Y. (2019) Traditional Chinese Medicine as a Cancer Treatment: Modern Perspectives of Ancient but Advanced Science. Cancer Medicine, 8, 1958-1975. https://doi.org/10.1002/cam4.2108
- 8. Zhang, L., Zhang, F.Y. and Li, G.F. (2021) Traditional Chinese Medicine and Lung Cancer—From Theory to Practice. Biomedicine & Pharmacotherapy, 137, Article ID: 111381. https://doi.org/10.1016/j.biopha.2021.111381
- 9. 全建峰, 任革, 白小娜, 等. 中晚期非小细胞肺癌中医证型研究[J]. 河北中医药学报, 2016, 31(4): 11-14.
- 10. 王文越, 王新蒙, 许丹丹, 等. 黄芪-当归药对配伍效用及其影响因素研究概况[J]. 中国中医基础医学杂志, 2023, 29(5): 865-870.
- 11. 袁伟琛, 甄建华, 李晓红. 黄芪抗肿瘤作用的研究现状[J]. 中华中医药学刊, 2023, 41(6): 91-97.
- 12. 马燕, 张育贵,石露萍, 等. 当归炮制品及其化学成分和药理作用研究进展[J]. 中国中药杂志: 1-10. https://doi.org/10.19540/j.cnki.cjcmm.20230717.301, 2023-07-19.
- 13. 王雪振, 张小雨, 牟悦, 等. 当归补血汤在恶性肿瘤中作用的研究进展[J]. 中国实验方剂学杂志, 2022, 28(9): 214-220.
- 14. Zhou, Z., Chen, B., Chen, S., et al. (2020) Applications of Network Pharmacology in Traditional Chinese Medicine Research. Evidence-Based Complementary and Alternative Medicine, 2020, Article ID: 1646905. https://doi.org/10.1155/2020/1646905
- 15. Guo, Q., Mao, X., Zhang, Y., et al. (2016) Guizhi-Shaoyao-Zhimu Decoction Attenuates Rheumatoid Arthritis Partially by Reversing Inflammation-Immune System Imbalance. Journal of Translational Medicine, 14, Article No. 165. https://doi.org/10.1186/s12967-016-0921-x
- 16. Wu, X.M. and Wu, C.F. (2015) Network Pharmacology: A New Approach to Unveiling Traditional Chinese Medicine. Chinese Journal of Natural Medicines, 13, 1-2. https://doi.org/10.1016/S1875-5364(15)60001-2
- 17. Ru, J., Li, P., Wang, J., et al. (2014) TCMSP: A Database of Systems Pharmacology for Drug Discovery from Herbal Medicines. Journal of Cheminformatics, 6, Article No. 13. https://doi.org/10.1186/1758-2946-6-13
- 18. 李亚男, 荣小凤, 曹文富, 等. 黄芪抗肿瘤有效成分及作用机制研究进展[J]. 实用中医药杂志, 2017, 33(3): 341-343.
- 19. 王常明, 姜睿斌, 李锋. 当归化学成分及抗肿瘤作用机制的研究进展[J]. 癌变∙畸变∙突变, 2019, 31(2): 162-165.
- 20. 徐婷, 麦葭沂, 向俊, 等. “黄芪-当归”药对主要活性成分的网络药理学研究[J]. 中药材, 2017, 40(9): 2195-2201.
- 21. Otasek, D., Morris, J.H., Bouças, J., Pico, A.R. and Demchak, B. (2019) Cytoscape Automation: Empowering Workflow- Based Network Analysis. Genome Biology, 20, Article No. 185. https://doi.org/10.1186/s13059-019-1758-4
- 22. Szklarczyk, D., Morris, J.H., Cook, H., et al. (2017) The STRING Database in 2017: Quality-Controlled Protein-Protein Association Networks, Made Broadly Accessible. Nucleic Acids Research, 45, D362-D368. https://doi.org/10.1093/nar/gkw937
- 23. Chin, C.H., Chen, S.H., Wu, H.H., et al. (2014) cytoHubba: Identifying Hub Objects and Sub-Networks from Complex Interactome. BMC Systems Biology, 8, Article No. S11. https://doi.org/10.1186/1752-0509-8-S4-S11
- 24. Zhou, Y., Zhou, B., Pache, L., et al. (2019) Metascape Provides a Biologist-Oriented Resource for the Analysis of Systems-Level Datasets. Nature Communications, 10, Article No. 1523. https://doi.org/10.1038/s41467-019-09234-6
- 25. Herbst, R.S., Morgensztern, D. and Boshoff, C. (2018) The Biology and Management of Non-Small Cell Lung Cancer. Nature, 553, 446-454. https://doi.org/10.1038/nature25183
- 26. 唐于平, 束晓云, 李伟霞, 等. 药对研究(Ⅰ)——药对的形成与发展[J]. 中国中药杂志, 2013, 38(24): 4185-4190.
- 27. Wu, T.H., Yeh, K.Y., Wang, C.H., et al. (2019) The Combination of Astragalus membranaceus and Angelica sinensis Inhibits Lung Cancer and Cachexia through Its Immunomodulatory Function. Journal of Oncology, 2019, Article ID: 9206951. https://doi.org/10.1155/2019/9206951
- 28. Rather, R.A. and Bhagat, M. (2020) Quercetin as an Innovative Therapeutic Tool for Cancer Chemoprevention: Molecular Mechanisms and Implications in Human Health. Cancer Medicine, 9, 9181-9192. https://doi.org/10.1002/cam4.1411
- 29. Klimaszewska-Wiśniewska, A., Hałas-Wiśniewska, M., et al. (2017) Antiproliferative and Antimetastatic Action of Quercetin on A549 Non-Small Cell Lung Cancer Cells through Its Effect on the Cytoskeleton. Acta Histochemica, 119, 99-112. https://doi.org/10.1016/j.acthis.2016.11.003
- 30. Lee, S.H., Lee, E.J., Min, K.H., et al. (2015) Quercetin Enhances Chemosensitivity to Gemcitabine in Lung Cancer Cells by Inhibiting Heat Shock Protein 70 Expression. Clinical Lung Cancer, 16, E235-E243. https://doi.org/10.1016/j.cllc.2015.05.006
- 31. Guo, H., Ding, H., Tang, X., et al. (2021) Quercetin Induces Pro-Apoptotic Autophagy via SIRT1/AMPK Signaling Pathway in Human Lung Cancer Cell Lines A549 and H1299 in vitro. Thoracic Cancer, 12, 1415-1422. https://doi.org/10.1111/1759-7714.13925
- 32. Lee, H.J., Lee, H.J., Lee, E.O., et al. (2009) In vivo Anti-Cancer Activity of Korean Angelica gigas and Its Major Pyranocoumarin Decursin. The American Journal of Chinese Medicine, 37, 127-142. https://doi.org/10.1142/S0192415X09006722
- 33. Chang, S.N., Khan, I., Kim, C.G., et al. (2021) Decursinol Angelate Arrest Melanoma Cell Proliferation by Initiating Cell Death and Tumor Shrinkage via Induction of Apoptosis. International Journal of Molecular Sciences, 22, Article 4096. https://doi.org/10.3390/ijms22084096
- 34. Chang, S.N. and Kang, S.C. (2023) Decursinol Angelate Inhibits Glutamate Dehydrogenase 1 Activity and Induces Intrinsic Apoptosis in MDR-CRC Cells. Cancers, 15, Article 3541. https://doi.org/10.3390/cancers15143541
- 35. Jung, S.Y., Choi, J.H., Kwon, S.M., et al. (2012) Decursin Inhibits Vasculogenesis in Early Tumor Progression by Suppression of Endothelial Progenitor Cell Differentiation and Function. Journal of Cellular Biochemistry, 113, 1478-1487. https://doi.org/10.1002/jcb.24085
- 36. Choi, H.S., Cho, S.G., Kim, M.K., et al. (2016) Decursin in Angelica gigas Nakai (AGN) Enhances Doxorubicin Chemosensitivity in NCI/ADR-RES Ovarian Cancer Cells via Inhibition of P-Glycoprotein Expression. Phytotherapy Research, 30, 2020-2026. https://doi.org/10.1002/ptr.5708
- 37. Tošić, I. and Frank, D.A. (2021) STAT3 as a Mediator of Oncogenic Cellular Metabolism: Pathogenic and Therapeutic Implications. Neoplasia, 23, 1167-1178. https://doi.org/10.1016/j.neo.2021.10.003
- 38. Zou, S., Tong, Q., Liu, B., et al. (2020) Targeting STAT3 in Cancer Immunotherapy. Molecular Cancer, 19, Article 145. https://doi.org/10.1186/s12943-020-01258-7
- 39. Yu, H. and Jove, R. (2004) The STATs of Cancer—New Molecular Targets Come of Age. Nature Reviews Cancer, 4, 97-105. https://doi.org/10.1038/nrc1275
- 40. Zhang, J., Liu, X., Zhang, G., et al. (2023) To Explore the Effect of Kaempferol on Non-Small Cell Lung Cancer Based on Network Pharmacology and Molecular Docking. Frontiers in Pharmacology, 14, Article ID: 1148171. https://doi.org/10.3389/fphar.2023.1148171
- 41. Zhou, J., Sun, M., Jin, S., et al. (2019) Combined Using of Paclitaxel and Salinomycin Active Targeting Nanostructured Lipid Carriers against Non-Small Cell Lung Cancer and Cancer Stem Cells. Drug Delivery, 26, 281-289. https://doi.org/10.1080/10717544.2019.1580799
- 42. Wang, S., Liu, X., Zhou, T., et al. (2023) PKMYT1 Inhibits Lung Adenocarcinoma Progression by Abrogating AKT1 Activity. Cellular Oncology, 46, 195-209. https://doi.org/10.1007/s13402-022-00744-y
- 43. 孙肖, 毕经旺. PI3K抑制剂与非小细胞性肺癌[J]. 中国肿瘤生物治疗杂志, 2017, 24(5): 547-552.
- 44. 宋忠花, 张金庆, 王言森. PIK3CA基因对人非小细胞肺癌A549细胞侵袭及迁移能力的影响[J]. 解剖科学进展, 2018, 24(3): 293-295.
- 45. Pompura, S.L. and Dominguez-Villar, M. (2018) The PI3K/AKT Signaling Pathway in Regulatory T-Cell Development, Stability, and Function. Journal of Leukocyte Biology, 103, 1065-1076. https://doi.org/10.1002/JLB.2MIR0817-349R
- 46. Zhang, M. and Zhang, X. (2019) The Role of PI3K/AKT/FOXO Signaling in Psoriasis. Archives of Dermatological Research, 311, 83-91. https://doi.org/10.1007/s00403-018-1879-8
- 47. Jiang, N., Dai, Q., Su, X., et al. (2020) Role of PI3K/AKT Pathway in Cancer: The Framework of Malignant Behavior. Molecular Biology Reports, 47, 4587-4629. https://doi.org/10.1007/s11033-020-05435-1
- 48. Xue, C., Yao, Q., Gu, X., et al. (2023) Evolving Cognition of the JAK-STAT Signaling Pathway: Autoimmune Disorders and Cancer. Signal Transduction and Targeted Therapy, 8, Article No. 204. https://doi.org/10.1038/s41392-023-01468-7
- 49. Hu, X., Li, J., Fu, M., Zhao, X. and Wang, W. (2021) The JAK/STAT Signaling Pathway: From Bench to Clinic. Signal Transduction and Targeted Therapy, 6, Article No. 402. https://doi.org/10.1038/s41392-021-00791-1
- 50. Tzeng, H.T., Chyuan, I.T. and Lai, J.H. (2021) Targeting the JAK-STAT Pathway in Autoimmune Diseases and Cancers: A Focus on Molecular Mechanisms and Therapeutic Potential. Biochemical Pharmacology, 193, Article ID: 114760. https://doi.org/10.1016/j.bcp.2021.114760
- 51. Villarino, A.V., Kanno, Y. and O’Shea, J.J. (2017) Mechanisms and Consequences of Jak-STAT Signaling in the Immune System. Nature Immunology, 18, 374-384. https://doi.org/10.1038/ni.3691
NOTES
*通讯作者。
