Advances in Clinical Medicine
Vol.
11
No.
04
(
2021
), Article ID:
41870
,
6
pages
10.12677/ACM.2021.114266
局灶性癫痫与全面性癫痫患者的 GABA基因多态性研究
彭 淑1,王 兰2,孙妍萍1*
1青岛大学附属医院神经内科,山东 青岛
2山东省青岛市第八人民医院神经内科,山东 青岛

收稿日期:2021年3月22日;录用日期:2021年4月19日;发布日期:2021年4月26日

摘要
目的:探讨GABA受体基因多态性在局灶性癫痫与全面性癫痫中是否存在差异。方法:将85例癫痫患者分为全面性发作组(n = 26)和局灶性发作组(n = 59),对患者样本进行测序,得到患者基因型结果,并进行统计分析。结果:rs211037的基因型频率和等位基因频率在局灶性发作组和全面性发作组中无明显差异(p = 0.173; p = 0.839),rs121909673在本研究所有患者中均未发生突变。结论:我们观察到rs211037和rs121909673在局灶性发作组和全面性发作组中差异无统计学意义,这些结果表明,GABA基因多态性与不同癫痫分类的关联不明确,仍需要进一步的研究。
关键词
局灶性癫痫,全面性癫痫,GABA,单核苷酸多态性

The Study on GABA Gene Polymorphism in Patients with Focal Epilepsy and Generalized Epilepsy
Shu Peng1, Lan Wang2, Yanping Sun1*
1Department of Neurology, The Affiliated Hospital of Qingdao University, Qingdao Shandong
2Department of Neurology, The Eighth People’s Hospital of Qingdao, Qingdao Shandong

Received: Mar. 22nd, 2021; accepted: Apr. 19th, 2021; published: Apr. 26th, 2021

ABSTRACT
Objective: To investigate whether there is a difference between GABA receptor gene polymorphism in focal epilepsy and generalized epilepsy. Methods: The 85 epilepsy patients were divided into two groups: generalized seizure group (n = 26) and focal seizure group (n = 59). The patient samples were sequenced to obtain the patient genotype results, and the results were statistically analyzed. Results: The genotype frequency and allele frequency of rs211037 showed no significant difference between the focal seizure group and the generalized seizure group (p = 0.173; p = 0.839), and there was no mutation of rs121909673 in all patients in this study. Conclusion: We observed that there was no significant difference in rs211037 and rs121909673 between focal seizures and generalized seizures. These results indicate that the association between GABA gene polymorphism and different types of epilepsy is not clear and further study is needed.
Keywords:Focal Epilepsy, Generalized Epilepsy, GABA, Single Nucleotide Polymorphisms

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
癫痫是一种慢性神经系统疾病,其定义为“由于大脑中异常过度或同步的神经元活动而出现的短暂的体征和/或症状” [1]。其特征是反复、无缘无故的癫痫发作 [2]。它是世界上最常见的神经系统疾病之一,影响着大约1%的世界人口(约6500万人),每年约有240万人新诊断为癫痫 [3],也是世界范围内负担最重的神经系统疾病之一 [4]。虽然癫痫的病因多种多样,但一些癫痫是遗传性的,最常见的遗传性疾病是由具有显著功能影响的致病变异(突变)引起的 [5]。尽管癫痫的患病率很高,但是仍未得到足够的重视,一项系统回顾发现,中国40%~50%的活动性癫痫患者没有得到足够的治疗 [6],这就是所谓的治疗差距。未经治疗或不定期治疗的癫痫对个人、家庭甚至是社会都构成了巨大威胁,无论是经济上、身体上还是心理上都是如此 [7],包括严重的受伤风险和偶尔的死亡风险,最常见的是癫痫猝死(SUDEP) [8] [9] [10] [11]。
癫痫根据发作症状可以分为全面性癫痫和部分性癫痫(或局灶性癫痫),全面性癫痫被定义为以全面性癫痫发作、双侧运动表现、发作间期和发作期广泛性脑电图放电为特征,局灶性癫痫包括单灶性和多灶性疾病,以及累及单侧大脑半球的癫痫发作;从病因学角度上来看,可以分为特发性和症状性癫痫,症状性癫痫的概念已被分成几个病因学类别:代谢、结构、感染、遗传、免疫和未知 [12] [13],而特发性癫痫的病因尚不明确,目前一些研究认为其与基因遗传相关 [14]。
γ-氨基丁酸(GABA)是一种抑制性神经递质,通过与突触前和突触后突起质膜上的特异性跨膜受体结合,作用于脑内的抑制性突触 [15],GABA受体分为3类,其中GABA (A)和GABA (C)受体是配体门控离子通道复合体的一部分,而代谢性受体GABA (B)是G蛋白偶联受体,通过G蛋白打开或关闭离子通道 [16]。γ-氨基丁酸(GABA)受体一直是癫痫病因和治疗的重要靶点,关于GABA与癫痫之间的研究较多,但是关于GABA与不同癫痫分类之间的相关性研究较少,因此本研究旨在评估GABA基因多态性在全面性癫痫与局灶性癫痫之间的差异。
2. 对象和方法
2.1. 研究对象
选择青岛大学附属医院门诊就诊的癫痫患者85例,纳入标准是根据癫痫诊断原则及分类标准:有典型的癫痫发作症状和(或)脑电图异常,排除所有已知病因的症状性癫痫患者及根据临床症状和脑电图等辅助检查不能分类的癫痫患者。参照国际抗癫痫联盟以及中国癫痫诊疗指南有关局灶性癫痫及全面性癫痫的定义将患者分为全面性癫痫组和局灶性癫痫组。局灶性发作:发作起始症状及脑电图改变提示大脑半球部分神经元首先被激活;全面性发作:发作起始症状及脑电图提示双侧大脑半球同时受累,其中26例为全面性发作,59例为局灶性发作。本研究获得患者理解及知情同意。
2.2. 研究方法
使用EDTA抗凝管留取患者外周血3 ml,于−20℃冰箱保存样本,按照核酸提取说明书使用血液基因组DNA提取试剂盒提取DNA样本,核酸样品需取3 ml进行电泳鉴定,初步判断核酸质量,针对目标位点设计不同长度延伸引物,每个位点设计3条引物(1对扩增引物和1条延伸引物),引物使用Primer Primer5软件设计,然后进行PCR扩增,引物信息见表1、表2。取稀释后的扩增产物进行虾碱酶纯化、单碱基延伸反应,将2 μL延伸反应后的产物按照样品孔位顺序加到已分好预混液的板上,盖上反应胶垫,4000 rpm离心1 min后上PCR仪。反应条件:PCR仪96℃变性4 min,下PCR仪后立即放在冰上冷却至4℃,离心至2000 rpm之后上3730测序仪进行检测(图1为其中一个样本的两位点测序峰图)。
Table 1. PCR primer
表1. PCR引物
Table 2. Single base extension primer
表2. 单碱基延伸引物
2.3. 统计学分析
本研究采用IBM SPSS软件版本22.0进行统计学处理,组间基因型、等位基因频率比较使用卡方检验,当n小于40或列联表中有五分之一的格子数小于5时,应用Fisher精确检验进行分析。p值 < 0.05表明差异具有统计学意义,p值 < 0.01表明差异具有显著性。
3. 结果
本研究共纳入受试者85例,其中全面性癫痫组26例,局灶性癫痫组59例,经过χ2检验,结果显示局灶组和全面组相比,SNP rs211037、rs121909673的基因型频率、等位基因频率在两组之间的分布无差异(见表3)。
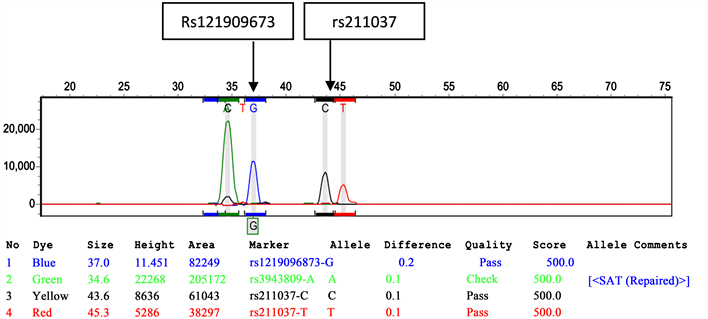
Figure 1. rs121909673 + rs211037
图1. rs121909673 + rs211037
Table 3. The genotype and allele frequency of rs211037 and rs121909673 in patients with focal and generalized epilepsy
表3. 局灶性和全面性癫痫患者rs211037、rs121909673的基因型和等位基因频率
注:P值由卡方检验(chi-square test)分析计算,SNP:单核苷酸多态性,OR = 优势比,CI = 置信区间
4. 讨论
γ-氨基丁酸作为大脑中主要的抑制性神经递质发挥着重要的作用,这些抑制作用是通过GABA受体介导的 [15],只有组装正确的受体才能通过内质网到达细胞表面和突触,当被GABA激活后它们在那里传递氯电流。只有到达细胞表面和突触的受体才能传递氯离子并发挥作用,而位于细胞内的亚基则没有功能 [17]。这些受体是主要位于神经元顶端树突的突触后受体,引起快速抑制的突触后电位。在成人大脑中,由于K+/Cl−共转运体的活性,大多数神经元内的细胞内氯离子浓度(Cl-)i低于细胞外间隙的氯离子浓度(Cl-)e。当GABA激活GABA受体时,中央孔打开,使得更多的氯离子进入细胞内,导致超极化,最终减少产生动作电位的机会。编码这些亚基的基因功能障碍会影响离子通道门控、受体的表达以及向细胞表面的转运 [15] [18]。目前已知与癫痫相关的GABA受体有GABA (A)和GABBR。GABAB受体与G蛋白偶联,其与兴奋性神经递质L-谷氨酸的代谢性受体序列相似。GABAB受体可以增加突触后K+电导,K+电导的增加可以导致长程抑制性突触后电位,从而抑制突触前神经递质的释放,致使突触后膜神经元的活化停止。GABR1转录本充足,在所有主要的大脑结构中都有表达 [19]。关于GABA (A)受体,GABA (A)受体是五聚氯离子通道,由α (α1-6),β (β1-3),γ (γ1-3),δ,π,ε,ρ (ρ1-3)和θ编码的蛋白质的不同组合组成 [16],其中,α1β2γ2亚基组合在大脑的各个部位都有丰富的表达 [20]。
有研究认为GABRG2 rs211037 (C588T)变异体可能改变GABA-A受体亚基的表达(机制尚不清楚),从而影响转录、mRNA稳定性和翻译效率,导致受体组成及其对外部环境信号的敏感性发生变化 [21]。一些学者进行了更为明确的机制说明,认为这个GABARG2突变,即位于核苷酸第588位的SNP 211037 (Asn196ASN)产生了表面表达最少的非功能性γ-2亚基 [22]。尽管rs211037多态性影响蛋白质的翻译后折叠,但它在剪接和转录组织中的重要作用这一事实仍有待研究。GABA (A)受体亚基表达和构象的许多修饰可能与癫痫的发生发展有关,如:mRNA不稳定、不典型的亚基折叠、GABA通道的扭曲门控和糖基化缺陷。所有这些都会导致受体组装、功能和转运的改变。此外,该基因的几个突变可以通过降低GABA的表达水平或加速失活而导致受体功能丧失 [23]。
Jingqiong Kang等人的研究结果表明,γ2S (R82Q)突变干扰了受体表达、折叠、组装、运输或稳定性的某些方面。在杂合表达的情况下,γ2S (R43Q)突变可能导致受体转运受损,并增加受体在包括内质网在内的细胞内的滞留。这种细胞表面表达的减少将导致体内抑制性GABA受体电流的减少,从而增加神经元的兴奋性和癫痫发生的可能 [24]。
近期关于GABA基因突变与癫痫发生之间的相关研究表明GABA基因对癫痫的易感性可能存在相关性,而关于不同癫痫分类,像局灶性癫痫和全面性癫痫之间的基因多态性的研究较少。本研究中两组rs211037,rs121909673的等位基因频率,基因型频率分布差异无统计学意义,rs121909673在局灶性癫痫和全面性癫痫患者中未发生突变。这可能与既往研究结果存在出入,对于这些不一致的发现,可能为种族差异造成。这些位点在世界上不同种族中的突变情况不同,其次,本研究的一个缺点为样本量较少,也可能会造成本研究结果与其他研究结果不同,下一步可适当地增加样本量,从而可以更好地代表本地人群。
因此,未来需要进一步大规模的研究来探讨GABA基因多态性在不同癫痫分类中的等位基因及基因型频率的差异,从而为癫痫药物治疗提供新的靶点。同时,还有助于今后基因相关性癫痫的准确诊断和治疗,为将来疾病的精准医学治疗提供更好的条件。
文章引用
彭 淑,王 兰,孙妍萍. 局灶性癫痫与全面性癫痫患者的GABA基因多态性研究
The Study on GABA Gene Polymorphism in Patients with Focal Epilepsy and Generalized Epilepsy[J]. 临床医学进展, 2021, 11(04): 1222-1227. https://doi.org/10.12677/ACM.2021.114266
参考文献
- 1. Fisher, R.S., Cross, J.H., French, J.A., Higurashi, N., Hirsch, E., Jansen, F.E., et al. (2017) Operational Classification of Seizure Types by the International League against Epilepsy: Position Paper of the ILAE Commission for Classification and Terminology. Epilepsia, 58, 522-530. https://doi.org/10.1111/epi.13670
- 2. Thurman, D.J., Beghi, E., Begley, C.E., Berg, A.T., Buchhalter, J.R., Ding, D., et al. (2011) Standards for Epidemiologic Studies and Surveillance of Epilepsy. Epilepsia, 57, 2-26. https://doi.org/10.1111/j.1528-1167.2011.03121.x
- 3. Sadangi, C., Rosenow, F. and Norwood, B.A. (2017) Validation of Reference Genes for Quantitative Gene Expression Analysis in Experimental Epilepsy. Journal of Neuroscience Research, 95, 2357-2366. https://doi.org/10.1002/jnr.24089
- 4. Murray, C.J., Vos, T., Lozano, R., Naghavi, M., Flaxman, A.D., Michaud, C., et al. (2012) Disability-Adjusted Life Years (DALYs) for 291 Diseases and Injuries in 21 Regions, 1990-2010: A Systematic Analysis for the Global Burden of Disease Study 2010. Lancet, 380, 2197-223. https://doi.org/10.1016/S0140-6736(12)61689-4
- 5. Díaz-Casado, E., Gómez-Nieto, R., de Pereda, J.M., Muñoz, L.J., Jara-Acevedo, M. and López, D.E. (2020) Analysis of Gene Variants in the GASH/Sal Model of Epilepsy. PLoS ONE, 15, e0229953. https://doi.org/10.1371/journal.pone.0229953
- 6. Gu, L., Liang, B., Chen, Q., Long, J., Xie, J., Wu, G., et al. (2013) Prevalence of Epilepsy in the People’s Republic of China: A Systematic Review. Epilepsy Research, 105, 195-205. https://doi.org/10.1016/j.eplepsyres.2013.02.002
- 7. Ding, X., Zheng, Y., Guo, Y., Shen, C., Wang, S., Chen, F., et al. (2018) Active Epilepsy Prevalence, the Treatment Gap, and Treatment Gap Risk Profile in Eastern China: A Population-Based Study. Epilepsy & Behavior, 78, 20-24. https://doi.org/10.1016/j.yebeh.2017.10.020
- 8. Buck, D., Baker, G.A., Jacoby, A., Smith, D.F. and Chadwick, D.W. (1997) Patients’ Experiences of Injury as a Result of Epilepsy. Epilepsia, 38, 439-444. https://doi.org/10.1111/j.1528-1157.1997.tb01733.x
- 9. Neufeld, M.Y., Vishne, T., Chistik, V. and Korczyn, A.D. (1999) Life-Long History of Injuries Related to Seizures. Epilepsy Research, 34, 123-127. https://doi.org/10.4081/ni.2009.e20
- 10. Nguyen, R. and Téllez Zenteno, J.F. (2009) Injuries in Epilepsy: A Review of Its Prevalence, Risk Factors, Type of Injuries and Prevention. Neurology International, 1, e20. https://doi.org/10.4081/ni.2009.e20
- 11. Scorza, F.A., Cysneiros, R.M., de Albuquerque, M., Scattolini, M. and Mario Arida, R. (2011) Sudden Unexpected Death in Epilepsy: An Important Concern. Clinics, 66, 65-69. https://doi.org/10.1590/S1807-59322011001300008
- 12. Berg, A.T., Berkovic, S.F., Brodie, M.J., Buchhalter, J., Cross, J.H., Van Emde Boas, W., et al. (2010) Revised Terminology and Concepts for Organization of Seizures and Epilepsies: Report of the ILAE Commission on Classification and Terminology, 2005-2009. Epilepsia, 51, 676-685. https://doi.org/10.1111/j.1528-1167.2010.02522.x
- 13. Scheffer, I.E., Berkovic, S., Capovilla, G., Connolly, M.B., French, J., Guilhoto, L., et al. (2017) ILAE Classification of the Epilepsies: Position Paper of the ILAE Commission for Classification and Terminology. Epilepsia, 58, 512-521. https://doi.org/10.1111/epi.13709
- 14. Saetre, E. and Abdelnoor, M. (2018) Incidence Rate of Sudden Death in Epilepsy: A Systematic Review and Meta-Analysis. Epilepsy & Behavior, 86, 193-199. https://doi.org/10.1016/j.yebeh.2018.06.037
- 15. Prasad, D.K., Shaheen, U., Satyanarayana, U., Surya Prabha, T., Jyothy, A. and Munshi, A. (2014) Association of GABRA6 1519 T>C (rs3219151) and Synapsin II (rs37733634) Gene Polymorphisms with the Development of Idiopathic Generalized Epilepsy. Epilepsy Research, 108, 1267-1273. https://doi.org/10.1016/j.eplepsyres.2014.07.001
- 16. Macdonald, R.L. and Olsen, R.W. (1994) GABAA Receptor Channels. Annual Review of Neuroscience, 17, 569-602. https://doi.org/10.1146/annurev.ne.17.030194.003033
- 17. Kang, J.Q. and Macdonald, R.L. (2016) Molecular Pathogenic Basis for GABRG2 Mutations Associated with a Spectrum of Epilepsy Syndromes, from Generalized Absence Epilepsy to Dravet Syndrome. JAMA Neurology, 73, 1009-1016. https://doi.org/10.1001/jamaneurol.2016.0449
- 18. Chou, I.C., Lee, C.C., Tsai, C.H., Tsai, Y., Wan, L., Hsu, Y.-A., et al. (2007) Association of GABRG2 Polymorphisms with Idiopathic Generalized Epilepsy. Pediatric Neurology, 36, 40-44. https://doi.org/10.1016/j.pediatrneurol.2006.09.011
- 19. Sander, T., Peters, C., Kämmer, G., Samochowiec, J., Zirra, M., Mischke, D., et al. (1999) Association Analysis of Exonic Variants of the Gene Encoding the GABAB Receptor and Idiopathic Generalized Epilepsy. American Journal of Medical Genetics, 88, 305-310. https://doi.org/10.1002/(SICI)1096-8628(19990820)88:4%3C305::AID-AJMG5%3E3.0.CO;2-X
- 20. Reid, C.A., Berkovic, S.F. and Petrou, S. (2009) Mechanisms of Human Inherited Epilepsies. Progress in Neurobiology, 87, 41-57. https://doi.org/10.1016/j.pneurobio.2008.09.016
- 21. Wang, D.D. and Kriegstein, A.R. (2009) Defining the Role of GABA in Cortical Development. The Journal of Physiology, 587, 1873-1879. https://doi.org/10.1113/jphysiol.2008.167635
- 22. Kang, J.Q., Shen, W. and Macdonald, R.L. (2013) Trafficking-Deficient Mutant GABRG2 Subunit Amount May Modify Epilepsy Phenotype. Annals of Neurology, 74, 547-559. https://doi.org/10.1002/ana.23947
- 23. Abou El Ella, S.S., Tawfik, M.A., Abo El Fotoh, W.M.M. and Soliman, O.A.M. (2018) The Genetic Variant “C588T” of GABARG2 Is Linked to Childhood Idiopathic Generalized Epilepsy and Resistance to Antiepileptic Drugs. Seizure, 60, 39-43. https://doi.org/10.1016/j.seizure.2018.06.004
- 24. Kang, J.Q., Kang, J. and Macdonald, R.L. (2004) The GABAA Receptor γ2 Subunit R43Q Mutation Linked to Childhood Absence Epilepsy and Febrile Seizures Causes Retention of α1β2γ2S Receptors in the Endoplasmic Reticulum. The Journal of Neuroscience, 24, 8672-8677. https://doi.org/10.1523/JNEUROSCI.2717-04.2004
NOTES
*通讯作者。
