Hans Journal of Biomedicine
Vol.
09
No.
02
(
2019
), Article ID:
29811
,
11
pages
10.12677/HJBM.2019.92011
Effect of Bifidobacterium lactis GKK2 on OVA-Induced Asthmatic Mice
Yu-Hsin Hou1, Shih-Wei Lin1, Chang Zhao2, Hung-Chieh Lu2, Yen-Lien Chen1, Wen-Hsin Lin3, Chin-Chu Chen1,4,5,6*
1Grape King Bio Ltd., Taoyuan Taiwan
2Shanghai Grape King Enterprise Co., Ltd., Shanghai
3School of Pharmacy, China Medical University, Taichung Taiwan
4Institute of Food Science and Technology, National Taiwan University, Taipei Taiwan
5Department of Food Science, Nutrition, and Nutraceutical Biotechnology, Shih Chien University, Taipei Taiwan
6Bioscience Technology, Chung Yuan Christian University, Taoyuan Taiwan

Received: Apr. 2nd, 2019; accepted: Apr. 15th, 2019; published: Apr. 22nd, 2019

ABSTRACT
Asthma is a chronic bronchitis that can cause respiratory failure and even lead to life-threatening in severe conditions. The present study is to evaluate Bifidobacterium lactis GKK2 ability in improving allergic problems and regulating related allergic factors in a mouse model of OVA-allergic asthma. Balb/c mice were divided into four groups as follows: control group, OVA-allergic asthma group, OVA-allergic asthma with GKK2-100 group (0.123 mg/day/kg) and OVA-allergic asthma with GKK2-300 group (0.41 mg/day/kg). Results showed that after OVA-allergic asthma mice were given both doses of B. lactis GKK2, their airway resistance, eosinophil, and OVA-specific IgE were significantly lower than those of OVA-induced asthmatic mice. In the IFN-γ and IgG2a, administration of B. lactis GKK2 can also effectively increase the content of IFN-γ and IgG2a in OVA-induced asthmatic mice and reduce allergic reactions.
Keywords:Bifidobacterium lactis GKK2, Probiotics, Allergic Asthma
乳双岐杆菌GKK2对OVA诱导气喘小鼠之影响
侯毓欣1,林诗伟1,赵敞2,卢弘捷2,陈炎炼1,林文鑫3,陈劲初1,4,5,6*
1葡萄王生技股份有限公司,台湾 桃园
2上海葡萄王企业有限公司,上海
3中国医药大学药学系,台湾 台中
4国立台湾大学食品科技研究所,台湾 台北
5实践大学食品营养与保健生技学系,台湾 台北
6中原大学生物科技学系,台湾 桃园
收稿日期:2019年4月2日;录用日期:2019年4月15日;发布日期:2019年4月22日

摘 要
气喘为气管道的慢性发炎性疾病,急性发作严重时可能会造成呼吸衰竭,甚至导致生命危险。本篇研究目的为评估自国人体内筛选出之乳双岐杆菌GKK2改善OVA诱导之小鼠过敏情形及有效调节相关过敏因子。实验将Balb/c小鼠分为四组:生理食盐水组、OVA诱导气喘组、OVA诱导小鼠给予GKK2-100组(0.123 mg/day/kg)及OVA诱导小鼠给予GKK2-300组(0.41 mg/day/kg)。实验结果显示,OVA致敏小鼠经给予乳双岐杆菌GKK2低高两剂量组后,其呼吸道阻力、嗜酸性球(eosinophil)及OVA特异性IgE皆较OVA诱导气喘小鼠组别显著降低许多。在IFN-γ及IgG2a方面,给予乳双岐杆菌GKK2,则能有效增加致敏小鼠体内IFN-γ及IgG2a的含量,降低过敏反应。
关键词 :乳双岐杆菌GKK2,益生菌,过敏性气喘

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
全世界有将近40%人口有过敏问题,而随着人们生活及饮食型态的改变、工作压力增加,以及社会环境的改变,过敏疾病的患病率逐年增加。过敏问题如过敏性鼻炎、过敏性气喘、异位性皮肤炎及荨麻疹等,皆为现代人常见的过敏性疾病 [1]。近年来因工业化及都市化,世界各地气喘之盛行率不断增加。过敏性气喘常伴随着其他过敏性疾病,如异位性皮肤炎或过敏性鼻炎,造成患病者许多不适症状。
过敏为人体内免疫细胞对外来物质或病原体的过度反应,其中,体内的免疫细胞——T细胞扮演着重要的角色。T细胞中的辅助型T细胞分为Th1及Th2,正常状态下,体内的Th1与Th2处于平衡状态,当Th1与Th2失衡,且偏向Th2细胞的免疫反应,就容易产生过敏反应。Th2细胞会分泌IL-4、IL5、IL13等免疫物质,引发B细胞分泌过敏相关抗体IgE,以及刺激肥大细胞(mast cell)、嗜酸性球(eosinophil)等释放,进而造成各种过敏症状;Th1细胞则会分泌INF-γ、IL2等,能够帮助抗过敏抗体IgG2a产生,INF-γ则具有抑制Th2细胞反应的作用 [2]。而过敏性气喘是由于外来刺激物或过敏原刺激呼吸道,使呼吸道发炎肿胀造成呼吸道狭窄,当黏液增多使得呼吸道阻塞,进而引起呼吸道的过度反应。因此,为有效改善过敏问题,需降低体内引发过敏相关物质的产生,且提升缓解过敏之细胞激素及抗过敏抗体含量。
益生菌(Probiotics)已被证实是肠内的有益细菌,具有抑制坏菌的整肠功能,也能改善人体免疫能力 [3]。研究发现肠道黏膜表面的乳酸杆菌(lactobacilli)及比菲德氏菌(bifidobacteria)具有改变胃肠道微生物的状态 [4],调节肠道的通透性 [5],增加肠道IgA的反应性 [6] 及调节免疫系统 [7] [8] 等生理功能。
动物或人体之免疫系统主要分为细胞性免疫和体液免疫系统两部份 [9]。在乳酸菌相关的研究结果中,发现少数益生性乳酸菌可促进INF-γ的表现,进而抑制过敏相关的IL-4、IL-5及特异性IgE的表现量,此种现象表示乳酸菌可以调降Th2的免疫反应,进而达到减缓过敏症状的效果 [10] [11]。亦有研究指出,给予8周乳酸菌,患有过敏的儿童体内IL-10分泌增加,缓解过敏 [12]。近年来临床试验的结果发现早期摄取益生菌,可减少婴儿异位性皮肤炎的产生或症状减轻,相对地减少过敏性气喘的发生 [13]。在临床流行病学的研究中亦证实婴儿在早期接受乳酸菌一段时间后其产生异位性湿疹的比例明显下降 [3]。
本研究目的为评估乳双岐杆菌(B. lactis) GKK2对以OVA致敏之小鼠相关过敏免疫反应的影响。探讨乳双歧杆菌(B. lactis) GKK2是否能改善致敏小鼠体内过敏相关物质分泌,且增加减缓过敏反应物质的产生。
2. 材料与方法
2.1. 实验菌株
乳双岐杆菌(B. lactis) GKK2:葡萄王公司自婴儿肠道分离筛选获得,经16S rRNA鉴定为乳双岐杆菌。
2.2. 乳双岐杆菌GKK2益生菌冻干粉末制备
GKK2培养于1 L MRS培养基中,经37℃、16小时培养后,以5000 rpm、25℃、离心10分钟取得菌泥,混入20%脱脂乳粉后冷冻干燥而得。
2.3. 乳双岐杆菌GKK2菌数测定
以Guava® easyCyte™进行乳双岐杆菌GKK2菌数测定,测定GKK2之总菌菌数、活菌菌数及死菌菌数。
2.4. 实验动物
Balb/c雄鼠5周大共24只,购自国家动物中心。动物饲养于中国医药大学动物中心小鼠专用房内之独立IVC (individual ventilated caging system)小鼠饲育系统,室温维持于22℃ ± 2℃,湿度40%~60%,定时12小时光照与黑暗,饲料及无菌逆渗透水均任由小鼠自由取食。小鼠饲养2周适应环境后开始进行实验。
2.5. 实验设计
2.5.1. 实验分组
将5周龄Balb/c雄鼠,共分为4组,各组之小鼠均随机分配为6只。组别包括喂食生理食盐水组、OVA诱导组、GKK2-100组及GKK2-300组。除了生理食盐水组之外,其余各组小鼠均进行卵白蛋白(OVA)致敏步骤。
2.5.2. 管灌喂食产品之剂量及途径
小鼠灌食剂量之计算依据实验动物与人体表面积比的等效剂量换算系数,小鼠与人的换算系数为9.01。小鼠每周秤量体重一次,每组计算出平均体重后,依成人(以体重60公斤计算)每日服用剂量1 × 1010 cfu/day,加以换算每天应管灌小鼠之剂量,公式如下所示:
实验样品每日以0.9%生理食盐水新鲜配制,各组小鼠分别管灌喂食0.2 ml体积之生理食盐水、安慰剂溶液或是不同浓度之GKK2溶液。各组小鼠每天管灌喂食,计划执行期间共连续投予60天。喂食GKK2剂量如下:
1) GKK2-100组:0.123 mg/day/kg
2) GKK2-300组:0.41 mg/day/kg
2.5.3. 实验流程
本实验设计流程如图1所示:
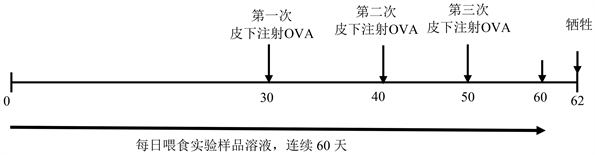
Figure 1. Time line of the mouse OVA allergy experiment
图1. Balb/c雄性小鼠之OVA致敏实验流程
2.5.4. 卵白蛋白抗原诱导小鼠过敏及气喘
将卵白蛋白抗原(OVA, 500 μg/ml)与不完全佐剂(Incomplete Freund’s adjuvant)以1:1等量均匀混合乳化后,以无菌过滤膜进行过滤后立即使用。各组小鼠于实验第30、40及50日,皆进行此过敏原之皮下注射,并且于第45天及第55天以喷雾2% OVA过敏原方式,进行10分钟呼吸道吸入(inhalation)以诱导小鼠产生过敏气喘。
2.5.5. 小鼠免疫细胞及血液之分离与制备
1) 血液取得及血清之分离与保存
收集小鼠腹腔巨噬细胞后,剪开腹部皮肤,以1 ml注射器于肝门静脉收集血液样本。收集小鼠全血检体,置于含有抗凝血剂之试管中,待进行血液中白血球分类计数。另外,收集小鼠全血检体于无含抗凝血剂的试管中,室温静置1小时后以1000 rpm离心10分钟,取得上清液检体即为血清。血清长期保存于−80℃,待日后分析血清中免疫球蛋白及过敏原诱发的特异性抗体。
2) 支气管肺泡冲洗液(Bronchoalveolar lavage fluid, BALF)
收集小鼠血液样本后,将小鼠下颚至胸腔的皮肤及骨骼剪开,把肌肉层拉开并使气管暴露,在气管靠近喉头处剪出个开口,插入0.965 mm的polyethylene Tubing末端接上25G的针头套管,用缝线将套管紧绑固定于气管上。将装有1 ml生理食盐水的注射针,慢慢将生理食盐水打进肺部至整个肺部完全膨胀,再回抽,如此反复三次后,将冲洗液以750 rpm,离心5分钟,下层细胞以1 ml生理食盐水回溶后,取100 ul支气管肺泡冲洗液,以细胞离心仪(cytospin)将细胞打至玻片做成细胞抹片,风干后,以刘氏染色法(Liu’s stain)染色。利用油镜(400×)观察200个白血球细胞种类,计算各占的百分比,乘上支气管肺泡冲洗液中细胞总数目,得出各白血球的绝对数目。
3) 脾脏细胞之取得
在无菌操作条件下,摘取小鼠腹部左上侧的脾脏,将脾脏放入含有3 ml PBS缓冲液的培养皿中,以干净无菌的10 ml针筒推进器尾端,将脾脏压紧并磨碎,以离心机1000 rpm离心10分钟,倒掉上清液。再加入cRPMI细胞培养液清洗后重复离心的步骤,并倒掉上清液,如此重复两次清洗动作。进行细胞计数后将细胞以cRPMI细胞培养液定量并进行相关实验。
2.6. 检验分析项目及方法
2.6.1. 呼吸道阻力测试
小鼠于牺牲前一天,以Buxco公司出产的Whole-body plethysmography (WBP),进行非侵入性之小鼠呼吸道阻力变化的测量,其阻力变化是依据小鼠呼吸过程中测得的数值经计算机分析后,得到一个enhanced pause (Penh)值来表示,而数值越高代表呼吸道阻力越大。首先将小鼠放进动物舱中,测量小鼠的基础Penh值三分钟。接着将小鼠暴露在雾化的0.9% NaCl三分钟后,测量Penh值三分钟。接着将小鼠暴露在雾化的非特异性气管收缩刺激剂methacholine (3.125 mg/ml)三分钟后,测量Penh值(PenhMch)三分钟,以逐渐增高浓度的methacholine (6.25 mg/ml、12.5 mg/ml、25 mg/ml)重复上述步骤,本实验中是以Penh Ratio来表示结果,其资料分析是将各浓度methacholine所得到的PenhMch读值除以给予生理食盐水的PenhNaCl读值来计算之。
2.6.2. 气管肺泡冲洗液中白血球比例计算
取100 μl离心后的冲洗液滴于载玻片上后风干,以刘氏染色法(Liu’s stain)染色。利用油镜(100×)观察200个白血球细胞种类,计算各细胞数量之百分比。
2.6.3. 血清中过敏原诱发的特异性抗体之含量分析
利用sandwich-ELISA免疫呈色反应法,定量血清中过敏原诱发的特异性IgE及IgG2a含量。首先以coating buffer (pH 9.6)配制含适量之anti-mice单株抗体并添加100 μg/mL卵白蛋白(OVA)抗原,覆盖于96孔微量分析盘(Nunc-Immuno plate)上,静置1小时后,以wash buffer冲洗未结合的单株抗体,再以200 μl/well的blocking buffer填补未被单株抗体结合的部位。室温下反应30分钟后,再以wash buffer冲洗,然后加入100 μl小鼠血清或已知浓度的各种免疫球蛋白标准品。小鼠血清或是各种免疫球蛋白标准品经过室温1小时反应后,以wash buffer冲洗,再加入适当浓度连结HRP的抗各种免疫球蛋白的二级抗体100 μl/well。于室温反应30分钟后,以wash buffer冲洗,接着以100 μl TMB受质反应,经15分钟呈色后,加入100 μl 2N H2SO4终止呈色反应,于450 nm波长测定其吸光值。根据各种免疫球蛋白标准品与吸光值所显示的标准曲线,经过回归运算后得到的公式,可用内插法来推算血清中过敏原诱发的特异性抗体的浓度。
2.6.4. 脾脏细胞之特异性细胞激素分泌量分析
将前述所收集并置于−80℃保存之脾脏细胞液进行各种细胞激素分析。以ELISA方法分析IFN-γ含量。分析步骤为于96孔微量分析盘(Nunc-Immuno plate)上注入,以coating buffer配制含适量之anti-mice cytokine单株抗体100 μl,静置4℃隔夜后,以wash buffer冲洗未结合的单株抗体,再以200 μl/well的blocking buffer充填未被单株抗体结合的部位。室温下反应2小时后,再以wash buffer冲洗,然后加入100 μl淋巴细胞培养上清液或已知浓度的recombinant cytokine标准品。细胞培养上清液或是细胞激素标准品经过室温2小时反应后,以wash buffer冲洗,再加入适当浓度连结生物素(biotin)的抗细胞激素二级抗体100 μl/well。于室温反应1小时后,以wash buffer冲洗,接着加入适当浓度的HRP 100 μl/well,室温反应1小时后,以wash buffer冲洗,接着以100 μl TMB受质进行反应,经15分钟呈色后,加入50 μl 2N H2SO4终止呈色反应,于450 nm波长测定其吸光值。根据细胞激素标准品与吸光值所显示的标准曲线,经过回归运算后得到的公式,用内插法来推算细胞培养上清液中细胞激素的浓度。
2.7. 统计分析
本份测试报告的实验结果以mean ± SD表示,并以SPSS 12.0软件包于计算机中进行统计分析,以T-test测定各组间之差异,显著性差异之判断标准为p < 0.05。
3. 结果
3.1. 乳双岐杆菌GKK2菌数测定
经菌数测定,结果为:GKK2总菌数为3.9 × 1011 cells/g、活菌菌数为3.0 × 1011 cells/g、死菌菌数为9 × 1010 cells/g。而培养法测得菌数约为3.5 × 1011 cfu/g。使用时依平板计数结果,以0.9%生理食盐水调整到1 × 1010 cfu/g及3 × 1010 cfu/g备用。
3.2. 呼吸道阻力测试的生理反应
为了评估受试样品对于气喘小鼠之呼吸道敏感性的影响,我们利用Whole body plethysmography以测量小鼠呼吸道的阻力变化。致敏后只喂食生理食盐水的小鼠组别,在此实验中定义为气喘对照组(Asthma),在渐增methacholine浓度的呼吸道刺激后,致敏各组小鼠的呼吸道阻力皆逐渐增加。实验结果如图2所示,而喂食不同GKK2剂量的两组小鼠在25mg的methacholine刺激下,小鼠之呼吸道阻力皆显著低于过敏诱导气喘组(Asthma) (p < 0.05)。
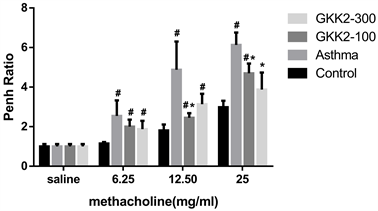 *Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
*Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
Figure 2. Effect of B. lactis GKK2 on respiratory resistance in OVA-induced asthmatic Balb/c male mice stimulated by different doses of methacholine
图2. 乳双岐杆菌GKK2对不同剂量methacholine刺激OVA致敏之Balb/c雄性小鼠呼吸道阻力的影响
3.3. 肺泡冲洗液及血液中免疫细胞次群分析
于小鼠气管肺泡冲洗液中各种白血球含量分析,过敏造成巨噬细胞(macrophage)增加对抗过敏原,进而引起严重的免疫反应;嗜酸性球(eosinophils)主要探讨于全身性与肺部的发炎反应及浸润现象。结果如图3所示,于肺部冲洗液中,未喂食受试样品的气喘对照组(Asthma),其嗜酸性球及巨噬细胞显著高于生理食盐水组(p < 0.05),而喂食GKK2-300的受试样品相对于气喘组小鼠,其肺部冲洗液中巨噬细胞的含量明显较低(p < 0.05);在嗜酸性球结果上,低高剂量GKK2组别小鼠其嗜酸性球含量皆明显下降(p < 0.05)。
3.4. 血清中OVA特异性抗体之含量分析
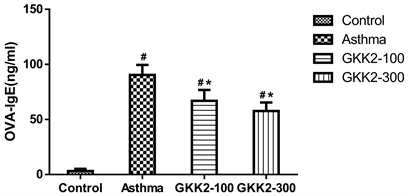
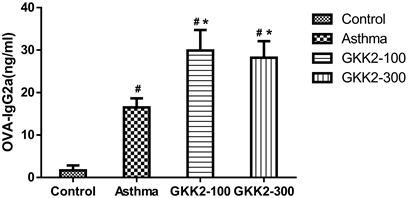
分析小鼠血清中的OVA特异性抗体,结果发现喂食GKK2-100及GKK2-300的小鼠组别,其OVA特异性IgE皆显著低于气喘组小鼠(p < 0.05),其中又以GKK2-300之降低效果较为显著,结果如图4所示。另外,分析血液OVA特异性IgG2a抗体,喂食GKK2的小鼠与气喘组进行比较时,发现GKK2-100及GKK2-300在统计上皆具有显著性较高的情形(p < 0.05),结果如图5所示。
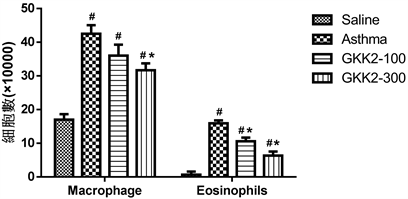 *Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
*Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
Figure 3. Number of Macrophage and Eosinophils in the bronchoalveolar lavage fluid of Balb/c male mice
图3. Balb/c雄性小鼠气管肺泡冲洗液中Macrophage及Eosinophils数量
 *Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
*Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
Figure 4. Concentration of OVA specific IgE in Balb/c male mice serum
图4. Balb/c雄性小鼠血清中OVA specific IgE抗体浓度
 *Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
*Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
Figure 5. Concentration of OVA specific IgG2a in Balb/c male mice serum
图5. Balb/c雄性小鼠血清中OVA specific IgG2a抗体浓度
3.5. 脾脏细胞之细胞激素分泌量分析
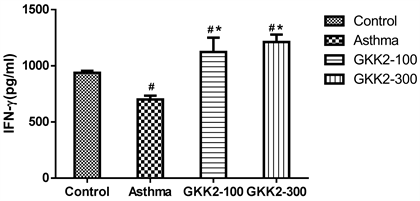
小鼠脾脏细胞以OVA抗原进行特异性的刺激后,分析其不同细胞激素的表现情形。结果发现所有喂食受试样品的小鼠,IFN-γ的产生量相较于气喘组皆有明显提高的趋势(p < 0.05),结果如图6所示。
 *Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
*Statistically significant difference (p < 0.05) compared to asthma group, #Statistically significant difference (p < 0.05) compared to control group.
Figure 6. Concentration of IFN-γ in Balb/c male mice spleen cells
图6. Balb/c雄性小鼠脾脏细胞中IFN-γ之表现浓度
4. 讨论
已有许多文献指出,食用乳酸菌对人体健康有正面的影响。如预防脂肪堆积、降低体重、免疫调节、改善肠道微生物群及减少肠道炎症等 [14] [15]。本研究以国内婴儿肠道自行筛选出之乳双岐杆菌GKK2,评估其对OVA所诱导过敏性气喘之小鼠是否具有改善过敏功效。
本次动物实验中,小鼠每日喂食样品,共60天,并分别于第30、40及50日,进行OVA皮下注射,并且于第45及55日以喷雾2% OVA过敏原方式,进行10分钟呼吸道吸入(inhalation)以诱导小鼠产生过敏性气喘。牺牲前一天,以Whole-body plethysmography (WBP)进行小鼠呼吸道阻力变化的测量,实验以气管收缩刺激剂methacholine刺激小鼠呼吸道,诱使小鼠呼吸道收缩剧烈,造成呼吸道阻力增加。结果显示,未经methacholine刺激则呼吸道阻力皆不会提高,不论有无OVA致敏。在methacholine刺激下,所有组别小鼠呼吸道阻力皆随methacholine浓度上升而增加,呈剂量效益,其中OVA致敏小鼠组别在各methacholine浓度上之呼吸道阻力皆显著高于生理食盐水组(p < 0.05)。低高剂量GKK2两组小鼠组别其呼吸道阻力亦会随methacholine浓度上升而增加,但在3个methacholine剂量下,低高剂量GKK2组皆可较无GKK2组显著降低呼吸道阻力(p < 0.05)。在Hougee等人 [16] 的研究中,以OVA诱导过敏性气喘小鼠评估6株乳酸菌之抗过敏功效,发现仅有3株乳酸菌能有效降低methacholine刺激所造成呼吸道阻力之增加,显示非所有乳酸菌株具有改善呼吸道发炎、孔道狭窄之能力。过敏会造成巨噬细胞(macrophage)增加对抗过敏原,进而引起严重的免疫反应。而文献指出,嗜酸性球(eosinophils)为造成气喘问题的一个重要因素,当呼吸道受过敏原刺激后,呼吸道中嗜酸性球将增加黏液分泌与造成呼吸道水肿,而引起支气管收缩,最终容易导致气喘发作 [17]。此外,有文献认为,嗜酸性球具有启动Th2细胞分泌相关免疫调节因子的作用,造成过敏反应增加 [18]。实验结果显示,小鼠经OVA致敏后,巨噬细胞及嗜酸性球皆明显增多(p < 0.05),OVA导致小鼠呼吸道中巨噬细胞大量增加以对抗过敏原侵入;嗜酸性球聚集使得呼吸道发炎且黏液增加,最终诱发过敏性气喘。先前研究结果发现,小鼠经OVA致敏诱发过敏性气喘后,发现小鼠肺泡冲洗液中巨噬细胞及嗜酸性球数量明显增加,显示此两者数量增加与OVA诱导过敏性气喘有关 [16],本实验结果与先前研究相符。若同时给予乳双岐杆菌GKK2,在高剂量GKK2组别上,小鼠之巨噬细胞数量显着降低(p < 0.05);在主要造成呼吸道发炎反应的嗜酸性球数量上,在低高剂量GKK2组别皆有显着性降低(p < 0.05)。此结果与小鼠之呼吸道阻力试验之结果相符,因此可初步左证喂食乳双岐杆菌GKK2亦可改善呼吸道受阻力现象。
一般常见过敏性疾病如气喘、过敏性鼻炎、湿疹等,皆属于第一型过敏反应,第一型过敏反应主要以过敏抗体IgE分泌为主,IgE会诱使肥大细胞(mast cell)活化进而释放致敏物质如组织胺、血小板活化因子等,造成过敏症状产生 [19]。Th2细胞会分泌B细胞生长因子IL-4,促进B细胞分泌过敏抗体IgE,IgE会同时抑制IgG2a分泌,使过敏反应加剧 [20] [21]。实验结果发现,经OVA致敏后,小鼠体内OVA-IgE含量显著增加,然给予乳双岐杆菌GKK2小鼠组别,体内OVA-IgE产生量明显下降(p < 0.05)。Ishida等人 [22] 指出,经OVA致敏小鼠喂食乳酸菌发酵乳后,能降低小鼠体内OVA-IgE含量;Kim等人 [23] 实验指出,给予乳酸菌Bifidobacterium lactis AD011及Lactobacillus acidophilus AD031皆能有效降低OVA致敏小鼠体内OVA-IgE,本实验与以上文献有相同的结果。
当过敏原入侵时,免疫反应受到刺激使抗体含量皆有所提高,从结果可知致敏小鼠体内IgE及IgG2a相较于正常小鼠皆显著提升(p < 0.05),此为一正常生理反应,而IgE含量增加会促进Th2反应进行;IgG2a增加则会驱使免疫反应偏向Th1。在此实验中,致敏小鼠体内IgE含量较IgG2a含量高,使小鼠免疫反应趋向Th2过敏反应。经给予低高剂量GKK2之小鼠,皆显著提升IgG2a含量(p < 0.05),使反应趋向Th1,以维持体内免疫平衡。而文献亦指出,IgG2a能够抑制IgE结合至肥大细胞上,防止过敏原入侵时与附着在肥大细胞上的IgE结合而造成一系列过敏反应 [24],因此IgG2a显著上升可有效缓解过敏问题。
研究指出,IFN-γ能够活化巨噬细胞,以抵抗病原菌或病毒感染细胞 [25],也具有抑制Th2细胞反应的作用 [2],并刺激抗过敏抗体IgG2a分泌 [26]。本次数据表明,小鼠经OVA诱导过敏性气喘后,其体内IFN-γ含量显著下降(p < 0.05),此因OVA致敏气喘后使体内免疫反应趋向Th2反应,Th2细胞分泌之激素会抑制Th1生长分化,进而抑制Th1细胞分泌IFN-γ,造成IFN-γ含量降低。当经OVA致敏小鼠同时给予乳双岐杆菌GKK2,发现能显着提升小鼠体内IFN-γ含量(p < 0.05),显示此菌能高度刺激IFN-γ分泌,进而抑制Th2反应,使过敏指数IgE分泌降低。此外,Yoshida等人 [27] 研究发现,给予IFN-γ能够改善以OVA诱导过敏性气喘之小鼠的呼吸道阻力增加问题,本实验低高剂量GKK2组别小鼠体内IFN-γ含量皆较OVA致敏组显著提升外(p < 0.05),在呼吸道阻力测试结果上,亦同时得到改善呼吸道阻力增加的结果。另结果发现低高剂量GKK2组之IFN-γ含量皆显着高于生理食盐水组(p < 0.05),推测因致敏小鼠体内的IFN-γ含量相较正常小鼠大幅下降,而原本正常小鼠中的IFN-γ含量不足以改善体内Th2过度反应,GKK2在致敏小鼠上藉由刺激IFN-γ大量产生,以改善体内Th1及Th2失衡状态。
许多文献显示给予乳酸菌死菌,亦有调节免疫、改善过敏的功效。Ou等 [28] 研究发现部分乳酸菌死菌能够增加IFN-γ含量,使体内免疫反应从Th2反应趋向Th1反应,进而舒缓过敏;Sashihara等 [29] 研究则指出,给予L. gasseri OLL2809死菌后,小鼠体内IgE浓度降低,显示死菌能够调节过敏反应。本实验乳双岐杆菌GKK2菌数测定结果中约含有25%之死菌(9 × 1010 cells/g),推测可能亦参与调节小鼠体内过敏反应。
5. 结论
小鼠经OVA诱发过敏性气喘后,同时给予乳双岐杆菌GKK2,观察其是否能改善小鼠过敏性气喘。当实验以methacholine来刺激小鼠呼吸道时,评估小鼠呼吸道阻力的生理变化,从结果可知,给予乳双岐杆菌GKK2,呼吸道阻力相较于气喘组有显著性降低(p < 0.05),此结果显示乳双岐杆菌GKK2对于呼吸道敏感反应有抑制作用,可减缓因OVA过敏原所引发的呼吸道压力,意即可改善气喘之压迫程度。在小鼠气管肺泡冲洗液分析上,给予乳双岐杆菌GKK2,其肺部冲洗液中巨噬细胞(macrophage)数量在高剂量GKK2组显著降低(p < 0.05),改善过度免疫反应;嗜酸性球(eosinophils)的数量则在低高剂量GKK2组皆明显降低(p < 0.05),显示肺部的发炎反应及浸润现象有所改善。分析小鼠血清中OVA特异性IgE及IgG2a抗体含量,发现给予乳双岐杆菌GKK2,可有效降低OVA-IgE抗体(p < 0.05)及提升抗过敏抗体IgG2a浓度(p < 0.05),减缓过敏发作及不适。在小鼠脾脏细胞分析中,结果发现喂食乳双岐杆菌GKK2的小鼠,IFN-γ的表现量相较于气喘组明显增加(p < 0.05),舒缓过敏反应。
综合以上结果证实,乳双岐杆菌GKK2能够改善过敏性气喘所造成呼吸阻力,巨噬细胞(macrophage)及嗜酸性球(eosinophils)数量增加,同时降低特异性IgE浓度,提升特异性IgG2a及IFN-γ浓度,改善过敏性气喘所造成的呼吸道发炎情形及不适。
文章引用
侯毓欣,林诗伟,赵 敞,卢弘捷,陈炎炼,林文鑫,陈劲初. 乳双岐杆菌GKK2对OVA诱导气喘小鼠之影响
Effect of Bifidobacterium lactis GKK2 on OVA-Induced Asthmatic Mice[J]. 生物医学, 2019, 09(02): 70-80. https://doi.org/10.12677/HJBM.2019.92011
参考文献
- 1. Holgate, S.T. (1999) The Epidemic of Allergy and Asthma. Nature, 402, B2-B4. https://doi.org/10.1038/35037000
- 2. Romagnani, S. (1999) Th1/Th2 Cells. Inflammatory Bowel Diseases, 5, 285-294. https://doi.org/10.1097/00054725-199911000-00009
- 3. Isolauri, E., Arvola, T., Sütas, Y., Moilanen, E. and Salminen. S. (2000) Probiotics in the Management of Atopic Eczema. Clinical and Experimental Allergy, 30, 1604-1610. https://doi.org/10.1046/j.1365-2222.2000.00943.x
- 4. Myllyluoma, E., Ahlroos, T., Veijola, L., Rautelin, H., Tynkkynen, S. and Korpela, R. (2007) Effects of Anti-Helicobacter Pylori Treatment and Probiotic Supplementation on Intestinal Microbiota. International Journal of Antimicrobial Agents, 29, 66-72.
- 5. Isolauri, E., Majamaa, H., Arvola, T., Rantala, I., Virtanen, E. and Arvilommi, H. (1993) Lactobacillus casei Strain GG Reverses Increased Intestinal Permeability Induced by Cow Milk in Suckling Rats. Gastroenterology, 105, 1643-1650. https://doi.org/10.1016/0016-5085(93)91059-Q
- 6. Fukushima, Y., Kawata, Y., Hara, H., Terada, A. and Mitsuoka, T. (1998) Effect of a Probiotic Formula on Intestinal Immunoglobulin A Production in Healthy Children. International Journal of Food Microbiology, 42, 39-44. https://doi.org/10.1016/S0168-1605(98)00056-7
- 7. Lin, W.-H., Yu, B., Lin, C.-K., Hwang, W.-Z. and Tsen, H.-Y. (2007) Immune Effect of Heat-Killed Multistrain of Lactobacillus acidophilus against Salmonella typhimurium Invasion to Mice. Journal of Applied Microbiology, 102, 22-31. https://doi.org/10.1111/j.1365-2672.2006.03073.x
- 8. Hisbergues, M., Magi, M., Rigaux, P., Steuve, J., Garcia, L., Goudercourt, D., Pot, B., Pestel, J. and Jacquet, A. (2007) In Vivo and in Vitro Immunomodulation of Der p 1 Al-lergen-Specific Response by Lactobacillus plantarum Bacteria. Clinical & Experimental Allergy, 37, 1286-1295. https://doi.org/10.1111/j.1365-2222.2007.02792.x
- 9. Abbas, Z.G. and Swai, A.B. (1997) Evaluation of the Ef-ficacy of Thiamine and Pyridoxine in the Treatment of Symptomatic Diabetic Peripheral Neuropathy. East African Medical Journal, 74, 803-808.
- 10. Blümer, N., Sel, S., Virna, S., Patrascan, C.C., Zimmermann, S., Herz, U., Renz, H. and Garn, H. (2007) Perinatal Maternal Application of Lactobacillus rhamnosus GG Suppresses Allergic Airway Inflammation in Mouse Offspring. Clinical & Experimental Allergy, 37, 348-357. https://doi.org/10.1111/j.1365-2222.2007.02671.x
- 11. Feleszko, W., Jaworska, J., Rha, R.D., Steinhausen, S., Avagyan, A., Jaudszus, A., Ahrens, B., Groneberg, D.A., Wahn, U. and Hamelmann, E. (2007) Probiotic-Induced Suppression of Allergic Sensitization and Airway Inflammation Is Associated with an Increase of T Regulato-ry-Dependent Mechanisms in a Murine Model of Asthma. Clinical & Experimental Allergy, 37, 498-505. https://doi.org/10.1111/j.1365-2222.2006.02629.x
- 12. Pessi, T., Sütas, Y., Hurme, M. and Isolauri, E. (2000) Interleukin-10 Generation in Atopic Children Following Oral Lactobacillus rhamnosus GG. Clinical & Experimental Allergy, 30, 1804-1808. https://doi.org/10.1046/j.1365-2222.2000.00948.x
- 13. Boyle, R.J. and Tang, M.L.K. (2006) The Role of Probi-otics in the Management of Allergic Disease. Clinical & Experimental Allergy, 36, 568-576. https://doi.org/10.1111/j.1365-2222.2006.02472.x
- 14. O’Hara, A.M. and Shanahan, F. (2007) Mechanisms of Action of Probiotics in Intestinal Diseases. The Scientific World Journal, 7, 31-46. https://doi.org/10.1100/tsw.2007.26
- 15. Iacono, A., Raso, G.M., Canani, R.B., Calignano, A. and Meli, R. (2011) Probiotics as an Emerging Therapeutic Strategy to Treat NAFLD: Focus on Molecular and Biochemical Mechanisms. The Journal of Nutritional Biochemistry, 22, 699-711. https://doi.org/10.1016/j.jnutbio.2010.10.002
- 16. Hougee, S., Vriesema, A.J.M., Wijering, S.C., Knippels, L.M.J., Folkerts, G., Nijkamp, F.P., Knol, J. and Garssen, J. (2010) Oral Treatment with Probiotics Reduces Allergic Symptoms in Ovalbumin-Sensitized Mice: A Bacterial Strain Comparative Study. International Archives of Allergy and Immunology, 151, 107-117. https://doi.org/10.1159/000236000
- 17. Wardlaw, A.J., Brightling, C., Green, R., Woltmann, G. and Pavord, I. (2000) Eosinophils in Asthma and Other Allergic Diseases. British Medical Bulletin, 56, 985-1003. https://doi.org/10.1258/0007142001903490
- 18. MacKenzie, J.R., Mattes, J., Dent, L.A. and Foster, P.S. (2001) Eosinophils Promote Allergic Disease of the Lung by Regulating CD4+ Th2 Lymphocyte Function. The Journal of Immunology, 167, 3146-3155. https://doi.org/10.4049/jimmunol.167.6.3146
- 19. Gould, H.J. and Sutton, B.J. (2008) IgE in Allergy and Asthma Today. Nature Reviews Immunology, 8, 205-217. https://doi.org/10.1038/nri2273
- 20. Coffman, R.L., Ohara, J., Bond, M.W., Carty, J., Zlotnik, A. and Paul, W.E. (1986) B Cell Stimulatory Factor-1 Enhances the IgE Response of Lipopolysaccharide-Activated B Cells. The Journal of Immunology, 136, 4538-4541.
- 21. 戴志展. 抗敏合方对过敏性鼻炎临床疗效之研究[J]. 中医药年报, 2008, 26(1): 233-252.
- 22. Ishida, Y., Bandou, I., Kanzato, H. and Yamamoto, N. (2003) Decrease in Ovalbumin Specific IgE of Mice Serum after Oral Uptake of Lactic Acid Bacteria. Bioscience, Biotechnology, and Biochemistry, 67, 951-957. https://doi.org/10.1271/bbb.67.951
- 23. Kim, J.Y., Choi, Y.O. and Ji, G.E. (2008) Effect of Oral Probiotics (Bifidobacterium lactis AD011 and Lactobacillus acidophilus AD031) Administration on Ovalbumin-Induced Food Allergy Mouse Model. Journal of Microbiology and Biotechnology, 18, 1393-1400.
- 24. Wai, C.Y.Y., Leung, N.Y.H., Leung, P.S.C. and Chu, K.H. (2016) T Cell Epitope Immunotherapy Ameliorates Allergic Responses in a Murine Model of Shrimp Allergy. Clinical & Experimental Allergy, 46, 491-503. https://doi.org/10.1111/cea.12684
- 25. Meydani, S.N. and Ha, W.K. (2000) Immunologic Effects of Yogurt. The American Journal of Clinical Nutrition, 71, 861-872. https://doi.org/10.1093/ajcn/71.4.861
- 26. Bossie, A. and Vitetta, E.S. (1991) IFN-Gamma Enhances Secretion of IgG2a from IgG2a-Committed LPS-Stimulated Murine B Cells: Implications for the Role of IFN-Gamma in Class Switching. Cellular Immunology, 135, 95-104. https://doi.org/10.1016/0008-8749(91)90257-C
- 27. Yoshida, M., Leigh, R., Matsumoto, K., Wattie, J., Ellis, R., O’Byrne, P.M. and Inman, M.D. (2002) Effect of Interferon-Gamma on Allergic Airway Responses in Interfer-on-Gamma-Deficient Mice. American Journal of Respiratory and Critical Care Medicine, 166, 451-456. https://doi.org/10.1164/rccm.200202-095OC
- 28. Ou, C.C., Lin, S.L., Tsai, J.J. and Lin, M.Y. (2011) Heat-Killed Lactic Acid Bacteria Enhance Immunomodulatory Potential by Skewing the Immune Response toward Th1 Polarization. Journal of Food Science, 76, M260-M267. https://doi.org/10.1111/j.1750-3841.2011.02161.x
- 29. Sashihara, T., Sueki, N. and Ikegami, S. (2006) An Anal-ysis of the Effectiveness of Heat-Killed Lactic Acid Bacteria in Alleviating Allergic Diseases. Journal of Dairy Science, 89, 2846-2855. https://doi.org/10.3168/jds.S0022-0302(06)72557-7
NOTES
*通讯作者。