Hans Journal of Biomedicine
Vol.
12
No.
02
(
2022
), Article ID:
49796
,
6
pages
10.12677/HJBM.2022.122012
Bafilomycin A1对脑缺血再灌注损伤小鼠的 保护作用及其机制
殷乐依,王志坚
嘉兴学院医学院,浙江 嘉兴
收稿日期:2022年1月3日;录用日期:2022年3月21日;发布日期:2022年3月29日

摘要
目的:探讨洛霉素A(Bafilomycin A1, Baf A1)对脑缺血再灌注损伤(middle cerebral artery occlusion-reperfusion, MCAO/R)小鼠的保护作用及机制。方法:Atg7f/f-Mx1-Cre小鼠15只,随机分为:假手术组(C)、模型组(M)、氟西汀组(M + F)、Baf A1组(M + B)和ATG7敲除组(M + ATG7 KO)。M + B组术前24小时给与脑立体定位注射,M + F组给与氟西汀灌胃连续14 d;其他组均于术前14天开始给予等体积生理盐水。缺血2小时再灌注24 h后,对各组小鼠进行神经行为学评分、脑含水量测定和脑梗死面积检测,Western blotting检测自噬相关蛋白Beclin 1和LC3的表达。结果:与C组相比,M组神经行为评分、脑含水量、脑梗死面积、自噬相关蛋白Beclin 1和LC3的表达显著增加,M + F组、M + B组和M + ATG7 KO组逆转以上结果,差异具有统计学意义。结论:Baf A1通过降低前期和后期细胞自噬水平实现对脑缺血再灌注损伤小鼠的保护作用。
关键词
洛霉素A1,脑立体定位注射,脑缺血再灌注损伤(MCAO/R),ATG7,细胞自噬

The Protective Effect and Mechanism of Bafilomycin A1 on Middle Cerebral Ischemia-Reperfusion Injury in Mice
Leyi Yin, Zhijian Wang
Jiaxing University College of Medicine, Jiaxing Zhejiang
Received: Jan. 3rd, 2022; accepted: Mar. 21st, 2022; published: Mar. 29th, 2022

ABSTRACT
Objective: To investigate the protective effect and mechanism of Bafilomycin A1 on middle cerebral ischemia-reperfusion injury in mice. Methods: 15 Atg7f/f-Mx1-Cre mice were randomly divided into sham group (C), model group (M), fluoxetine group (M + F), Baf A1 group (M + B) and ATG7 knockout group (M + ATG7 KO). Group (M + B) was given stereotactic injection 24 hours before operation, Group (M + F) was given intragastric fluoxetine for 14 days, and other groups were given an equal volume of saline 14 days before the operation. After 2 hours of ischemia and 24 hours of reperfusion, the mice in each group were evaluated by neurobehavioral score, cerebral water content and cerebral infarction area. The expression of autophagic related proteins Beclin 1 and LC3 was detected by western blotting. Results: Compared with Group C, the neurobehavioral score, cerebral water content, cerebral infarct size, autophagy associated protein Beclin 1 and LC3 were significantly increased in group M, and reversed in Group (M + F), Group (M + B) and Group (M + ATG7 KO) and the difference was statistically significant. Conclusion: Baf A1 may protect mice from cerebral ischemia-reperfusion injury by decreasing autophagy levels in the early and late stages.
Keywords:Bafilomycin A1, Stereotactic Injection, MCAO/R, ATG7, Cell Autophagy

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
缺血性脑损伤的发病率逐年升高,目前已成为威胁人类生命的最主要疾病之一 [1],临床上尚无有效的治疗方案,在有效时间窗内再灌注并抑制再灌注损伤成为目前治疗缺血性脑损伤的关键环节 [2],药物治疗仍是关键。研究表明,Baf A1对神经功能损伤具有一定的保护作用 [3],前期研究发现,Baf A1作用后缺血性脑损伤减小,并且可能跟抑制自噬水平有关 [4]。为了探究Baf A1是否通过抑制细胞自噬水平实现对脑缺血再灌注损伤的保护作用,我们借助条件性敲除自噬关键基因ATG7的小鼠,建立自噬基因敲除的脑缺血再灌注损伤小鼠模型,既能回答Baf A1的保护作用是否直接和调节细胞自噬水平相关,又能探究自噬在脑缺血再灌注损伤发生、发展中的重要作用。
2. 材料与方法
2.1. 动物
Atg7f/f-Mx1-Cre小鼠15只,将含Atg7基因打靶序列的纯合转基因小鼠,与诱导型的Mx1-Cre转基因小鼠(由美国Jackson实验室引进)交配,进而筛选获得,可以用pIpC诱导敲除Atg7基因的转基因小鼠模型(Atg7f/f-Mx1-Cre)。
2.2. 给药方法
B组术前24小时给与脑立体定位注射,F组给与氟西汀灌胃连续14 d,其他组均于术前14天开始给予等体积生理盐水。
2.3. Atg7f/f-Mx1-Cre脑缺血再灌注损伤小鼠模型制备
采用改良longa. Zea氏线栓法 [5] 制备小鼠脑缺血再灌注模型。固定住10%的水合氯醛(0.3 ml/100g)麻醉的小鼠,剪毛消毒后于颈部正中切口,分离组织,暴露左侧颈内动脉、颈外动脉、颈内动脉,结扎颈总近端、颈外根部,于颈内处备线打一活结。在左侧颈内近颅端夹一微动脉夹,颈总结扎处远端剪一斜口,经此插入备好的线栓,并将其缓慢经颈内入颅至大脑前动脉。2小时后,拔出线栓,结扎缝合皮肤并消毒。24 h再灌注后处死动物。C组只分离、暴露血管,不插栓线。
2.4. 神经行为评分
采用改良Bederson 评分法进行神经功能缺损评分 [6]。评分标准:0分,无明显神经病学症状;1分,不能完全伸展右侧前爪(左侧手术);2分,向右侧旋转;3分,行走时向右侧倾倒;4分,不能自行行走。0分及昏迷不醒者剔除。
2.5. TTC染色
小鼠麻醉后颈椎脱臼,冰上快速断头取脑。把脑组织迅速放入−20℃冰箱冷冻10 min,切成2 mm的冠状切片放入六孔板,加入1% TTC溶液,避光,37℃烘箱30 min后取出按顺序摆好位置,拍照分析梗死面积,正常组织被染成鲜红色,梗死组织不染色为白色,计算出梗死体积占大脑体积的百分比。
2.6. 脑组织含水量测定
麻醉小鼠后开颅取新鲜大脑,用滤纸吸干表面水分,电子秤称量脑湿重,然后将其置于105℃的烤箱烘烤48 h至恒重,称量干重,计算脑含水量。脑组织含水量 = (脑湿重 − 脑干重)/脑湿重 × 100%。
2.7. Western Blotting
收集大鼠左侧海马组织,提取组织总蛋白用BCA试剂盒进行蛋白定量和变性后,进行SDS-PAGE电泳(凝胶浓度为10%和5%,80 V,30 min后换110 V,70 min),转膜后于5%脱脂奶粉室温封闭1 h,加入一抗(Beclin 1、LC3) 4℃冰箱过夜,加入辣根过氧化物标记的兔源二抗,显影定影后用ImageJ分析蛋白相对表达量。
2.8. 统计学处理
所有实验均重复3次以上,数据采用GraphPad Prism8.0处理。结果以均数±标准差(mean ± SD)表示,各组间计量资料的比较采用单因素方差分析(One-Way ANOVA),以P < 0.05为差异有统计学意义。
3. 结果
3.1. BafA1对脑缺血再灌注损伤小鼠脑组织的保护作用
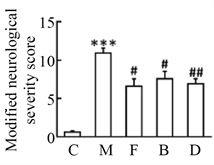
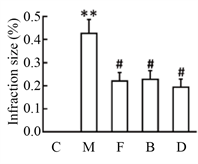
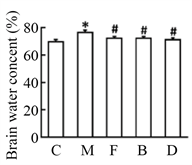
图1显示,与C组相比,M组神经行为评分、脑梗死面积和脑含水量显著增加,而M + F组、M + B组和M + ATG7 KO组神经行为评分、脑梗死面积和脑含水量均显著降低,差异具有统计学意义。
3.2. BafA1对脑缺血再灌注损伤小鼠海马组织自噬相关蛋白Beclin 1和LC3的影响
提取损伤侧海马组织总蛋白,图2结果显示,与C组相比,M组细胞自噬信号通路蛋白Beclin1和LC3表达显著增加,而M + F组、M + B组和M + ATG7 KO组细胞自噬信号通路蛋白Beclin1、LC3表达显著降低,差异具有统计学意义。
 (a)
(a)
 (b)
(b)
 (c)
(c)
 (d)Mean ± SD, n =3. *P < 0.05 vs NC; **P < 0.01 vs NC; ***P < 0.001 vs NC; #P < 0.05 vs M; ##P < 0.01 vs M; ###P < 0.001 vs M
(d)Mean ± SD, n =3. *P < 0.05 vs NC; **P < 0.01 vs NC; ***P < 0.001 vs NC; #P < 0.05 vs M; ##P < 0.01 vs M; ###P < 0.001 vs M
Figure 1. The changes of neurobehavioral score, cerebral infraction size and brain water content in five groups. (a) Process of experiment; (b) Neurobehavioral score; (c) Cerebral infraction size; (d) Brain water
图1. 5组小鼠神经行为评分、脑梗死面积和脑含水量的变化。(a) 实验过程;(b) 神经行为学评分;(c) 脑梗死面积;(d) 脑含水量
 (a) (b) (c)Mean ± SD, n = 3. *P < 0.05 vs NC; **P < 0.01 vs NC; ***P < 0.001 vs NC; #P < 0.05 vs M; ##P < 0.01 vs M; ###P < 0.001 vs M.
(a) (b) (c)Mean ± SD, n = 3. *P < 0.05 vs NC; **P < 0.01 vs NC; ***P < 0.001 vs NC; #P < 0.05 vs M; ##P < 0.01 vs M; ###P < 0.001 vs M.
Figure 2. The changes of autophagy related proteins in five groups. (a) Western blotting; (b) Statistical result of Beclin1; (c) Statistical result of LC3
图2. 5组小鼠海马自噬相关蛋白的变化。(a) 免疫印迹;(b) Beclin1统计学结果;(c) LC3统计学结果
4. 讨论
我国已经进入老龄化社会,缺血性脑损伤的发病率逐年升高,目前已成为威胁人类生命的最主要疾病之一,由于发病率、致死率或致残率高给社会和家庭造成严重危害,缺血组织恢复血流后会引起更严重的组织损伤和功能障碍,并且治疗效果非常差,临床称为缺血再灌注损伤 [7],缺血再灌注损伤已成为现代医学研究研究热点,但是缺血再灌注损伤的发病机制尚未完全阐明,临床上尚无有效的治疗方案,药物治疗仍是关键。
研究表明,在脑缺血、炎症反应等应激状态下,神经元内Beclin1、LC3、ATG5、LAMP1等自噬相关蛋白表达增加,自噬溶酶体途径被激活且参与了脑缺血再灌注损伤 [2] [9],目前关于脑缺血再灌注损伤中的自噬调控作用已经成为研究热点 [10]。研究表明,Baf A1对神经功能损伤具有一定的保护作用 [3],前期研究发现,Baf A1作用后缺血性脑损伤减小,并且可能跟抑制自噬水平有关。为了探究Baf A1是否通过抑制细胞自噬水平实现对脑缺血再灌注损伤的保护作用,我们借助条件性敲除自噬关键基因ATG7的小鼠建立了自噬缺失的脑缺血再灌注损伤小鼠模型。ATG7是在哺乳动物体内的酵母APG7的同源基因,这一基因是过氧化物酶和空泡膜融合所必须的,是一种研究自噬非常重要和常用的基因 [11],是自噬程序启动过程中的必要调节器。本实验以条件性敲除自噬关键基因ATG7建立的脑缺血再灌注损伤小鼠模型为研究对象,预防性的应用Baf A1结合氟西汀治疗,氟西汀作为阳性对照,既能回答Baf A1的保护作用是否直接和调节细胞自噬水平相关,又能探究自噬在脑缺血再灌注损伤发生、发展中的重要作用。
本实验采用改良longa. Zea氏线栓法 [5],制备小鼠脑缺血再灌注模型。结果显示,与假手术组相比,脑缺血再灌注组神经行为评分、脑梗死面积、脑含水量、Beclin1和LC3表达均显著增加,与以往的文献相同 [2] [9],说明造模成功。而氟西汀组、Baf A1组和ATG7 KO组均逆转上述变化,说明Baf A1与氟西汀相似,对脑缺血再灌注损伤小鼠具有一定的保护作用,Baf A1保护作用与ATG7 KO组相似,说明Baf A1的保护作用与细胞自噬水平相关,且自噬在其中起到了关键作用。Belin 1和LC3结果显示,Baf A1抑制了前期和后期自噬水平。通过以上数据,我们推断,Baf A1通过抑制前期和后期细胞自噬水平实现对脑缺血再灌注损伤小鼠的保护作用。当然,本实验如果再引用一个自噬激活剂,会更能说明问题,还需进一步研究。
基金项目
感谢浙江省实验动物科技计划项目(No. LGD19C090002)支持。
文章引用
殷乐依,王志坚. Bafilomycin A1对脑缺血再灌注损伤小鼠的保护作用及其机制
The Protective Effect and Mechanism of Bafilomycin A1 on Middle Cerebral Ischemia-Reperfusion Injury in Mice[J]. 生物医学, 2022, 12(02): 97-102. https://doi.org/10.12677/HJBM.2022.122012
参考文献
- 1. Wu, M.Y., Yiang, G.T., Liao, W.T., Tsai, A.P., Cheng, Y.L., Cheng, P.W., Li, C.Y. and Li, C.J. (2018) Current Mechanistic Concepts in Ischemia and Reperfusion Injury. Cell Physiology Biochemistry, 46, 1650-1667. https://doi.org/10.1159/000489241
- 2. 庄伟, 陈金波. 脑缺血再灌注损伤[J]. 国际脑血管病杂志, 2019, 27(12): 948-952.
- 3. 伏春艳, 王志坚, 沈忠飞, 等. 巴弗洛霉素A对抑郁大鼠行为及海马脑源性神经营养因子的影响[J]. 四川大学学报(医学版), 2017, 48(1): 50-53.
- 4. 王志坚, 刘胜兵, 沈忠飞. 巴弗洛霉素A1对脑缺血再灌注损伤作用的初步研究[J]. 赤峰学院学报(自然科学版), 2017, 35(5): 42-43.
- 5. Gagliardi, S., Rees, M. and Farina, C. (1999) Chemistry and Structure Activity Relationships of Bafilomycin A1, a Potent and Selective Inhibitor of the Vacuolar H+−ATPase. Current Medicinal Chemistry, 6, 1197-212.
- 6. Longa, E.Z., and Carlson, S.P.R. (1989) Reversible Middle Cerebral Artery Occlusion without Craniectomy in Rats. Stroke, 20, 84-89. https://doi.org/10.1161/01.STR.20.1.84
- 7. Bederson, J.B., Pitts, L.H., Tsuji, M., Nishimura, M.C., Davis, R.L. and Bartkowski, H. (1986) Rat Middle Cerebral Artery Occlusion: Evaluation of the Model and Development of a Neurologic Examination. Stroke, 17, 472-476. https://doi.org/10.1161/01.STR.17.3.472
- 8. Peng, C., Rao, W., Zhang, L., et al. (2018) Mitofusin 2 Exerts a Protective Role in Ischemia Reperfusion Injury Through Increasing Autophagy. Cell Physiology Biochemistry, 46, 2311-2324. https://doi.org/10.1159/000489621
- 9. Puyal, J., Vaslin, A., Mottier, V., et al. (2009) Postischemic Treatment of Neonatal Cerebral Ischemia Should Target Autophagy. Annals of Neurology, 66, 378-389. https://doi.org/10.1002/ana.21714
- 10. Huang, Y.G., Tao, W., Yang, S.B., Wang, J.F., Mei, Z.G. and Feng, Z.T. (2019) Autophagy: Novel Insights into Therapeutic Target of Electroacupuncture against Cerebral Ischemia/Reperfusion Injury. Neural Regeneration Research, 14, 954-961.
- 11. Arakawa, S., Honda, S., Yamaguchi, H. and Shimizu, S. (2017) Molecular Mechanisms and Physiological Roles of Atg5/Atg7-Independent Alternative Autophagy. Proceedings of the Japan Academy, Series B, 6, 378-385. https://doi.org/10.2183/pjab.93.023