Hans Journal of Chemical Engineering and Technology
Vol.08 No.02(2018), Article ID:24159,10
pages
10.12677/HJCET.2018.82014
Synthesis of 1-(3-Diethylaminophenyloxy)-2-Propanol Catalyzed by MgO-Al2O3 Composite Oxides
Xu Yang, Hongqi Li*, Hong Fan
College of Chemistry, Chemical Engineering & Biotechnology, Donghua University, Shanghai

Received: Mar. 6th, 2018; accepted: Mar. 16th, 2018; published: Mar. 26th, 2018

ABSTRACT
1-(3-Diethylaminophenyloxy)-2-propanol was synthesized with 3-hydroxy-N,N-diethylaniline and 1,2-propylene oxide as reactants. In the presence of alkaline catalyst, 1-(3-diethylaminopheny-loxy)-2-propanol was synthesized. The effects of catalyst composition and preparation process on the catalytic synthesis of 1-(3-diethylaminophenyloxy)-2-propanol were investigated. The results showed that the MgO-Al2O3 composite oxides calcined at 300˚C exhibited efficient catalytic performance when the molar ratio of Mg:Al was 0.0015. The optimum reaction condition was as follows: reaction temperature 120˚C, reaction time 5 h, molar ratio of the reactants being n(3-hydroxy-N,N-diethylaniline):n(1,2-propylene oxide) = 1:1.7, and catalyst feeding ratio 1 wt%. Under the optimum reaction condition, the yield of 1-(3-diethylaminophenyloxy)-2-propanol reached 81.78%, the conversion rate was 93.06%, and the selectivity was 88.39%.
Keywords:Composite Oxides, Propylene Oxide, 1-(3-Diethylaminophenoxy)-2-Propanol, PPh
MgO-Al2O3复合氧化物催化合成1-(3-二乙氨基苯氧基)-2-丙醇
杨旭,李洪启*,范虹
东华大学化学化工与生物工程学院,上海

收稿日期:2018年3月6日;录用日期:2018年3月16日;发布日期:2018年3月26日

摘 要
以3-羟基-N,N-二乙基苯胺与1,2-环氧丙烷为反应物,在碱性催化剂的作用下合成1-(3-二乙氨基苯氧基)-2-丙醇。作者研究了催化剂组成和制备工艺对催化合成1-(3-二乙氨基苯氧基)-2-丙醇反应的影响。结果显示,当镁铝摩尔比为0.0015,经过300℃煅烧制成的MgO-Al2O3复合氧化物表现出高效的催化性能。通过实验得到的最佳工艺条件为:反应温度为120℃,反应时间为5 h,反应物摩尔比n(3-羟基-N,N-二乙基苯胺):n(1,2-环氧丙烷) = 1:1.7,催化剂投料量为1 wt%。在此工艺条件下,1-(3-二乙氨基苯氧基)-2-丙醇的产率达到81.78%,转化率为93.06%,选择性为88.39%。
关键词 :复合氧化物,1,2-环氧丙烷,1-(3-二乙氨基苯氧基)-2-丙醇,丙二醇苯醚

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着染料工业化的发展,染料中间体的应用范围渗透到炸药工业、农药工业、制药工业和信息记录材料工业,以及塑料、表面活性剂、香料、助剂和合成纤维等领域。但染料中间体的发展依然面临着诸多问题,例如一些染料中间体产品的品质并不高,生产技术也不够先进 [1] {李娜, 2012 #1} 。目前,对于丙二醇苯醚的研究受到了许多科研工作者的重视,工业产品品种很多 [2] ,通过研究寻找到了合适的催化剂及工艺条件,丙二醇苯醚的产率得到了提升 [3] [4] [5] 。然而丙二醇苯醚类染料中间体的研究并不是很多,由于其与丙二醇苯醚具有相似的化学结构,在进一步合成为阳离子染料后,其柔性支链上的羟基可以与腈纶纤维结构中的第三单体衣康酸发生酯化反应,从而增强染料分子与纤维的结合力,可以表现出许多优点如着色能力强、色光鲜艳、耐光牢度好、毒性小、相对绿色以及环保性佳等诸多特点,是一类重要的阳离子染料中间体。有关丙二醇醚类染料中间体的合成工艺的文献较少,但其合成路径及方法类似于丙二醇苯醚的合成方法。传统工艺主要采用三乙醇胺液体为催化剂,催化效率并不高,并且由于液–液体系分离纯化流程复杂,成本较高,因此研发新型高效固体催化剂的趋势更加的迫切。
以水滑石及类水滑石为前驱体煅烧所制得的复合氧化物均存在碱中心,作为碱性催化剂已被用于烯烃异构化反应、亲核卤代反应、烷基化反应、烯烃环氧化反应和Claisen-Schmidt反应等 [4] - [9] 。鉴于类水滑石为前驱体的复合氧化物在上述催化反应中显示出活性高、稳定性好、选择性强、金属活性组分分散度高、再生重复性强等特点,本文以类水滑石化合物为前驱体制备得到的复合氧化物为催化合成1-(3-二乙氨基苯氧基)-2-丙醇的新型催化剂。通过对催化剂的结构以及催化性能的考察,开发出了高效的固体碱催化剂,并进一步系统研究了反应条件对该反应的影响。
2. 实验部分
2.1. 目标催化剂的制备及其表征
2.1.1. 主要仪器与试剂
仪器:HG-10-4B型箱式电阻炉,DZG-6050型真空干燥箱,DGG-9140A型电热恒温鼓风干燥箱,YZPR-50型水热反应釜,岛津GCMS-QP2010 Ultra,FT-IR傅立叶变换红外光谱仪,TG 209 F1热分析仪,18KW转靶X射线衍射仪,飞纳台式扫描电镜。
试剂:氧化镁(AR),九水合硝酸铝(AR),1,2-环氧丙烷(AR),3-羟基-N,N-二乙基苯胺(AR),甲醇(AR)。
2.1.2. 目标催化剂的制备
按摩尔比为MgO:Al2O3 = 1:0.0015分别称取原料氧化镁和九水合硝酸铝,溶于50 ml去离子水中,用玻璃棒搅拌使其完全溶解,加入到三颈瓶中,放入磁石,在40℃恒温油浴中反应12 h。取出反应后的白色非均相液体,过滤得到滤饼,置于真空烘燥箱中80℃烘干6 h。
取出前驱体将其置于马弗炉中进行煅烧,设定升温程序为5℃/min,从室温升至300℃,再在300℃恒温煅烧3 h,自然冷却,即制得MgO-Al2O3复合氧化物。
2.1.3. 目标催化剂的表征
采用美国珀金埃尔默股份有限公司的傅立叶变换红外光谱仪对目标催化剂中的官能团和化学键进行测定。
采用日本Rigaku公司的18KW转靶X射线衍射仪(XRD)对目标催化剂的物相进行测定。
采用德国耐驰仪器制造有限公司的TG 209 F1热分析仪(TG-DTG)对目标催化剂进行样品的热稳定性分析。分析条件:氮气气氛,升温速率为10℃/min,升温至600℃。
采用飞纳台式扫描电镜对复合氧化物的表面形貌进行表征。
2.2. 1-(3-二乙氨基苯氧基)-2-丙醇的合成
2.2.1. 反应原理
1,2-环氧丙烷和3-羟基-N,N-二乙基苯胺在固体碱性催化剂的作用下发生开环加成反应生成1-(3-二乙氨基苯氧基)-2-丙醇,副产物主要包括1-(3-二乙氨基苯氧基)-2-丙醇继续和1,2-环氧丙烷反应得到的少量二丙二醇苯醚类副产物,以及因1,2-环氧丙烷不同的开环方式所生成的2-(3-二乙氨基苯氧基)-1-丙醇。
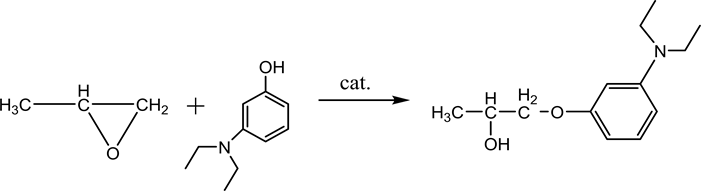
2.2.2. 1-(3-二乙氨基苯氧基)-2-丙醇的合成
用天平称取6.6 g (0.04 mol) 3-羟基-N,N-二乙基苯胺于水热反应釜当中,并加入0.1 g制备好的的MgO-Al2O3固体碱催化剂,然后用注射器吸取4.2 ml (0.03 mol)的1,2-环氧丙烷并缓慢加入到水热反应釜中。
向水热反应釜中通一段时间的氮气后,将其密封好,以防止气体外漏,然后将水热反应釜置于恒温烘燥箱中,逐渐升温至120℃,恒温反应5 h。反应结束后,逐渐冷却至室温,将水热反应釜取出。对反应液进行真空抽滤,以除去反应体系中的MgO-Al2O3固体碱催化剂,最终得到的产物为红棕色的粘稠液体。以GC-MS对产物进行定量分析。
3. 结果与讨论
3.1. 催化剂的表征
3.1.1. IR表征
将以上镁铝(Mg/Al)摩尔比n(Mg):n(Al) = 0.0015,煅烧温度为300℃的MgO-Al2O3固体碱催化剂使用KBr压片,测试光谱范围4500 cm−1~500 cm−1,扫描次数32次,得到的IR光谱图如图1所示。由图1可见,3698.87 cm−1处有很强的吸收峰,是属于游离的羟基即Mg-OH和Al-OH的伸缩振动吸收峰;3446.24 cm−1处的宽吸收峰对应的是缔合的氢键或H2O中的O-H伸缩振动吸收峰;1641.16和1382.74 cm−1处的吸收峰较弱,是属于Mg-OH和Al-OH的弯曲振动吸收峰;500 cm−1左右是属于金属本征晶格,O-M-O的特征吸收峰 [10] 。
3.1.2. XRD表征
复合MgO-Al2O3氧化物的XRD测试结果如图2所示,可以看到,300℃、空气气氛煅烧条件下的MgO-Al2O3固体碱氧化物的XRD谱图中有明显的立方晶型的MgO和Al2O3的特征衍射峰,其中2 = 38.10˚和62.28˚特征衍射峰归属于MgO,2 = 18.82˚和50.78˚特征衍射峰归属于Al2O3,2 = 58.92˚特征衍射峰则归属于MgAl2O4,以上相关特征衍射峰反映出制备的MgO-Al2O3固体碱氧化物表面存在着MgO、Al2O3和MgAl2O4,证实了其表面有微量Al2O3的存在 [10] [11] 。总的来说,谱图基线平稳,衍射强度大,衍射峰峰形尖而窄,表明晶面生长有序度较高,结晶度较好。
3.1.3. TG-DTG表征
未经过高温煅烧MgO-Al2O3固体碱氧化物的热重分析结果如图3所示,测试时首先用分析天平称取未煅烧MgO-Al2O3固体碱氧化物约4 mg,测试条件为:N2气氛,从室温25℃升温至600℃,升温速率为10℃/min。由图3可知,MgO-Al2O3固体碱氧化物有两次失重。第一次失重情况发生在升温初期,由DTG曲线可以得出此阶段失重峰并不明显,在这个阶段主要是由于失去MgO-Al2O3固体碱氧化物表面上物理吸附的水合物自身所带的结晶水 [12] 。

Figure 1. IR of MgO-Al2O3
图1. MgO-Al2O3复合氧化物的红外光谱图

Figure 2. XRD patterns of MgO-Al2O3
图2. MgO-Al2O3复合氧化物的XRD图

Figure 3. TG-DTG patterns of MgO-Al2O3
图3. 未经过高温煅烧的MgO-Al2O3复合氧化物的TG-DTG图
在第二个失重阶段,当温度在260℃~400℃范围内MgO-Al2O3固体碱氧化物出现了第二次失重现象,此次失重现象明显,最大失重达到约27%,DTG曲线可以明显显示出这个十分明显且尖锐的吸热峰。此时主要是因为MgO-Al2O3固体碱氧化物脱去了层间的-OH,此外还有一些 和 分解并从表面脱去。随着温度进一步升高,TG曲线区域平稳。
我们可以分析得到,MgO-Al2O3固体碱氧化物经过300℃高温煅烧之后,失去了表面上一些阴离子和层间水,产生氧化物粒度十分均匀,尺寸小,晶体结构有序,可作为高效的MgO-Al2O3固体碱催化剂,这一结果与XRD相吻合 [13] 。
3.1.4. SEM表征
为了进一步研究MgO-Al2O3固体碱氧化物表面的形貌,对催化剂进行了SEM表征,具体的形貌如图4所示。由于反应时间、温度梯度和浸渍扩散控制等诸多因素的存在,图4中为300℃煅烧的MgO-Al2O3固体碱氧化物的表面,其形貌显示为狭长的片层,类似于细长花瓣状的结构,分散均匀,结构规整,因而具有十分发达的表层结构,类似于这种小尺寸结构的表面具有很高的利用率。
3.2. 反应条件的考察
3.2.1. 温度对反应的影响
本实验中选择100℃、110℃、120℃、130℃和140℃这5个温度值考察反应温度对产率的影响,工艺条件为:反应时间5 h,反应物摩尔比n (间羟基-N,N-二乙基苯胺):n (环氧丙烷) = 1:1.5,且MgO-Al2O3固体碱催化剂用量选择为反应物料质量的1%,结果如图4所示。其中,物质A为主产物1-(3-二乙氨基苯氧基)-2-丙醇,物质B为主要副产物2-(3-二乙氨基苯氧基)-1-丙醇。
从表1和图5中可以得出,当反应温度在100℃到120℃这个上升区间时,产物中1-(3-二乙氨基苯氧基)-2-丙醇(A)的产率随着温度的升高而增加,而当温度进一步上升,自120℃到140℃这个区间升温时,产物中1-(3-二乙氨基苯氧基)-2-丙醇(A)的产率出现减小的现象。在反应温度为120℃时反应中主产物的产率和间羟基-N,N-二乙基苯胺的转化率达到最大值,虽然在120℃时的选择性不是最高,但与其他温度值下的选择性相差很小,同时由相应的A/B的数值可以看到对于同一种催化剂而言,温度的的改变对于其催化反应所得到的产物的选择性影响不大,A/B都在8.5左右,而且此时原料的转化率是最高的,有利于节约成本。因此选择最佳反应温度为120℃。

Figure 4. SEM of MgO-Al2O3
图4. MgO-Al2O3复合氧化物的SEM图
Table 1. Effect of reacting temperature
表1. 不同反应温度对反应的影响

Figure 5. Effect of reacting temperature
图5. 不同反应温度下产率折线图
3.2.2. 时间对反应的影响
本实验中选择2 h、3 h、4 h、5 h和6 h这5个时间考察反应时间对产率的影响,工艺条件为:反应温度120℃,反应物摩尔比n (间羟基-N,N-二乙基苯胺):n (环氧丙烷) = 1:1.5,MgO-Al2O3固体碱催化剂用量选择为反应物料质量的1%,测定结果如表2和图5所示。
从表2和图6可以明显得出,反应时间从2 h延长至5 h时,产率增加明显,然而当时间从5 h增至至6 h时,产率变化并不明显。在反应时间为5 h时产物的产率和间羟基-N,N-二乙基苯胺的转化率达到最大值,继续增大反应时间会增加生产成本,所以选择最佳反应时间为5 h。同时由选择性数值可以看出,虽然在反应时间为5 h时的选择性不是最高,但与最佳选择性的数值差别很小,由相应的A/B的数值可以看到对于同一种催化剂而言,反应时间的改变对于其催化反应所得产物的选择性影响很小,A/B在5 h时达最大值8。综上所述,最佳反应时间选择为5 h。
3.2.3. 反应物摩尔比对反应结果的影响
实验中选择的反应物摩尔比为n (间羟基-N,N-二乙基苯胺):n (环氧丙烷) = 1:1、1:1.2、1:1.5、1:1.7和1:2,考察不同反应物摩尔比对反应产率的影响,工艺条件为:反应温度120℃,反应时间为5 h,MgO-Al2O3固体碱催化剂用量选择为反应物料质量的1%,测定结果如表3和图7所示。
从以上图表中可以得出,随着n (间羟基-N,N-二乙基苯胺):n (环氧丙烷)增加时,反应的产率也随之增加。在n (间羟基-N,N-二乙基苯胺):n (环氧丙烷) = 1:1.7时,生成物中主产物1-(3-二氨基苯氧基)-2-丙醇产率达到最大值,继续增大摩尔比的情况下,产物1-(3-二氨基苯氧基)-2-丙醇的产率下降并不明显。因此从主产物产率角度考虑,摩尔比为1:1.7最佳;由于采用环氧丙烷过量的方法,所以生成产物的参数以间羟基-N,N-二乙基苯胺的量来计算,从转化率的角度考察反应,摩尔比为1:1.7时的转化率要明显高于摩尔比为其它数值时;选择性在摩尔比为1:1.7时不是最佳,但相对来说各个摩尔比的选择性差异不大;由A/B的比值可以看出对于相同种类及配方的催化剂而言,反应物摩尔比的变化对于其催化反应所得产物的选择性影响不大。
3.2.4. 催化剂投料量对反应的影响
实验中选择催化剂投料量为0.05 g,0.1 g,0.2 g,0.3 g和0.4 g,考察催化剂投料量对产率的影响。
Table 2. Effect of time
表2. 不同反应时间对反应的影响

Figure 6. Effect of time
图6. 不同反应时间下的产率折线图

Figure 7. Effect of mole ratio
图7. 不同反应物摩尔比下的产率的折线图
Table 3. Effect of mole ratio
表3. 不同反应物摩尔比对反应的影响
Table 4. Effect of catalyst input
表4. 催化剂投料量对反应的影响
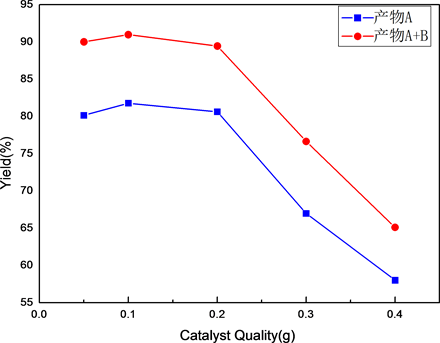
Figure 8. Effect of catalyst input
图8. 不同催化剂投料量下产率的折线图
工艺条件为:反应温度120℃,反应时间为5 h,n (间羟基-N,N-二乙基苯胺):n (环氧丙烷) = 1:1.5,MgO-Al2O3固体碱催化剂用量选择为反应物料质量的1%,测定结果如表4和图8所示。
由表4和图7可以看到,当催化剂用量小于0.2 g (2 wt%)时,产物中1-(3-二乙氨基苯氧基)-2-丙醇(A)的产率基本稳定在80%左右。当催化剂的投料超过2 wt%时,产物的产率急剧下降。因此反应中催化剂的用量选定为1 wt%,此时间羟基-N,N-二乙基苯胺的转化率也最高。选择性在催化剂用量为4 wt%时很低,其它情况差异不大。综合考虑三个条件,最佳催化剂投料量选择为1 wt%。
4. 结论
采用共沉淀法可制备MgO-Al2O3类水滑石,以其为前驱体经过高温煅烧制备的复合氧化物可作为催化剂,对以3-羟基-N,N-二乙基苯胺和1,2-环氧丙烷为反应物合成1-(3-二乙氨基苯氧基)-2-丙醇的反应表现出较高的催化活性和选择性。MgO-Al2O3复合氧化物催化合成1-(3-二乙氨基苯氧基)-2-丙醇适宜的工艺条件为:催化剂投料为反应物总质量的1%,反应原料间羟基-N,N-二乙基苯胺与环氧丙烷的摩尔比为1.7:1,反应温度为120℃,反应时间为5 h。在此反应条件下,1-(3-二乙氨基苯氧基)-2-丙醇的收率达到81.78%,转化率达到93.06%,选择性达到88.39%。
文章引用
杨 旭,李洪启,范 虹. MgO-Al2O3复合氧化物催化合成1-(3-二乙氨基苯氧基)-2-丙醇
Synthesis of 1-(3 Diethylaminophenyloxy)- 2-Propanol Catalyzed by MgO-Al2O3 Composite Oxides[J]. 化学工程与技术, 2018, 08(02): 108-117. https://doi.org/10.12677/HJCET.2018.82014
参考文献
- 1. 韩晨曦, 韩永奇. 染料中间体发展遭遇瓶颈[N]. 中国纺织报, 2013-1-23.
- 2. 姚莉, 李东风, 袁金芳, 等. 水性涂料成膜剂丙二醇苯醚的合成与表征[J]. 广州化工, 2007, 35(1): 38-39.
- 3. Zhang, Y., Lu, B., Wang, X., et al. (2011) An Atom-Economic Reaction for Synthesis of 1-Phenoxy-2-Propanol over Al2O3/MgO. Applied Catalysis A: General, 408, 125-129. https://doi.org/10.1016/j.apcata.2011.09.010
- 4. Feng, S., Cao, F., Lu, B., et al. (2014) A Magnetically Separable Catalyst for Synthesis of 1-Phenoxy-2-Propanol via Atom-Economic Reaction. Journal of the Chinese Chemical Society, 61, 1065-1167. https://doi.org/10.1002/jccs.201300622
- 5. Lu, H., Cheng, H., Sun, L., et al. (2013) Method for Synthesizing β-Alkoxy Alcohol Compounds. Patent CN103333058A.
- 6. 石英华. 近代丙二醇醚合成技术[J]. 黎明化工, 1994(2): 15-16.
- 7. 梁天开. 环氧丙烷与低级脂肪醇在固体酸催化剂上的醚化[J]. 石油化工, 1991, 20(6): 371-372.
- 8. 乌云高娃, 张婕. 有关合成丙二醇醚催化剂方面的进展[J]. 西北纺织工学院学报, 1999, 13(4): 431-435.
- 9. 李军. KF/AMO固体碱催化剂催化合成丙二醇甲醚的研究[D]: [硕士学位论文]. 天津: 天津大学, 2006: 3-5.
- 10. 张永博. 苯酚和环氧丙烷催化合成丙二醇苯醚的原子经济反应研究[D]: [硕士学位论文]. 哈尔滨: 哈尔滨师范大学, 2011: 10-15.
- 11. Li, Y., Amin, M.N., Lu, X., et al. (2016) Pyrolysis and Catalytic Upgrading of Low-Rank Coal Using a NiO/MgO-Al2O3 Catalyst. Chemical Engineering Science, 155, 194-200. https://doi.org/10.1016/j.ces.2016.08.003
- 12. 朱娟. 固体碱催化环氧丙烷法合成丙二醇甲醚[D]: [硕士学位论文]. 上海: 华东师范大学, 2011: 1-6.
- 13. 程文萍, 王雯娟, 赵月昌, 等. ZnMgAl复合氧化物催化合成丙二醇苯醚[J]. 化工学报, 2007, 58(12): 3072-3075.
NOTES
*通讯作者。
