Advances in Analytical Chemistry
Vol.06 No.04(2016), Article ID:18869,7
pages
10.12677/AAC.2016.64017
Research Progress in Cyanine Dyes and Their Functionalized Nanocomposites Used for Bioanalysis and Near-Infrared Molecular Fluorescent Imaging
Hongxiang Huang
Department of Macromolecular Science of Fudan University, State Key Laboratory of Molecular Engineering of Polymers, Shanghai

Received: Oct. 11th, 2016; accepted: Nov. 1st, 2016; published: Nov. 7th, 2016
Copyright © 2016 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Cyanine (Cy) compounds can produce strong fluorescent emission in the near infrared region after radiation and be easily modified with various substituents, thus they have been recently widely used as fluorescent probes to bind with bio-molecules, cells and tissues. The as-prepared luminescent materials have provided a facile route for the bioanalysis, molecular fluorescent imaging and clinicopathologic analysis, especially for the tumour diagnosis and treatment. In this work, we reviewed the latest achievement of applications of several well-known cyanine derivatives such as Cy3, Cy5, Cy7, Cy3.5, Cy5.5, and their bio-nanocomposites produced with inorganic nanoparticles as luminescent probes in the fields of bioanalysis and near infrared molecular imaging.
Keywords:Cyanine, Bioanalysis, Near Infrared Image, Bio-Nanocomposite, Fluorescence

菁染料及其功能化的纳米材料在生物分析和 近红外荧光成像方面的应用研究进展
黄红香
复旦大学高分子科学系,聚合物工程国家重点实验室,上海
Email: hxhuang@fudan.edu.cn
收稿日期:2016年10月11日;录用日期:2016年11月1日;发布日期:2016年11月7日

摘 要
菁染料(Cy)在近红外区域有较强的荧光发射且易于修饰,因而近年来被广泛地应用于敏化生物分子、细胞和组织等物质,形成荧光标记的复合体,从而为生物分析、生物成像和疾病(特别是肿瘤)的机理分析和治疗提供了一条非常便利的途径。本文总结了近年来几种常见的菁染料(Cy3, Cy5, Cy7, Cy3.5和Cy5.5)及其与无机纳米粒子形成的纳米荧光标记物在生物分析和近红外成像方面所取得的最新成果。
关键词 :菁染料,生物分析,近红外成像,生物纳米复合材料,荧光

1. 引言
随着荧光探针和光学成像技术的发展,近年来近红外成像方法被广泛用于细胞标记、组织和活体成像、药物释放和疾病治疗的动力学等方面的研究领域 [1] [2] [3] ,特别是在肿瘤模型的定位及光动力学治疗等领域。在近红外成像研究和实际应用方面,具有稳定性好、近红外区域荧光效率高的荧光剂是标记研究目标的重要组成部分。目前常用的荧光染料有多次甲基菁(常称为菁染料)、方酸菁、荧光素和罗丹明等。多次甲基菁被发现于1856年,由于这类菁染料具有稳定性高、摩尔消光系数大、吸收波长可调以及化合物易于修饰等特点,作为光学材料一直受到人们的广泛关注 [4] [5] 。特别是近年来,随着分子识别技术、量子点、荧光标记和生物成像技术的发展,菁染料已经发展成为在DNA、蛋白质和核酸的分析,以及生物医学中肿瘤细胞的定位和治疗等方面使用的一种重要的荧光探针 [6] [7] 。
本文介绍了菁染料中代表性的Cy系列(Cy3, Cy5, Cy7, Cy3.5和Cy5.5)荧光标记剂及其功能化的生物无机纳米材料在生物检测、近红外成像和治疗等方面的应用研究。
2. 菁染料的合成及其基本性质
菁染料是由不同的杂环核通过甲川链连接起来的一类不饱和杂环化合物,其结构通式为M2N-(CH=CH)n-NM2,典型的Cy系列的菁染料的结构如图1所示 [2] 。共轭链的两端可以连接有杂环或芳香环,分子内部杂环上的氢原子也可以被一些烷基或其它功能基团所取代,形成菁染料的衍生物。常用的Cy系列菁染料中,根据两个氮杂环之间的甲川链的长度,可分为三甲川、五甲川和七甲川等菁染料,分别用Cy3, Cy5, Cy5.5和Cy7等表示(如图1所示)。这些菁染料具有一定的水溶性,有时为了提高它们的水溶性,人们会在杂环基端引入一些亲水基团,使得菁染料衍生物能够更好地与生物分子作用,提高荧光发射效率 [7] [8] 。不仅杂环N原子上的羧基可以改性,甲川链上的C原子也可以进一步烷基化,引入烷基或其它功能基团,改善菁染料的发光特性,满足生物标记的需要 [7] [8] [9] 。经过改性的菁染料还可以插入反胶束等微环境中,调节菁染料分子之间的距离,从而调控菁染料的发光特性,得到微环境对菁染料发光性质的影响,为生物标记提供模型体系 [10] 。
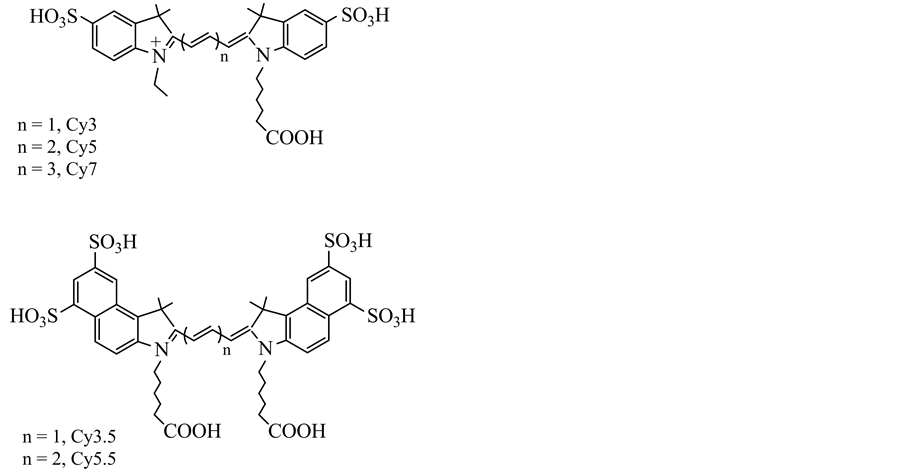
Figure 1. Chemical structure of well-used cyanine dyes (Cy3, Cy5, Cy7, Cy3.5 and Cy5.5)
图1. 常用的菁染料(Cy3, Cy5, Cy7, Cy3.5和Cy5.5)的结构式
从图1可以看到,菁染料分子含有一个大的π-共轭体系,与常见的卟啉/酞菁等大环化合物一样,菁染料分子吸收光能后,分子外层电子会由基态跃迁到激发态,然后经过一系列的能量转移过程后,激发态电子再回到基态,从而将激发态能量以光的形式发射,得到其特征的荧光发射光谱 [11] [12] 。菁染料的吸收光谱和发射光谱与取代基的种类和位置密切相关,共轭体系越大,吸收和发射光谱的波长越长;取代基上的给电子或吸电子基团也对吸收和荧光发射光谱有明显的影响,所以研究人员可以根据实际需要对菁染料进行化学修饰,得到受环境影响较小的发射光谱,从而提高被检测信号的准确度。此外,对阴离子也对菁染料分子的荧光有一定的影响;如邓洪杰等人发现如果将菁染料的对离子由甲基磺酸盐换成高氯酸盐,荧光发射光谱可以移到830 nm [13] 。
图2是常用的具有与本文所讨论的菁染料类似结构的3,3’-二乙基硫代甲川菁染料碘化物(3,3’-Diethylthiacarbocyanine iodide, DTCy)和11-氯-1,1’-二正丙基-3,3,3’,3’-四甲基-10,12三亚甲基吲哚三碳花青碘盐(11-Chloro-1,1’-di-n-propyl-3,3,3’,3’-tetramethyl-10,12-trimethyleneindatricarbocyanine iodide, CPTTCy)在甲醇溶液中的紫外-可见吸收和荧光发射光谱曲线。这两种染料均购自AlfaAesar公司。
从图2可以看出,DTCy染料在556 nm处有一个强的吸收峰,在约520 nm处有一个肩峰,均对应于该染料外层电子由基态到激发态的跃迁。对于CPTTCy染料,在350~450 nm的波长范围内由几个小的吸收峰,并在778 nm处有一个很强的吸收峰,对应于染料分子由基态到激发态的跃迁。两种染料在500到700 nm范围内有较强的荧光发射。DTCy染料的发射峰主要在575附近,而CPTTCy染料的发射峰在此范围内有三个小峰组成,与其吸收光谱对应。这些发射峰是由于染料激发态分子由最低激发态回到基态时的能量释放。
3. 菁染料在生物分析中的应用
菁染料的这种荧光特性及其结构的易修饰性,使得它们除可用于红外激光染料、光学存储器件和非线性光学等方面的应用外,非常适合于对生物分子的标记、分析和检出。菁染料对生物分子的分析和检测主要包括与核酸、DNA和蛋白质等进行染色(形成复合物),然后通过荧光光谱或近红外分子成像技术
 (a) (b)
(a) (b)
Figure 2. Absorption (a) and fluorescence emission (b) spectra of two cyanine dyes in the dilute methanol solutions (excited wavelength; DTCy, 560 nm, CPTTCy, 480 nm).
图2. 两种Cy系列菁染料在稀的甲醇溶液中的(a)紫外吸收和(b)荧光发射光谱图(激发波长:DTCy, 560 nm; CPTTCy, 480 nm)
进行跟踪研究 [14] [15] 。Cy系列菁染料也是常用的一类荧光材料,如Li等人最近合成了具有不同结构的Cy7并用于检测硝基还原酶 [16] 。结果发现,只有对位上是硝基苯修饰的Cy7能够用于快速检测硝基还原酶,原因是当对位上有吸电子的硝基基团时,分子间能够形成氢键,同时空间结构也比较匹配。共聚焦显微镜结果表明,这种Cy7荧光染料能够在细胞层次上检测硝基还原酶。
Gruber等人则通过合成一些Cy染料,从两个方面评价了Cy系列荧光染料与生物素的作用机理 [17] 。一个方面是将荧光染料共价键合到抗体上,通过调节染料与蛋白质的比例,再与未标记的荧光染料对比,揭示荧光染料与生物素的作用机理。另一方面是将荧光染料接到生物素上形成相应的发光衍生物,再分析其荧光光谱的变化与结构的关系。结果发现,所标记的生物素和抗体衍生物的荧光与染料的结构密切相关。作者对衍生物的发光机理与结构的关系展开了深入的讨论,并得出如下结论:抗体与Cy3和Cy3.5形成的衍生物有明显的荧光发射,而与Cy5和Cy7结合后,染料荧光被猝灭,为生物标记时荧光染料的选择提供了一些规律性的结果。
Cy系列染料还常常用于肿瘤方面的研究,如Kang等人利用Cy3, Cy5, Cy7, Cy3.5和Cy5.5等设计了一种专门针对与肿瘤相关的酶的荧光探针 [18] 。他们将染料分子直接或间接地锚定在甘氨酸骨架上,由于此时染料分子之间的距离比较近,所以荧光被猝灭。但是,当复合材料加入生物组织后,探针被体系中的酶催化水解,导致Cy系列荧光染料被释放,从而可以检测到它们的荧光。根据荧光光谱和近红外的图像可以进一步跟踪肿瘤的形成及其存在状态。此外,还可以把荧光染料分子与正在凋亡的细胞作用,根据染料分子的荧光强度的变化推测肿瘤细胞凋亡的规律,进而分析药物与肿瘤细胞的作用机理等 [19] 。Chen等人将包括Cy7系列的多种荧光染料分子嫁接到一系列的有机多酸上,然后用这些荧光染料去标记前列腺特异性膜抗原 [20] 。结果发现,这些修饰过的荧光染料都可以用来标记前列腺特异性膜抗原肿瘤,其中Cy7修饰的衍生物具有最高的标记肿瘤的相应性,也就是说Cy7系列荧光染料可能更加适合于此类体系的研究。
4. 菁染料-无机纳米复合材料在生物分析方面的应用
随着纳米和超分子技术的发展,菁染料与纳米材料通过共价或非共价键形成的杂化材料或复合纳米材料在生物检测和分子成像方面取得了快速的研究进展,特别是在分子成像方面,纳米材料具有很高的比表面积并易于与染料分子和生物分子作用,因而可形成容易被跟踪的荧光靶向材料 [21] [22] 。
根据目前文献的研究结果 [21] [22] ,作者发现染料分子与纳米材料的复合物的制备通常可以通过两种途径进行。如图3所示,一种是在染料分子的某一位置接上可以与纳米材料作用的基团;另一种是修饰纳米材料,使纳米材料的表面功能化,从而与染料分子形成复合材料。比如,Kircher等人先合成了氨基功能化的纳米氧化铁,然后将Cy7荧光染料嫁接到功能化的纳米氧化铁表面,再与蛋白酶作用,形成生物纳米复合材料。然后,与作为内标的另一个荧光染料Cy5.5的荧光发射进行比较,提出了利用双重荧光图像化的方法来原位探讨蛋白酶的生物活性 [23] 。
Gianella等人通过水包油的微乳液体系,合成了由氧化铁纳米晶、荧光染料Cy7和具有疏水性的糖皮质激素醋酸泼尼松龙戊酸(glucocorticoid prednisolone acetatevalerate)组成的靶向材料。磁共振成像(MRI)和近红外成像的研究结果发现,这些纳米微乳液易于在肿瘤附件聚集,从而为肿瘤的指导治疗提供了帮助 [24] 。另外,纳米SiO2也是经常使用的一种无机纳米材料,由于其具有生物相容性好、低毒性、表面具有亲水性、易于制备成介孔结构和表面功能化等特点,与荧光染料作用后,被广泛用于生物分析和药物的载体 [25] [26] 。
5. 菁染料及其无机纳米复合材料在近红外成像方面的应用
利用Cy系列荧光染料的近红外成像能更能具体直观地描述和检测肿瘤细胞的产生和凋亡过程,如Zou等人将荧光染料Cy7嫁接到老鼠的单克隆抗体上,并利用近红外成像法研究了荧光标记的抗体在被解剖的组织上的分布情况。该方法可以发展成为检测肿瘤细胞的一个途径 [27] 。
将Cy荧光染料与具有高灵敏度的磁共振材料(Gd3+)共同使用,可以开发出具有双重功能的分析和测试方法。如Yamane等人将多种Cy7的荧光染料与Gd3+形成共轭化合物,用来研究Gd3+化合物在细胞中的穿透作用 [28] 。结果发现,这些荧光标记的Gd3+共轭化合物可以有效地进入细胞,给出磁共振图像,并发现疏水性强的非离子型荧光染料更容易进入细胞。该工作的结果说明,可以利用疏水染料共轭的Gd3+化合物来推动高灵敏度的磁共振成像技术。Li等人则首先制备了一种菁染料与Y0.6Eu0.4VO4纳米粒子的复合材料 [29] ,这种复合材料中两种荧光成分(菁染料和稀土离子)形成了复合结构,所以没有荧光发射;当体系中加入碱性磷酸酶后,磷酸酶破坏了纳米粒子与菁染料之间的磷酸键链接单元,使二者分离,从而可以检测出荧光分子的发射光谱。作者认为,该方法不仅可以比较准确和精确地测量碱性磷酸酶的浓度,而且能够检测碱性磷酸酶的活性。
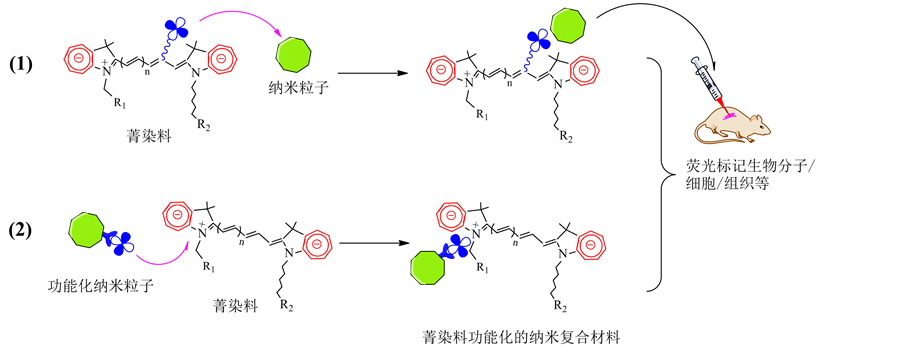
Figure 3. Schematic drawing for the surface functionalization of cyanine dyes and sensitized inorganic nanoparticles as well as formation of the bio-nanocomposites
图3. 菁染料和无机纳米粒子经过表面功能化形成敏化的生物无机纳米复合材料的过程示意图
菁染料与纳米粒子形成的复合材料与生物分子相容性好、荧光强,因而更加适合于近红外成像方面的研究和应用。如Jin等人则利用荧光染料与氧化钽纳米粒子形成复合材料,他们将聚乙二醇、荧光染料Cy7、阿霉素和透明质酸修饰到40 nm的氧化钽表面形成一种纳米荧光共轭复合物。该共轭复合物具有靶向制剂、pH相应的药物释放和近红外光学成像的特性。体内和体外实验表明,这种纳米荧光共轭复合物在荧光分子成像和CT成像中均具有很高的对比度,并可明显提高治疗肿瘤的效率,是名副其实的多功能的复合材料 [30] 。
此外,高分子材料也常常被用于与荧光染料分子或无机纳米粒子一起形成生物标记材料。比如,Yang等人利用溶胶–凝胶的方法,将荧光染料Cy7包埋到以聚乙烯醇构成的胶囊中 [31] 。荧光发射光谱结果表明,胶囊中的Cy7的发光强度比非胶囊中的Cy7提高了大约16倍,并有更长的血液半衰期。该方法可用于异体移植时对噬菌细胞体系的非侵害近红外光学成像表征和标记。
Mieszawska等人基于微流体技术合成了由高分子聚合物和纳米金晶体形成的含有药物、载体和荧光染料Cy7的复合纳米粒子体系 [32] 。高分子聚合物为经过化学修饰的聚(乳酸–乙醇酸) (poly(lactic-co-glycolic) acid),药物包裹在聚合物磷脂层中,荧光染料修饰的金纳米粒子处于复合材料的核心。该纳米复合材料可以通过计算机断层扫描和近红外荧光成像,并可用于跟踪药物的释放和材料在肿瘤细胞上的富集。
6. 结论与展望
菁染料具有独特的近红外荧光发射及其组成和结构的易修饰性,因而研究人员可以直接使用常见的菁染料来标记生物分子、细胞和组织等并用于生物标记、分析和近红外光学成像。另一方面,随着分子组装技术、纳米材料的合成和超分子科学的发展,研究人员可以将这些具有独特荧光特性的菁染料通过化学键嫁接到纳米和超分子材料的表面,增加对被测生物分子的富集,提高检测灵敏度和成像的清晰度,推动分子/纳米成像技术在生物检测和医疗领域的应用。最后,具有一定的光学活性和磁性的纳米材料与菁染料的复合物在疾病的诊断、跟踪治疗等方面也有重要的应用前景。
文章引用
黄红香. 菁染料及其功能化的纳米材料在生物分析和近红外荧光成像方面的应用研究进展
Research Progress in Cyanine Dyes and Their Functionalized Nanocomposites Used for Bioanalysis and Near-Infrared Molecular Fluorescent Imaging[J]. 分析化学进展, 2016, 06(04): 109-115. http://dx.doi.org/10.12677/AAC.2016.64017
参考文献 (References)
- 1. Porcu, E.P., Salis, A., Gavini, E., Rassu, G., Maestri, M. and Giunchedi, P. (2016) Indocyanine Green Delivery Systems for Tumour Detection and Treatments. Biotechnology Advances, 34, 768-789. http://dx.doi.org/10.1016/j.biotechadv.2016.04.001
- 2. 刘艳霞, 张象涵, 王兰英, 等. 菁染料在生物医学中的应用进展[J]. 化学试剂, 2010, 32(1): 37-42.
- 3. 高志宇, 刘燕刚, 陈妍. 生物荧光标记菁染料的研究进展[J]. 影像技术, 2001(2): 10-16.
- 4. 蒋林玲, 李宝林. 菁染料的应用研究进展[J]. 安徽农业科学, 2009, 37(15): 6829-6831.
- 5. 杨大伟, 于东升, 王雪岭, 等. 人血清蛋白和菁染料的相互作用研究[J]. 广州化工, 2015(19): 58-60.
- 6. Luo, S., Tan, X., Fang, S., et al. (2016) Mitochondria-Targeted Small-Molecule Fluorophores for Dual Modal Cancer Phototherapy. Advanced Functional Materials, 26, 2826-2835. http://dx.doi.org/10.1002/adfm.201600159
- 7. 张秀富, 付义乐, 左治钧, 等. 水溶性吲哚菁染料的合成、光谱性质及其与DNA和BSA的作用[J]. 有机化学, 2013, 33(8): 1709-1714.
- 8. 王丽秋, 彭孝军. 生物标记用3H-吲哚菁染料[J]. 染料工业, 2002, 39(4): 8-12.
- 9. 佟玲, 温俊峰, 李锦, 等. 生物荧光分析试剂Cy系列的应用及合成[J]. 分析实验室, 2003, 22(S1): 275-277.
- 10. 张志颖, 刘春艳. 反胶束微环境对菁染料光谱性质的影响[J]. 光谱学与光谱分析, 2001, 21(2): 247-250.
- 11. Wang, L., Xiang, J., Sun, H., et al. (2015) Controllable Cy3-MTC-Dye Aggregates and Its Applications Served as Achemosensor. Dyes and Pigments, 122, 382-386. http://dx.doi.org/10.1016/j.dyepig.2015.07.018
- 12. Stennett, E.M.S., Ciuba, M.A. and Levitus, M. (2014) Pho-tophysical Processes in Single Molecule Organic Fluorescent Probes. Chemical Society Reviews, 43, 1057-1075. http://dx.doi.org/10.1039/C3CS60211G
- 13. 邓洪杰, 张存林, 章鹤龄, 等. 一种CTP用红外吸收菁染料的合成[J]. 首都师范大学学报, 2006, 27(3): 34-36.
- 14. 王晓驰, 常刚, 曹瑞军, 等. 近红外荧光染料的结构、性质及生物荧光成像应用[J]. 化学进展, 2015(7): 794-805.
- 15. 张娜娜, 郭丽, 罗圣霖, 等. 新型近红外吲哚七甲川菁染料的合成与荧光成像的特性[J]. 华西药学杂志, 2012, 27(4): 349-352.
- 16. Li, Y., Sun, Y., Li, J., et al. (2005) Ultrasensitive Near-Infrared Fluorescence-Enhanced Probe for in Vivo Nitroreductase Imaging. Journal of the American Chemical Society, 137, 6407-6416. http://dx.doi.org/10.1021/jacs.5b04097
- 17. Gruber, H.J., Hahn, C.D., Kada, C., et al. (2000) Anomalous Fluorescence Enhancement of Cy3 and Cy3.5 versus Anomalous Fluorescence Loss of Cy5 and Cy7 upon Covalent Linking to IgG and Noncovalent Binding to Avidin. Bioconjugate Chemistry, 11, 696-704. http://dx.doi.org/10.1021/bc000015m
- 18. Kang, H.W., Weissleder, R. and Bogdanov, A. (2002) Targeting of MPEG-Protected Polyamino Acid Carrier to Human E-Selection in Vitro. Amino Acids, 23, 301-308. http://dx.doi.org/10.1007/s00726-001-0142-2
- 19. Christin, P., Kai, L., Detlef, S.F., et al. (2005) Comparison of Two Tricarbocyanine-Based Dyes for Fluorescence Optical Imaging. Journal of Fluorescence, 15, 443-454.
- 20. Chen, Y., Pullambhatla, M., Banerjee, S.R., et al. (2012) Synthesis and Biological Evaluation of Low Molecular Weight Fluorescent Imaging Agents for the Prostate-Specific Membrane Antigen. Bioconjugate Chemistry, 23, 2377-2385. http://dx.doi.org/10.1021/bc3003919
- 21. Jenkins, R., Burdette, M.K. and Foulger, S.H. (2016) Mini-Review: Fluorescence Imaging in Cancer Cells Using Dye-Doped Nanoparticles. RSC Advances, 6, 65459-65474. http://dx.doi.org/10.1039/C6RA10473H
- 22. Ayala-Orozco, C., Liu, J.G., Knight, M.W., et al. (2014) Fluores-cence Enhancement of Molecules inside a Goldnanomatryoshka. Nano Letters, 14, 2926-2933. http://dx.doi.org/10.1021/nl501027j
- 23. Kircher, M.F., Weissleder, R. and Josephson, L. (2004) A Dual Fluoro-chromeprobe for Imaging Proteases. Bioconjugate Chemistry, 15, 242-248. http://dx.doi.org/10.1021/bc034151d
- 24. Gianella, A., Jarzyna, P.A., Mani, V., et al. (2011) Multifunctional Nanoemulsion Platform for Imaging Guided Therapy Evaluated in Experimental Cancer. ACS Nano, 5, 4422-4433. http://dx.doi.org/10.1021/nn103336a
- 25. Lee, C.H., Cheng, S.H., Wang, Y.J., et al. (2009) Near-Infrared Meso-porous Silica Nanoparticles for Optical Imaging: Characterization and in Vivo Biodistribution. Advanced Functional Materials, 19, 215-222. http://dx.doi.org/10.1002/adfm.200800753
- 26. Liu, Y., Xu, M., Chen, Q., et al. (2015) Gold Nano-rods/Mesoporous Silica-Based Nanocomposite as Theranostic Agents for Targeting Near-Infrared Imaging and Photo-thermal Therapy Induced with Laser. International Journal of Nanomedicine, 10, 4747-4761. http://dx.doi.org/10.2147/IJN.S82940
- 27. Zou, P., Xu, S., Povoski, S.P., et al. (2009) Near-Infrared Fluorescence Labeled Anti-TAG-72 Monoclonal Antibodies for Tumor Imaging in Colorectal Cancer Xenograft Mice. Molecular Pharmacology, 6, 428-440. http://dx.doi.org/10.1021/mp9000052
- 28. Yamane, T., Hanaoka, K., Muramatsu, Y., et al. (2011) Method for Enhancing Cell Penetration of Gd3+-Based MRI Contrast Agents by Conjugation with Hydrophobic Fluorescent Dyes. Bioconjugate Chemistry, 22, 2227-2236. http://dx.doi.org/10.1021/bc200127t
- 29. Li, B.H., Zhang, Y.L., Li, F.S., et al. (2016) A Novel Sensor for the Detection of Alkaline Phosphatase Activity Based on the Self-Assembly of Eu3+-Doped Oxide Nanoparticles and Hep-tamethine Cyanine Dye. Sensors and Actuators B, Chem., 233, 479-485. http://dx.doi.org/10.1016/j.snb.2016.04.102
- 30. Jin, Y., Ma, X., Feng, S., et al. (2015) Hyaluronic Acid Modified Tantalum Oxide Nanoparticles Conjugating Doxorubicin for Targeted Cancer Theranostics. Bioconjugate Chemistry, 26, 2530-2541. http://dx.doi.org/10.1021/acs.bioconjchem.5b00551
- 31. Yang, Z., Zheng, S., Harrison, W.J., et al. (2007) Long-Circulating Near-Infrared Fluorescence Core-Cross-Linked Polymeric Micelles: Synthesis, Characterization, and Dual Nuclear/Optical Imaging. Biomacromolecules, 8, 3422- 3428. http://dx.doi.org/10.1021/bm7005399
- 32. Mieszawska, A.J., Kim, Y.T., Gianella, A., et al. (2013) Synthesis of Polymer-Lipid Nanoparticles for Image-Guided Delivery of Dual Modality Therapy. Bioconjugate Chemistry, 24, 1429-1434. http://dx.doi.org/10.1021/bc400166j