Advances in Analytical Chemistry
Vol.07 No.01(2017), Article ID:19856,9
pages
10.12677/AAC.2017.71006
Investigation on Interaction of Ceftazidime with Pepsin
Peipei Qi1, Yanqin Zi2
1Huaibei Environmental Protection Monitoring Station, Huaibei Anhui
2Huaibei Normal University, Huaibei Anhui

Received: Feb. 10th, 2017; accepted: Feb. 24th, 2017; published: Feb. 28th, 2017

ABSTRACT
The interaction between Ceftazidime with pepsin and the mechanism of fluorescence quench were studied by fluorescence spectroscopy and ultraviolet-visible absorption spectroscopy. The results showed that the fluorescence of pepsin is quenched regularly by Ceftazidime. The binding constants and thermodynamic parameters of Ceftazidime with pepsin are obtained at different temperatures. The electrostatic interaction force plays a main role in the binding of Ceftazidime with pepsin. The distances of binding site between Ceftazidime with pepsin are also obtained according to the theory of Förster’s non-radiative energy transfer.
Keywords:Ceftazidime, Pepsin, Fluorescence Quenching
头孢他啶与胃蛋白酶相互作用的研究
亓培培1,訾言勤2
1淮北市环境保护监测站,安徽 淮北
2淮北师范大学,安徽 淮北
收稿日期:2017年2月10日;录用日期:2017年2月24日;发布日期:2017年2月28日

摘 要
采用荧光光谱和紫外吸收光谱法研究了头孢他啶与胃蛋白酶的荧光猝灭作用。结果表明,头孢他啶可以有规律地使胃蛋白酶内源荧光猝灭,其猝灭机理可认为是头孢他啶与胃蛋白酶形成复合物的静态猝灭,实验获得了不同温度下头孢他啶与胃蛋白酶作用的结合常数和热力学参数。根据所得结果可推断头孢他啶与胃蛋白酶的作用力为静电引力,同时由Förster非辐射能量转移理论计算得出了头孢他啶与胃蛋白酶结合位置的距离。
关键词 :头孢他啶,胃蛋白酶,荧光猝灭作用

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
胃蛋白酶(pepsin)是一种消化性蛋白酶,由胃部中的胃粘膜主细胞所分泌,功能是将食物中的蛋白质分解为小的肽片段。胃蛋白酶在酸性环境中具有较高活性,其最适pH值约为3。在中性或碱性pH值的溶液中,胃蛋白酶会发生解链而丧失活性。胃蛋白酶的活性在药用方面价值很大。
头孢他啶(Ceftazidime, CEF)为半合成的第三代头孢菌速。适用于敏感革兰氏阴性杆菌所至的败血症、下呼吸系感染、腹腔胆系感染、复杂性尿路感染和严重皮肤软组织感染,分子量:636.65。化学结构式见图1所示。
头孢他啶能抑制转肽酶在细胞壁合成的最后一步交叉连接中的转肽作用,使交叉连接不能形成,从而影响细胞壁合成,导致细菌溶菌死亡。头孢他啶是第三代头孢菌素,在其结构中引入了亚酰基双键、羧基,降低了它的毒副性。本文用荧光光谱法,紫外-可见吸收光谱法,研究了在生理条件下,不同温度对胃蛋白酶与头孢他啶相互作用的影响,求得二者的结合常数,并根据热力学常数确定了该药物与胃蛋白酶之间的作用类型。这对于药物的运输过程以及其在体内的作用机制,了解生物大分子与药物小分子相互作用的化学本质具有一定的意义。
2. 实验部分
2.1. 实验仪器与试剂
RF-5301PC 荧光光度计,FA2004型电子天平,TU-1901双光束紫外可见分光光度计,pHs-23型精密pH计;
头孢他啶溶液(2.0 × 10−4 mol/L):准确称量0.1096g头孢他啶(分子量546.58)用去离子水溶解稀释,
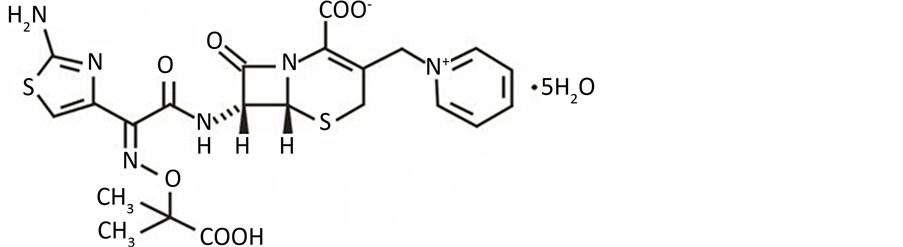
Figure 1. The chemical structure of Ceftazidime
图1. 头孢他啶(CEF)的化学结构式
定容于100 mL容量瓶中,摇匀后,继续取10 mL待测药物继续定容至100 mL容量瓶中,摇匀放入冰箱中备用;胃蛋白酶(2 × 10−4 mol/L):准确称量1.7524 g胃蛋白酶(分子量35,000)用去离子水稀释,定容于250 mL容量瓶中摇匀后放入冰箱中备用;B-R缓冲溶液:在500 mL三酸混合液(磷酸、乙酸、硼酸,浓度均为0.04 moL/L)中,加入0.2 moL/L的NaOH溶液调解所需要的pH,用酸度计测定;所用试剂均为分析或优级纯,冰箱保存;实验用水为去离子水。
2.2. 实验方法
依次加入pH为1.81的B-R缓冲溶液1.00 mL,胃蛋白酶溶液1.00 mL和一定量的头孢他啶溶液于10 mL比色管中,以去离子水定容至10 mL,摇匀,调节恒温箱,分别在17℃和37℃的条件下,恒温放置20 min后,以水为参比,用TU-1901双光束紫外可见分光光度计,在190~400 nm范围内扫描得吸收光谱;用RF-5301PC荧光光谱仪,固定激发波长276 nm,激发和发射狭缝宽均为5 nm,以1 cm石英池测量荧光强度,绘制290~500 nm范围内的荧光光谱,记录340 nm处的发射荧光强度。应用紫外可见光谱的光度值与荧光光谱的荧光值计算热力学常数,判断反应的类型、分子间相互作用力种类及生物大分子构型的变化。
3. 结果与讨论
3.1. 头孢他啶与胃蛋白酶的荧光猝灭光谱与猝灭机制
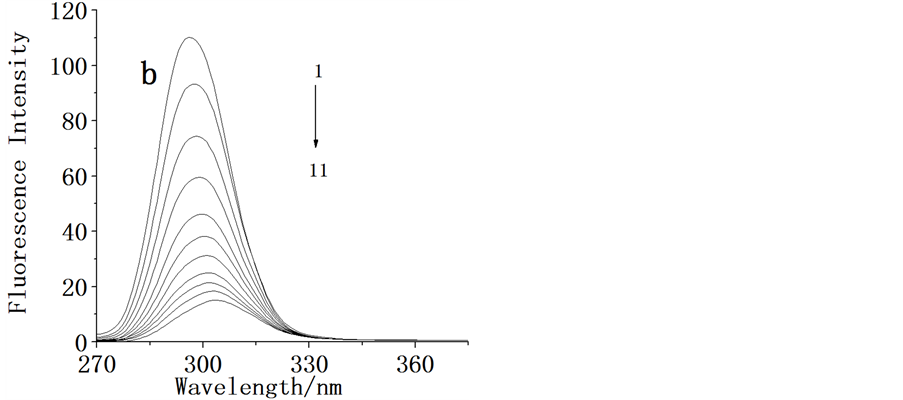
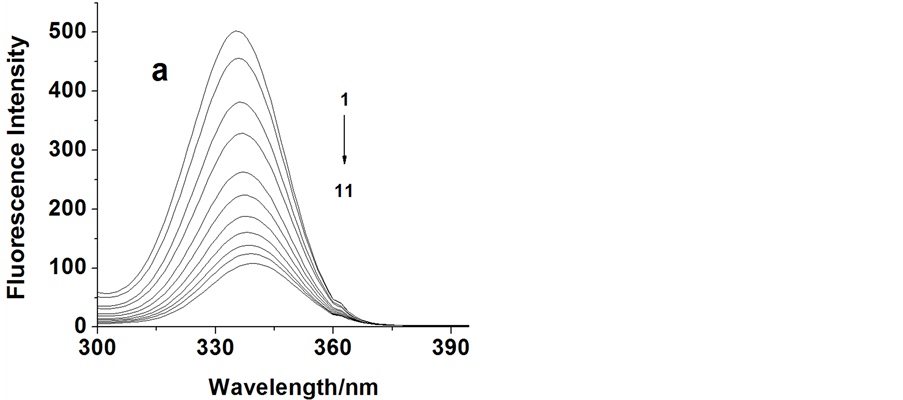
蛋白质中含有色氨酸、酪氨酸及苯丙氨酸等残基而发射较强的荧光。图2显示了胃蛋白酶固定激发波长在276 nm时荧光猝灭光谱,在pH = 1.81的模拟胃环境条件下,固定胃蛋白酶浓度,向其中增加头孢他啶浓度时,可以看到蛋白质中色氨酸在340 nm左右荧光强度逐渐下降,表明了头孢他啶与胃蛋白酶可能发生了相互作用。
荧光淬灭是由于荧光物质分子与溶剂分子或其它溶质分子的相互作用引起的荧光强度降低的现象。荧光淬灭的机制主要有静态淬灭和动态淬灭两种,二者都需要荧光发色基团与淬灭剂之间的分子接触 [1] ,对于动态淬灭,淬灭剂必须在激发态寿命时间内扩散到蛋白质的荧光发色基团,一旦接触,荧光发色基团不发射光子;对于静态淬灭,荧光发色基团和淬灭剂形成了复合物,该复合物不发光。这两种猝灭均符合Stern-Volmer方程 [2] [3] :
 (1)
(1)
式中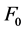 和F分别为加入淬灭剂(头孢他啶)前后混合溶液的荧光强度,
和F分别为加入淬灭剂(头孢他啶)前后混合溶液的荧光强度,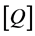 为淬灭剂的浓度,
为淬灭剂的浓度,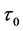 为无荧光猝灭剂时胃蛋白酶的平均荧光寿命,约10 ns数量级,
为无荧光猝灭剂时胃蛋白酶的平均荧光寿命,约10 ns数量级, 为双分子碰撞淬灭常数,单位是L/mol/s,它描述了生物大分子与荧光猝灭剂分子之间因分子的扩散作用和彼此碰撞对生物大分子荧光寿命衰减速率的影响,
为双分子碰撞淬灭常数,单位是L/mol/s,它描述了生物大分子与荧光猝灭剂分子之间因分子的扩散作用和彼此碰撞对生物大分子荧光寿命衰减速率的影响,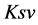 为,Stern-Volmer淬灭常数,单位是L/mol,且
为,Stern-Volmer淬灭常数,单位是L/mol,且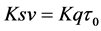 ,它反映了生物大分子与荧光猝灭剂在动态猝灭过程中彼此扩散和相互碰撞达到平衡时的关系。在温度分别为290,310 K条件下,以
,它反映了生物大分子与荧光猝灭剂在动态猝灭过程中彼此扩散和相互碰撞达到平衡时的关系。在温度分别为290,310 K条件下,以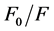 对
对 作图结果如图3。
作图结果如图3。
由图3(a)可以看出,头孢他啶与胃蛋白酶作用的曲线是向上弯曲的二项式曲线。由图3(b)可以看出,头孢他啶浓度从0.50 × 10−6到2.50 × 10−6 mol/L区间与胃蛋白酶作用的曲线是直线。他们都显现出良好的线性关系,其对应的斜率就Stern-Volmer猝灭常数。从而可以求得由扩散碰撞的动态猝灭常数,所得数据列于表1。
静态猝灭是药物分子与蛋白质分子间形成了不发荧光的复合物而导致的荧光碎灭,且所生成的复合物会随着温度的升高而发生解离,故猝灭常数会随着温度的升高而降低。动态猝灭是药物和蛋白质的激
 λex = 276 nm, Cpepsin = 2.0 × 10−5 mol/L; C/(10−5 mol/L):curve 1→11:0.00, 0.50, 1.00, 1.50, 2.00, 2.50, 3.00, 3.50, 4.00, 4.50, 5.00 (T = 310 K, pH = 1.81)
λex = 276 nm, Cpepsin = 2.0 × 10−5 mol/L; C/(10−5 mol/L):curve 1→11:0.00, 0.50, 1.00, 1.50, 2.00, 2.50, 3.00, 3.50, 4.00, 4.50, 5.00 (T = 310 K, pH = 1.81)
Figure 2. The fluorescence emission spectra of pepsin in the absence and presence of increasing amount of CEF
图2. 头孢他啶与胃蛋白酶的荧光猝灭光谱
 (a) Plots of F0/F for pepsin against C of CEF at different temperatures ((■) 290 K; (●) 310 K); λex = 277 nm, λem = 285 nm, Cpepsin = 2.0 × 10−5 mol/L, the concentration of CEF were from 0.5 × 10-5 to 5.00×10-5 mol/L; (b) straight lines in the inset are plots of F0/F for pepsin against C of CEF ranging (0.50, 1.00, 1.50, 2.00, 2.50) × 10-6 mol/L, pH = 1.81
(a) Plots of F0/F for pepsin against C of CEF at different temperatures ((■) 290 K; (●) 310 K); λex = 277 nm, λem = 285 nm, Cpepsin = 2.0 × 10−5 mol/L, the concentration of CEF were from 0.5 × 10-5 to 5.00×10-5 mol/L; (b) straight lines in the inset are plots of F0/F for pepsin against C of CEF ranging (0.50, 1.00, 1.50, 2.00, 2.50) × 10-6 mol/L, pH = 1.81
Figure 3.The Stern-Volmer curve linear equation of pepsin with CEF system
图3. 头孢他啶和胃蛋白酶体系的Stern-Volmer方程曲线
Table 1. Stern-Volmer quenching constants for pepsin-CEF system at different temperatures
表1. 不同温度下头孢他啶与胃蛋白酶相互作用的猝灭常数
发态分子之间的相互碰撞而导致的荧光碎灭,随着温度的升高,激发态分子之间的相互碰撞更加剧烈,故猝灭常数会随着温度的升高而增大 [4] 。
随着温度的升高,Stern-Volmer猝灭常数Ksv增大,这表明,头孢他啶和胃蛋白酶之间为动态猝灭。然而不同温度下的表观猝灭常数Kq值均大于最大动态扩散碰撞速率常数2.0 × 1010 L/mol/s。因此,我们推断头孢他啶和胃蛋白酶荧光猝灭过程主要由静态猝灭体系的形成产生的,而不是由一个动态猝灭过程构成 [5] 。
3.2. 结合常数及结合位点
在静态猝灭过程中,在静态猝灭中,荧光体的荧光强度与其游离浓度成正比,蛋白质与小分子的结合常数可由荧光体和猝灭剂的结合常数表达式导出 [6] [7] :
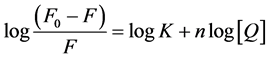 (2)
(2)
其中K是荧光体和猝灭剂的结合常数,n是结合点数。以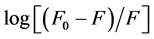 对
对 作图,得到图4,直线斜率代表结合位点数n,直线截距为
作图,得到图4,直线斜率代表结合位点数n,直线截距为 。得到以下两式:
。得到以下两式:
290 K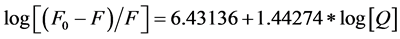 (3)
(3)
310 K 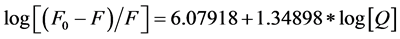 (4)
(4)
由(3)式、(4)式可求得结合常数K,见表2,可看出在头孢噻肟钠和胃蛋白酶之间存在强烈的相互作用,同时头孢他啶和胃蛋白酶之间有1~2个结合位点。
3.3. 热力学计算及作用类型
小分子与蛋白质等生物大分子之间的作用力主要包括氢键、范德华力、静电引力、疏水作用力等。当温度变化不太大时,反应的焓变可看作一个常数。根据方程式(5)、(6)、(7)可分别计算出反应焓变ΔH,吉布斯自由能变ΔG和熵变ΔS。
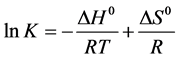 (5)
(5)
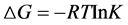 (6)
(6)
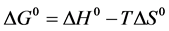 (7)
(7)
上式中K是结合常数,R是摩尔气体常数,由17、37℃两个温度下的结合常数可以计算出头孢他啶和胃蛋白酶相互作用的反应焓变ΔH,吉布斯自由能变ΔG和熵变ΔS,如表3。
生物大分子与小分子间的相互作用的作用力通常有氢键、范德华力、静电引力、疏水作用力等,根据其相互作用的有关热力学参数可以简单判断其相互作用力的类型 [8] :
1) 若 且
且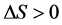 ,主要表现为疏水作用;
,主要表现为疏水作用;
2) 若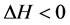 且
且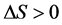 ,主要表现为静电作用;
,主要表现为静电作用;
3) 若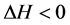 且
且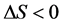 ,主要表现为氢键或范德华力作用。
,主要表现为氢键或范德华力作用。
根据实验结果17、37℃时 ,且
,且 ,表明头孢他啶与胃蛋白酶的结合是一个放热反应,熵增加是该作用过程的主要热力学驱动因素。
,表明头孢他啶与胃蛋白酶的结合是一个放热反应,熵增加是该作用过程的主要热力学驱动因素。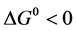 ,表明该结合过程是一个自发的过程。因此可以推测在该温度范围内,该体系头孢拉定和胃蛋白酶之间的作用力是静电作用力。
,表明该结合过程是一个自发的过程。因此可以推测在该温度范围内,该体系头孢拉定和胃蛋白酶之间的作用力是静电作用力。
3.4. 同步荧光的构象变化
同步荧光调查的蛋白质构象变化是一个有用的工具,可以提供荧光发色基团附近微环境的变化信息。
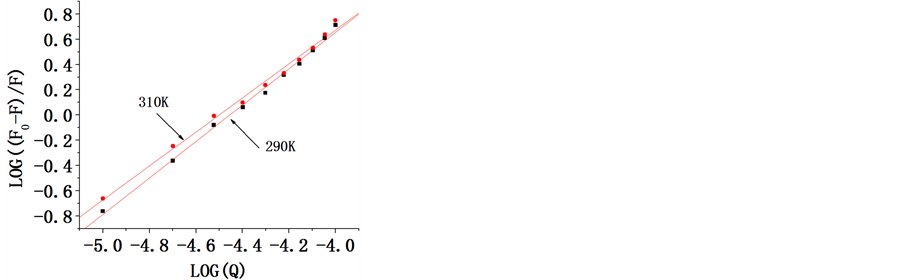
Figure 4. Line weaver-Bunk curve of pepsin with CEF system
图4. CEF和胃蛋白酶体系的双对数方程曲线
Table 2. Biding constants and thermodynamic parameters for pepsin-CEF system at different temperatures, PH = 1.81
表2. 在PH = 1.81,不同温度下头孢他啶与胃蛋白酶相互作用的结合常数
Table 3. Thermodynamic parameters of CEF with Pepsin at different temperatures
表3. 不同温度下头孢他啶与胃蛋白酶相互作用的猝灭常数
固定 和
和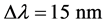 所作出的同步荧光光谱分别表现为色氨酸残基和酪氨酸残基的光谱特性 [9] 。色氨酸的最大荧光发射峰位对环境很敏感 [10] ,所处环境的疏水性降低,其最大发射波长红移,所处环境的疏水性增强,其最大发射波长蓝移。这是研究蛋白质的构象的一种方法。蛋白质的最大发射波长在330~332 nm范围,表明色氨酸残基处于非极性环境中,既完全处在蛋白质的疏水腔内;最大发射波长为342 nm,部分处在疏水环境中,最大发射波长在350~352 nm范围,色氨酸残基暴露于水相中,即蛋白质的疏水腔瓦解,结构较为松散 [11] 。图5为头孢他啶和胃蛋白酶体系的同步荧光光谱。从图中可以看出,色氨酸残基的荧光强度相对较大(图5(a)),随着头孢他啶浓度的增加,最大发射波长缓慢地红移,荧光强度逐渐减弱;酪氨酸残基的荧光强度较弱(图5(b)),随着头孢他啶浓度的增加,酪氨酸残基的最大发射波长缓慢地红移,荧光强度逐渐减弱。这些结果表明,头孢他啶与胃蛋白酶发生作用时,不仅影响了色氨酸残基的微环境,也影响了酪氨酸残基的微环境,头孢他啶结合到胃蛋白酶的疏水腔中,使色氨酸、酪氨酸残基周围的极性增加,疏水性减小,导致胃蛋白酶的结构松散。
所作出的同步荧光光谱分别表现为色氨酸残基和酪氨酸残基的光谱特性 [9] 。色氨酸的最大荧光发射峰位对环境很敏感 [10] ,所处环境的疏水性降低,其最大发射波长红移,所处环境的疏水性增强,其最大发射波长蓝移。这是研究蛋白质的构象的一种方法。蛋白质的最大发射波长在330~332 nm范围,表明色氨酸残基处于非极性环境中,既完全处在蛋白质的疏水腔内;最大发射波长为342 nm,部分处在疏水环境中,最大发射波长在350~352 nm范围,色氨酸残基暴露于水相中,即蛋白质的疏水腔瓦解,结构较为松散 [11] 。图5为头孢他啶和胃蛋白酶体系的同步荧光光谱。从图中可以看出,色氨酸残基的荧光强度相对较大(图5(a)),随着头孢他啶浓度的增加,最大发射波长缓慢地红移,荧光强度逐渐减弱;酪氨酸残基的荧光强度较弱(图5(b)),随着头孢他啶浓度的增加,酪氨酸残基的最大发射波长缓慢地红移,荧光强度逐渐减弱。这些结果表明,头孢他啶与胃蛋白酶发生作用时,不仅影响了色氨酸残基的微环境,也影响了酪氨酸残基的微环境,头孢他啶结合到胃蛋白酶的疏水腔中,使色氨酸、酪氨酸残基周围的极性增加,疏水性减小,导致胃蛋白酶的结构松散。
3.5. 头孢他啶与胃蛋白酶作用距离的计算
根据Förster偶极–偶极非辐射能量转移理论 [12] ,可以求出结合位置与蛋白质分子中发荧光集团之间的距离。能量转移效率E与供体-受体间的距离R和临界距离R0的关系为 [13] [14] :
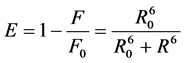 (8)
(8)
 Δλ = 60 nm (a) and Δλ = 15 nm (b) in the absence and presence of increasing amount of CEF ranging (0.500, 1.00, 1.500, 2.00, 2.500) × 10−6 mol/L, respectively, pH=1.81., Cpepsin = 2.0 × 10−5 mol/L; T = 310 K, pH = 1.81
Δλ = 60 nm (a) and Δλ = 15 nm (b) in the absence and presence of increasing amount of CEF ranging (0.500, 1.00, 1.500, 2.00, 2.500) × 10−6 mol/L, respectively, pH=1.81., Cpepsin = 2.0 × 10−5 mol/L; T = 310 K, pH = 1.81
Figure 5. Synchronous fluorescence spectra of pepsin with CEF system
图5. 头孢他啶和胃蛋白酶体系的同步荧光光谱
式中,F0为不存在药物时胃蛋白酶的荧光强度;F为胃蛋白酶和药物摩尔比为1:1时胃蛋白酶的荧光强度;R0为转移效率为50%的临界距离,被称为Förster距离;R是供体与受体的真实距离,其中,
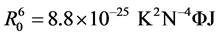 (9)
(9)
式中,K2为偶极空间取向因子,通常取向因子为供体和受体各向随机分布的平均值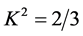 ;N为介质的折射指数,取水和有机物的平均值1.336;Φ为供体的荧光量子产率。
;N为介质的折射指数,取水和有机物的平均值1.336;Φ为供体的荧光量子产率。
一般来讲,蛋白质作为给体进行荧光共振能量转移的残基只有色氨酸和酪氨酸,而最大荧光峰在344 nm处的能量转移在Pepsin中只有色氨酸残基,其量子产率F以色氨酸为标准物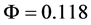 [15] ;J为供体的荧光发射光谱与受体的吸收光谱之间的光谱重叠积分:
[15] ;J为供体的荧光发射光谱与受体的吸收光谱之间的光谱重叠积分:
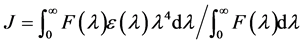 (10)
(10)
式中,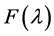 为供体在λ至λ + dλ以波数间隔内的校正荧光强度;
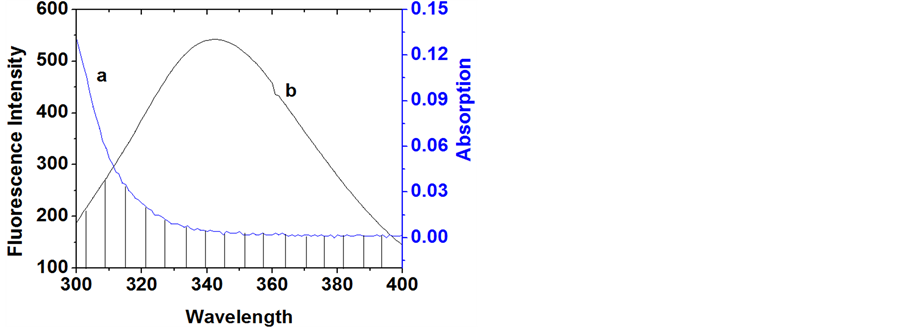
为供体在λ至λ + dλ以波数间隔内的校正荧光强度;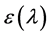 为药物在波长λ处的摩尔吸收系数。图6是头孢他啶与胃蛋白酶物质的量为1:1时,胃蛋白酶的荧光光谱和位点药物的紫外吸收光谱重叠图,发现胃蛋白酶的荧光光谱和位点药物的紫外吸收光谱有一定的重叠。
为药物在波长λ处的摩尔吸收系数。图6是头孢他啶与胃蛋白酶物质的量为1:1时,胃蛋白酶的荧光光谱和位点药物的紫外吸收光谱重叠图,发现胃蛋白酶的荧光光谱和位点药物的紫外吸收光谱有一定的重叠。
通过计算处理荧光和紫外数据得光谱的重叠积分J = 6.69 × 10−17 cm3 L/mol,依次可求得:R0 = 1.06 nm,E = 0.30,R = 1.23 nm。从计算结果来看,头孢他啶的结合位点与胃蛋白酶分子中色氨酸残基的距离为1.23 nm。R0和R皆小于8 nm [16] ,说明头孢拉定与胃蛋白酶作用过程中发生了非辐射能量转移,两者形成了复合物,且结合紧密。同时也进一步说明了低浓度下头孢他啶与胃蛋白酶的荧光猝灭属于静态猝灭机理。
4. 结论
实验表明,胃蛋白酶和头孢他啶结合使胃蛋白酶内源荧光发生有规律的淬灭,该淬灭常数大于生物大分子的最大扩散碰撞淬灭常数,因此说明该结合过程是一个静态淬灭过程。并且头孢他啶和胃蛋白酶结合过程是自发进行的放热反应;作用力主要表现为静电引力,二者在作用过程中发生了非辐射能量转移。头孢他啶与胃蛋白酶的相互作用所处环境的极性增加、疏水性降低,导致胃蛋白酶发生构象变化。这些实验数据为药物的药理及在体内的代谢机制提供了可靠的实验数据,同时对进一步了解蛋白质的结
 when the molar ratio is 1:1,Cpepsin = C = 2. 0 × 10−4 mol/L, T = 300 K, pH = 1.81
when the molar ratio is 1:1,Cpepsin = C = 2. 0 × 10−4 mol/L, T = 300 K, pH = 1.81
Figure 6. The overlap of the UV absorption spectrum of CEF (a) with the fluorescence emission spectrum of Pepsin (b) of Overlap figure
图6. 头孢他啶紫外吸收光谱(a)与胃蛋白酶荧光光谱(b)重叠图
构和功能关系也提供了可靠的信息。
文章引用
亓培培,訾言勤. 头孢他啶与胃蛋白酶相互作用的研究
Investigation on Interaction of Ceftazidime with Pepsin[J]. 分析化学进展, 2017, 07(01): 39-47. http://dx.doi.org/10.12677/AAC.2017.71006
参考文献 (References)
- 1. 卢珍, 冯育林. p一环糊精一荧光包合色谱法测定氧氟哌酸、甲氟哌酸和司帕氟哌酸[J]. 分析化学, 2005, 33(7): 999-1002.
- 2. Loffler, D. and Ternes, T.A. (2003) Determination of Acidic Pharmaceuticals, Antibiotics Andivermectin in River Sediment Using Liquid Chromatography Tandem Mass Spectrometry. Journal of Chromatography A, 1021, 133-144. https://doi.org/10.1016/j.chroma.2003.08.089
- 3. Förster, T. (1965) In: Sinaoglu, O., Ed., Modern Quantum Chemistry, Vol. 3, Academic Press, New York.
- 4. Cristobal, G., Dos, R. and Pierre, D.J.M. (1995) Fluorescence Resonance Energy Transfer Spec-troscopy Is a Reliable “Ruler” for Measuring Structural Changes in Proteins: Dispelling the Problem of the Unknown Orientation Factor. Journal of Structural Biology, 115, 175-185. https://doi.org/10.1006/jsbi.1995.1042
- 5. Saha, D.C., Ray, K. and Misra, T.N. (2000) Energy Transfer in triton-X 100 Micelles: A Fluorescence Study. Spectrochimica Acta Part A, 56, 797-801. https://doi.org/10.1016/S1386-1425(99)00169-9
- 6. Bertucci, C. and Domenici, E. (2002) Reversible and Covalent Binding of Drugs to Human Serumalbumin: Methodological Approaches and Physiological Relevance. Current Medicinal Chemistry, 9, 1463-1481. https://doi.org/10.2174/0929867023369673
- 7. Lakowica, J.R. (1983) Principle of Fluorescence Spectroscopy. Plenum Press, New York, 341-381. https://doi.org/10.1007/978-1-4615-7658-7_11
- 8. Valeur, B. and Brochon, J.C. (1999) New Trends in Fluorescence Spectroscopy. 6th Edition, Springer Press, Berlin.
- 9. Lakowicz, J.R. (1983) Principles of Fluorescence Spectroscopy. Plenum Press, New York, Chapter 10, 303-339.
- 10. Eftink, M.R. and Ghiron, C.A. (1976) Fluorescence Quenching of Indole and Model Michelle Systems. The Journal of Physical Chemistry, 80, 486-493. https://doi.org/10.1021/j100546a014
- 11. Tang, J.H., Qi, S.D. and Chen, X.G. (2005) Spectroscopic Studies of the Interaction of Anti-Coagulant Rodenticide Diphacinone with Human Serum Albumin. Journal of Molecular Structure, 779, 87-95. https://doi.org/10.1016/j.molstruc.2005.07.023
- 12. He, Y., Wang, Y.W., Tang, L.F., Liu, H., Chen, W., Zheng, Z.L. and Zou, G.L. (2008) Binding of Puerarin to Human Serum Albumin: A Spectroscopic Analysis and Molecular Docking. Journal of Fluorescence, 18, 433-442. https://doi.org/10.1007/s10895-007-0283-0
- 13. Feng, X.Z., Lin, Z., Yang, L.J., Wang, C. and Bai, C.L. (1998) Investigation of the Interaction between Acridine Orange and Bovine Serum Albumin. Talanta, 47, 1223-1229. https://doi.org/10.1016/S0039-9140(98)00198-2
- 14. Jiang, M., Xie, M.X., Liu, Y., Li, X.Y. and Chen, X. (2004) Spectroscopic Studies on the Interaction of Cinnamic Acid and Its Hydroxyl Derivatives with Human Serum Albumin. Journal of Molecular Structure, 692, 71-80. https://doi.org/10.1016/j.molstruc.2004.01.003
- 15. 杨频, 高飞. 生物无机化学原理[M]. 科学出版社, 2002: 495-520.
- 16. 敖登高娃, 张莹, 樊海燕. 同步一导数荧光光谱法测定混合样品中美他环素[J]. 光谱学与光谱学分析, 2006, 26(s): 1530-1532.
