Advances in Clinical Medicine
Vol.06 No.03(2016), Article ID:18649,9
pages
10.12677/ACM.2016.63025
PD Model Rats’ Observation of the Changes of Learning and Memory Ability
Shuoyue Wang1*, Yan Wang1, Li Fang1, Yajing Sun1, Bing Chen1,2, Hua Xing1,2#
1College of Veterinary Medicine, Yangzhoou University, Yangzhou Jiangsu
2Jiangsu Co-Innovation Center for Prevention and Control of Important Animal Infectious Disease and Zoonoses, Yangzhou Jiangsu

Received: Sep. 8th, 2016; accepted: Sep. 26th, 2016; published: Sep. 29th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
[Aim] To evaluate the learning and memory impairment in rat model of Parkinson disease (PD) which established by injection of 6-hydroxydopamine (6-OH) at different stages with Morris maze, passive avoidance test and active avoidance test. [Methods] Rats were grouped into two: PD model rats and Normal rats. The unilateral stereotaxic intra-striatal single point injection of 6-hydroxy- dopamine (6-OH) was adopted to establish PD model rats. The rats were induced to rotate by injecting apomorphine (APO) while 2 weeks after operation, in order to screen the successful PD rat model. The number of rotations for the successful PD model rats is greater than 7 r/min. Measuring the distance and the time that the rats stayed the quadrant of the platform with Morris maze. Application of rats box for the shuttle box passive avoidance response, acquisition and analysis of the number of active escapes and takes the initiative to escape the average time(s). [Results] In Morris maze, PD model rats compared with the normal control rats, quadrant swimming distance decreased significantly (P < 0.05) and the swimming time in target quadrant was reduced (P < 0.01) significantly; passive avoidance test for multiple testing method, camera lucida observation time percentage (%) was significantly shortened (P < 0.05). [Conclusion] The learning and memory ability of PD rats which were constructed by striatal injection of 6-OHDA was significantly reduced, and it can be used as a model for the study of Parkinson’s disease dementia.
Keywords:Rats, Parkinson Disease, Learning and Memory, Impairment

帕金森病模型大鼠学习记忆能力变化的观察
王硕玥1*,王焱1,方丽1,孙雅婧1,陈兵1,2,邢华1,2#
1扬州大学兽医学院,江苏 扬州
2江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州

收稿日期:2016年9月8日;录用日期:2016年9月26日;发布日期:2016年9月29日

摘 要
[目的]利用Morris水迷宫、避暗箱、穿梭箱检测6-羟多巴胺(6-OHDA)致帕金森病(PD)模型大鼠学习记忆的能力,了解PD除行为障碍外的认知变化,并运用大鼠脑内酪氨酸羟化酶(tyrosine hydroxylase, TH)表达量检测的方法来对PD大鼠模型进行检验和评价。[方法]实验分为PD模型组和正常对照组。首先以立体定位单侧纹状体注射6-OHDA法制备PD大鼠模型,2周后腹腔注射阿扑吗啡(APO)诱导转圈,旋转圈数 > 7 r/min的大鼠判定为成功PD模型,并运用大鼠脑内酪氨酸羟化酶(tyrosine hydroxylase, TH)表达量检测的方法来对PD大鼠模型进行检验和评价。应用Morris水迷宫测定大鼠的目标象限游泳路程及目标象限游泳时间;采用大鼠避暗箱进行多次测试法,获取并分析明箱观察时间百分比(%)数据;应用大鼠穿梭箱进行穿梭箱被动回避反应,获取并分析主动逃避次数(次)和主动逃避平均时间(秒)。[结果] PD模型组大鼠和正常对照组相比,Morris水迷宫实验中,象限游泳路程显著减少(p < 0.05),目标象限游泳时间极显著减少(p < 0.01);避暗箱进行多次测试法中,明箱观察时间百分比(%)明显缩短(p < 0.05);穿梭箱被动回避反应实验中,主动逃避次数(次)和主动逃避平均时间(秒)均明显减少(p < 0.05)。[结论] 6-OHDA纹状体注射构建的PD大鼠的学习记忆能力明显降低,可以作为研究人类帕金森病性痴呆的模型。
关键词 :大鼠,帕金森病,学习记忆,障碍

1. 引言
帕金森病(Parkinson’s disease, PD)是一种缓慢发生的神经退行性疾病,其发病机制是选择性中脑黑质多巴胺能神经元丧失和纹状体多巴胺含量明显减少。帕金森病患者中帕金森病性痴呆的发生率可高达4%~93% [1] ,常见于中、晚期帕金森病患者,高于非帕金森病的同年龄人。帕金森病性痴呆的发病机制可能为运动神经元变性累及皮质、海马,其临床表现为记忆力、视觉空间、认知能力等受损 [2] 。本实验运用6-羟多巴胺(6-hydroxydopamine, 6-OHDA)立体定位术制成的PD模型大鼠,以Morris水迷宫、避暗箱、穿梭箱,观察PD大鼠的学习记忆能力的变化,为PD影响学习记忆的深入研究提供技术平台。
2. 材料与方法
2.1. 实验动物
健康雌性Wistar大鼠,体重200~220 g,由扬州大学比较医学中心提供,实验动物生产许可证为SCXK(苏)2012-0004,使用许可证为SYXK(苏)2012-0029。室温保持在25℃左右,自由饮水饮食,12 h明/12 h暗制度人工光照。实验随机分组为正常对照组和成功模型组两组,每组15只大鼠。
2.2. 试剂与仪器
2.2.1. 实验仪器
单臂脑立体定位仪(68025型,深圳市瑞沃德生命科技有限公司),脑立体定位微量注射泵(KDS-310-PLUS,美国KDS公司),大小鼠通用Morris水迷宫(RD1101-MWM-G,上海移数信息科技有限公司),大鼠避暗箱(163030型,上海移数信息科技有限公司)大鼠穿梭箱(163028型大鼠穿梭箱,上海移数信息科技有限公司),PCR仪(Thermal Cycler 2720型,ABI公司),凝胶成像系统(INFINITY型,VL),Step OneTM Real-Time PCR System (ABI公司)
2.2.2. 主要试剂及材料
阿扑吗啡(Apomorphine, APO) (美国Sigma公司),总RNA提取试剂盒(TIANGEN公司),氯仿、无水乙醇(国产分析纯),PrimeScriptTMRT reagent Kit、SYBR Premix Ex TaqTMII (TaKaRa公司),八联排PCR管(GE-BIO公司),RNaseZAPTM (Sigma),1.5 ml Rnase microtube、0.6 ml Rnase microtube (AXYGEN),Rnase-ddH20 (TIANGEN),6 × loading buffer (TIGEN),琼脂糖(Oxoid),TH及GAPDH引物(宝生物)。
2.3. 方法
2.3.1. 实验动物筛选
在PD模型制备前,分别以Morris水迷宫和阿扑吗啡(Apomorphine, APO) (0.5 mg/kg)腹腔注射诱导大鼠的旋转行为,淘汰记忆障碍或有旋转行为的大鼠 [3] 。
2.3.2. PD模型大鼠的制备
腹腔注射2%戊巴比妥钠2 mL/kg麻醉大鼠。头部去毛,将大鼠固定于脑立体定位仪上,颅顶消毒,头皮正中线切开皮肤,充分暴露颅骨,找到前囟点,参照George Paxinos主编的《大鼠脑立体定向图谱》,确定注射位点,即位点1的x、y和z轴坐标分别为−2.5、−1.8和−8 (mm),位点2的x、y和z轴坐标分别为−2.5、−1.8和−4 (mm)。于注射位点牙科钻头骨钻孔,10 μl微量进样针吸取8 μl 6-OHDA,据上述两点通过自动进样泵各注4 μl,进样速度1 μL/min,位点1注射完成后,停针5 min,缓慢提升至位点2,继续上述操作,停留5 min后缓慢提针,缝合创口,消毒,编号,自然苏醒后正常饲养,第一周每天注射抗生素防止感染 [4] 。术后注意保暖、补水。术后第14天腹腔注射APO (4 mg/kg),诱发大鼠产生向健侧旋转行为,平均转速 > 7 r/min的大鼠判定为成功PD模型。选择15只成功PD模型动物备用。
2.3.3. PD大鼠模型的评价
采用APO诱导旋转行为和PD模型大鼠脑内酪氨酸羟化酶(tyrosine hydroxylase, TH)表达量检测的方法来对PD大鼠模型进行评价。
APO诱导旋转行为:术后第14天腹腔注射APO (0.5 mg/kg),诱发大鼠产生向健侧旋转行为,平均转速 > 7 r/min的大鼠判定为成功PD模型,备用。
PD模型大鼠脑内TH表达量检测:在行为学实验全部结束时,将15只PD模型大鼠和15只正常大鼠均取脑,并且检测其脑内TH表达量,用以对之前制备的成功PD模型大鼠进行确证。通过NCBI数据库,查找大鼠TH的基因和内参GAPDH的基因编码序列,应用Primer 5引物设计软件设计引物(表1),引物由宝生物公司合成。
用试剂盒提取大鼠脑组织总RNA,将RNA进行反转录成cDNA,将反转录得到的cDNA放置在−20℃保存,用于之后PCR实验和荧光定量PCR实验。
将反转录得到的cDNA用于荧光定量PCR反应,并且配制荧光定量PCR的反应液,PCR反应及数
Table 1. Primer sequence and amplification length of TH gene
表1. TH基因引物序列及扩增长度
据采集在ABI公司的Step OneTM Real-Time PCR系统上进行,以GAPDH为内参对所有样品进行处理,每个cDNA样品设置3个重复实验。并且计算大鼠脑组织TH mRNA的表达量。
2.3.4. PD模型大鼠学习记忆能力的测定
本研究以经典的Morris水迷宫、避暗反应和穿梭箱被动回避实验测定PD模型大鼠的学习记忆能力,并与正常对照大鼠进行比较。
1) Morris水迷宫实验:分别通过获得性训练、探查训练对实验动物进行空间探索实验。将Morris水迷宫的水池分为4个象限,并分别作标记(分别为不同颜色的正方形、圆形、五角星形、三角形)。训练和实验时,四周用遮光窗帘围住Morris水迷宫,使四周环境除标记外均一致。放水至适宜大鼠游泳的高度,透明平台置于其中一个象限区的中央低于水平面2 cm,保证实验过程中透明平台于同一象限内。保持水温22℃,适宜大鼠游泳。每天的同一时间进行获得性训练,在第六天进行探查训练。
I. 获得性训练:将大鼠头朝池壁放入水中,放入位置随机取东、西、南、北四个起始位置之一。在几次训练中,如果这个时间超过60 s,则引导大鼠到平台,并且让动物在平台上停留15 s。后将动物移开、擦干。每只大鼠每天训练5次,两次训练之间间隔20 min,连续训练5 d。
II. 探查训练:最后一次获得性训练结束后的第二天,将平台撤除,开始60 s的探查训练,摄像记录其1 min内水中游泳路径。将动物由原先平台象限的对侧放入水中。记录动物在目标象限(原先放置平台的象限)所花的时间(s)和在目标象限(原先放置平台的象限)所经过的路程(cm),以此作为空间记忆的检测指标。
2) 避暗反应实验:实验前将避暗潜伏期大于180 s的大鼠弃去不用 [5] 。避暗仪暗室底部铜栅通30 v、0.4 A交流电,先将大鼠放入避暗仪反应箱中训练3 min,大鼠受电击逃往明室。正式测试开始时将大鼠背对洞口放入明室,大鼠进入暗室则受到电击,避暗仪自动记录5 min内大鼠进入在明箱呆的时间占总实验时间的百分比,记录明箱观察时间百分比 [6] - [8] 。第1天上午9:00开始训练实验,当日下午15:00、次日上午9:00和第3天上午9:00(训练实验48 h后)分别测试3次。
3) 穿梭箱被动回避反应:实验分为记忆获得和记忆保持两个阶段。
实验开始时首先设定实验参数,包括安全期(非条件刺激与条件刺激之间的间隔时间)、条件刺激(高频率的稳定声音刺激和闪光灯强光刺激)时间、非条件刺激(电击)时间及强度、穿梭次数等。
在记忆获得阶段首先把实验鼠放入一侧室,接近并面向端壁,适应5 min后开始训练。穿梭实验视频分析系统按照预先设定好的程序,先给高频率的稳定声音刺激和闪光灯强光刺激,持续一定时间后,如果实验鼠仍停留在同侧,则再给一个电击刺激。动物受到电击后将从圆洞逃至对侧一定时间后,对侧再给予条件和非条件刺激,如此反复。每只大鼠连续训练30~50次,直到大鼠学会。24 h后,对大鼠进行检测。经过反复训练后,只给条件刺激,大鼠即逃到对侧安全区以逃避电击,此即形成了条件反射或称主动回避反应。
全部训练结束后,计算机显示出每次穿梭的轨迹,记录大鼠的主动回避反应(active avoidance response,AAR,即大鼠在条件刺激后,非条件刺激到来之前就产生的穿梭)次数、主动逃避平均时间(秒)。以AAR作为其学习记忆成绩的主要评价指标 [9] 。
2.4. 统计学方法
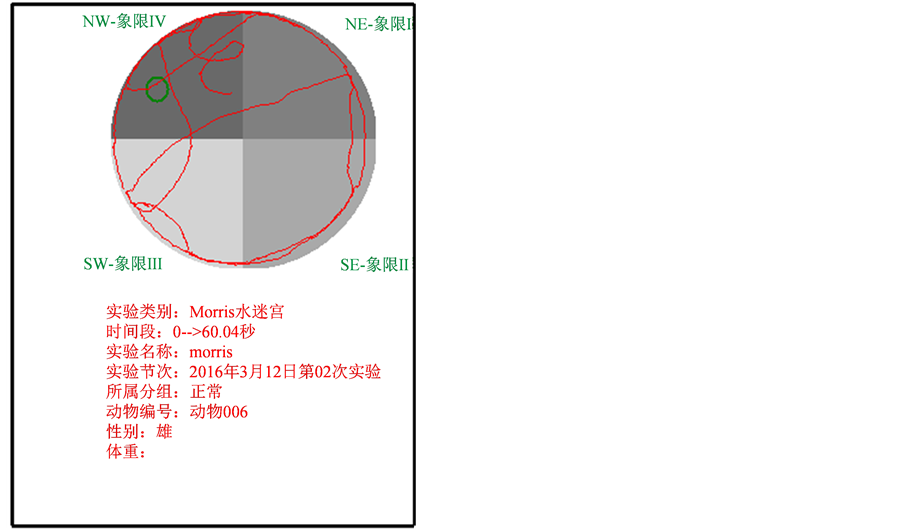
采用统计学处理数据,计量资料以(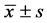 )表示,进行t检验,比较PD模型大鼠与正常大鼠在Morris水迷宫中穿过原平台象限的路程(cm)和处于原平台象限的时间(s)、避暗箱中避暗潜伏期及穿梭箱被动回避反应中的主动逃避次数(次)和主动逃避平均时间(秒)的差异,分析PD模型大鼠相关的学习记忆变化。
)表示,进行t检验,比较PD模型大鼠与正常大鼠在Morris水迷宫中穿过原平台象限的路程(cm)和处于原平台象限的时间(s)、避暗箱中避暗潜伏期及穿梭箱被动回避反应中的主动逃避次数(次)和主动逃避平均时间(秒)的差异,分析PD模型大鼠相关的学习记忆变化。
3. 结果
3.1. Morris水迷宫法对大鼠空间学习记忆能力测定结果
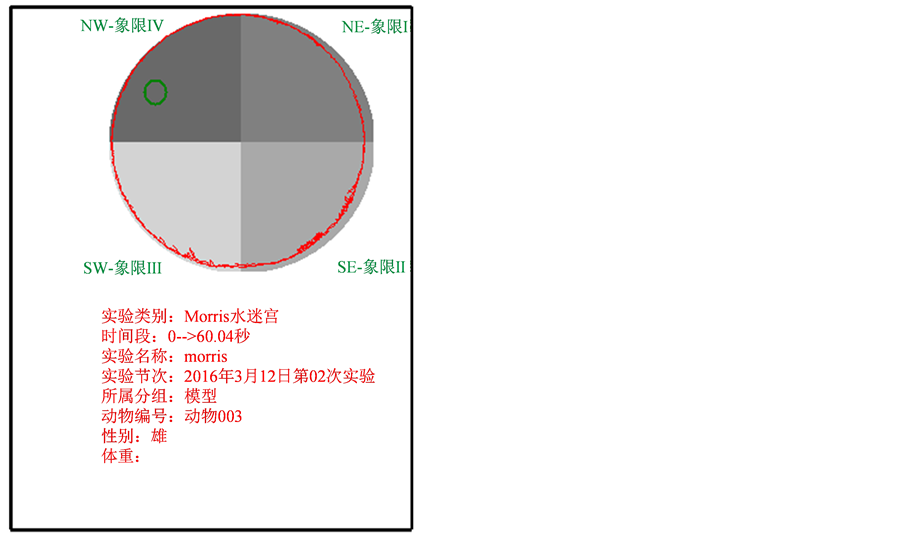
在Morris水迷宫内,PD模型鼠基本沿池壁游泳,其轨迹随机均匀的分布于四个象限(图1(a)),且该PD模型鼠并没有经过原先放置平台的位置;正常对照组大鼠有较多路线处于Morris水迷宫中央(图1(b)),在目标象限所游动的路线最多,其次是位于平台相邻的两个象限,很少跨至对侧象限,并且有穿过原先放置平台的位置。大鼠游泳的轨迹的差异表明了其空间搜索能力的差异。
大鼠Morris水迷宫探查训练实验结果见表2。由表可见,PD模型大鼠每分钟在目标象限的时间为11.9 ± 2.91 s,极显著少于正常对照组大鼠的15.5 ± 3.41 s (p < 0.01,图1(a));PD模型组在目标象限所经过的路程为290.7 ± 88.77 cm/min,亦比正常对照组的370.8 ± 82.37 cm/min显著减少(P < 0.05,图1(b))。提示帕金森病动物获取经验的能力和完成某一特定任务的能力均有下降,即空间学习及空间工作记忆均存在一定障碍。
3.2. 避暗反应法对大鼠学习记忆能力测定结果
大鼠避暗反应实验结果见表3。从表可知,PD模型大鼠明箱观察时间百分比(%)显著少于正常对照组大鼠(P < 0.05,表3),且在3天反复测试中无显著性差异。正常组大鼠的明箱中所在时间百分比大,表明正常组大鼠对暗箱中存在电击有记忆;反之,模型大鼠的明箱中所在时间百分比小,提示PD模型大鼠学习记忆能力存在一定障碍。
3.3. 穿梭箱被动回避反应实验对大鼠学习记忆能力测定结果
大鼠穿梭箱主动回避反应实验结果见表4。由表可见,2周和5周模型组大鼠穿梭箱被动回避反应实验中,主动逃避次数(次)极显著少于正常对照组大鼠,主动逃避平均时间(秒)也极显著减少(p < 0.01);且5周的PD模型组大鼠的主动逃避次数与主动逃避时间比2周的PD模型组大鼠明显减少。实验显示,正常大鼠对条件刺激反应更敏感,积极的躲避非条件刺激。由此推测,帕金森病大鼠存在着学习记忆能力障碍。
3.4. 大鼠脑组织TH mRNA检测结果
大鼠脑组织TH mRNA检测结果见表5。由表可知,正常大鼠右脑与左脑的TH mRNA相对表达量无显著差异(0.989 vs 1.041,p > 0.05),提示正常大鼠左、右脑组织中的多巴胺神经元的功能均正常。
造模后8周PD大鼠的右脑(损毁侧) TH mRNA相对表达量显著低于左侧脑(正常侧)表现为术后大鼠以正常侧(左脑) (0.399 vs 1.020,p < 0.05)。说明6-OHDA注射侧的TH mRNA表达量明显减少。TH是多巴胺合成的限速酶,是神经系统内多巴胺能神经元的蛋白标志,其缺乏或减少可能是帕金森病发病的主要原因。由此,提示,实验早期用APO诱导旋转行为学测试选出的PD模型大鼠经过PCR分析出TH mRNA表达量的验证,证明造模成功 [10] 。
 (a) PD模型大鼠 (b) 正常大鼠
(a) PD模型大鼠 (b) 正常大鼠
Figure 1. The swimming track picture of the rat in the Morris water maze
图1. 大鼠在Morris水迷宫内游泳轨迹图
Table 2. Time and distance in the target quadrant of the Morris water maze in rats ()
表2. 大鼠在Morris水迷宫目标象限的时间与路程(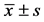 )
)
注:*与正常组大鼠差异显著(P < 0.05),**与正常组大鼠差异极显著(p<0.01)
Table 3. The time of avoid dark reaction in rats in bright box (%) ()
表3. 大鼠避暗反应明箱中所在时间(%) ( )
)
注:*与相对应的正常组相比存在显著差异
Table 4. Times and average time of rats’ active escape in the shuttle box ()
表4. 大鼠在穿梭箱中主动逃避次数与平均时间( )
)
注:*差异显著,**差异极显著
Table 5. Expression of mRNA TH in rat brain
表5. 大鼠脑组织TH mRNA的表达量
*与相对应的正常侧组相比存在显著性差异。
4. 讨论
本实验将6-OHDA双点注射于大鼠单侧黑质致密部,在制模后2周,用经典的APO诱导实验诱导其向健侧旋转,成模率达到80%。此模型较多用于研究PD患者的运动障碍,而较少用于研究PD患者的认知障碍 [11] 。
实验中,在黑质致密部内注射6-OHDA来损伤酪氨酸羟化酶阳性细胞,以达到耗竭纹状体DA,这些模型动物都表现出类似PD患者的多种形式记忆功能障碍 [12] [13] 。可能的情况是,DA能投射在皮质纹状体丘脑-皮质环路多个水平上调节神经活动 [14] ,进而直接或间接影响纹状体、苍白球、边缘叶和皮质的功能。而个体DA能投射对记忆功能的影响大小与任务及PD患者的临床阶段也都可能有一定关系 [15] 。
PD为一种应激相关的神经疾病,其下丘脑-垂体-肾上腺皮质轴反馈调节紊乱,前额叶皮质内内源性糖皮质激素的释放减少。动物实验表明这种减少抑制DA释放和上调D1受体,进而导致工作记忆损害 [16] 。
Morris水迷宫实验是目前广泛采用的动物行为学研究模式之一 [17] 。避暗实验因其方法简单、指标便于观察被广泛地应用于动物学习和记忆能力的测试,又因此法的实验周期短,动物只需一次训练性实验后便可进行正式的测试,所以常被用于动物行为学检测。穿梭箱可定量描述实验动物的主动回避反应等行为特征,是目前评估啮齿类动物学习记忆能力最为常用的行为学测量工具。
本实验结果显示PD模型鼠在Morris水迷宫实验在学习记忆能力方面有明显下降的表现。在Morris水迷宫实验中,水下的不可见平台的位置一直保持不变,大鼠需要根据空间环境中的线索(四周有正方形、三角形、五角形与圆形塑料贴片)从而找到平台 [18] 。大鼠进入水迷宫的位置是随机的,因此水中平台的位置与大鼠进入水迷宫时的位置和状态无关,是一种依靠周围环境线索为参照物而形成的参考认知,因此所形成的记忆是一种空间参考记忆 [19] 。
空间探索实验中,将空间参考记忆练习中平台撤去是一种测验空间工作记忆能力的方法。经过5天的训练,本实验中PD模型大鼠比起正常大鼠在目标象限(原先放置平台的象限)所花的时间(s)和在目标象限(原先放置平台的象限)所经过的路程(cm)均明显较少,有明显差异,证明模型大鼠对空间参考记忆的获得能力与探查能力比较差,表明单侧纹状体内注射6-OHDA制成的PD模型与正常大鼠比,空间记忆能力比较弱,PD模型有明显的空间工作记忆障碍,这与临床PD患者出现空间工作记忆障碍相一致。
该实验中,PD模型大鼠与正常对照组大鼠在目标象限所花的时间(s)有极显著差异,而PD模型大鼠与正常对照组大鼠在目标象限所经过的路程(cm)只有显著差异,主要是由于大鼠的个体差异,每只大鼠的游泳速度不一致,一只游泳速度快的大鼠,虽然在目标象限呆的时间比较短,但路程也可以比较长,因此,路程比时间的参考价值低,并没有那么显著的差异。
观察空间探索实验大鼠游泳轨迹,发现PD模型组大鼠呈现贴壁现象,无目的性;正常对照组大鼠有较多路线处于Morris水迷宫中央,说明大鼠对Morris水迷宫中有平台存在记忆;在目标象限游动的路线较多,大鼠存在该象限有平台的空间参考记忆;并且有穿过原先放置平台的位置,若有平台,该鼠应该已经找到平台。
大鼠避暗反应实验结果(见表3)。从表可知,PD模型大鼠明箱观察时间百分比(%)显著少于正常对照组大鼠,且在3天反复测试中无显著性差异。正常组大鼠的明箱中所在时间百分比大,表明正常组大鼠对暗箱中存在电击有记忆;反之,模型大鼠并未产生暗箱中存在电击的记忆,PD模型大鼠简单学习记忆能力存在一定障碍 [20] 。
2周和5周模型组大鼠穿梭箱被动回避反应实验中,主动逃避次数(次)明显下降,与对照组比较主动逃避平均时间(秒)明显减少,具有极显著统计学意义(P < 0.01,见表4),由该实验推测PD模型鼠在学习记忆能力方面有明显下降。本实验中帕金森病模型大鼠的联合性学习记忆能力有所损伤,但仍能有一定概率顺利的完成穿梭,且随着病程的迁延逐渐加重,表明联合性学习记忆能力在帕金森病中有明显衰退表现。总而言之,本实验结果提示,帕金森病会影响记忆的获取和保存的能力 [21] 。
5. 结论
本实验单侧纹状体注射6-OHDA制成PD大鼠模型 [22] ,不仅有典型的APO诱导旋转的运动障碍,而且在Morris水迷宫、避暗反应实验、穿梭箱被动回避反应实验中有明显的认知记忆障碍,提示此模型可以成为实验研究PD患者认知记忆障碍的模型,并为临床PD的治疗提供理论依据。
基金项目
江苏省大学生创新创业训练计划(201511117062Y),国家自然科学基金(31172284),江苏高校优势学科建设工程资助项目(PAPD)。
文章引用
王硕玥,王 焱,方 丽,孙雅婧,陈 兵,邢 华. 帕金森病模型大鼠学习记忆能力变化的观察
PD Model Rats’ Observation of the Changes of Learning and Memory Ability[J]. 临床医学进展, 2016, 06(03): 138-146. http://dx.doi.org/10.12677/ACM.2016.63025
参考文献 (References)
- 1. Jellinger, K.A. (2012) Neurobiology of Cognitive Impairment in Parkinson’s Disease. Expert Review of Neurotherapeutics, 12, 1451-1466. http://dx.doi.org/10.1586/ern.12.131
- 2. Archibald, N.K., Hutton, S.B., Clarke, M.P., et al. (2013) Visual Exploration in Parkinson’s Disease and Parkinson’s Disease Dementia. Brain, 136, 739-750.
- 3. 张伟, 杨辉. 6-OHDA制作帕金森病大鼠模型及评估[J]. 四川医学, 2007, 28(8): 818-820.
- 4. Paxinos, G. 大鼠脑立体定位图谱[M]. 第3版. 北京: 人民卫生出版社, 2005.
- 5. 刘少林, 张均田. 学习记忆方法学[M]. 第3版. 北京: 人民卫生出版社, 2002: 226-834.
- 6. Jin, U.-H., et al. (2007) Enhancement of Learning and Memory by a Medicinal Formulation, Saenhyetang, in Mice. Journal of Ethnopharmacology, 109, 271-280. http://dx.doi.org/10.1016/j.jep.2006.07.030
- 7. 瞿融, 马世平, 夏卫军, 等. 定志小丸对不同模型鼠学习记忆功能的影响[J]. 中药药理与临床, 2003, 19(5): 4-6.
- 8. 侯悦, 吴春福, 何祥, 等. 氟哌啶醇对小鼠在避暗实验中学习记忆获得、巩固和再现过程的影响[J]. 中国临床康复, 2006, 10(34): 99-102.
- 9. Cheng, X.R., Yang, Y., Zhou, W.X., et al. (2011) Expression of VGLUTs Contributes to Degeneration and Acquisition of Learning and Memory. Neurobiology of Learning & Memory, 95, 361-375. http://dx.doi.org/10.1016/j.nlm.2011.01.010
- 10. 吴均. 表达TH、AADC和GCH-I三重基因骨髓基质细胞脑内移植治疗帕金森病模型大鼠的实验研究[D]: [硕士学位论文]. 北京: 首都医科大学, 2014.
- 11. 顾平, 张忠霞, 崔冬生, 等. 帕金森病大鼠空间学习记忆和精神行为的改变[J]. 河北医科大学学报, 2010, 31(3): 259-263.
- 12. Da, C.C., Angelucci, M.E. and Canteras, N.S. (2002) The Lesion of the Rat Substantia Nigra Pars Compacta Dopaminergic Neurons as a Model for Parkinson’s Disease Memory Disabilities. Cellular & Molecular Neurobiology, 22, 227-237. http://dx.doi.org/10.1023/A:1020736131907
- 13. Braga, R., Kouzmine, I., Canteras, N.S., et al. (2005) Lesion of the Substantia Nigra, Pars Compacta Impairs Delayed Alternation in a Y-Maze in Rats. Experimental Neurology, 192, 134-141. http://dx.doi.org/10.1016/j.expneurol.2004.11.006
- 14. 张贝. 黑质区微注射鱼藤酮对大鼠纹状体和丘脑腹外侧核神经元电活动的影响[D]: [硕士学位论文]. 上海: 华东师范大学, 2007.
- 15. 王小川, 张家兴. 帕金森病记忆功能障碍及机制[J]. 中华神经科杂志, 2007, 40(12): 852-856.
- 16. Mizoguchi, K., Ishige, A., Takeda, S., et al. (2004) Endogenous Glucocorticoids Are Essential for Maintaining Prefrontal Cortical Cognitive Function. The Official Journal of the Society for Neuroscience, 24, 5492-5499. http://dx.doi.org/10.1523/JNEUROSCI.0086-04.2004
- 17. Brandeis, R., Brandys, Y. and Yehuda, S. (1989) The Use of the Morris Water Maze in the Study of Memory and Learning. International Journal of Neuroscience, 48, 29-69. http://dx.doi.org/10.3109/00207458909002151
- 18. Pearce, J.M., Roberts, A.D.L. and Good, M. (1998) Hippocampal Lesions Disrupt Navigation Based on Cognitive Maps but Not Heading Vectors. Nature, 396, 75-77. http://dx.doi.org/10.1038/23941
- 19. 方松, 余化霖. Morris水迷宫实验中海马相关空间学习记忆的研究进展[J]. 国际病理科学与临床杂志, 2010, 30(4): 321-326.
- 20. 王莹, 杨文微, 罗菊花. 避暗实验测定小鼠学习记忆功能方法的研究[J]. 大理学院学报: 综合版, 2011, 10(6): 25-27.
- 21. 鲁燕侠, 张癸荣, 聂凌云, 等. 不同实验条件对穿梭箱系统研究大、小鼠学习记忆行为学的影响[J]. 中国药理学通报, 2012, 28(6): 787-791.
- 22. 李进, 孙杰, 赵楠, 等. 3种不同脑区定点注射6-OHDA单侧损伤大鼠帕金森病模型的比较研究[J]. 河北医科大学学报, 2016, 37(6): 667-671.
*第一作者。
#通讯作者。
