Advances in Clinical Medicine
Vol.
09
No.
07
(
2019
), Article ID:
31334
,
8
pages
10.12677/ACM.2019.97130
Effects of Ginkgo Biloba Extract on H9C2 microRNA-1, BCL-2 and Caspase Pathways in Cardiomyocytes
Junxia Li, Mingji Ren
Inner Mongolia Medical University, Hohhot Inner Mongolia

Received: Jun. 28th, 2019; accepted: Jul. 12th, 2019; published: Jul. 19th, 2019

ABSTRACT
Objective: To investigate the expression of microRNA-1, BCL-2 and caspase in cardiac myocytes induced by Ginkgo biloba extract (GBE) in order to find out the mechanism of action of GBE on cardiac myocytes. Methods: CCK-8 method was used to obtain the optimal concentration of Ginkgo biloba extract. The expression of microRNA-1 was detected by quantitative PCR, and the expression of BCL-2 and caspase was detected by Western blot. Results: The growth of H9C2 cells was the best when the concentration of Ginkgo biloba extract was 10 μM for 36 h. At 0, 4 h, 8 h, the expression of microRNA-1 gradually decreased with time (P < 0.05). At 0, 4 h, 8 h, the expression of Bcl-2 gradually increased with time (P < 0.05). At 8 h, the expression of Bcl-2 at 12 h had no significant difference (P > 0.05). The expression of Bax decreased gradually with the increase of time at 0, 4 and 8 hours (P < 0.05), but did not change at 8 and 12 hours (P > 0.05). The expression of caspase 3, caspase 8 and caspase 9 decreased gradually with the increase of time at 0, 4 and 8 hours (P < 0.05), while the expression of caspase 3, caspase 8 and caspase 9 did not change at 8, 12 hours (P > 0.05). Conclusion: Ginkgo biloba extract has a preliminary effect on the proliferation of cardiac myocytes through microRNA-1, Bcl-2, Bax, caspase-3, caspase-8, caspase-9 and so on.
Keywords:Ginkgo Biloba Extract, Myocardial Cells, bcl-2
银杏叶提取物对心肌细胞H9C2 miR-1,BCL-2和Caspase通路的作用
李俊霞,任明姬
内蒙古医科大学,内蒙古 呼和浩特

收稿日期:2019年6月28日;录用日期:2019年7月12日;发布日期:2019年7月19日

摘 要
目的:本研究以心肌细胞H9C2为研究对象,对银杏叶提取物对心肌细胞中的miR-1,BCL-2和caspase的表达进行研究,旨在找到银杏叶提取物对心肌细胞的作用机制。方法:通过CCK-8法得到最佳的银杏叶提取物浓度,通过定量PCR检测了miR-1的表达,通过western blot 检测了BCL-2和caspase的表达。结果:当银杏叶提取物的浓度为10 μM的银杏叶提取物在作用36 h时,H9C2细胞的的生长情况最佳。在0,4 h,8 h随着时间的增加miR-1在mRNA水平的表达量逐渐降低(P < 0.05)。在0,4 h,8 h随着时间的增加Bcl-2的表达量逐渐升高(P < 0.05)。而在8 h,12 h在Bcl-2的表达量则没有显著差异(P > 0.05)。在0,4 h,8 h随着时间的增加Bax的表达量逐渐降低(P < 0.05),而8 h,12 h Bax的表达量没有变化(P > 0.05)。在0,4 h,8 h随着时间的增加caspase 3,caspase 8,caspase 9的表达量逐渐降低(P < 0.05),而8 h,12 h caspase 3,caspase 8,caspase 9的表达量没有变化(P > 0.05)。结论:初步表明银杏叶提取物对心肌细胞的增殖作用是通过miR-1,Bcl-2和Bax,caspase 3,caspase 8,caspase 9等起作用的。
关键词 :银杏叶提取物,心肌细胞,bcl-2

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在缺血再灌注损伤的组织中,心肌的损伤最为常见。心肌在经历了缺血再灌注损伤之后,其在功能和能量代谢上均产生了很大的变化。银杏叶提取物对缺血再灌注的心肌有保护作用。那么在体外银杏叶提取物对心肌细胞中的miR-1,BCL-2和caspase的作用是什么样的呢?本研究以心肌细胞H9C2为研究对象,对银杏叶提取物对心肌细胞中的miR-1,BCL-2和caspase的表达进行研究,旨在找到银杏叶提取物对心肌细胞的作用机制。
2. 实验材料
2.1. 试剂
胎牛血清(gibico),细胞培养液(gibico),MRS培养基,胰酶,PBS,青链霉素,caspase 3,caspase 9,caspase 8,Bcl-2,Bax,β-actin兔抗人一抗(abcam)。二抗辣根过氧化物酶羊抗兔(abcam)。脱脂奶粉(BD),PVDF膜(MILIPORE),吐温-20(sigma),SDS-PAGE制胶试剂盒(碧云天),ELC显色液(pierce),IP裂解液,PMSF。心肌细胞H9C2购自中科院细胞库,RNA提取试剂盒(天根公司),RT试剂盒和PCR试剂盒购自大连宝生物公司。银杏叶提取物购自sigma公司。
2.2. 实验仪器
二氧化碳培养箱(贺利氏),超净工作台(苏净),细胞超声裂解仪,水平和垂直电泳仪(百晶),电转移(百晶),凝胶成像系统(UVP),脱色摇床,低温高速离心机(艾本德),PCR仪(ABI)。
3. 实验方法
3.1. CCK-8法
当心肌细胞H9C2在培养皿或培养瓶中(37℃,5%的CO2)铺满底部时进行消化。将培养皿或培养瓶中的培养液倒出,用PBS洗三次,加入胰酶消耗5 min,并用移液器反复吹打,在显微镜下观察,直至所有细胞脱落瓶底;接种到96孔板中:根据合适的铺板细胞数,每孔约100 ul细胞悬液,同样的样本可做3个重复。37℃培养箱中培养:细胞接种后贴壁大约需要培养4小时后,加入终浓度为0,5,10,20 μM银杏叶提取物,分别培养12 h,24 h,36 h和48 h。然后加入10 μl CCK8:由于每孔加入CCK8量比较少,有可能因试剂沾在孔壁上而带来误差,在加完试剂后轻轻敲击培养板以帮助混匀。或者直接配置含10% CCK8的培养基,以换液的形式加入。测定450 nm吸光度:建议采用双波长进行测定,检测波长450~490 nm,参比波长600~650 nm。然后依据公式算出细胞增长率(增长百分比) = (样本OD − 空白对照OD)/空白对照OD。
3.2. 实验分组
用最佳的银杏叶提取物的浓度,作用于心肌细胞H9C2并于0,4,8和12收集细胞。
3.3. 定量PCR
3.3.1. 心肌细胞H9C2 RNA的提取
按试剂盒说明操作。
3.3.2. RT及定量PCR
按试剂盒操作说明操作。内参用U6
miR-1 Target sequence 5-UGGCAGUGUCUUAGCUGGUUGU 3'
按试剂盒说明书,进行定量PCR,其反应程序为,95℃ 5 min,95℃ 10 s,60℃ 60 s 45个循环,用2-ΔΔCT计算表达量。
3.4. Western Blot
用预冷的PBS洗涤细胞三次,将PBS弃净后把EP管置于冰上。每管加含PMSF的裂解液,于冰上裂解30 min。蛋白样品与等体积上样缓冲液混合,100℃水浴5 min,待完全冷却后,用12% SDS-PAGE电泳。将凝胶中的蛋白质转移至NC膜上5%脱脂奶粉封闭,加1:1000稀释的一抗,4℃孵育过夜;再加入对应的1:3000的碱性磷酸酶标记的二抗IgG,室温振荡孵育1 h。将ECL试剂盒中底物液A液和B液按1:1混合,滴在NC膜的蛋白面上1 min,甩干后显影并拍照,获得蛋白印迹结果。照片在FluorsMutilmager 图像分析仪(Bio-Rad公司)上用Quantity One 4.1版图像分析软件进行分析,以相应蛋白条带的平均光强度值来表示蛋白的表达量。以此数值作柱形图。
3.5. 统计学方法
计算各指标的均数±标准差( ± S),用SPSS软件进行统计分析,样本均数间差异用单因素方差分析。p < 0.05具有统计学意义。
4. 结果
4.1. 通过CCK-8法检测了不同浓度的银杏叶提取物对H9C2细胞增殖的影响
经过公式计算可以的表1的结果。由表可以看出随着时间的增长,H9C2细胞的增长率逐渐变化,呈升高趋势,其字36 h,24 h的生长率显著高于12 h (P < 0.05),而36 h与24 h相比,也明显升高(P < 0.05),而对于48 h和36 h的生长情况而言,基本一致(P > 0.05)。而在36 h和48 h,不同浓度的银杏叶提取物作用于H9C2细胞的增长率则在0,5,10 μM时随着时间的增加增长率也升高(P < 0.05),而在20 μM时的增长率与10 μM的相差不大(P > 0.05)。而在12 h和24 h,0 μM和5 μM的增长率没有差异(P > 0.05),但都显著低于10 μM和20 μM的增长率(P < 0.05)。而在12 h时,10 μM和20 μM的增长率没有差异(P > 0.05)。在24 h时,10 μM的增长率显著高于20 μM的增长率(P < 0.05)。由表1可以看出,当银杏叶提取物的浓度为10 μM的银杏叶提取物在作用36 h时,H9C2细胞的的生长情况最佳。
Table 1. Proliferation of H9C2 cells treated with different concentrations of Ginkgo biloba extract (%)
表1. 不同浓度的银杏叶提取物作用于H9C2细胞的增殖情况(%)
*表示与12 h组比较差异显著;#表示与24 h组比较差异显著;&表示与36 h组比较差异显著;a表示与0 μM组比较差异显著;b表示与5 μM组比较差异显著;c表示与10 μM组比较差异显著。
4.2. 银杏叶提取物作用于H9C2细胞不同时间miR-1在mRNA水平的表达量
用10 μM的银杏叶提取物作用于心肌细胞H9C2细胞分别在0,4 h,8 h,12 h收集细胞,提取细胞RNA,定量PCR检测miR-1在mRNA水平的表达量。结果表明(图1),在0,4 h,8 h随着时间的增加miR-1在mRNA水平的表达量逐渐降低(P < 0.05)。而在8 h,12 h miR-1在mRNA水平的表达量则没有显著差异(P > 0.05)。
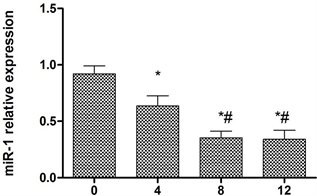
Figure 1. The expression of microRNA-1 in H9C2 cells treated with Ginkgo biloba extract at different time levels
图1. 银杏叶提取物作用于H9C2细胞不同时间miR-1在mRNA水平的表达量
4.3. 银杏叶提取物作用于H9C2细胞不同时间Bcl-2和Bax表达量的变化
用10 μM的银杏叶提取物作用于心肌细胞H9C2细胞分别在0,4 h,8 h,12 h收集细胞,提取细胞总蛋白,Western blot检测Bcl-2和Bax在蛋白水平的表达量。结果表明(图2),在0,4 h,8 h随着时间的增加Bcl-2的条带逐渐加深。而在8 h,12 h在Bcl-2的条带则没有显著差异。在0,4 h,8 h随着时间的增加Bax的条带逐渐变浅,而8 h,12 h Bax的条带没有变化。
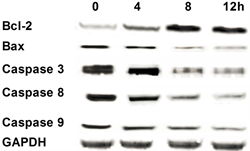
Figure 2. Western blot results
图2. Western blot结果
为以进一步的研究银杏叶提取物作用于H9C2细胞不同时间Bcl-2和Bax表达量的变化,本研究将Bcl-2和Bax的条带进行灰度分析,结果表明(图3)在0,4 h,8 h随着时间的增加Bcl-2的表达量逐渐升高(P < 0.05)。而在8 h,12 h在Bcl-2的表达量则没有显著差异(P > 0.05)。在0,4 h,8 h随着时间的增加Bax的表达量逐渐降低(P < 0.05),而8 h,12 h Bax的表达量没有变化(P > 0.05)。
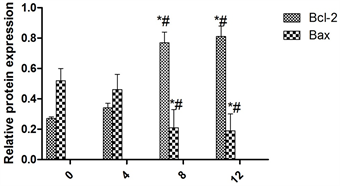 注:*表示与0 h组比较差异显著(P < 0.05),#表示与4 h组比较差异显著(P < 0.05),&表示与8 h组比较差异显著(P < 0.05)。
注:*表示与0 h组比较差异显著(P < 0.05),#表示与4 h组比较差异显著(P < 0.05),&表示与8 h组比较差异显著(P < 0.05)。
Figure 3. Bcl-2 and Bax expression at protein level
图3. Bcl-2和Bax在蛋白水平上的表达量。
4.4. 银杏叶提取物作用于H9C2细胞不同时间caspase 3, caspase 8, caspase 9表达量的变化
用10 μM的银杏叶提取物作用于心肌细胞H9C2细胞分别在0,4 h,8 h,12 h收集细胞,提取细胞总蛋白,Western blot检测caspase 3,caspase 8,caspase 9在蛋白水平的表达量。结果表明(图2),在0,4 h,8 h随着时间的增加caspase 3,caspase 8,caspase 9的条带逐渐变浅,而8 h,12 h,caspase 3,caspase 8,caspase 9的条带没有变化。
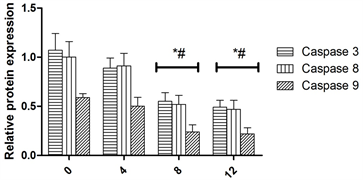 注:*表示与0 h组比较差异显著(P < 0.05),#表示与4 h组比较差异显著(P < 0.05),&表示与8 h组比较差异显著(P < 0.05)。
注:*表示与0 h组比较差异显著(P < 0.05),#表示与4 h组比较差异显著(P < 0.05),&表示与8 h组比较差异显著(P < 0.05)。
Figure 4. Caspase 3, caspase 8, caspase 9 expression at protein level
图4. Caspase 3,caspase 8,caspase 9在蛋白水平上的表达量
为以进一步的研究银杏叶提取物作用于H9C2细胞不同时间caspase 3,caspase 8,caspase 9表达量的变化,本研究将caspase 3,caspase 8,caspase 9的条带进行灰度分析,结果表明(图4)在0,4 h,8 h随着时间的增加caspase 3,caspase 8,caspase 9的表达量逐渐降低(P < 0.05),而8 h,12 h,caspase 3,caspase 8,caspase 9的表达量没有变化(P > 0.05)。
5. 讨论
在超微结构下观察心肌细胞,可以发现,心肌的质膜遭到严重的破坏,同时肌原纤维也受到不同程度的破坏,在肌丝上有不同程度的断裂,溶解和线粒体肿胀,而在机制内有大量的钙离子盐的沉积 [1] [2] [3] [4]。在心肌受到缺血再灌注损伤的时候,心肌的能量代谢也会发生很大的变化,其主要表现在ATP的变化,在再灌注发生时,合成ATP的物质如腺苷,肌酐次黄嘌呤等迅速被移走,因而其含量降低 [3] [5]。而且由于缺血的原因,使得心肌对氧的需求也可以引起ATP的明显降低。在心肌缺血再灌注损伤发生的时候有一些主要的特点。氧自由基,钙超载,炎性反应和能量代谢及细胞的凋亡 [6] [7] [8]。
首先氧自由基,在急性心肌梗死发生的时候,及时的给予再灌注治疗,可以使心肌得到大量的氧,这样就会使氧自由基在最短的时间内迅速的爆发,而这些大量的自由基可以将线粒体的功能破坏,还可以使ATP的生成量降低,同时还可以使一氧化氮失活,使中性粒细胞趋化物在血浆中产生,使白细胞粘附于血管内皮细胞,使微血管堵塞,造成无法复流 [9] - [14]。
其次是钙离子超载,很多的研究发现,把心肌细胞内的钙离子降低二分之一就可以使心肌梗死的面积减少一半以上,在急性心肌缺血再灌注发生的时候,钙离子在组织内大量的超载,进入到线粒体,使氧化磷酸化受到不同程度的影响,从而阻碍ATP的生成,进而导致心肌能量代谢受到阻碍 [15] [16] [17] [18] [19]。
第三炎性反应,研究发现,在梗死发生早期,炎性细胞就迅速进入梗死 [20] [21] [22]。
第四能量的代谢,当心肌发生缺血时,伴随着就是缺氧的发生,心肌细胞发生无氧的糖酵解过程,产生各种不利的因素导致线粒体功能受到阻碍,使心肌细胞发生凋亡 [23] [24] [25]。
最后细胞凋亡,到目前为止,研究表明,细胞凋亡是缺血再灌注损伤机制的重要环节。最早有研究在兔子心脏缺血再灌注实验时发现再灌注损伤可以促进相关细胞凋亡的产生 [26] [27] [28] [29]。
银杏叶提取物是一种非选择性阿片受体激动剂,在阿片类制剂中银杏叶提取物的镇痛效应最强,已经广泛应用于临床麻醉及术后、ICU的镇痛。而且有良好的血液动力学稳定性,可同时保证足够的心肌氧供应. 近年来已有部分临床和动物实验研究显示银杏叶提取物对缺血再灌注性心肌损害有很好的保护作用 [30] [31] [32]。
在本研究中发现银杏叶提取物的浓度为10 μM的银杏叶提取物在作用36 h时,H9C2细胞的生长情况最佳。说明银杏叶提取物对心肌细胞的增殖有保护的作用。同时为了进一步研究银杏叶提取物对心肌细胞增殖作用的机制,本研究检测了miR-1的表达,结果表明,10 μM的银杏叶提取物作用于心肌细胞H9C2细胞分别在0,4 h,8 h随着时间的增加miR-1在mRNA水平的表达量逐渐降低(P < 0.05)。而在8 h,12 h miR-1在mRNA水平的表达量则没有显著差异(P > 0.05)。而对于Bcl-2和caspsae3,8,9的表达则是在0,4 h,8 h随着时间的增加Bcl-2,caspase 3,caspase 8,caspase 9的表达量逐渐升高(P < 0.05)。而在8 h,12 h在Bcl-2的表达量则没有显著差异(P > 0.05)。在0,4 h,8 h随着时间的增加Bax的表达量逐渐降低(P < 0.05),而8 h,12 h Bax的表达量没有变化(P > 0.05)。这就初步表明银杏叶提取物对心肌细胞的增殖作用是通过miR-1,Bcl-2和Bax,caspase 3,caspase 8,caspase 9等起作用的。
文章引用
李俊霞,任明姬. 银杏叶提取物对心肌细胞H9C2 miR-1,BCL-2和Caspase通路的作用
Effects of Ginkgo Biloba Extract on H9C2 microRNA-1, BCL-2 and Caspase Pathways in Cardiomyocytes[J]. 临床医学进展, 2019, 09(07): 844-851. https://doi.org/10.12677/ACM.2019.97130
参考文献
- 1. Kim, J., Kim, J.I., Na, Y.K., et al. (2011) Intra-Renal Slow Cell-Cycle Cells Contribute to the Restoration of Kidney Tubules Injured by Ischemia/Reperfusion. Anatomy & Cell Biology, 44, 186-193. https://doi.org/10.5115/acb.2011.44.3.186
- 2. Huang, Y., Lu, S.F., Hu, C.J., et al. (2014) Electro-Acupuncture at Neiguan Pretreatment Alters Genome-Wide Gene Expressions and Protects Rat Myocardium against Ische-mia-Reperfusion. Molecules, 19, 16158-16178. https://doi.org/10.3390/molecules191016158
- 3. Groenendaal, F., Shadid, M., McGowan, J.E., et al. (2000) Ef-fects of Deferoxamine, a Chelator of Free Iron, on NA(+), K(+)-ATPase Activity of Cortical Brain Cell Membrane during Early Reperfusion after Hypoxia-Ischemia in Newborn Lambs. Pediatric Research, 48, 560-564. https://doi.org/10.1203/00006450-200010000-00023
- 4. Babsky, A.M., Topper, S., Zhang, H., et al. (2008) Evaluation of Extra- and Intracellular Apparent Diffusion Coefficient of Sodium in Rat Skeletal Muscle: Effects of Prolonged Ischemia. Magnetic Resonance in Medicine, 59, 485-491. https://doi.org/10.1002/mrm.21568
- 5. Beller, G.A., Conroy, J. and Smith, T.W. (1976) Ischemia-Induced Al-terations in Myocardial (Na+ + K+)-ATPase and Cardiac Glycoside Binding. Journal of Clinical Investigation, 57, 341-350. https://doi.org/10.1172/JCI108285
- 6. Aufricht, C., Bidmon, B., Ruffingshofer, D., et al. (2002) Is-chemic Conditioning Prevents Na,K-ATPase Dissociation from the Cytoskeletal Cellular Fraction after Repeat Renal Ischemia in Rats. Pediatric Research, 51, 722-727. https://doi.org/10.1203/00006450-200206000-00010
- 7. Alves, D.S., Thulin, G., Loffing, J., et al. (2015) Akt Substrate of 160 kD Regulates Na+,K+-ATPase Trafficking in Response to Energy Depletion and Renal Ischemia. Journals of the American Society of Nephrology, 26, 2765-2776. https://doi.org/10.1681/ASN.2013101040
- 8. Zhuang, M., Fang, Y., Wu, L.R., et al. (2008) Protective Effects of Metallothionein Induced by Dexamethasone against Ischemia/Reperfusion Injury of Myocardium of Isolated Rat Heart. Chinese Critical Care Medicine, 20, 223-226.
- 9. You, Y., Hirsch, D.J. and Morgunov, N.S. (1992) Functional Integrity of Proximal Tubule Cells. Effects of Hypoxia and Ischemia. Journal of the American Society of Nephrology, 3, 965-974.
- 10. Ye, T.M., Qian, L.B., Cui, J., et al. (2010) Auricularia Auricular Polysaccharide Protects Myocardium against Ischemia/Reperfusion Injury. Chinese Journal of Applied Physiology, 26, 154-158.
- 11. Yano, K., Maruyama, T., Makino, N., et al. (1993) Effects of Amiloride on the Mechanical, Electrical and Biochemical Aspects of Ischemia-Reperfusion Injury. Molecular and Cellular Biochemistry, 121, 75-83. https://doi.org/10.1007/BF00928702
- 12. Yan, J., Yang, X.F., Yi, S.X., et al. (2007) Effect of Electroacupuncture of “Neiguan” (PC 6) on Na+-K+-ATPase Activity and Its Gene Expression in Cardiocyte Membrane in Rats with My-ocardial Ischemia-Reperfusion Injury. Acupuncture Research, 32, 296-300.
- 13. Woroniecki, R., Ferdinand, J.R., Morrow, J.S., et al. (2003) Dissociation of Spectrin-Ankyrin Complex as a Basis for Loss of Na-K-ATPase Polarity after Ischemia. American Journal of Physiology-Renal Physiology, 284, F358-F364. https://doi.org/10.1152/ajprenal.00100.2002
- 14. Wang, Z.W., Liu, Y.Q., Zhao, B., et al. (2014) Effect of JTS Caps. Treating Cerebral Ischemia on Metabolism and Antioxidant System in Cerebral Ischemia Rat. Chinese Journal of Applied Physiology, 30, 115-118.
- 15. Yin, X., Wang, X., Fan, Z., et al. (2015) Hyperbaric Oxygen Preconditioning Attenuates Myocardium Ischemia-Reper- fusion Injury through Upregulation of Heme Oxygenase 1 Expression: PI3K/Akt/Nrf2 Pathway Involved. Journal of Cardiovascular Pharmacology and Therapeutics, 20, 428-438. https://doi.org/10.1177/1074248414568196
- 16. Yang, Q., Yang, K., Li, A., et al. (2013) Anti-Apoptosis and Expression of microRNA-21 in Rat Myocardium during Early Ischemia-Reperfusion Injury. Journal of Central South University. Medical Sciences, 38, 483-489.
- 17. Zhang, X., et al. (2004) Protective Effect of Ulinastatin against Is-chemia-Reperfusion Injury in Rat Small Bowel Transplantation. Transplantation Proceedings, 36, 1564-1566. https://doi.org/10.1016/j.transproceed.2004.05.059
- 18. Turkozkan, N., Bilighan, A., Cayci, B., et al. (1996) The Effects of 2-Chloroadenosine and Deoxycoformycin on the ATP Level, Na-K ATPase Activity in Experimental Brain Ischemia of Gerbil. Neurological Research, 18, 345-348. https://doi.org/10.1080/01616412.1996.11740434
- 19. Tiwari, M., Hemalatha, T., Ganesan, K., et al. (2008) Myocardial Ischemia and Reperfusion Injury in Rats: Lysosomal Hydrolases and Matrix Metalloproteinases Mediated Cellular Damage. Molecular and Cellular Biochemistry, 312, 81-91. https://doi.org/10.1007/s11010-008-9723-7
- 20. Villa, R.F., Gorini, A. and Hoyer, S. (2002) ATPases of Synaptic Plasma Membranes from Hippocampus after Ischemia and Recovery during Ageing. Neurochemical Research, 27, 861-870. https://doi.org/10.1023/A:1020381829107
- 21. Vicencio, J.M., Yellon, D.M., Sivaraman, V., et al. (2015) Plasma Exosomes Protect the Myocardium from Ischemia-Reperfusion Injury. Journal of the American College of Cardiology, 65, 1525-1236. https://doi.org/10.1016/j.jacc.2015.02.026
- 22. Vatner, D.E., Knight, D.R., Shen, Y.T., et al. (1988) One Hour of Myocardial Ischemia in Conscious Dogs Increases Beta-Adrenergic Receptors, But Decreases Adenylate Cyclase Ac-tivity. Journal of Molecular and Cellular Cardiology, 20, 75-82. https://doi.org/10.1016/S0022-2828(88)80180-9
- 23. Tanaka, E., Uchikado, H., Niiyama, S., et al. (2002) Extru-sion of Intracellular Calcium Ion after in Vitro Ischemia in the Rat Hippocampal CA1 Region. Journal of Neurophysi-ology, 88, 879-887. https://doi.org/10.1152/jn.2002.88.2.879
- 24. Szekeres, L. (2005) Drug-Induced Delayed Cardiac Protection against the Effects of Myocardial Ischemia. Pharmacology & Therapeutics, 108, 269-280. https://doi.org/10.1016/j.pharmthera.2005.04.007
- 25. Suh, J.G., An, S.J., Park, J.B., et al. (2002) Transcortical Alterations in Na(+)-K+ ATPase and Microtubule-Associated Proteins Immunoreactivity in the Rat Cortical Atrophy Model Induced by Hypoxic Ischemia. Neural Plasticity, 9, 135-146. https://doi.org/10.1155/NP.2002.135
- 26. Stanimirovic, D.B., Ball, R. and Durkin, J.P. (1997) Stimulation of Glutamate Uptake and Na,K-ATPase Activity in Rat Astrocytes Exposed to Ischemia-Like Insults. Glia, 19, 123-134. 3.0.CO;2-1>https://doi.org/10.1002/(SICI)1098-1136(199702)19:2<123::AID-GLIA4>3.0.CO;2-1
- 27. Soumya, R.S., Vineetha, V.P., Salin Raj, P., et al. (2014) Beneficial Properties of Selenium Incorporated Guar Gum Nanoparticles against Ischemia/Reperfusion in Cardiomyoblasts (H9c2). Metallomics, 6, 2134-2147. https://doi.org/10.1039/C4MT00241E
- 28. Song, W., Fu, J., Jia, X., et al. (2002) Changes of ATPase in Fetal Rat’s Cerebral Mitochondria and Endoplasmic Reticulum Subsequent Intrauterus Ischemia and Hypoxia. Chinese Journal of Obstetrics and Gynecology, 37, 146-148.
- 29. Smith, N.C. and Levi, R. (1999) LLC-PK(1) Cells Stably Expressing the Human Norepinephrine Transporter: A Functional Model of Carrier-Mediated Norepinephrine Release in Protracted Myocardial Ischemia. Journal of Pharmacology and Experimental Therapeutics, 291, 456-463.
- 30. Bergmann, I., Szabanowski, T., Brauer, A., et al. (2015) Remifentanil Added to Sufentanil-Sevoflurane Anesthesia Suppresses Hemodynamic and Metabolic Stress Responses to Intense Surgical Stimuli More Effectively than High-Dose Sufentanil-Sevoflurane Alone. BMC Anesthesiology, 15, 3. https://doi.org/10.1186/1471-2253-15-3
- 31. Zhang, Y., Zhang, L., Gu, E., et al. (2016) Long-Term Insulin Treatment Restores Cardioprotection Induced by Sufentanil Postconditioning in Diabetic Rat Heart. Experimental Biology and Medicine (Maywood), 241, 650-657. https://doi.org/10.1177/1535370215622706
- 32. Wu, Q.L., Shen, T., Ma, H., et al. (2012) Sufentanil Postcondi-tioning Protects the Myocardium from Ischemia-Reperfu- sion via PI3K/Akt-GSK-3beta Pathway. Journal of Surgical Research, 178, 563-570. https://doi.org/10.1016/j.jss.2012.05.081
