Pharmacy Information
Vol.
08
No.
03
(
2019
), Article ID:
30107
,
9
pages
10.12677/PI.2019.83010
Advances in Research of Integrin αvβ3 in Tumor Diagnosis and Treatment
Tianzhen Han, Xuemei Ji, Yu Liu*
School of Life Science and Technology, China Pharmaceutical University, Nanjing Jiangsu

Received: Apr. 20th, 2019; accepted: May 1st, 2019; published: May 8th, 2019

ABSTRACT
The general characteristics of tumor cells are strong proliferation and metastasis, which are regulated by integrin expression in tumor cells. Integrin αvβ3 is one of the most intensively studied and discussed extracellular matrix adhesion receptors. Because of the high expression of αvβ3 in tumor neovascularization, it has become an important target for tumor diagnosis and anti-tumor drug research. Natural ligands of αvβ3 contain a section of arginine-glycine-aspartic acid (RGD) sequence, which is involved in the proliferation and metastasis of tumor cells. This property of RGD can be used to construct molecular imaging probes in vitro for tumor diagnosis and drugs for targeted therapy. Based on the critical role of integrin αvβ3 in the diagnosis and treatment of cancer, the structure and function of αvβ3 and its role in the diagnosis and treatment of cancer are briefly reviewed.
Keywords:Integrin αvβ3, RGD, Tumor Neovascularization, Tumor Diagnosis, Targeted Therapy
整合素αvβ3在肿瘤诊断与治疗中的研究进展
韩田振,纪雪梅,刘 煜*
中国药科大学生命科学与技术学院,江苏 南京

收稿日期:2019年4月20日;录用日期:2019年5月1日;发布日期:2019年5月8日

摘 要
肿瘤细胞具有较强的增殖和扩散转移能力,肿瘤细胞的增殖和转移受细胞表达的整合素所调节。其中,整合素αvβ3是被研究和讨论最为集中的细胞外基质粘附受体之一。因为αvβ3在肿瘤新生血管中的高表达,使其成为肿瘤诊断和抗肿瘤药物研究的重要靶点。αvβ3的天然配体中都含有一段精氨酸–甘氨酸–天冬氨酸(RGD)序列,参与肿瘤细胞的增殖和转移等活动。RGD的此特性可用于为体外构建肿瘤诊断的分子成像探针和用于靶向治疗的药物。基于整合素αvβ3在肿瘤诊断和治疗中所起到的关键性作用,本文对αvβ3的结构功能以及在癌症诊断和治疗中的作用进行简要概述。
关键词 :整合素αvβ3,RGD,肿瘤新生血管,肿瘤诊断,靶向治疗

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肿瘤细胞较强的增殖和转移特性决定了其具有远距离定植的能力。首先,肿瘤细胞在微环境中的扩增是肿瘤细胞局部侵袭的前提,肿瘤细胞与细胞外基质(Extracellular matrix, ECM)通过整合素相互作用给局部扩散提供了条件,肿瘤细胞转移和侵袭的过程须要对ECM沿侵袭方向进行高效的降解。此外,细胞与细胞间可以通过整合素进行持续的“cross-talk”作用,此过程可激活细胞内信号加速肿瘤细胞增殖和向邻近部位的浸润与转移 [1]。ECM是一种蛋白质网络系统,它为细胞和组织提供机械支持,并为内皮细胞转移和构建新血管提供准备。ECM的组成包括组织结构及其调控分子,包括胶原蛋白、纤层粘连蛋白、玻璃粘附蛋白、维连接蛋白等。整合素属于细胞粘附受体家族,其结构是一种跨膜异二聚体,作用是将细胞外基质与细胞骨架进行连接。每种整合素都是各由一个α和β亚基构成,其中α亚基18种,β亚基9种,两个亚基之间的结合方式为非共价连接,共形成24个异二聚体。整合素蛋白结构包括细胞外结构域,单个跨膜区和短细胞质尾,其细胞外结构域对精氨酸–甘氨酸–天冬酰胺(RGD)基序显示出高亲和力,并在整个胞内结构域中传导信号 [2]。当细胞膜上的整合素与ECM相互作用时,它们在膜上发生集聚并结合信号蛋白和肌动蛋白,促进肌动蛋白应激纤维的装配和信号蛋白的激活。整合素αvβ3 (Integrin αvβ3)是整合素家族中重要的成员,因其在肿瘤中的高度表达而成为研究的重点。基于RGD能够特意性结合整合素αvβ3,RGD被大量设计用于肿瘤诊断和治疗的试剂与药物的研究中 [3]。
2. αvβ3的结构与功能
整合素αvβ3是一种ECM受体,由一个125 KDa的αv (CD51)亚基和一个105 KDa的β3 (CD61)亚基组成,又称玻连蛋白(Vitronectin, VN)受体。整合素αvβ3可以与ECM中含有RGD基序的蛋白广泛结合,包括纤连蛋白、纤维蛋白原、血管性血友病因子、玻连蛋白和蛋白水解形式的胶原蛋白和层粘连蛋白。αvβ3的晶体结构大致分为头中尾3部分,最明显的特征是大的椭圆形头部,其中包含主要的亚基间界面(类似于G蛋白上的G/G界面)。αv亚基的胞外域中头部结构为β-propeller结构域,中部结构为Thigh结构域,尾部结构为calf-1和calf-2结构域。β3亚基的胞外域中βΙ结构域构成头部结构,PSI (Plexin/Semaphorin/Integrin)结构域和hybrid结构域构成中部结构,EGF (Epidermal growth factor) 1~4结构域与βTail结构域构成了尾部结构,见图1 [4]。αvβ3与配体的结合和激活依赖于六个二价阳离子的结合位点,它们属于金属离子依赖性结合位点。αvβ3激活时,会逐渐从弯折构象转变到中等亲和性构象,最后达到高亲和性构象,见图2 [5]。αvβ3激活信号途径包括两种形式,即“inside-out”过程及“outside-in”过程。当配体结合后,整合素αvβ3在配体部位发生聚集导致细胞内信号传导的激活,称为“outside-in”信号传导。“inside-out”信号传导则是指胞质内通过整合素尾部与细胞受体结合来控制胞外配体结合活性。这种与配体亲和力大小的改变通常由其构象变化进行调节,主要通过细胞质中黏着斑蛋白与整合素的细胞质尾部的结合来使其向亲和力高的构象转变 [6]。尽管αvβ3与ECM的粘附对于驱动“outside-in”信号是细胞信号内外传导必需的,但证据表明,αvβ3与细胞质中黏着斑蛋白的结合所触发的“inside-out”信号对细胞与ECM的信号交流同样重要。“outside-in”信号可以使下游激酶发生磷酸化修饰,如丝裂原活化蛋白激酶(Mitogen- activated protein kinases, MAPK)、磷酸肌醇激酶(Phosphoinositide 3-kinase, PI3K)和细胞外信号调节激酶(Extracellular signal regulated kinase, ERK),而未被配体结合的αvβ3不具有激活胞内激酶的活性,见图3 [7] [8]。此外,αvβ3还显示出对许多酪氨酸激酶活化受体的亲和力,如表皮生长因子受体和血小板衍生生长因子受体,其激活能够促进乳腺癌、胰腺癌和胶质瘤恶性细胞的增殖 [9]。

Figure 1. Structure of the integrin αvβ3 [10]
图1. 整合素αvβ3的结构 [10]
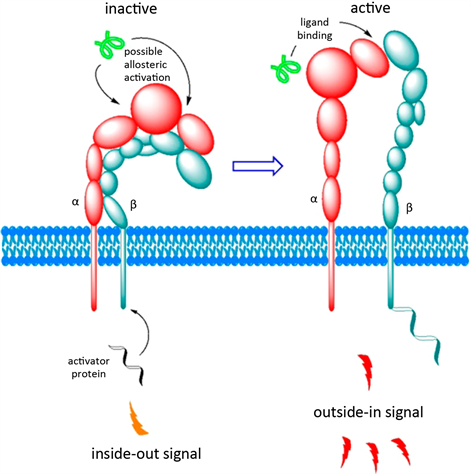
Figure 2. Conformational change of the integrin αvβ3 [5]
图2. 整合素αvβ3的构象变化 [5]

Figure 3. Schematic diagram of the “outside-in” signaling pathway [8]
图3. “outside-in”信号传导途径示意图 [8]
3. 整合素αvβ3与肿瘤细胞
3.1. αvβ3与肿瘤细胞增殖
整合素αvβ3在静息的内皮细胞(Endothelial cell, EC)和其他正常组织中低表达甚至不表达,但在肿瘤细胞和当EC受到VEGF、bFGF和IL-8和其他多种刺激因子的作用下αvβ3的表达上调。
αvβ3介导的信号传导主要参与调节细胞增殖、激活失巢凋亡、诱导整合素介导的死亡和癌细胞获得干细胞特性等过程。肿瘤细胞增殖过程受许多受体调节,αvβ3依赖性激酶可与这些受体所驱动细胞内信号相互作用,从而使αvβ3调控肿瘤细胞的增殖过程 [11]。
肿瘤细胞通过αvβ3对ECM的锚定粘附对于驱动增殖信号至关重要,而未结合的αvβ3导致无法进行细胞内外信号传导 [12]。细胞内信号的激活需要在FAK上聚集αvβ3,然后进行c-Src磷酸化和PI3K的结合并激活,PI3K激活作为一个产生刺激的枢纽。细胞增殖所依赖的FAK/PI3K/AKT磷酸化和细胞存活所依赖的Ras/Raf/MEK/Erk激酶转录都受到PI3K产生的刺激调节 [13]。通过以上信号途径表明,整合素αvβ3在肿瘤细胞存活和细胞增殖活动中发挥着重要的作用。
3.2. αvβ3与肿瘤细胞转移
肿瘤细胞的转移是细胞与远处组织骨架结合的固有特性。αvβ3介导的信号以不同的方式参与肿瘤细胞的转移,包括驱动上皮-间充质转化(Epithelial-mesenchymal transition, EMT)、上调趋化因子的表达、促进肿瘤细胞产生致瘤可溶性因子。EMT是肿瘤细胞发生转移的常用指标,它的产生需要上皮细胞极性丧失和向成纤维细胞样的形态学转变。其纤细的表型指向转移方向,同时上皮细胞标志物E-cadherin表达下调和间质细胞标志物表达上调,如Vimentin、Desmin等。在获得间充质样形态后,肿瘤细胞通过上调几个趋化因子侵袭附近组织 [14]。尿激酶纤溶酶原激活剂(uPA)及其受体(uPAR)的相互作用也参与αvβ3调控的肿瘤细胞转移。另外,αvβ3和蛋白水解酶与金属蛋白酶(Matrix metalloproteinase, MMP)的相互作用也参与调控的肿瘤细胞转移。多种肿瘤模型中,ECM的持续降解主要由uPA/uPAR和MMP相互作用完成 [15]。
这些机制表明在肿瘤细胞的转移过程,αvβ3参与几个途径共同激活并相互作用进行对基质降解。因此,在肿瘤细胞中αvβ3的表达和激活增强了肿瘤细胞的增殖和转移能力,表明靶向于αvβ3可为抑制肿瘤细胞的增殖及转移提供有效的治疗方案。
4. αvβ3与肿瘤诊断
肿瘤被发现时所处的阶段很大程度上决定着病情的发展,若在肿瘤发展的初期阶段就发现病情并及时进行有效的治疗,一定能极大程度上提高肿瘤患者的治愈率或延长生存时间。早期传统的检查方法,很难做到对肿瘤的初期准确诊断。肿瘤新血管生成是肿瘤细胞增殖和转移不可或缺的条件,过程受到整合素αvβ3受体的调节 [16]。αvβ3可促进肿瘤细胞与ECM的粘附,表明αvβ3的表达水平与肿瘤增殖和转移的潜能呈正相关。因此αvβ3成为肿瘤的重要诊断位点 [17]。基于上述中RGD与整合素αvβ3的特异性结合活性,RGD被广泛用于整合素αvβ3高度表达肿瘤的早期诊断中。将RGD肽与放射性示踪剂偶联,可以靶向定位于αvβ3高度表达的肿瘤部位,达到肿瘤的诊断与定位。在过去的研究中,研究者已经使用正电子放射断层造影术(Positron emission tomography, PET)、单正电子发射计算机断层扫描(Single positron emission computed tomography, SPECT)评估了几种用于监测αvβ3表达的含RGD肽拮抗剂。整合素αvβ3受体的分子成像示踪剂可用于肿瘤的诊断。
整合素表达在血管内皮细胞的有腔面和无腔面,介导内皮细胞的迁移和毛细血管管腔的形成。靶向αvβ3的PET示踪剂成像是迄今为止对肿瘤血管生成成像最系统的研究。PET具有很高的灵敏度,可以对皮摩尔浓度的放射性示踪剂进行有效检测 [18]。与PET相比,SPECT的放射性核素更易制备。此外,SPECT成像的获取更方便,通常比用于PET的放射性核素具有较长的半衰期。放射性核素[18F]、[68Ga]、[64Cu]、[125I]、[89Zr]、[99mTC]已成功应用于临床肿瘤血管生成PET显像检测。例如,已经在临床招募乳腺癌、食道癌、淋巴癌和类风湿患者对99mTc-3PRGD2用于SPECT的安全性和诊断性能的评估 [19] [20]。常用的分子示踪剂还有[18F]Galacto-RGD、125I-RGDmPEG、68Ga-NOTA-RGD4、和99mTc-HYNIC-RGD等。OI和MRI很好地补充了上述基于放射性核素技术在活体观察和疾病治疗在生物复杂性方面的劣势。已有大量研究证明将靶向αvβ3的环状RGD肽与光学和磁共振活性分子信标偶联的效用,并有效用于肿瘤相关血管生成的体内外无创成像。
用放射物标记RGD肽使整合素αvβ3成像的临床应用可以用来评估恶性肿瘤的潜在危险,供患者选择抗αvβ3治疗的方案。此外,整合素αvβ3的表达成像是检测抗血管生成药物治疗的有效工具。因为多数形式的治疗方案通常是抑制肿瘤使其生长停止,而不是使瘤块消退。因此,需要很长时间来评估肿瘤生长停滞,仅通过评估肿瘤大小等形态学方面的常规分期方法似乎并不理想。基于αvβ3的血管成像研究具有显著的优势:一方面,RGD肽的放射物标记和光学成像可能成为早期预测非细胞毒性抗血管生成治疗临床反应的工具,以及检测作为血管生成的生物标志物αvβ3来反映和监测肿瘤发展的趋势和药物治疗的效果 [21] ;另一方面,在治疗反应的早期评估之后,整合素αvβ3的成像也可为抗整合素αvβ3靶向治疗中药物剂量的选择提供理论依据。
5. αvβ3与靶向治疗药物
5.1. 单克隆抗体
目前,针对整合素αvβ3的抗体研究主要有斯科利普斯研究协会制备的LM609和美国医学免疫公司的Etaracizumab (伊瑞西珠,Vitaxin II,MEDI-522)以及一些嵌合抗体。其中进入临床研究阶段的只有Etaracizumab。现阶段临床II期已经完成,主要针对的是胃癌、肾癌、黑色素瘤、小肠癌、淋巴瘤和银霄病 [22]。
LM609是斯科利普斯研究协会的Cheresh在1987制备的一种针对人αvβ3受体的小鼠单克隆抗体,与来自兔,鸡和仓鼠的αvβ3具有交叉反应,但不识别小鼠αvβ3受体。LM609的主要抗血管生成机制是通过抑制依赖整合素αvβ3或αvβ5的血管生成途径 [23]。与αv或β3单亚基特异性抗体相比,LM609特异性识别整合素αvβ3异二聚体的能力提高了与其受体结合的活性。然而,因为LM609是小鼠来源的单克隆抗体,其不可避免的存在部分缺陷,例如与人免疫效应细胞的相互作用效率低,其在人体内的免疫原性引起的血清半衰期较短,LM609并未进入临床试验阶段。
Vitaxin是美国医学免疫公司(MedImmune)对LM609进行人源化改造的单克隆抗体,由人IgG1-κ链和LM609的补体结构域组成。Vitaxin能够抑制αvβ3依赖的内皮细胞粘附和转移,临床前试验显示可有效抑制新血管生成抑制肿瘤的生长。Vitaxin I是LM609的第一种人源化形式抗体,又称为MEDI-523,由于稳定性和生产问题,Vitaxin I的临床开发被停止。Etaracizumab又称为MEDI-522和Vitaxin II,是第二代LM609工程化的人源化单克隆抗体,现阶段临床II期已经完成,主要针对的是胃癌、肾癌、黑色素瘤、小肠癌、淋巴瘤和银霄病 [24]。
嵌合c7E3Fab抗体和鼠m7E3F(ab')2抗体也用于阐明整合素αIIbβ3和αvβ3在血管生成、肿瘤生长和转移中的作用。c7E3Fab和m7E3F(ab')2不与鼠整合素αvβ3发生交叉反应,可同样对人肿瘤细胞整合素αvβ3发挥直接阻断作用来抑制肿瘤转移和生长的作用 [25]。
5.2. 多肽与模拟肽拮抗剂
RGD序列最早在20世纪70年代早期被发现为纤连蛋白中的细胞附着位点。后来,该序列被认为是许多天然配体中存在的最小整合素αvβ3受体结合序列,如纤维蛋白原、纤连蛋白、玻连蛋白、纤溶酶原、血小板反应蛋白,凝血酶原、MMP-2、层粘连蛋白、骨桥蛋白等 [26]。RGD是目前设计用来识别αvβ3和其他整合素的基序。
环五肽c[(RGDf(NMe)V)] (EMD-121974,又名Cilengitide)结合αv和β3亚基之间的主要界面,触发细胞信号传导所需的整合素的三级和四级结构重排,包括直接接触配体并稳定配体结合表面的阳离子 [27]。在乳腺癌异种移植模型中,Cilengitide对肿瘤生长有显著的抑制作用,以及在胶质母细胞瘤I期和II期临床研究中也显示出低毒性和良好的抗肿瘤活性,并在治疗头颈部高血管化肿瘤中进入II期临床试验 [28]。Cilengitide成为首个进入III期临床的抗肿瘤整合素抑制剂。
模拟肽是一段含有天然或者合成氨基酸的蛋白样肽链,常设计用来靶标特定蛋白分子诱导肿瘤细胞凋亡。模拟肽可以提供药理学上所需的特性,例如由于使用特异性的肽序列而增加药物的药效持久性、口服生物利用度和靶标粘附性。与肽拮抗剂相比,模拟肽的一个重要优点是它们可被扩展的能力,使得能够对模拟肽文库筛选以确定最有效的拮抗剂。含有RGD基序的模拟肽具有整合素αvβ3拮抗能力,已被证明可阻断不同的病理过程,包括血管生成和血管内皮功能障碍 [29]。
5.3. 基因抑制剂和盐拮抗剂
由于许多关键模型生物的基因组基本已完成测序,基于基因的治疗方法,以特异的核酸序列对特定的基因表达沉默正在成为功能基因组学的强大工具。在癌症治疗中,针对整合素αvβ3及其相关整合素的siRNA治疗可能比那些在蛋白水平上阻断生物功能的整合素拮抗剂更有效,因为基于基因的癌症治疗是选择性抑制mRNA和蛋白水平上的表达 [30]。
近年来,默克公司提交了关于胺盐用作αvβ3抑制剂的一系列专利申请。与作为无定形形式存在的两性离子拮抗剂相比,这些盐对热和光具有更高的化学稳定性。这些盐抑制剂在水中也具有高溶解度,因此它们特别适合于制备需要浓缩型水溶液的鼻内制剂。此外,还使用各种酸基盐来阻断αvβ3表达。另外,默克公司还报道了使用新型链氟化链烷酸衍生物作为αvβ3的抑制剂 [31]。
总体而言,这些类型的αvβ3抑制剂的开发处于早期发展阶段。目前,多家公司已致力于αvβ3的单克隆抗体和小分子αvβ3拮抗剂的研发,其中有多个产品处于临床试验阶段,未来具有巨大的发展潜能。
6. 总结与讨论
靶向肿瘤新生血管整合素αvβ3的显像研究将为肿瘤的诊断、抗肿瘤药物的研发和药效评价提供了参考价值。以整合素αvβ3为靶点的药物也为肿瘤的靶向治疗展示了其他的方向。其中研究最为集中和热门的为含有RGD的多肽和模拟肽,其在肿瘤的分子诊断和靶向治疗中都为研究的重点。含有RGD肽的配体可以有效的与常规化学治疗剂偶联,以提供具有针对各种癌症类型及多药抗性肿瘤的靶向功能的药物递送系统。基于RGD的功能,其还可以为其他新效应成分做递送载体,如治疗性肽和蛋白质、反义或抗原寡核苷酸、siRNA或整个基因。因此,筛选出更高亲和力的整合素αvβ3的配体是一个关键问题。另外,仍然存在一些问题需要重视和优化解决,例如RGD肽介导的药物是否改变药物在细胞内的分布,以及RGD的主动靶向和被动靶向是否互补,最重要的是能否发现更好的靶向配体。肿瘤的诊断和治疗期待着这类新型药物能够在显像剂的选择、显像效果的优化和对肿瘤的靶向治疗中取得更多突破性进展。
文章引用
韩田振,纪雪梅,刘 煜. 整合素αvβ3在肿瘤诊断与治疗中的研究进展
Advances in Research of Integrin αvβ3 in Tu-mor Diagnosis and Treatment[J]. 药物资讯, 2019, 08(03): 79-87. https://doi.org/10.12677/PI.2019.83010
参考文献
- 1. Madrazo, E., Conde, A.C. and Redondo-Munoz, J. (2017) Inside the Cell: Integrins as New Governors of Nuclear Alterations? Can-cers, 9, 82. https://doi.org/10.3390/cancers9070082
- 2. Schips, T.G., Vanhoutte, D., Vo, A., et al. (2019) Thrombospondin-3 Augments Injury-Induced Cardiomyopathy by Intracellular Integrin Inhibition and Sarcolemmal Instability. Nature Communications, 10, 76. https://doi.org/10.1038/s41467-018-08026-8
- 3. Niu, J. and Li, Z. (2017) The Roles of Integrin Alphavbeta6 in Cancer. Cancer Letters, 403, 128-137. https://doi.org/10.1016/j.canlet.2017.06.012
- 4. Xiong, J.P., Stehle, T., Diefenbach, B., et al. (2001) Crystal Structure of the Extracellular Segment of Integrin Alpha Vbeta3. Science, 294, 339-345. https://doi.org/10.1126/science.1064535
- 5. Holtke, C. (2018) isoDGR-Peptides for Integrin Targeting: Is the Time Up for RGD? Journal of Medicinal Chemistry, 61, 7471-7473. https://doi.org/10.1021/acs.jmedchem.8b01123
- 6. Guo, J., Zhang, Y., Li, H., et al. (2018) Intramembrane Ionic Protein-Lipid Interaction Regulates Integrin Structure and Function. PLoS Biology, 16, e2006525. https://doi.org/10.1371/journal.pbio.2006525
- 7. Zoppi, N., Chiarelli, N., Ritelli, M., et al. (2018) Multifaced Roles of the αvβ3 Integrin in Ehlers-Danlos and Arterial Tortuosity Syndromes’ Dermal Fibroblasts. International Journal of Molecular Sciences, 19, pii: E982. https://doi.org/10.3390/ijms19040982
- 8. Sun, C.C., Qu, X.J. and Gao, Z.H. (2016) Arginine-Glycine-Aspartate-Binding Integ-rins as Therapeutic and Diagnostic Targets. American Journal of Therapeutics, 23, e198-e207. https://doi.org/10.1097/MJT.0000000000000053
- 9. Streuli, C.H. and Akhtar, N. (2009) Signal Co-Operation between Integ-rins and Other Receptor Systems. The Biochemical Journal, 418, 491-506. https://doi.org/10.1042/BJ20081948
- 10. Temming, K., Schiffelers, R.M., Molema, G., et al. (2005) RGD-Based Strategies for Selective Delivery of Therapeutics and Imaging Agents to the Tumour Vasculature. Drug Resistance Updates: Reviews and Commentaries in Antimicrobial and Anticancer Chemotherapy, 8, 381-402. https://doi.org/10.1016/j.drup.2005.10.002
- 11. Hsieh, M.T., Wang, L.M., Changou, C.A., et al. (2017) Crosstalk be-tween Integrin αvβ3 and ERalpha Contributes to Thyroid Hormone-Induced Proliferation of Ovarian Cancer Cells. Oncotarget, 8, 24237-24249. https://doi.org/10.18632/oncotarget.10757
- 12. Cheresh, D.A. and Stupack, D.G. (2002) Integrin-Mediated Death: An Explana-tion of the Integrin-Knockout Phenotype? Nature Medicine, 8, 193-194. https://doi.org/10.1038/nm0302-193
- 13. Aoudjit, F. and Vuori, K. (2001) Matrix Attachment Regulates Fas-Induced Apoptosis in Endothelial Cells: A Role for c-Flip and Implications for Anoikis. The Journal of Cell Biology, 152, 633-643. https://doi.org/10.1083/jcb.152.3.633
- 14. Fidler, I.J. (2003) The Pathogen-esis of Cancer Metastasis: The “Seed and Soil” Hypothesis Revisited. Nature Reviews Cancer, 3, 453-458. https://doi.org/10.1038/nrc1098
- 15. Van Der Pluijm, G., Sijmons, B., Vloedgraven, H., et al. (2001) Uroki-nase-Receptor/Integrin Complexes Are Functionally Involved in Adhesion and Progression of Human Breast Cancer in Vivo. The American Journal of Pathology, 159, 971-982. https://doi.org/10.1016/S0002-9440(10)61773-7
- 16. Kubas, H., Schafer, M., Bauder-Wust, U., et al. (2010) Multivalent Cyclic RGD Ligands: Influence of Linker Lengths on Receptor Binding. Nuclear Medicine and Biology, 37, 885-891. https://doi.org/10.1016/j.nucmedbio.2010.06.005
- 17. Desgrosellier, J.S. and Cheresh, D.A. (2010) Integrins in Cancer: Biological Implications and Therapeutic Opportunities. Nature Reviews Cancer, 10, 9-22. https://doi.org/10.1038/nrc2748
- 18. Beer, A.J. and Schwaiger, M. (2011) PET Imaging of αvβ3 Expression in Cancer Patients. Methods in Molecular Biology, 680, 183-200. https://doi.org/10.1007/978-1-60761-901-7_13
- 19. Chen, Z., Fu, F., Li, F., et al. (2018) Comparison of [(99m)Tc]3PRGD2 Imaging and [(18)F]FDG PET/CT in Breast Cancer and Expression of Integrin αvβ3 in Breast Cancer Vascular Endothelial Cells. Molecular Imaging and Biology, 20, 846-856. https://doi.org/10.1007/s11307-018-1178-y
- 20. Lv, N., Gao, S., Bai, L., et al. (2019) Advantages of (99m)Tc-3PRGD2 SPECT over CT in the Preoperative Assessment of Lymph Node Metastasis in Patients with Esophageal Cancer. Annals of Nuclear Medicine, 33, 39-46. https://doi.org/10.1007/s12149-018-1300-x
- 21. O’connor, J.P., Jackson, A., Parker, G.J., et al. (2007) DCE-MRI Biomarkers in the Clinical Evaluation of Antiangiogenic and Vascular Disrupting Agents. British Journal of Cancer, 96, 189-195. https://doi.org/10.1038/sj.bjc.6603515
- 22. Hersey, P., Sosman, J., O’day, S., et al. (2010) A Randomized Phase 2 Study of Etaracizumab, a Monoclonal Antibody against Integrin alpha(v)beta(3), + or − Dacarbazine in Patients with Stage IV Metastatic Mela-noma. Cancer, 116, 1526-1534. https://doi.org/10.1002/cncr.24821
- 23. Borst, A.J., James, Z.M., Zagotta, W.N., et al. (2017) The Therapeutic Antibody LM609 Selectively Inhibits Ligand Binding to Human αvβ3 Integrin via Steric Hindrance. Structure, 25, 1732-9.e5. https://doi.org/10.1016/j.str.2017.09.007
- 24. Gutheil, J.C., Campbell, T.N., Pierce, P.R., et al. (2000) Targeted Antiangiogenic Therapy for Cancer Using Vitaxin: A Humanized Monoclonal Antibody to the Integrin αvβ3. Clinical Cancer Research, 6, 3056-3061.
- 25. Trikha, M., Zhou, Z., Timar, J., et al. (2002) Multiple Roles for Platelet GPIIb/IIIa and αvβ3 Integrins in Tumor Growth, Angiogenesis, and Metastasis. Cancer Research, 62, 2824-2833.
- 26. Sheldrake, H.M. and Patterson, L.H. (2009) Function and Antagonism of beta3 Integrins in the Development of Cancer Therapy. Current Cancer Drug Targets, 9, 519-540. https://doi.org/10.2174/156800909788486713
- 27. Xiong, J.P., Stehle, T., Zhang, R., et al. (2002) Crystal Structure of the Ex-tracellular Segment of Integrin Alpha Vbeta3 in Complex with an Arg-Gly-Asp Ligand. Science, 296, 151-155. https://doi.org/10.1126/science.1069040
- 28. Zhang, L., Gulses, A., Purcz, N., et al. (2019) A Comparative Assessment of the Effects of Integrin Inhibitor Cilengitide on Primary Culture of Head and Neck Squamous Cell Carcinoma (HNSCC) and HNSCC Cell Lines. Clinical & Translational Oncology. https://doi.org/10.1007/s12094-018-02025-3
- 29. Kumar, C.C., Malkowski, M., Yin, Z., et al. (2001) Inhibition of Angiogenesis and Tumor Growth by SCH221153, a Dual alpha(v)beta3 and alpha(v)beta5 Integrin Re-ceptor Antagonist. Cancer Research, 61, 2232-2238.
- 30. Chu, J.J. and Ng, M.L. (2004) Interaction of West Nile Virus with αvβ3 Integrin Mediates Virus Entry into Cells. The Journal of Biological Chemistry, 279, 54533-54541. https://doi.org/10.1074/jbc.M410208200
- 31. Hsu, A.R., Veeravagu, A., Cai, W., et al. (2007) Integrin αvβ3 Antagonists for Anti-Angiogenic Cancer Treatment. Recent Patents on Anti-Cancer Drug Discovery, 2, 143-158. https://doi.org/10.2174/157489207780832469