Hans Journal of Food and Nutrition Science
Vol.05 No.03(2016), Article ID:18337,9
pages
10.12677/HJFNS.2016.53014
Preventive and Therapeutic Effects of Nitric Oxide and Natural Antioxidants on Alzheimer’s Disease
Mengyuan Chen1*, Juan Zhang2*, Chao Li1, Zhixian Zhang3, Li Xu3, Qiang Liu2#, Yan Zhao1#
1Department of Bioengineering, Harbin Institute of Technology at Weihai, Weihai Shandong
2CAS Key Laboratory of Brain Function and Disease, School of Life Science, University of Science and Technology of China, Hefei Anhui
3College of Life Science, Jilin University, Changchun Jilin

Received: Aug. 1st, 2016; accepted: Aug. 15th, 2016; published: Aug. 18th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In this study, the preventive and therapeutic potential of nitric oxide (NO) and natural antioxidants on Alzheimer’s disease (AD) were studied using transgenic cells and C. elegans models. It was found that low concentration of NO protected neuronal cells by reducing the production of reactive oxygen species (ROS). In contrast, high concentration of NO aggravated the cell damage by producing more ROS. Low concentration of NO and natural antioxidant could protect C. elegans against paralysis induced by expression of transgenic Abeta gene. It was found that a formulation of L-arginine and natural antioxidants increased the viability of N
Keywords:Nitric Oxide, Natural Antioxidants, Alzheimer’s Disease, Reactive Oxygen Species

一氧化氮和天然抗氧化剂对阿尔茨海默症的潜在防治作用
陈梦媛1*,张娟2*,李超1,张智贤3,徐力3,刘强2#,赵燕1#
1哈尔滨工业大学(威海)生物工程系,山东 威海
2中国科学技术大学生命科学学院,中科院脑功能与脑疾病重点实验室,安徽 合肥
3吉林大学生命科学学院,吉林 长春

收稿日期:2016年8月1日;录用日期:2016年8月15日;发布日期:2016年8月18日

摘 要
本文以转基因细胞和线虫体系为模型,研究了一氧化氮(nitric oxide, NO)和天然抗氧化剂的合理搭配组合对阿尔茨海默症(Alzheimer’s disease, AD)的防治作用。结果发现,低浓度的NO可以通过降低细胞内活性氧的水平保护神经细胞,防止APPsw和ApoE4过量表达引起的损伤作用;而高浓度的NO可以通过增强活性氧(reactive oxygen species, ROS)的产生加剧神经细胞损伤。适量NO和天然抗氧化剂都对Abeta转基因诱导的线虫瘫痪行为具有抑制作用。NO和天然抗氧化剂的合理搭配组合既可以通过显著清除ROS抑制ApoE4和APPsw转基因引起的细胞活力降低,又可以更好的延缓Abeta转基因诱导的线虫瘫痪行为。这些结果说明,NO和天然抗氧化剂合理搭配可以在AD细胞和线虫模型中抑制转基因引起的细胞和线虫的损伤,有可能对AD具有一定的防治作用。
关键词 :一氧化氮,天然抗氧化剂,阿尔茨海默症,活性氧

1. 引言
阿尔茨海默症(Alzheimer’s disease, AD)是最常见的神经退行性疾病之一,多发于老年。其主要病理特征是患者大脑中出现以β-淀粉样蛋白(β-amyloid protein, Abeta)为主要成分的老年斑和异常磷酸化的tau蛋白形成的神经纤维缠绕(neurofibrillary tangles, NFTs)以及神经元缺失 [1] 。AD患者的认知、动作等一系列高级神经功能逐渐发生障碍,最终丧失生活自理能力。随着全球人口的老龄化,AD的患病几率在世界各地都持续增长。在美国,AD已成为65岁以上人群的第五大致死因素。我国已经进入老龄化社会,近年来,患AD的人数也显著增加,据统计,年龄在60岁以上的人当中约有1.6%被诊断为AD,并且这个比例正在逐年升高。对AD病人的护理和治疗已给家庭和社会带来越来越沉重的精神压力和经济负担,成为人们面临的一个严峻的医疗和社会问题 [2] [3] 。然而,目前并没有可以有效治愈AD的药物。因此,如何预防和延缓AD的发病时间,不仅是医疗工作者的责任,也是科学研究和健康战线的一个艰巨任务。
一氧化氮(nitric oxide, NO),也被称为内皮细胞松弛因子,由NO合成酶(nitric oxide synthase, NOS)转化L-精氨酸(L-arginine, L-Arg)生成。除了调节血管扩张,NO在免疫反应、炎症和血小板凝集等体内一系列重要生理过程中发挥作用。此外,NO是中枢神经系统的一个重要的信号分子,与认知功能、痛觉感受和神经分泌调节等过程紧密相关 [4] 。研究表明,当浓度适量时,NO具有神经保护作用。事实上,有研究发现,以NO供体DETA-NONOate处理大鼠皮质神经元可以降低氧化应激诱导的神经元凋亡 [5] 。而在神经细胞过量表达神经元型NO合成酶(neuronal nitric oxide synthase, nNOS)或补充外源NO能够抑制血清移除诱导的神经细胞凋亡 [6] 。但是,当NO的生成失去控制,过量的NO被认为是导致神经毒性和病理的主要分子之一。在神经元中,NO可以和超氧化物反应形成过氧化亚硝酸盐,直接或间接促进氧化应激和亚硝化应激,最终导致神经元细胞活性的降低 [7] 。氧化应激和亚硝化应激在AD病理发生和发展中起到非常重要的作用。因此,NO的大量产生可能对AD病理具有促进的作用。而避免NO大量生成的同时维持细胞内适量的NO水平可能有益于抑制AD的病理机制。
研究发现,天然抗氧化剂可以清除缺血再灌注损伤时产生的氧自由基,调节和促进NO自由基产生,降低缺血再灌注损伤,保护心肌和脑组织 [8] - [10] 。L-Arg和天然抗氧化剂合理搭配形成一个NO和天然抗氧化剂的合理搭配组合后,可在细胞体系和动物组织体系中,既产生一定量的NO,又可以清除活性氧(reactive oxygen species, ROS),保护细胞和组织,在缺血再灌注模型中抑制氧化应激并降低组织损伤 [11] 。在本研究中,我们利用AD转基因细胞和线虫模型,探讨了一个L-Arg和天然抗氧化剂的合理搭配组合对AD的预防和延缓作用。结果显示,在细胞模型中,这个L-Arg和天然抗氧化剂合理搭配组合能够清除细胞产生的氧自由基,对细胞活性有明显保护作用;在线虫体系模型中,这个组合可以延缓Abeta转基因诱导的毒性作用。
2. 材料和方法
2.1. 实验材料
L-Arg, sodium nitroprusside (SNP)和diethylenetriamine/nitric oxide (DETA/NO)购自Sigma Chemical (St. Louis, MO, USA)。山楂提取物、知母提取物和虾青素购自西安清乐生物科技有限公司。Dulbecco’s modified eagle’s medium (DMEM)购自Invitrogen (Eugene, OR, USA)。胎牛血清和青霉素-链霉素双抗购自Thermo Scientific (Rockford, IL, USA)。ROS检测试剂盒购自Beyotime Institute of Biotechnology (Haimen, China).
2.2. 细胞培养和处理
N
2.3. 线虫的培养和处理
AD线虫模型CL2006和GMC101的肌肉细胞表达人类Abeta42,表型为出现肌肉麻痹和渐行性瘫痪。其中GMC101为温度诱导型。AD线虫在长有E. coli OP50的nematode growth medium (NGM)培养基(3 mg/ml NaCl,2.5 mg/ml胰蛋白胨,17 mg/ml琼脂,1 mM CaCl2,5 mg/ml胆固醇,1 mM MgSO4,25 mM K3PO4缓冲液)上培养和传代直至实验,培养温度为
2.4. 统计分析
Abeta诱导的麻痹作用以Kaplan-Meier log-rank test分析。其它数据以one-way或two-way ANOVA进行检测。P < 0.05被认为有显著性差异。
3. 结果
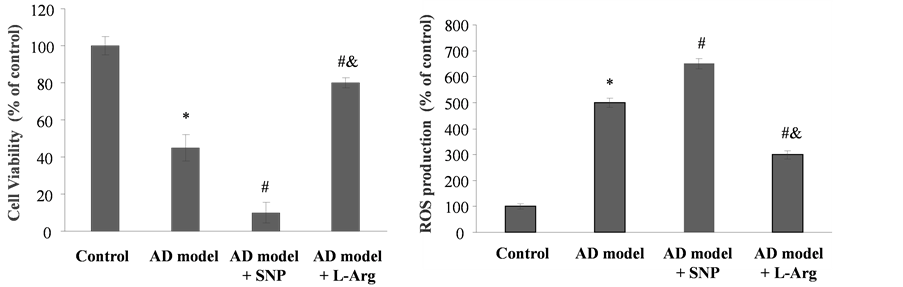
3.1. 不同浓度NO对AD细胞模型中细胞活性和活性氧生成的影响
首先,我们利用稳定转入ApoE4和APPsw的N
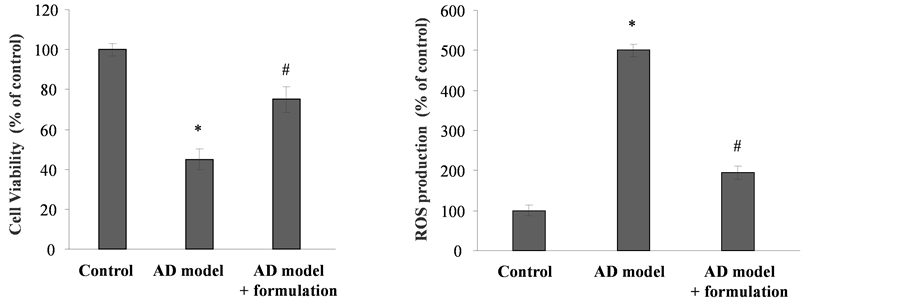
3.2. L-Arg和天然抗氧化剂合理搭配组合对细胞活性和ROS的作用
当以一个L-Arg和天然抗氧化剂的搭配组合处理AD细胞模型时,与未处理AD细胞相比,细胞活性有非常明显的升高(图2(a)),说明此L-Arg和天然抗氧化剂的搭配组合能够明显减弱AD细胞模型的细胞毒性。如图2(b)所示,L-Arg和天然抗氧化剂的合理搭配组合降低了AD细胞内的ROS水平,与AD细胞相比,细胞内ROS水平减少了大约2.5倍。以上结果显示,L-Arg和天然抗氧化剂的合理搭配组合可以显著降低AD细胞内ROS水平并对细胞具有保护作用。
 (a) (b)
(a) (b)
Figure 1. Effects of SNP and L-Arg on cell viability and ROS production. Cells were treated with SNP (
图1. NO供体SNP以及L-Arg对AD细胞模型细胞活性及ROS水平的作用。NO供体SNP (
 (a)(b)
(a)(b)
Figure 2. Effects of NO and natural antioxidants formulation on cell viability and ROS production. Cells were treated with the formulation for 24 h. (a) Cell viability was analyzed by MTT. (b) Intracellular ROS levels were determined. Control: N
图2. NO和天然抗氧化剂合理搭配组合对AD细胞模型的保护作用及其对AD细胞模型活性氧生成的清除作用。NO和天然抗氧化剂的合理搭配组合处理细胞24 h后用MTT法检测细胞活力(a)和细胞内ROS水平(b)。Control:对照N
3.3. NO对Abeta诱导的瘫痪行为的作用
接下来,我们利用AD转基因线虫模型GMC101研究了NO在动物体内对Abeta毒性的作用。如图3,以不同浓度的NO供体DETA/NO处理同步化至L4的GMC101线虫,结果显示,Abeta转基因的表达诱导AD转基因线虫出现麻痹现象,而不同浓度的DETA都对Abeta诱导的线虫瘫痪病理行为具有不同程度的抑制作用。其中,1 mM的抑制效果最好。这一结果显示适量浓度的NO可能对Abeta诱导的病理行为具有抑制作用。
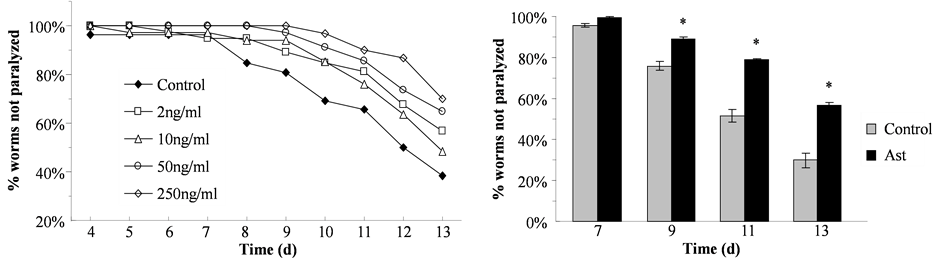
3.4. 天然抗氧化剂虾青素对Abeta诱导的瘫痪行为的作用
虾青素是一种脂溶性天然抗氧化剂,可以有效清除ROS。为了测试天然抗氧化剂对AD线虫模型中Abeta诱导的瘫痪行为的作用,我们利用AD转基因线虫模型CL2006检测了虾青素对Abeta毒性的作用。同步化至L4的AD转基因线虫模型CL2006线虫被转移到加入不同浓度虾青素的培养基上培养,在第4~13天每天检测瘫痪线虫的数目。实验结果发现,在不同浓度虾青素培养基上培养的线虫与在溶剂对照培养基上培养的线虫相比,发生瘫痪的比例均有所降低。其中,250 ng/ml的虾青素对线虫瘫痪的抑制作用最强(图4(a))。在第11和13天时,在250 ng/ml虾青素和对照培养基上培养的线虫的非瘫痪率分别为78.94%和51.59%,以及56.76%和29.84%。此结果显示虾青素处理对Abeta诱导的瘫痪病理行为具有显著的抑制作用(图4(b))。
3.5. L-Arg和天然抗氧化剂合理搭配组合对Abeta诱导瘫痪行为的作用
接下来我们利用AD转基因线虫模型检测了上述L-Arg和天然抗氧化剂的合理搭配组合对Abeta诱导的瘫痪行为的作用。实验结果发现,在加入L-Arg和天然抗氧化剂合理搭配组合的培养基上培养的CL2006线虫与在溶剂对照培养基上培养的线虫相比,发生瘫痪的比例均有所降低(图5)。其中,100 ng/ml对线虫瘫痪的抑制作用最强。这一结果显示L-Arg和天然抗氧化剂的合理搭配组合对Abeta诱导的毒性具有有效的抑制作用。

Figure 3. Effect of DETA on Abeta-induced paralysis in C. elegans. Worms synchronized to L4 stage were transferred to plates with different concentrations of DETA (0, 0.1, 1 and 10 mM). Transgenic Abeta was induced 4 hs later and the number of the paralyzed worms was counted 18 hs later
图3. 不同浓度NO供体DETA对Abeta诱导的AD转基因线虫的瘫痪病理行为的影响。同步化至L4的AD转基因线虫GMC101被转移到加入不同浓度DETA (0、0.1、1和10 mM)的培养基上培养,4小时后将线虫置于
 (a)(b)
(a)(b)
Figure 4. Effect of astaxanthin on Abeta-induced paralysis in C. elegans. (a) CL2006 worms synchronized to L4 stage were transferred to plates with different concentrations of astaxanthin (0, 2, 10, 50 and 250 ng/ml). The number of paralyzed worms was counted from 4 to 13 d. (b) Synchronized CL2006 worms were cultured on plates with or without 250 ng/ml astaxanthin and the number of paralyzed worms was counted on d 7, 9, 11 and 13. Ast: worms treated with Ast. *significantly different from untreated worms, P < 0.05
图4. 不同浓度虾青素抑制Abeta诱导的AD 转基因线虫的瘫痪病理行为。(a) 同步化至L4的AD转基因线虫模型CL2006线虫被转移到加入不同浓度虾青素(0、2、10、50和250 ng/ml)的OP50大肠杆菌培养基上培养,在第4~13天每天检测瘫痪线虫的数目。(b) 同步化的CL2006线虫在加入250 ng/ml虾青素的OP50大肠杆菌培养基上培养,在不同时间检测瘫痪线虫的数目。Ast:线虫以虾青素处理。*与不经虾青素处理的control线虫相比有显著差异,P < 0.05

Figure 5. Effect of NO and natural antioxidants formulation on Abeta-induced paralysis in C. elegans. CL2006 worms synchronized to L4 stage were transferred to plates with different concentrations (0, 100, 500, 1000 and 2500 ng/ml) of the formulation. The number of paralyzed worms was counted from 5 to 13 d
图5. 不同浓度NO和天然抗氧化剂合理搭配组合抑制Abeta诱导的AD转基因线虫瘫痪病理行为。同步化的CL2006线虫在加入不同浓度的NO和天然抗氧化剂的合理搭配组合(0、100、500、1000和2500 ng/ml)的培养基上培养,在第5~13天检测瘫痪线虫的数目
4. 讨论
NO在生物体内承担着重要的生物功能。作为内皮细胞松驰因子,NO起到舒张血管调节血压的作用 [12] [13] 。同时,NO是一个重要的细胞信号,具有神经生理及神经保护作用,特别是在神经生存和分化中发挥着重要作用 [4] [14] 。NO可以通过调节神经前体细胞增殖和促进神经细胞分化保护神经细胞。研究表明,NO可以抑制氧化应激和生长因子移除诱导的神经细胞毒性 [5] [6] 。但NO的生物效应具有两面性,除具有神经生理及神经保护作用外,当它在脑中以高浓度产生时,可以介导一系列神经病理过程,如神经退行性疾病、炎症及脑缺血-再灌注损伤等 [14] [15] 。
实验中所用L-Arg和天然抗氧化剂的组合配方中的抗氧化剂包括虾青素、知母宁和山楂提取物。虾青素(3,
本研究的实验结果表明,低浓度的NO可以通过清除活性氧保护神经细胞,防止AD基因过量表达造成的细胞损伤作用;而高浓度的NO可以通过增强活性氧产生加剧神经细胞损伤。适量NO和天然抗氧化剂都对AD线虫模型中Abeta诱导的病理特征具有较好的抑制作用。而当NO合成酶底物L-Arg和上述天然抗氧化剂进行合理搭配后,所形成的配方既可以延缓由Abeta转基因引起的线虫瘫痪病理行为,又可以显著抑制由于过量表达ApoE4和APPsw转基因造成的ROS水平升高和细胞活性降低。实验表明,由L-Arg和天然抗氧化剂合理搭配组合所形成的配方在细胞体系和组织体系中,既可以产生一定量的NO,又可以清除氧自由基 [11] 。因此,L-Arg和天然抗氧化剂合理搭配组合对于AD细胞及动物模型的保护作用可能与其可以适度增加NO的产生和降低ROS水平相关。而维持大脑内适度的NO水平及氧化还原平衡对保护大脑功能,预防和延缓AD病理发展具有重要意义。所以L-Arg和天然抗氧化剂的合理搭配组合可能对降低AD风险和推迟AD发病时间具有一定的作用。
此外,由于AD是多因素疾病,除了调控氧化还原平衡,抑制Abeta毒性及促进神经细胞存活,NO和天然抗氧化剂的搭配组合还有可能通过其它机制如抑制炎症 [26] 和调节整体健康等发挥作用。本研究结果为研发预防AD发病和延缓AD病理发展的功能食品和药物提供了有价值的参考。
致谢
本工作感谢国家自然科学基金项目(81422015, 91332111, 31371087, 31201338),国家重点基础研究发展计划(2014CB548100),中组部青年千人计划(刘强),山东省重点研发计划(2015GSF115014),威海市科技发展计划项目(2009-3-93),中国科学技术大学启动基金的支持。
文章引用
陈梦媛,张 娟,李 超,张智贤,徐 力,刘 强,赵 燕. 一氧化氮和天然抗氧化剂对阿尔茨海默症的潜在防治作用
Preventive and Therapeutic Effects of Nitric Oxide and Natural Antioxidants on Alzheimer’s Disease[J]. 食品与营养科学, 2016, 05(03): 105-113. http://dx.doi.org/10.12677/HJFNS.2016.53014
参考文献 (References)
- 1. Querfurth, H.W. and La Ferla, F.M. (2010) Alzheimer’s Disease. The New England Journal of Medicine, 362, 329- 344. http://dx.doi.org/10.1056/NEJMra0909142
- 2. Ferri, C.P., Prince, M., Brayne, C., Brodaty, H., Fratiglioni, L., Ganguli, M., Hall, K., Hasegawa, K., Hendrie, H., Huang, Y., Jorm, A., Mathers, C., Menezes, P.R., Rimmer, E., Scazufca, M., Alzheimer’s Dis-ease International (2005) Global Prevalence of Dementia: A Delphi Consensus Study. The Lancet, 366, 2112-2117. http://dx.doi.org/10.1016/S0140-6736(05)67889-0
- 3. Dong, M.J., Peng, B., Lin, X.T., Zhao, J., Zhou, Y.R. and Wang, R.H. (2007) The Prevalence of Dementia in the People’s Republic of China: A Systematic Analysis of 1980-2004 Studies. Age Ageing, 36, 619-624. http://dx.doi.org/10.1093/ageing/afm128
- 4. Guix, F.X., Uribesalgo, I., Coma, M. and Muñoz, F.J. (2005) The Physiology and Pathophysiology of Nitric Oxide in the Brain. Progress in Neurobiology, 76, 126-152. http://dx.doi.org/10.1016/j.pneurobio.2005.06.001
- 5. Fernandez-Tome, P., Lizasoain, I., Leza, J.C., Lorenzo, P. and Moro, M.A. (1999) Neuroprotective Effects of, a Nitric Oxide Donor, on Hydrogen Peroxide-Induced Neurotoxicity in Cortical Neurones. Neuropharmacology, 38, 1307- 1315. http://dx.doi.org/10.1016/S0028-3908(99)00069-6
- 6. Ciani, E., Guidi, S., Della Valle, G., Perini, G., Bartesaghi, R. and Contestabile, A. (2002) Nitric Oxide Protects Neuroblastoma Cells from Apoptosis Induced by Serum Deprivation through cAMP-Response Element-Binding Protein (CREB) Activation. The Journal of Biological Chemistry, 277, 49896-49902. http://dx.doi.org/10.1074/jbc.M206177200
- 7. Fatokun, A.A., Stone, T.W. and Smith, R.A. (2008) Prolonged Exposures of Cerebellar Granule Neurons to S-Nitroso- N-Acetylpenicillamine (SNAP) Induce Neuronal Damage Independently of Peroxynitrite. Brain Research, 1230, 265- 272. http://dx.doi.org/10.1016/j.brainres.2008.06.109
- 8. Shen, J., Wang, J., Zhao, B., Hou, J., Gao, T. and Xin, W. (1998) Effects of EGb-761 on Nitric Oxide, Oxygen Free Radicals, Myocardial Damage and Arrhythmias in Ischemia-Reperfusion Injury in Vivo. Biochimica et Biophysica Acta, 1406, 228-236. http://dx.doi.org/10.1016/S0925-4439(98)00007-6
- 9. Shen, J., Li, M., Xin, W. and Zhao, B. (2000) Effects of Chinonin on Nitric Oxide Free Radical, Myocardial Damage and Arrhythmia in Ischemia-Reperfusion Injury in Vivo. Applied Magnetic Resonance, 19, 9-19. http://dx.doi.org/10.1007/BF03162257
- 10. Zhang, D. and Zhao, B. (2004) Oral Administration of Crataegus Extraction Protects against Ischemia/Reperfusion Brain Damage in the Mongolian Gerbils. Journal of Neurochemistry, 90, 211-219. http://dx.doi.org/10.1111/j.1471-4159.2004.02480.x
- 11. Zhao, B. (2015) “Double Edge” Effects of Nitric Oxide Free Radical in Cardio-Brain-Vascular Diseases and Health Studied by ESR. Chinese Journal of Magnetic Resonance, 32, 195-207.
- 12. Palmer, R.M., Ferrige, A.G. and Moncada, S. (1987) Nitric Oxide Release Accounts for the Biological Activity of Endothelium-Derived Relaxing Factor. Nature, 327, 524-526. http://dx.doi.org/10.1038/327524a0
- 13. Furchgott, R.F. and Vanhoutte, P.M. (1989) Endothelium-Derived Relaxing and Contracting Factors. The FASEB Journal, 3, 2007-2018.
- 14. Contestabile, A. and Ciani, E. (2004) Role of Nitric Oxide in the Regulation of Neuronal Proliferation, Survival and Differentiation. Neurochemistry International, 45, 903-914. http://dx.doi.org/10.1016/j.neuint.2004.03.021
- 15. Calabrese, V., Mancuso, C., Calvani, M., Rizzarelli, E., Butterfield, D.A. and Stella, A.M. (2007) Nitric Oxide in the Central Nervous System: Neuroprotection versus Neurotoxicity. Nature Reviews Neuroscience, 8, 766-775. http://dx.doi.org/10.1038/nrn2214
- 16. Higuera-Ciapara, I., Felix-Valenzuela, L. and Goycoolea, F. (2006) Astaxanthin: A Review of Its Chemistry and Applications. Critical Reviews in Food Science and Nutrition, 46, 185-196. http://dx.doi.org/10.1080/10408690590957188
- 17. Ikeda, Y., Tsuji, S., Satoh, A., Ishikura, M., Shirasawa, T. and Shimizu, T. (2008) Protective Effects of Astaxanthin on 6-Hydroxydopamine-Induced Apoptosis in Human Neuroblastoma SH-SY5Y Cells. Journal of Neurochemistry, 107, 1730-1740. http://dx.doi.org/10.1111/j.1471-4159.2008.05743.x
- 18. Chang, C., Chen, C., Chiou, J., Peng, R. and Peng, C. (2010) Astaxanthine Secured Apoptotic Death of PC12 Cells Induced by Beta-Amyloid Peptide 25-35: Its Molecular Action Targets. Journal of Medicinal Food, 13, 548-556. http://dx.doi.org/10.1089/jmf.2009.1291
- 19. Shen, H., Kuo, C., Chou, J., Delvolve, A., Jackson, S.N., Post, J., Woods, A.S., Hoffer, B.J., Wang, Y. and Harvey, B.K. (2009) Astaxanthin Reduces Ischemic Brain Injury in Adult Rats. The FASEB Journal, 23, 1958-1968. http://dx.doi.org/10.1096/fj.08-123281
- 20. Al Makdessi, S., Sweidan, H., Dietz, K. and Jacob, R. (1999) Protective Effect of Crataegus Oxyacantha against Reperfusion Arrhythmias after Global No-Flow Ischemia in the Rat Heart. Basic Research in Cardiology, 94, 71-77. http://dx.doi.org/10.1007/s003950050128
- 21. Petkov, E., Nikolov, N. and Uzunov, P. (1981) Inhibitory Effect of Some Fla-vonoids and Falvonoid Mixtures on Cyclic Amp Phosphodiesterase Activity of Rat Heart. Planta Medica, 43,183-186. http://dx.doi.org/10.1055/s-2007-971497
- 22. Li, L.D., Li, Y.G., Gao, F.H., Liu, Z., Zhang, J. and Yu, L. (1984) Studies on Hawthorn and Its Active Principle. II. Effects on Cultured Rat Heart Cells Deprived of Oxygen and Glucose. Journal of Traditional Chinese Medicine, 4, 289-292.
- 23. Walker, A.F., Marakis, G., Morris, A.P. and Robinson, P.A. (2002) Promising Hypotensive Effect of Hawthorn Extract: A Randomized Double-Blind Pilot Study of Mild, Essential Hypertension. Phytotherapy Research, 16, 48-54. http://dx.doi.org/10.1002/ptr.947
- 24. Zhao, B., Shen, J., Li, M., Li, M., Wan, Q. and Xin, W. (1996) Scavenging Effect of Chinonin on NO and Oxygen Free Radicals and Its Protective Effect on the Myocardium from the Injury of Ischemia-Reperfusion. Biochimica et Biophysica Acta, 1315, 131-137. http://dx.doi.org/10.1016/0925-4439(95)00112-3
- 25. Shen, J.G., Guo, X.S., Jiang, B., Li, M., Xin, W. and Zhao, B. (2000) Chinonin, a Novel Drug against Cardiomyocyte Apoptosis Induced by Hypoxia and Reoxygenation. Biochimica et Biophysica Acta, 1500, 217-226. http://dx.doi.org/10.1016/S0925-4439(99)00109-X
- 26. Coleman, J.W. (2001) Nitric Oxide in Immunity and Inflammation. International Immunopharmacology, 1, 1397- 1406. http://dx.doi.org/10.1016/S1567-5769(01)00086-8
*共同第一作者。
#通讯作者。