Hans Journal of Food and Nutrition Science
Vol.06 No.02(2017), Article ID:20716,10
pages
10.12677/HJFNS.2017.62010
A Acute Toxicity Study of Cordyceps cicadae Mycelium in ICR Mice and SD Rats
Minyi Lin1, Juihsia Hsu1, Jiajiu Wu2, Chun-Han Shih3, Chinchu Chen1,4,5,6*
1Grape King Bio Ltd., Taoyuan Taiwan
2Food Industry Research and Development Institute, Hsinchu Taiwan
3Quest Pharmaceutical Services, Taipei Taiwan
4Institute of Food Science and Technology, National Taiwan University, Taipei Taiwan
5Department of Food Science, Nutrition, and Nutraceutical Biotechnology, Shin Chien University, Taipei Taiwan
6Department of Bioscience Technology, Chung Yuan Christian University, Taoyuan Taiwan

Received: May 8th, 2017; accepted: May 19th, 2017; published: May 26th, 2017

ABSTRACT
Cordyceps cicadae (C. cicadae) is a valuable traditional Chinese medicine. It exhibits a variety of biological functions, including vision improvement and protection of renal function. Because of the shortage of wild C. cicadae, artificial cultivation is an ideal alternation. The C. cicadae sample was collected from the mountain area of Taiwan and mass produced by submerged cultivation. This study was conducted to a single limit dose of acute toxicity assessment in ICR mice and SD rats. ICR mice were divided into four groups and were fed with RO water, 12 g/kg bw of freeze dried C. cicadae powder, 12 g/kg bw water extract of C. cicadae powder and 3 g/kg bw alcohol extract of C. cicadae powder. In the other test SD rats were also divided into four groups and were fed with RO water and 2000 mg/kg bw of freeze dried C. cicadae powder from three different batches. Each group has 5 experiment animals. During the study period, no abnormality occurred in clinical signs and body weight. There was no significant difference in biochemistry parameters between the treatment and control group. Necropsy and histopathological examination showed no treatment-related change. The results of this study provide evidences for the use of C. cicadae fermentation product as a safe agent in functional food. The LD50 of C. cicadae powder, its water extract and alcohol extract was greater than 12 g/kg bw, 12 g/kg bw and 3 g/kg bw in both ICR male and female mice respectively.
Keywords:Cordyceps cicadae, Acute Toxicity Assessment, ICR Mice, Histopathological, LD50
蝉花液态培养菌丝体对ICR小鼠及 SD大鼠之急毒性探讨
林明义1,徐瑞霞1,吴家驹2,施君翰3,陈劲初1,4,5,6*
1葡萄王生技股份有限公司,台湾 桃园
2食品工业发展研究所,台湾 新竹
3昌达生化科技股份有限公司,台湾 台北
4国立台湾大学食品科技研究所,台湾 台北
5实践大学食品营养与保健生技学系,台湾 台北
6中原大学生物科技学系,台湾 桃园

收稿日期:2017年5月8日;录用日期:2017年5月19日;发布日期:2017年5月26日

摘 要
蝉花为名贵传统中药材,具有保护眼睛、保护肾功能等多样生理功效,野生蝉花采集不易,人工大量发酵生产是个可行的替代方式。本篇研究以采集自台湾地区的野生大蝉花作为菌种来源,并以液态发酵方式培养蝉花菌丝体,进行ICR小鼠及SD大鼠之单一极限剂量安全性评估试验。ICR小鼠的实验中分别给予RO水、12 g/kg bw蝉花发酵液冻干粉末、12 g/kg bw水萃物及3 g/kg bw酒萃物;SD大鼠则给予RO水及2000 mg/kg bw三批独立发酵生产之蝉花发酵液冻干粉末,各组别5只试验动物。试验结果显示,试验期间所有受试动物生长情况良好无死亡情形,无明显临床症状发生,生化学检查、总解剖及组织病理学检查结果与对照组相比,亦均无明显差异,此结果可作为日后人体食用功能性蝉花发酵菌丝体之安全性参考依据,并推测蝉花发酵液冻干粉末及其水萃、酒萃物喂食ICR雄、雌鼠之口服急性毒性剂量,其LD50分别大于12 g/kg bw、12 g/kgbw及3 g/kg bw。
关键词 :蝉花,急毒性测试,ICR小鼠,组织病理学,LD50

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
蝉花(Cordyceps cicadae,C. cicadae)又名虫花、蝉草、胡蝉、蝉菌、蝉蛹草、金蝉花、蝉茸或蚕茸等,是由虫草属(Cordyceps)真菌C. cicadae、感染蝉科山蝉(Cicada flammate)、蝼蛄(Platypleurakaempferi)、黑蚱(Crytotympanapustulata)及竹蝉(Platylomiapieli)等幼虫,后于虫体头部形成花蕾状子座。蝉花多分布于气温18℃~24℃,相对湿度大于80%的热带与亚热带地区,在中国多产于长江以南地区,亦可见于日本、韩国、东南亚、及北美等地,在台湾亦有发现野生蝉花子实体踪迹。
蝉花为名贵传统中药材,药用部位为其子座及寄主昆虫的尸体(菌核)。最早见于,南北朝刘宋时代雷斅所著之《雷公炮炙论》首次提到蝉花之加工干燥过程,根据中国传统医书【宋朝苏颂—图经本草】、【北宋唐慎微—证类本草】、【明朝李时珍—本草纲目】大致记载蝉花具有有散风热、镇惊、明目、退翳障、透疹之功效,主治小儿天吊、惊痫、心悸、夜啼、止疟疾等。在【中华药物大全】和【中华药海】两部中药典籍中均有记载传统常用方剂如『万应蝉花散』、『蝉花明目方』及『蝉花清热方』等。蝉花有多种药理作用。包含治疗或缓解眼疾 [1] [2] 、调节免疫功能 [3] 、保护肾功能 [4] [5] [6] 、抗肿瘤 [7] [8] 、降血糖 [9] 、镇痛解热 [10] 、抗辐射 [11] 以及抗疲劳 [12] 等多项生物活性。
野外采集蝉花除了产量低不稳定且不易区分菌种类别外,也容易误采或采集到腐败品,无法符合日益成长的市场需求。目前许多研究显示人工培养之蝉花子实体或液态发酵蝉花菌丝体的生物活性及主要活性物质均和野生蝉花相似,甚至超出野生蝉花 [13] - [18] 。以液态发酵培养蝉花菌丝体是一种较卫生、安全且节省人工的方式。然而,以液态发酵培养菌丝体可能因培养方法不同而产生不同产物或代谢物,代谢物又可依其极性不同概分为水萃可溶或醇萃可溶等物质,因此以液态发酵之大蝉花菌丝体之冻干粉末及其水萃物跟酒萃物为样品,对不同品系之ICR小鼠进行单一极限剂量之口服急毒性测试,试图推测试验物之LD50;并以不同批次之发酵液冻干粉末为样品再次对SD大鼠进行口服急毒性测试验证其安全性及再现性并比较大小鼠之异同,以做为日后产品开发供人体食用安全剂量之参考依据。
2. 材料与方法
2.1. 供试菌种
大蝉花(Cordyceps cicadae,C. cicadae)采集于新北市三峡满月圆山区之野生大蝉花,后接种培养于马铃薯葡萄糖洋菜培养基(potato dextrose agar,PDA),于25℃恒温培养,每月于无菌操作台进行继代培养,并密封保存,经DNA定序并与NCBI Gen-Bank基因数据库比对,鉴定结果为Isaria cicadae (有性世代为Cordyceps cicadae)。并寄存于台湾新竹食品工业发展研究所之生物资源研究中心(BCRC)。
2.2. 蝉花菌丝体液体发酵条件及冷冻干燥粉末酒萃、水萃条件
取PDA平板培养基上菌丝体接种于内含1 L培养基(2%葡萄糖、1%酵母萃出物、1%黄豆粉、pH 6.0)的2 L烧瓶中,以转速120 rpm于25℃培养三天,至发酵液呈亮紫色,再将此培养出之菌丝体发酵液接种至500 L发酵槽中,相同培养基、通气0.5 vvm、搅拌速度60 rpm下继续培养三天后,再放大到50吨发酵槽中,除转速降低到20 rpm外其余条件相同下继续培养三天后对菌丝体发酵液进行减压浓缩及冷冻干燥后磨粉,即为蝉花发酵液冻干粉末;酒精萃取方式:将部份冻干粉末加入20倍重量之95%酒精后超音波震荡1小时,经离心后收集上清液并进行浓缩至膏状物后热风干燥磨粉;水萃取方式:将部份冻干粉末加入20倍重量之RO过滤水后于100℃加热30分钟,经离心后收集上清液随后进行冷冻干燥及磨粉,而后将上述三种样品(发酵液冻干粉末、发酵液冻干粉末酒萃物、发酵液冻干粉末水萃物)保存于4℃备用。
2.3. 动物饲养及实验伦理管理声明
本篇试验之ICR小鼠(5~6周龄)与SD大鼠(7~8周龄) 均由乐斯科生物科技股份有限公司提供(宜兰、台湾),在实验期间饮水与饲料均无限制供应,饲养环境与方式通过【国际动物管理评估及认证协会】认证。本试验所执行之试验程序均经委托机构之动物试验管理委员会审阅。描述于试验报告中之操作程序均以避免并降低试验动物之不适、紧迫、疼痛之方式进行。本试验之实验动物管理委员会核可编号为[CTPS-15-004]及[动管字第104-03]。
2.4. ICR小鼠喂养试验方法
将实验动物分成是当重量群后,再随机分成4组,各组雌雄鼠均5只,分别为对照组(A)、蝉花发酵液冻干粉末组(粉末组B)、发酵液冻干粉末水萃组(水萃组C)及发酵液冻干粉末酒萃组(酒萃组D),喂食前禁食16小时,于喂食时将测试品持续搅拌以维持其均质状态,并依小鼠体重分别进行3~4次喂食,以达12 g/kg bw (B、C组)及3 g/kg bw (D组),对照组小鼠(A)以RO过滤水管喂10 ml/kg bw。开始喂饲之后,每天观察动物的一般临床状态、中毒症状和死亡情况,并于试验开始前一日(0W)及喂食后第1、2周(1 W、2 W)对试验动物进行秤重与记绿,并于试验结束前禁食16小时,将所有试验动物进行安乐死并采血,进行Alanine aminotransferase (ALT)、Aspartate aminotransferase (AST)及Blood urea nitrogen (BUN)等血清生化分析,随后对采血动物进行尸体解剖、肉眼检查及组织病理镜检等并拍照记录。
2.5. SD大鼠喂养及试验方法
将实验动物分成是当重量群后,再随机分成4组,各组雄鼠均5只,分别为对照组(A)、三次不同批次之蝉花发酵液冻干粉末组(B)、(C)及(D),喂食前禁食16小时,于喂食时将测试品配制成悬浮液后持续搅拌以维持其均质状态,并以2000 mg/kg bw之剂量给予大鼠,对照组之大鼠(A)以RO过滤水管喂15 ml/kg bw。开始喂饲之后,每天观察动物的一般临床状态、中毒症状和死亡情况,并于试验开始前(D1)及试验结束(D8)对试验动物进行秤重与记绿,并于试验结束前一天禁食16小时,以随机方式选取试验动物进行安乐死并由心脏采血1.5~2 ml将血液收集在不含任何抗凝剂的集血管中,离心并分离血清后,以Hitachi Model 7060自动生化分析仪进行ALT、AST及BUN等血清生化分析,随后对采血动物进行尸体解剖、肉眼检查及组织病理镜检等并拍照记录。
2.6. 统计分析
试验数据以平均值(Mean) ± 平均数标准误差(SEM)来表示,以Dunnett-test与对照组比较,当p < 0.05表示具有显着性差异。
3. 结果
3.1. 动物死亡率及临床观察
试验期间大、小鼠之试验动物死亡率及临床症状总结于表1及表2。试验观察期间,喂食所有试验物质及对照溶液之各组动物均存活、活动状况均正常,且无发现任何临床异常症状。
Table 1. Mortality and clinical symptoms of ICR mice after 14 days of C. cicadae mycelium administration
表 1. 小鼠喂食试验物质之死亡率及临床症状
1.N/N = 死亡动物数目/所有动物数目。2.试验组(A):RO过滤水、对照组(B):蝉花发酵液冻干粉末、对照组(C):蝉花发酵液冻干粉末水萃物对照组(D)蝉花发酵液冻干粉末酒萃物。
Table 2. Mortality and clinical symptoms of SD rats after 7 days of C. cicadae mycelium administration
表2. 大鼠喂食试验物质之死亡率及临床症状
1. N/N = 死亡动物数目/所有动物数目。2.对照组(A):注射用水、试验组(B、C、D):不同批次之蝉花发酵液冻干粉末。
3.2. 体重变化
试验期间大、小鼠之试验动物之平均体重及变化如表3、表4。数值比较之下,除喂食『大蝉花菌丝体发酵液冻干粉末』之雄性小鼠体重增长百分率(%),在第一周与对照组间有显着性差异(p < 0.05)外,其余各处理组与对照组间均不具显着性差异(p > 0.05)。
3.3. 血清生化分析式
试验期间喂食各项试验物质及对照溶液之大、小鼠血清生化分析结果如表5及表6所示。各试验物质处理组与对照组动物于所有血清生化分析项目结果皆无显着差异。
3.4. 尸体解剖、肉眼检查、肝脏及肾脏组织病理
试验动物之尸体肉眼检查及病理镜检结果总结于表7、表8解剖图片如、图1和图2;小鼠之肝脏、肾脏组织病理图如图3,结果显示所有试验动物皆未发现与试验物质处理相关之病变。大鼠之肝脏肾脏组织病理检查结果显示所有试验动物皆未发现与试验物质处理相关之病变,但检查结果中观察到此SD大鼠物种中常见的特异性病变如图4,但对照组与试验组之间的病变发生之机率亦无显着性差异。
4. 讨论
在ICR小鼠的试验中由于蝉花菌丝体酒萃物的水溶性较差,再能均质喂食测试物的条件下,酒萃物最大的喂食量为3 g/kg bw,而蝉花菌丝体及其水萃物的水溶性较好,约可为酒萃物的4倍,因此两者的喂食量能达到12 g/kg bw;N6-(2-羟乙基)腺苷[N6-(2-hydroxyethyl)-adenosine,HEA蝉花之止痛活性物质]之含量经分析后水萃物为1.6 mg/g、酒萃物为1.2 mg/g。而在ICR小鼠的生长状况方面,喂食蝉花冻干粉末组之雄性小鼠之体重增长百分率于第一周明显较低外其余组别均生长情况良好,推测其原因可能是蝉花菌丝体冻干粉末含有大量菌丝体细胞壁纤维,导致雄性小鼠消化缓慢及饱胀感以至于当周进食状况不佳,体重增长不较少,但饲养时间延长后该状况立即改善,体重之增长即与对照组无显着性差异。血液生化检查方面酒萃组之ALT与AST之数值变化差异较大但经Dunmett-test统计分析与对照组相比仍无显着性差异,解剖肉眼检查与组织病理学检查之结果与对照组相比,也均无明显差异。
在SD大鼠的测试方面,除与小鼠进行不同品种间交互验证外,亦进行三批独立发酵制备之蝉花菌丝体冻干粉末之急毒性试验评估,结果显示无论在临床症状、体重变化、血清生化分析、解剖肉眼检查与组织病理镜检等上均与对照组无显着差异且未见与测试物处理之相关病变,证实蝉花菌丝体在各不同批次发酵培养的产物均安全且稳定,未来将更进一步测试不同培养条件的安全性。
试验剂量换算方面根据美国食品药物管理局所公告之实验初期估算方法(Estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult healthy volunteers),本次小鼠试验之剂量
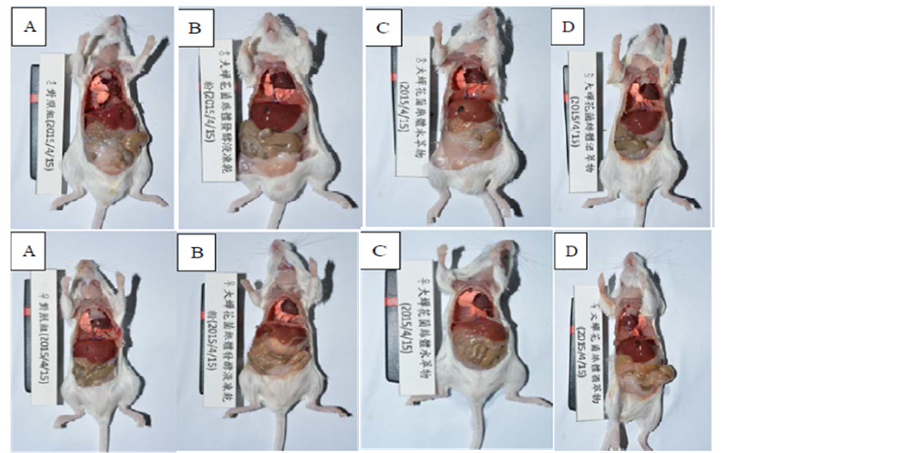
Figure 1. Anatomy examination of ICR mice
图1. 小鼠之解剖肉眼检查情形
对照组(a) 试验组(b) 试验组(c) 试验组(d)
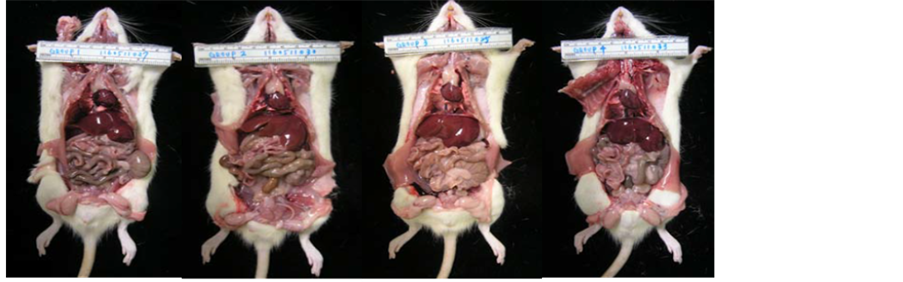
Figure 2. Anatomy examination of SD rats
图2. 大鼠之解剖肉眼检查情形
Table 3. Body weight of ICR mice at the beginning and the end of the study
表3. 小鼠喂食测试物后之平均体重变化
Data expressed as mean ± S.D., n = 5. *Significant different from control group (p < 0.05).
 (a)
(a)
 (b)
(b)
 (a)
(a)
 (b)
(b)
 (a)
(a)
 (b)
(b)
 (a)
(a)
 (b)
(b)
Figure 3. Histopathological changes of control and treated ICR mice in the acute oral toxicity study. No significant histopathological findings of kidney (a), liver (b). Pictures order are four groups: Control group (A), freeze dried C. cicadae powder (B), water extract of C. cicadae powder (C), and alcohol extract of C. cicadae powder (D)
图3. 小鼠口服急毒性试验之组织病理变化肾脏(a)、肝脏(b)等脏器均无明显组织病理变化。H & E,400×-(图片由上而下依序试验编组为对照组(a)、大蝉花菌丝体发酵液冻干粉末组(b)、大蝉花菌丝体冻干粉水萃组(c)、大蝉花菌丝体冻干粉酒萃组(d)
 (a)
(a)
 (b)
(b)
 (c)
(c)
 (d)
(d)
 (e)
(e)
 (f)
(f)
Figure 4. Histopathological changes (non-specific disease) of control and treated SD rats in the acute oral toxicity study. (A) Chronic progressive nephropathy; (B) Mononuclear cell infiltration, interstitial; (C) Cystic dilation, renal tubular in kidney and (D) Mononuclear cell infiltration (E) Hepatocellular vacuolation, micro-to macrovesicular, midzonal; (F) Extramedullary hematopoiesis, periortal/sinusoidal in liver
图4. 大鼠口服急毒性试验之肝、肾脏非特异性病变(a)肾脏慢性进展性肾病;(b)肾脏兼职单核细胞浸润;(c)肾脏肾小管囊肿样扩张;(d)肝脏散发单核细胞浸润;(e)肝脏中间区肝细胞小型至巨泡性空泡化;(f)肝窦门脉/状隙髓外造血
Table 4. Body weight of SD rats at the beginning and the end of the study
表4. 大鼠喂食测试物后之平均体重变化
Data expressed as mean ± S.D. n = 5. *Significant different from control group (p < 0.05).
Table 5. Hematology of ICR mice after 14 days of C. cicadae mycelium administration
表5. 小鼠喂食试验物质后之血清生化分析
Data expressed as mean ± S.D., n = 5. *Significant different from control group (p < 0.05).
Table 6. Hematology of SD rats after 7 days of C. cicadae mycelium administration
表6. 大鼠喂食试验物质后之血清生化分析
Data expressed as mean ± S.D., n = 5. *Significant different from control group (p < 0.05).
Table 7. Anatomy examination and histopathology changes of kidney and liver of ICR mice after 14 days of C. cicadae mycelium administration
表7. 小鼠喂食试验物质后解剖之肉眼检查及组织病理镜检
Data expressed as mean ± S.D., n = 5.*Significant different from control group (p < 0.05).
Table 8. Anatomy examination and histopathological changes of kidney and liver of SD rats after 7 days of C. cicadae mycelium administration
表8. 大鼠喂食试验验物质后解剖之肉眼检查及组织病理镜检
Data expressed as mean ± S.D., n = 5. *Significant different from control group (p < 0.05).
换算成人体之测试剂量约为0.975 g/kg bw,相当于60公斤的成人一次摄取58.5 g之蝉花发酵液冻分粉末,其结果仍具有一定之安全性。
5. 结论
蝉花为中国传统中药材,自古以来即有食用的纪录,亦出现于传统常用中药方剂中,可见天然蝉花子实体毒性低。现今以生物科技所生产的蝉花菌丝体发酵液及其水萃与酒萃物的安全性评估结果,对小鼠LD50分别大于12 g/kg bw、12 g/kg bw及3 g/kg bw显示无论菌丝体发酵液本身或其水萃物、酒萃代谢物皆有一定安全性。禅花发酵液冻干粉末在SD大鼠上亦有同样的安全性,且不同三批次发酵培养所生产的发酵液冻干品对SD大鼠也不会造成毒性,与先前研究结果90天大鼠喂食的毒性测试(陈等 [19] ),基因毒性测试(徐等 [20] ),28天喂食LY品系白猪之亚急性毒性测试(周等 [21] )及生殖与发育毒性测试(李等 [22] )等之结果相符,均不对测试目标造成影响,证实蝉花液态培养菌丝体不具有急毒性的疑虑,此结果可作为日后人体食用蝉花液态发酵菌丝体之安全性参考依据。
文章引用
林明义,徐瑞霞,吴家驹,施君翰,陈劲初. 蝉花液态培养菌丝体对ICR小鼠及SD大鼠之急毒性探讨
A Acute Toxicity Study of Cordyceps cicadae Mycelium in ICR Mice and SD Rats[J]. 食品与营养科学, 2017, 06(02): 96-105. http://dx.doi.org/10.12677/HJFNS.2017.62010
参考文献 (References)
- 1. 彭广华, 张黎. 中药生液散和蝉花五味散配合西药治疗外伤性低眼压[J]. 中西医结合眼科杂志, 1994(3): 173- 174.
- 2. 王洪泉, 赵展, 张莉. 自拟蝉花汤治疗单纯疱疹性角膜炎50例[J]. 中医药信息, 2001(4): 35.
- 3. Weng, S.C., Chou, C.J., Lin, L.C., et al. (2001) Immunomodulatory Functions of Extracts from the Chinese Medicinal Fungus Cordyceps cicadae. Journal of Ethnopharmacology, 83, 79-85.
- 4. 彭秀秀, 柴一秋, 朱碧纯, 等. 蝉花虫草提取物N6-(2-羟乙基)腺苷对小鼠肾脏缺血再灌注损伤的保护作用[J]. 菌物学报, 2015(34): 311-320.
- 5. 刘玉宁, 陈以平, 王立红, 等. 蝉花菌丝抗大鼠肾小管间质纤维化的实验研究[J]. 中国中西医结合肾病杂志, 2011(12): 243-245.
- 6. Zhu, R., Chen, Y.P., Deng, Y.Y., et al. (2011) Cordyceps cicadae Extracts Ameliorate Renal Malfunction in a Remnant Kidney Model. Journal of Zhejiang University Science B (Biomedicine & Biotechnology), 12, 1024-1033. https://doi.org/10.1631/jzus.B1100034
- 7. 陈安徽, 邵颖, 李继武, 等. 人工培育蝉花抗肿瘤活性研究[J]. 食品科学, 2014. (网络出版)
- 8. 芦柏震, 姜志明, 牟瀚舟, 等. 蝉花粗提物对肺癌细胞作用的实验研究[J]. 中国中医药科技, 2006, 13(5): 328- 329.
- 9. 宋捷民, 忻家础, 朱英. 蝉花对小鼠血糖及造血功能影响[J]. 中华中医药学刊, 2007, 25(6): 1144-1145.
- 10. 王海颖, 陈以平. 陈以平教授巧用蝉花经验[J]. 中国中医药信息杂志, 2000, 7(10): 71.
- 11. 陈万群, 陈古荣. 冬虫夏草代用品研究进展[J]. 中草药, 1994, 255(5): 269-271.
- 12. 王砚, 赵小京, 唐法娣. 蝉花药理作用的初步探讨[J]. 浙江中医杂志, 2001, 36(5): 219-220.
- 13. 胡海燕, 邹晓, 罗力, 等. 传统中药蝉花的活体家蚕人工培养[J]. 中国中药杂志, 2009, 34(17): 2140-2143.
- 14. 刘广玉, 胡菽英. 天然蝉花与人工培养品的镇静镇痛作用的比较[J]. 现代应用药学, 1991, 8(2): 5-8.
- 15. 刘森琴, 温鲁, 夏敏, 等. 人工培育蝉花的活性成分含量测定[J]. 安徽农业科学, 2008, 36(2): 429.
- 16. 温鲁, 唐玉玲, 张平. 蝉花与有关虫草活性成分检测比较[J]. 江苏中草药, 2006, 27(1): 45-46.
- 17. 葛飞, 夏成润, 李春如, 等. 蝉拟青霉菌丝体与天然蝉花中化学成分的比较分析[J]. 菌物学报, 2007, 26(1): 68- 75.
- 18. 陈祝安, 刘广玉, 胡菽英. 蝉花的人工培养及其药理作用研究[J]. 真菌学报, 1993, 12(2): 138-144.
- 19. Chen, Y.L., Yeh, S.H., Lin, T.W., et al. (2015) A 90-Day Subchronic Toxicity Study of Submerged Mycelial Culture of Cordyceps cicadae (Ascomycetes) in Rats. International Journal of Medicinal Mushrooms, 17, 771-781.
- 20. 徐瑞霞, 叶淑幸, 黄维茜, 等. 大蝉花菌种分离、鉴定及其液态培养菌丝体之基因毒性评估[J]. 检验及品保杂志, 2015(4): 114-127.
- 21. 周柏谊, 徐瑞霞, 叶淑幸, 等. 蝉花液态培养菌丝体对高葡萄糖膳食LY品系白猪之亚急毒性探讨[J]. 食品与营养科学, 2016, 5(2): 13-20.
- 22. Li, I.C., Hsu, J.H., Lin, T.W., et al. (2017) Prenatal Developmental Toxicity Study of HEA-Enriched Cordyceps Cicadae Mycelia in Sprague-Dawley Rats. SDRP Journal of Food Science & Technology, 2.
NOTES
*通讯作者。
