Hans Journal of Ophthalmology
Vol.06 No.01(2017), Article ID:20076,5
pages
10.12677/HJO.2017.61006
Observation of Retinal Nerve Fiber Layer in Rats with Traumatic Optic Nerve Injury Treated by Shuang Shao Hu Jing Powder
Jiaxiang Xiao*, Ting Wen, Ying Yao
Ophthalmology of Guizhou Province Hospital of Traditional Chinese Medicine, Guiyang Guizhou

Received: Mar. 16th, 2017; accepted: Mar. 27th, 2017; published: Mar. 31st, 2017

ABSTRACT
Objective: To observe the change of retinal nerve fiber layer of rats with traumatic optic nerve ınjury that treated by Shuang Shao Hu Jing Powder. Methods: 15 rats were randomly selected from 60 SD rats as control group, and the remaining 45 model rats were randomly divided into model control group, saline group and TCM treatment group; each group had 15 rats. Retina of the blank control group and the model control group were peeled after 24 hours, while that of the normal saline group and TCM treatment group (Shuang shao hu jing powder) were peeled after 4 weeks of treatment. Changes of retinal ganglion cells and nerve fiber layer morphology and thickness were observed. Results: In the model control group, there was a large amount of RGC in the retina, and the nerve fiber layer was significantly thickened. The thickness of the nerve fiber layer was significantly different from that of the control group (P < 0.05). A large number of RGC in the normal saline group showed vacuolar degeneration, shedding, and the nerve fiber layer became thinner; while in the treatment group, there was a slight swelling of RGC in the retina and a slight thinning of the nerve fiber layer, and there was significant difference between the treatment group and the saline group (P < 0.05). Conclusion: Shuang Shao Hu Jing Powder, with a combined function of nourishing blood to activate blood, showed certain effects of anti-optic-nerve injury, promoting retinal ganglion cells’ development and optic nerve fiber recovery, thus, protecting the optic nerve.
Keywords:Shuang Shao Hu Jing Powder, Retinal Nerve Fiber Layer, Optic Nerve/Traumatic Injury, Disease Models
双芍护睛散抗大鼠外伤性视神经损伤的视网膜神经纤维层观察
肖家翔*,文婷,姚莹
贵阳中医学院第一附属医院,贵州 贵阳

收稿日期:2017年3月16日;录用日期:2017年3月27日;发布日期:2017年3月31日

摘 要
目的:观察双芍护睛散抗大鼠外伤性视神经损伤的视网膜神经纤维层变化。方法:将实验SD大鼠60只随机抽取15只为空白对照组,其余45只造模后随机分为模型对照组、生理盐水组及中药治疗组,每组15只。空白对照组及模型对照组造模后24小时后,生理盐水组及中药治疗组(双芍护睛散)用药4周后取左眼观察视网膜神经节细胞及神经纤维层形态与神经纤维层厚度的变化。结果:模型对照组的视网膜中大量RGC肿胀,神经纤维层明显水肿增厚,其厚度与空白对照组比较有显著性差异(p < 0.05)。生理盐水组视网膜大量RGC呈空泡样变性、脱落,神经纤维层显著变薄;而中药治疗组视网膜少量RGC轻度肿胀,神经纤维层轻度变薄,其厚度与生理盐水组比较有显著性差异(p < 0.05)。结论:以养血行血法组方的双芍护睛散具有一定抗视神经的损伤,促进视网膜神经节细胞及视神经纤维修复的作用而保护视神经。
关键词 :双芍护睛散,视网膜神经纤维层,视神经/外伤,疾病模型

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
视神经萎缩(optic atrophy, OA)是由于各种原因导致视网膜神经节细胞(RGC)及其轴突、视神经纤维损害的结果,是眼科常见的致盲眼病之一 [1] [2] 。本病以外伤性、炎症性居多 [3] 。外伤性视神经损伤导致的视神经萎缩的研究既往主要集中在解除视神经受压方面,而“神经保护”未得到足够的重视。临床上相当多的患者在视神经解压后已存在视功能的损害,表明在视神经受压时需及时对视神经进行保护性治疗,故本研究采用临床治疗视神经萎缩行之有效,以养血行血为法组方制成的双芍护睛散用于实验性外伤性视神经损伤,通过对视网膜神经纤维层的观察,以证实养血行血方有抗视神经损伤的作用,为开发有效治疗视神经萎缩中药制剂提供理论依据及实验数据。
2. 材料与方法
2.1. 材料
2.1.1. 实验动物
选用健康3月龄SD大鼠60只,雌雄不限,体重200~250 g,由贵州医科大学动物实验中心提供(合格证号:SCXK(黔)2013-017)。购进大鼠经手持裂隙灯检查双眼角膜透明,虹膜血管清晰,瞳孔对光反射灵敏,晶状体无混浊者纳入实验。动物实验室温度控制在20℃ ± 2℃,通风、干燥、清洁、光照充足,予自动喂食、饮水装置进行喂养。
2.1.2. 药物
以养血行血法组方(白芍、赤芍、茺蔚子、桑葚、泽兰、牛膝、鸡血藤、川芎等),按现代中药制剂工艺制成双芍护睛散,由贵阳中医学院中药制剂室制备。
2.2. 方法
2.2.1. 动物分组及造模
参照秦川编写人民卫生出版社出版的2008版《医学实验动物学》动物实验标准,将60只大鼠抽取15只为空白对照组,其余45只采用左眼视神经钳夹法建立视神经挤压伤模型,造模后随机分为模型对照组、生理盐水组及中药治疗组,每组15只。造模参照李云琴 [4] 方法进行造模:将需造模的45只大鼠于造模前3天用0.25%氯霉素眼药水滴眼,每日3次。造模时以3.5%水合氯醛作右下腹腔注射麻醉,并以1%盐酸丙美卡因对大鼠左眼进行表面麻醉。麻醉后,将大鼠固定于动物手术台上,沿左眼颞侧角膜缘将球结膜环形剪开,分离球结膜和巩膜,分离时避开外直肌,然后继续向后分离,打开肌锥后将视神经暴露出来,用钳夹力相等的视神经钳夹器夹于球后视神经2 mm处,30秒后松开钳夹器,用8-0尼龙线缝合球结膜,造模完后以庆大霉素球做结膜下注射,以0.3%妥布霉素眼膏涂于结膜囊内,然后将大鼠保温至苏醒。观察造模眼的瞳孔情况,以瞳孔直接对光反射消失,间接对光反射存在者作为造模成功的实验动物纳入实验。
2.2.2. 给药方法
中药治疗组及生理盐水组造模成功24小时后开始每日给药,剂量参照徐叔云主编的《药理实验方法学》 [5] 中关于人和动物间按体表面积折算的等效剂量比值表拟定,治疗组以混悬液(每100 ml含散剂30 g)灌胃,剂量为5 ml/Kg.d,每天2次;生理盐水组以等剂量生理盐水灌胃,每天2次。2周为一个疗程,停药2天后继续第二个疗程,共2个疗程。
2.2.3. 标本制作及观察
空白对照组及模型对照组在造模成功24小时后;中药治疗组以及生理盐水组给药2个疗程后采用完全随机法随机抽取各组中的10只大鼠以10%水合氯醛过量腹腔注射处死,摘取左眼眼球后,沿角膜缘剪开眼球后,去除晶体、玻璃体,保留球后视神经2 mm,取过视盘一约2 cm × 2 cm的全层眼球壁。将实验眼标本立即置于4%多聚甲醛磷酸缓冲液(pH7.4)内4℃固定24h,梯度酒精脱水和二甲本透明后,常规石蜡包埋。将包埋好的眼球标本以平行于视盘矢状且以其为平面的视网膜进行连续切片,厚约5 μm,置于预先用多聚赖氨酸处理的载玻片上,60℃温箱烤片过夜,HE染色后进行光镜观察,光镜观察采用四川大学图象图形研究所的Biomias 2001图象分析系统,视场面积:3.2728 mm2。在×200倍LONYPAS HB51型光学显微镜下,通过SONY摄像头将切片视网膜图像采集并输入本图像分析系统。其中每组5个标本观察视网膜神经节细胞及神经纤维层的形态学改变;另外每组5个标本测量视网膜神经纤维层厚度(RNFLT),每个标本随机选取5个视场,每个视场随机选取5个不同的部位用鼠标分割系统自动测量法测量视网膜神经纤维层厚度,并取平均值。
2.2.4. 统计学分析
对于RNFLT应用SPSS16.0统计软件,采用重复测量资料的方差分析法评价双芍护睛散对实验性外伤性视神经损伤的影响,组间比较采用t检验,p < 0.05为有统计学意义。
3. 结果
3.1. 光镜下各组大鼠视网膜神经节细胞及神经纤维层的组织结构
如图1所示:空白对照组视网膜RGC排列整齐,胞浆丰富,染色均匀;神经纤维层结构清晰(图1A)。
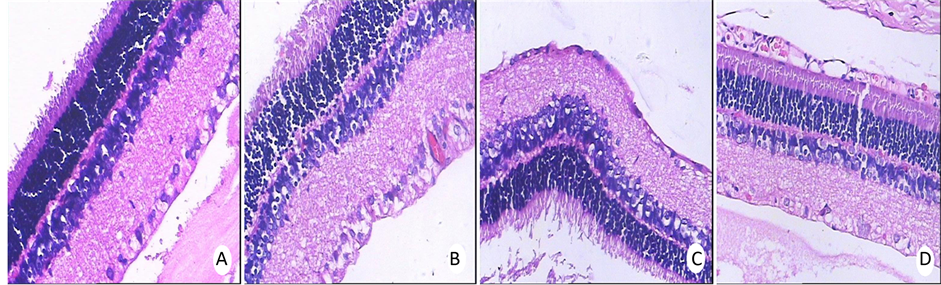
Figure 1. Light microscopy of retina (HE Dyeing × 200); A: Blank control group; B: Model control group; C: Normal saline group; D: Chinese medicine treatment group
图1. 视网膜光镜照片(HE染色 × 200);A:为空白对照组;B:为模型对照组;C:生理盐水组;D:为中药治疗组
模型对照组视网膜大量RGC肿胀,排列不规则,层次欠清晰;神经纤维层明显水肿增厚(图1B)。生理盐水组视网膜RGC呈空泡样变性、脱落,染色不均匀,数量减少,神经纤维层显著变薄(图1C)。中药治疗组视网膜少量RGC轻度肿胀,层次尚清晰,数量略减少,神经纤维层轻度变薄(图1D)。
3.2. 光镜下各组大鼠视网膜神经纤维层厚度(RNFLT)
如表1所示,经析因设计的方差分析检验结果显示,组间差异明显(F = 0.132, P = 0.00)。大鼠RNFLT模型对照组较空白对照组增厚,组间平均值比较有显著性差异(p < 0.05);经过4周的治疗,大鼠RNFLT生理盐水组与中药治疗组较空白对照组变薄,平均值比较均有差异,前者有极显著性差异(p < 0.01),后者有显著性差异(p < 0.01);生理盐水组变薄更为明显,与中药对照组比较有显著性差异(p < 0.05)。
Table 1. Average RNFLT in each group (, μm)
表1. 各组平均RNFLT ( ,μm)
,μm)
注:模型对照组与空白对照组比较,*P < 0.05;生理盐水组与空白对照组比较,*P < 0.01;中药治疗组与空白对照组比较,△P < 0.05;中药治疗组和生理盐水组比较☆P < 0.05。
4. 讨论
视神经萎缩是由于各种病因造成视神经纤维变性丧失传导功能的最终结局。视神经由视网膜神经节细胞所发出的轴突纤维汇集而成,当视神经受损时,神经纤维会出现部分变细或者全部变细的形态学改变。位于视网膜的神经纤维层主要由神经节细胞的轴突所组成,此外尚有传出纤维、MÜller纤维和视网膜血管。外伤性视神经损伤引起视功能损害主要为视神经血流灌注不良而缺血缺氧,早期为组织细胞水肿肿胀,继之发生变性引起视网膜神经节细胞凋亡,轴突数量减少,神经纤维受损,导致视神经萎缩。
视神经萎缩一度被认为是不可逆视神经损害结果,近年的研究改变了这种看法,有研究显示适当而积极的治疗对视神经萎缩的视功能可以得到一定的改善,并提出了残余视觉激活理论 [6] 。对视神经萎缩的治疗中西医均进行了较为广泛的探索。相关实验证明 [7] ,受损的轴突在一定条件下,可得到一定程度的修复,从而促进神经纤维的再生。孔祥梅等 [8] 通过实验观察甲钴胺治疗视神经钳夹伤后大鼠,光镜和电镜下可见视神经轴突和神经节细胞异性改变明显减少,能有效减少视神经的退变及丧失。郑幼平等 [9] 用银杏内脂B对视神经钳夹伤后大鼠进行腹腔注射,结果显示其能有效改善视神经钳夹伤后RGC存活数量和时间。
目前治疗视神经萎缩尚无确切有效疗法,本研究以中医理论为基,结合外伤性视神经损伤主要为视神经血流灌注不良而缺血缺氧,导致视网膜神经节细胞及轴突损害引发视神经萎缩的发病机制,提出目络瘀阻,目系失养的立法依据。针对外伤性视神经损伤有血“亏滞”的关键环节,其治血一要养,二要行。故本研究选用临床有效治疗视神经萎缩,以养血行血为法组成的双芍护睛方制成散剂,用于实验性外伤性视神经损伤模型,通过对视网膜神经纤维层的观察以证实养血行血方对外伤性视神经损伤具有保护作用。
研究结果显示,大鼠造模后视网膜大量RGC肿胀,排列不规则,神经纤维层明显水肿增厚,其厚度与空白对照组比较有显著性差异。经过治疗期,生理盐水组视网膜大量RGC呈空泡样变性、脱落,数量显著减少,神经纤维层显著变薄,与空白对照组比较有极显著性差异;而中药治疗组通过养血行血中药的作用,对组织细胞的变性进行了一定的干预,故视网膜少量RGC轻度肿胀,数量略减少,神经纤维层轻度变薄,虽未达到空白对照组神经纤维层的厚度,但与生理盐水组比较有显著性差异。提示以养血行血法组方的双芍护睛散具有一定抗视神经的损伤,促进视网膜神经节细胞及视神经纤维修复的作用而保护视神经。双芍护睛散减轻视神经损伤和保护视神经的作用机制,还有待进一步深入研究。
基金项目
贵州省社发攻关项目[黔科合SY字[2012]3087号]。
文章引用
肖家翔,文 婷,姚 莹. 双芍护睛散抗大鼠外伤性视神经损伤的视网膜神经纤维层观察
Observation of Retinal Nerve Fiber Layer in Rats with Traumatic Optic Nerve Injury Treated by Shuang Shao Hu Jing Powder[J]. 眼科学, 2017, 06(01): 30-34. http://dx.doi.org/10.12677/HJO.2017.61006
参考文献 (References)
- 1. 张晓君. 进一步提高视神经萎缩的诊断水平[J]. 眼科, 2011, 20(6): 364-366.
- 2. Dahlmann-Noor, A.H., Vijay, S., Limb, G.A., et al. (2010) Strategies for Optic Nerve Rescue and Regeneration in Glaucoma and Other Optic Neuropa-thies. Drug Discovery Today, 15, 287-299.
- 3. 滕克禹, 吕丽萍. 视神经萎缩病因分析[J]. 中国中医眼科杂志, 2013, 23(6): 428-430.
- 4. 李云琴. 大鼠外伤性视神经损伤模型的建立[J]. 眼科新进展2011, 31(10): 934-936.
- 5. 徐叔云. 药理实验方法学[M]. 第1版. 北京: 人民卫生出版社, 2010: 302-303.
- 6. 魏世辉, 张秀兰. 正确认识视神经萎缩的治疗价值[J]. 中华眼科杂志, 2012, 48(12): 1057-1058.
- 7. 张世杰, 王传富, 孙为荣, 等. 视神经挫伤轴浆运输和超微结构变化的实验研究[J]. 眼科研究, 2003, 21(6): 585-587.
- 8. 孔祥梅, 孙兴怀. 甲钴胺对钳夹大鼠视神经的保护作用[J]. 眼视光学杂志, 2004, 9(6): 157-164.
- 9. 郑幼平, 吴小桃, 田原, 等. 银杏内酯B对视神经钳夹伤后大鼠视网膜神经节细胞的保护作用[J]. 中国医学创新2015, 7(12): 13-15.
