Hans Journal of Ophthalmology
Vol.
08
No.
04
(
2019
), Article ID:
33408
,
9
pages
10.12677/HJO.2019.84025
Preparation and Formulation Optimization of Loaded Celastrol Nanostructure Lipid Carriers for Topical Ocular Application
Ying Guo1,2, Zhen Liang1, Zhen Zhang1, Jing-Bo Wang1, Jun-Jie Zhang1*
1Xinxiang Medical University, Henan Province People’s Hospital, Zhengzhou Henan
2Henan Eye Institute, Zhengzhou Henan

Received: Nov. 20th, 2019; accepted: Dec. 4th, 2019; published: Dec. 11th, 2019

ABSTRACT
Objective: The central composite design-response surface methodology (CCD-RSM) was used to optimize the application of tricorne nanostructured lipid carrier (CEL-NLC) in the local application of eyes. Methods: The lipid with the best solubility was screened out by determining the solubility of celastrol in different lipids. CEL-NLC was prepared by microemulsion technique. Quality of solid lipid (X1), quality of liquid lipid (X2), surfactant/cosurfactant (X3) as objects of investigation, while particle size (Y1), encapsulation efficiency (Y2) and drug loadings rate (Y3) as dependent variables, the optimal prescription was obtained by CCD-RSM and verified subsequently. Results: The best prescription of CEL-NLC was Celastrol 0.04 g, palmitic acid 0.09 g, oleic acid 0.18g, tween-80 4.34 g and Glycerine 2.16 g. The encapsulation efficiency was (75.28 ± 3.44)%; the drug loading rate was (0.45 ± 0.02)%; the particle size was (18.66 ± 2.63) nm. The PDI was 0.39 ± 0.03. The deviation between the measured and predicted values was less than 5%. Conclusion: The optimized CEL-NLC obtained by CCD-RSM has high encapsulation efficiency, small particle size and good stability, which can be further used in the follow-up study of local application of Celastrol in eyes.
Keywords:Celastrol, Nano-Structure Lipid Carrier, Central Composite Design-Response Surface Methodology, Encapsulation Rate, Drug Loading Rate
星点设计–效应面法优化眼局部应用雷公藤红素纳米结构脂质载体处方
郭莹1,2,梁珍2,张振2,王敬博2,张俊杰2*
1新乡医学院河南省人民医院,河南 郑州
2河南省眼科研究所,河南 郑州

收稿日期:2019年11月20日;录用日期:2019年12月4日;发布日期:2019年12月11日

摘 要
目的:采用星点设计–效应面法(CCD-RSM)优化应用于眼局部应用雷公藤红素纳米结构脂质载体(CEL-NLC)处方。方法: 通过测定雷公藤红素在各种脂质的溶解度,筛选出溶解度较好的脂质,采用微乳法制备CEL-NLC,分别以药物/脂质用量比(X1)、表面活性剂/助表面活性剂用量比(X2)为考察对象,以粒径(Y1)、包封率(Y2)和载药量(Y3)为考察指标,经效应面法预测最佳处方,并验证最佳处方。结果:根据CCD-RSM优化得出最佳处方为雷公藤红素40 mg,棕榈酸0.09 g,油酸0.18 g,吐温-80 4.34 g,甘油2.16 g。按最优处方制备的CEL-NLC包封率为(75.28 ± 3.44)%,载药量为(0.45 ± 0.02)%;粒径为(18.66 ± 2.63) nm,多分散指数(PDI)为0.39 ± 0.03。实际值与预测值偏差均小于5%。结论:采用CCD-RSM优化的CEL-NLC处方,包封率高,粒径小,稳定性好,方法可靠,可进一步用于眼局部应用雷公藤红素的后续研究。
关键词 :雷公藤红素,纳米结构脂质载体,星点设计-效应面法,粒径,包封率,载药量,微乳法

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
雷公藤红素(Celastrol)是从卫茅科雷公藤属植物雷公藤中分离提纯得到的五环三萜醌类化合物。雷公藤的主要有效成分具有抗肿瘤、抗炎、抗菌、抗氧化、免疫抑制、止痛等多种药理活性 [1] [2]。近些年来,雷公藤红素在眼科局部抗角膜新生血管方面的作用受到国内外研究人士的广泛关注。但是雷公藤红素为难溶性物质,体内吸收极差,生物利用度低,而且毒副作用大,严重限制了雷公藤红素的应用范围 [3] [4]。
纳米结构脂质载体(Nanostructured Lipid Carrier, NLC)是在一定温度下以空间构象不同的固态脂质和液态脂质为载体材料混合而成的具有特殊结构的胶体给药系统 [5],与传统制剂相比具有以下特点:提高载药量、降低突释效应,并可避免纳米混悬体系水分含量高的缺点、增强物理稳定性、防止敏感药物水解、缓控释药物的释放、生物利用度高、生物相容性好,适合包疏水性药物且靶向性良好及易于制备等 [6]。
星点设计–效应面法(Central Composite Design-Response Surface Methodology, CCD-RSM)是国内外常用的实验设计优化方法,可用集数学和统计学方法于一体的效应面法(RSM)进行优化,利用实验设计并通过实验得到一定数据,采用多元二次方程来拟合因素和效应值之间的函数关系,通过对回归方程的分析来寻求最优处方,解决多变量问题。与正交设计法相比,可以评价指标和因素间的非线性关系,使用方便,预测性好,预测结果接近实际实验结果 [7]。
笔者通过测定雷公藤红素在各种脂类的溶解度,筛选出溶解效果较好的脂质,然后绘制三元相图,通过CCD-RSM优化雷公藤红素纳米结构脂质载体(Celastrol Loaded Nanostructured Lipids Carrier, CEL-NLC)的最佳处方,并对其进行验证,考察理化性质,为进一步将CEL-NLC制成滴眼制剂应用于眼局部提供实验依据 [8] [9]。
2. 仪器与材料
2.1. 药品与试剂
雷公藤红素(华禹生物有限公司);棕榈酸(北京百灵威科技有限公司,批号:LN60R09);油酸(大连美仑生物有限公司,批号:83L6C);吐温-80 (四川金山制药有限公司,批号:160201);甘油(浙江遂昌惠康药业有限公司,批号:20181238);甲醇(美国Tedia公司,HPLC级);乙腈(美国Tedia公司,HPLC级);冰醋酸(郑州派尼化学试剂厂,批号:170914);水为超纯水,其他试剂均为分析纯。
2.2. 仪器
Waters 2695 (Waters公司,美国);UV-2401紫外可见分光光度仪(岛津公司,日本);Mettler AE260电子分析天平(Metter Toledo公司,瑞士),针头式无菌过滤器(0.22 um,津腾公司)。Amicon Ultra-4离心过滤器(德国默克公司,截留分子量10 k)。EEN3700型马尔文粒径测定仪(德国Malvern)。
3. 方法
3.1. 溶解度的测定
精密称量蓖麻油、単辛酸甘油酯、油酸、棕榈酸、硬脂酸、月桂酸甘油酯、单硬脂酸甘油酯各1.000 g分别置于U型玻璃试管中,加入0.100 g的雷公藤红素原料药。70℃烘箱加热24 h,取上清,甲醇稀释至适当浓度,紫外测定。根据Celastrol标准曲线及计算公式分析雷公藤红素在几种脂质中的溶解度的大小。
3.2. CEL-NLC的制备
根据雷公藤红素在脂质中的溶解度测定结果选用溶解度较好的固体脂质棕榈酸和液态脂质油酸两种脂质,采用微乳法制备雷公藤红素纳米结构脂质载体。精密称取处方量的雷公藤红素、固体脂质、液体脂质和表面活性剂和助表面活性剂置于25 ml小烧杯中,恒温70度加热至药物完全溶解,然后逐滴加入5 ml纯化水,搅拌5分钟,即得澄清透明的微乳,用注射器在搅拌状态下(1500 rpm∙min−1)快速注入0℃冰水中,搅拌20分钟,纯化水定容40 ml至刻度,即形成CEL-NLC,制剂呈橘红色澄清透明液体 [10]。
3.3. 雷公藤红素紫外检测波长的选择
精密称取适量的雷公藤红素标准品,用甲醇溶解并稀释至10 ug/mL标准品溶液,在300~600 nm波长范围内进行紫外吸收波长检测。结果所示:在424 nm波长处吸收最强,因此在424 nm处进行雷公藤红素HPLC-UV的分析与检测。
3.4. 实验方法学
3.4.1. 标准曲线的绘制
精密称量雷公藤红素40.00 mg于50 mL量瓶中,用甲醇溶解并定容,得质量浓度为 800 ug∙mL−1雷公藤红素对照品贮备液。精密吸取上述母液加甲醇稀释依次配制获得浓度为0、2、4、8、16、32 ug/ml的对照品溶液,用UV-2401紫外可见分光光度仪精密测量吸光度。以雷公藤红素浓度为横坐标,吸光度为纵坐标得回归方程Y = 0.0296 + 0.0003,R2 = 1 (如图1所示),表明雷公藤红素在0~32 ug/ml范围内与吸光度有着良好得线性关系。

Figure 1. Standard curve of Celastrol
图1. 雷公藤红素标准曲线
3.4.2. 计算日内精密度
精密吸取雷公藤红素对照品贮备液适量,用甲醇配制成2.0、4.0、16.0的标准溶液于1日内间隔相等时间分别测定3次,结果表明雷公藤红素的日内精密度RSD值小于5% (n = 5),说明检测方法重复性好。
3.4.3. 计算日间精密度
同3.4.1标准液配制方法,每日测定1次,连续测定5 d,计算日间精密度RSD。结果表明雷公藤红素的日间精密度RSD值小于2% (n = 5),说明本实验仪器性能、试剂、环境条件等稳定,符合分析要求。
3.4.4. 空白回收率试验
精密吸取1 mL雷公藤红素对照品溶液,分别加入空白纳米结构脂质载体溶液中,配制成质量浓度分别为2.0、4.0、16.0 ug∙mL−1的雷公藤红素溶液,分别取0.5 mL置于离心超滤管内管中,4000 r/min离心20 min,取外管中超滤液,测其药物浓度,计算回收率。各质量浓度雷公藤红素的回收率分别为99.6%,99.5%,99.4% (n = 5),表明该测定方法符合后续实验的检测要求。
3.5. CEL-NLC的包封率和载药量
3.5.1. 包封率及载药量测定
取雷公藤红素纳米结构脂质载体5 ml,置于离心管中,4000 r/min离心20 min,取上清液2 ml,置于透析袋中,透析48 h,用水定容至10 mL,测量药物浓度(C游)。另取离心后上清液2 ml,甲醇定容破乳至10 ml,测定药物浓度(C总)。
C游为游离药物浓度;
C总为雷公藤红素纳米结构脂质载体分散液中的总药物浓度。
3.5.2. 粒径及多分散系数的测定
另取适量样品,蒸馏水稀释倍数后,0.22 um的过滤器过滤后测定其粒径和多分散系数,平行操作测量了三份样品的粒径和多分散系数。
3.5.3. CCD-RSM优化处方
在Celastrol投药量为40 mg时,选择对CEL-NLC性质影响较显著2个因素:药物/脂质(X1)、表面活性剂/助表面活性剂(S/Cos) (X2)作为考察对象,在5个水平上进行优化研究,以包封率(Y1)及载药量(Y2)、粒径(Y3)为评价指标进行CCD-RSM实验,每个考察因素分为五水平,各代码为0,±1,±α,其中α = 1.414。各因素大小极值水平依照单因素实验结果选定。CCD的因素和水平值,具体安排见表1。
Table 1. Horizontal code values of 2 factors and corresponding values (m/g)
表1. 2个因素的水平代码值及相应的数值(m/g)
二次回归方程的建立——根据表2设计表格,采用实验软件Designexport 8.0对表1中数据进行拟合分析,得到的二次多元回归模型为
;
;
;
根据CCD-RSM结果,得到的预测最优处方为D/L = −0.07,S/Cos = −1.4,Y1 = 21.31,Y2 = 75.71,Y3 = 0.45,通过计算及转换最终所得固体和液体脂质以及表面活性剂、助表面活性剂的实际值(图2)。
Table 2. CCD design table
表2. CCD设计表格
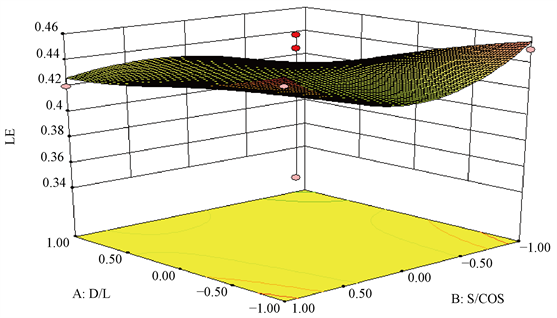


Figure 2. 3D effect surface diagram
图2. 3D效应面图
4. 结果
4.1. 雷公藤红素在几种脂质中溶解度的测定结果
从大到小依次排列:油酸 > 棕榈酸 > 硬脂酸 > 単辛酸甘油酯 > 蓖麻油 > 单硬脂酸甘油酯 > 月桂酸甘油酯。
4.2. CCD-RSM优化最佳处方
根据CCD-RSM结果,得到的药/脂比及表面活性剂/助表面活性比的预测值,通过计算及转换最终所得固体和液体脂质以及表面活性剂、助表面活性剂的实际值为雷公藤红素40 mg,棕榈酸0.09 g,油酸0.18 g,吐温-80 4.34 g,甘油2.16 g。
4.3. 最优处方验证
按最优处方制备5批CEL-NLC,其包封率和载药量、粒径见表3。
从表3可知实验观察值和模型预测值比较接近,偏差的绝对值均小于5%,说明模型的预测性良好。试验结果见表3。
Table 3. Experimental results of CCD-RSD optimal prescription validation (n = 5)
表3. CCD-RSM优选所得最优处方验证试验结果(n = 5)

Figure 3. Particle size distribution and poly-dispersion coefficient
图3. 粒径分布图和多分散系数
偏差 = (实测值 − 预测值)/预测值
bias = (predicted value − observed value)/predicted value.
最优处方及工艺下制备的CEL-NLC的包封率,平均包封率为(75.28 ± 3.44)%,与预测值的平均偏差为0.26%;载药量为(0.45 ± 0.02)%,与预测值的平均偏差为0.2%;粒径为(18.66 ± 2.63) nm,与预测值的平均偏差为0.34%。
4.4. 粒径及多分散系数
结果见图3,CEL-NLC 的粒径范围分布较窄,平均粒径为(18.66 ± 2.63) nm,多分散指数(PDI)为0.39 ± 0.03。
5. 讨论
由于眼的解剖和生理特性,眼局部给药生物利用度小于5%,所以眼局部给药仍然是药物技术领域研究人员面临的一大挑战 [11]。纳米结构脂质载体给药是近年来研究的热点,极好的生物相容性和黏附特性有助于延长药物在角膜的滞留时间,提高其眼部生物利用度,减少药物的局部和全身副作用 [12] [13]。
雷公藤红素难溶于水,脂溶性高。拟将雷公藤红素制备成纳米结构脂质载体,局部应用于抑制角膜新生血管的生成,有望避免口服给药的胃肠道刺激,进而减少毒副作用并降低药物对全身性的不良反应。本研究筛选出溶解雷公藤红素能力较强的棕榈酸和油酸,使用眼科常用的乳化剂吐温-80、甘油,获得的处方包封率、载药量、粒径等能满足制剂的需要。目前,优化处方较传统的方法有正交设计、均匀设计等,即用线性数学模型进行拟合,实验次数虽少,但精度不够,预测性较差,因为大多数情况下,各因素对效应的影响并非是线性的。现阶段应用较多的是星点设计-效应面法,即根据星点设计所建立的数学模型描绘效应面,从效应面上选择较佳效应区,多个效应所选择的较佳条件通过叠加,从而优选出自变量取值范围(最佳实验条件),直观、方便确定最优处方工艺 [14]。由于星点设计–效应面法具有简单操作,准确性高等优点,近年来成为纳米制剂工艺筛选的首选方法 [15] [16] [17]。
笔者未把Zeta电位作为CEL-NLC处方优化的因变量。考虑到角膜上皮带负电荷,而CEL-NLC因为油酸的使用而带负电,因此CEL-NLC与角膜上皮间会因为负电荷间的排斥作用,导致其在角膜的滞留时间短,进而降低CEL-NLC的生物利用度。为克服这一问题,后续研究考虑修饰CEL-NLC使其带正电荷,因此,效应面优化时未考察Zeta电位 [18] [19]。
6. 结论
本实验采用CCD-RSM 获得了CEL-NLC的最优处方,并对最佳处方进行验证,偏差均在5%以内,说明本实验方法有效、可行。制备的CEL-NLC包封率高、粒径小,可用于在眼部方面的后续研究。
文章引用
郭 莹,梁 珍,张 振,王敬博,张俊杰. 星点设计–效应面法优化眼局部应用雷公藤红素纳米结构脂质载体处方
Preparation and Formulation Optimization of Loaded Celastrol Nanostructure Lipid Carriers for Topical Ocular Application[J]. 眼科学, 2019, 08(04): 160-168. https://doi.org/10.12677/HJO.2019.84025
参考文献
- 1. 袁菱, 周蕾, 陈彦, 等. 雷公藤红素纳米结构脂质载体的制备及其理化性质考察[J]. 中成药, 2013, 35(9): 2023-2027.
- 2. 李萍, 黄萌萌, 刘玉萍, 等. 雷公藤红素-薏苡仁油微乳的制备及其体外抗肿瘤活性评价[J]. 中国实验方剂学志, 2017, 23(6): 1-6.
- 3. Sanna, V., Chamcheu, J.C., et al. (2015) Nanoencapsulation of Natural Triterpenoid Celastrol for Prostate Cancer Treatment. International Journal of Nanomedicine, 10, 6835-6846.
https://doi.org/10.2147/IJN.S93752 - 4. 袁菱, 周蕾, 陈彦, 等. 雷公藤红素纳米结构脂质载体的制备及其体外透皮研究[J]. 中成药, 2012, 43(8): 1514-1518.
- 5. Fu, T., Yi, J.L., Lv, S.Y. and Zhang, B. (2016) Ocular Amphotericin B Delivery by Chitosan Modified Nanostructured Lipid Carriers for Fungal Keratitis Targeted Therapy. Journal of Liposome Research, 27, 228-233.
https://doi.org/10.1080/08982104.2016.1224899 - 6. Li, Z.R., Li, J.G., Zhu, L., et al. (2016) Celastrolnanomicelles Attenuate Cytokine Secretion in macrophages and Inhibit Macrophage-Induced Corneal Neovascularization in Rats. International Journal of Nanomedicine, 11, 6135-6148.
https://doi.org/10.2147/IJN.S117425 - 7. 周维, 李小芳, 向志芸, 等. 星点设计-效应面优化黄芩苷自微乳化制剂的处方[J]. 中药与临床, 2016, 7(1): 27-30+36.
- 8. 刘碧林, 石明芯, 朱照静, 等. 星点设计-效应面法优化姜黄素正负离子纳米结构脂质载体处方[J]. 中草药, 2016, 47(19): 3401-3406.
- 9. 杨龙, 陈凌云, 魏刚, 等. 眼用脂质纳米制剂的研究进展[J]. 中国医药工业杂志, 2016, 47(12): 1592-1599.
- 10. 高珊珊, 李宁, 田宝成, 等. 星点设计-响应面法优化氯诺昔康纳米结构脂质载体处方[J]. 中国药房, 2017, 28(28): 3980-3983.
- 11. Sánchez-López, E., Espina, M., Doktorovova, S., Souto, E.B. and García, M.L. (2016) Lipid Nanoparticles (SLN, NLC): Overcoming the Anatomical and Physiological Barriers of the Eye-Part II-Ocular Drug-Loaded Lipid Nanoparticles. European Journal of Pharmaceutics and Biopharmaceutics, 110, 58-69.
https://doi.org/10.1016/j.ejpb.2016.10.013 - 12. Üstündag-Okur, N., Homan Gökçe, E., Inci, D., et al. (2014) Preparation and in Vitro-in Vivo Evaluation of Ofloxacin Loaded Ophthalmic Nano Structured Lipid Carriers Modified with Chitosan Oligosaccharide Lactate for the Treatment of Bacterial Keratitis. European Journal of Pharmaceutical Sciences, 63, 204-215.
https://doi.org/10.1016/j.ejps.2014.07.013 - 13. Mo, Z., Ban, J.F., Zhang, Y., Du, Y., et al. (2018) Nanostructured Lipid Carriers-Based Thermosensitive Eye Drops Forenhanced, Sustained Delivery of Dexamethasone. Nanomedicine, 13, 1239-1253.
https://doi.org/10.2217/nnm-2017-0318 - 14. 田霞, 范云周, 孙媛, 等. 星点设计-效应面法优化蒿甲醚自微乳释药系统[J]. 国际药学研究杂志, 2016, 43(5): 966-970.
- 15. 陈蕾, 战争尧, 李姝影. 星点设计-效应面法优化吴茱萸碱脂质体的处方[J]. 中国药师, 2017, 20(1): 77-81+90.
- 16. Hejri, A., Khosravi, A., Gharanjig, K. and Hejazi, M. (2013) Optimisation of the Formulation of B-Carotene Loaded Nanostructured Lipid Carriers Prepared by Solvent Diffusion Method. Food Chemistry, 141, 117-123.
- 17. Sarangi, B., Jana, U., Sahoo, J., Prasad Mohanta, G. and Kumar Manna, P. (2018) Systematic Approach for the Formulation and Optimization of Atorvastatin Loaded Solid Lipid NANOAPARTICLES Using Response Surface Methodology. Biomedical Microdevices, 20, 53.
https://doi.org/10.1007/s10544-018-0285-5 - 18. Shen, J., Deng, Y.P., Jin, X.F., et al. (2010) Thiolated Nanostructured Lipid Carriers as a Potential Ocular Drug Delivery System for Cyclosporine A: Improving in Vivo Ocular Distribution. International Journal of Pharmaceutics, 402, 248-253.
https://doi.org/10.1016/j.ijpharm.2010.10.008 - 19. Sandri, G., Motta, S., Bonferoni, M.C., et al. (2017) Chitosan-Coupled Solid Lipid Nanoparticles: Tuning Nanostructure and Mucoadhesion. European Journal of Pharmaceutics and Biopharmaceutics, 110, 13-18.
NOTES
*通讯作者。
