Traditional Chinese Medicine
Vol.
09
No.
06
(
2020
), Article ID:
38728
,
8
pages
10.12677/TCM.2020.96074
白毛乌蔹莓醇提物不同萃取部位抗氧化 活性研究
周芳1,2*,段湘兰3*,彭伊玲1,姚旺1,张卓1,易刚强1,李斌1,彭彩云1#
1湖南中医药大学药学院中药民族药物创新发展国际实验室,湖南 长沙
2湖南中医药大学第一附属医院,湖南 长沙
3湖南省农科院职工医院,湖南 长沙

收稿日期:2020年10月21日;录用日期:2020年11月17日;发布日期:2020年11月24日

摘要
目的:研究白毛乌蔹莓(Cayratia albifolia C. L. Li)乙醇提取物不同萃取部位抗氧化活性。方法:以VC为阳性对照,选取清除1,1-diphenyl-2-picrylhydrazyl (DPPH)自由基清除能力为抗氧化指标,探究白毛乌蔹莓乙醇提取物不同萃取部位抗氧化活性。结果:正丁醇层、乙酸乙酯层、二氯甲烷层、石油醚层DPPH清除能力分别为2.76、0.48、16.99、3.03 (mg/g) VC当量。结论:白毛乌蔹莓乙醇提取物二氯甲烷层的抗氧化能力最强,其次是石油醚层,正丁醇层,乙酸乙酯层活性最弱。
关键词
白毛乌蔹莓,不同萃取部位,抗氧化活性,DPPH法

Study on Antioxidant Activity of Different Solvent Extract of Cayratia albifolia C. L. Li
Fang Zhou1,2*, Xianglan Duan3*, Yiling Peng1, Wang Yao1, Zhuo Zhang1, Gangqiang Yi1, Bin Li1, Caiyun Peng1#
1Innovation and Development International Laboratory of Traditional Chinese Medicine, School of Pharmacy, Hunan University of Chinese Medicine, Changsha Hunan
2The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha Hunan
3Staff Hospital of Hunan Academy of Agricultural Sciences, Changsha Hunan
Received: Oct. 21st, 2020; accepted: Nov. 17th, 2020; published: Nov. 24th, 2020

ABSTRACT
Objects: To study the antioxidant activity of different solvent extract of ethanol extract of Cayratia albifolia C. L. Li. Methods: VC was used as positive control; 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical scavenging ability was used as an antioxidant index; the antioxidant activity of different solvent extract of ethanol extract of Cayratia albifolia C. L. Li was studied. Results: The DPPH scavenging abilities of n-butanol layer, ethyl acetate layer, dichloromethane layer and petroleum ether layer were 2.76, 0.48, 16.99, 3.03 (mg/g) VC equivalent. Conclusion: The antioxidant activity of dichloromethane layer was the strongest, followed by petroleum ether layer, n-butanol layer and ethyl acetate layer.
Keywords:Cayratia albifolia C. L. Li, Different Solvent Extract, Antioxidant Activity, DPPH Method

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
白毛乌蔹莓(Cayratia albifolia C. L. Li)隶属于葡萄科(Vitaceae)乌蔹莓属(CayratiaJuss),该属约45种,广泛分布于亚洲、非洲及大洋洲等世界各地,在中国约有13种,主要分布在江西、浙江、福建、湖北、湖南、广东、广西、四川、贵州、云南等地区,生于海拔300~2000米的山谷林中或山坡岩石上 [1]。在《唐本草》、《本草纲目》和《草木便方》等古代医籍中都有记载,其主要作用是清热解毒,活血散瘀,利尿的功效 [2]。
乌蔹莓属植物在民间多被用于咽喉肿痛、痢疾、痈肿、跌打肿痛、毒蛇咬伤等证的治疗,也常被用于治疗风湿性疾病、泌尿系统感染、口腔疱疹等疾病 [2]。现代药理研究显示,乌蔹莓属植物具有镇痛 [3] [4]、抗菌、抗炎、抗病毒和抗肿瘤活性,其醇提物还表现出较好抗氧护活性 [5]。侗族是我国人口数第11位的少数民族,聚集在湘黔桂毗邻地区,白毛乌蔹莓(侗语发音“教美姑”,“教眉库”)在湖南湘西北侗族聚居区被用于治疗类风湿性关节炎,疗效确切 [6]。相对于其他种乌蔹莓,目前尚未有白毛乌蔹莓化学成分与活性研究的相关报道 [7] [8] [9]。自由基是机体多种疾病的发生和发展重要参与者,是心血管疾病、癌变、糖尿病、神经病变等多种疾病诱发因素之一,因此研究药物清除自由基能力和抗氧化能力是新药研究最基础的活性筛选途径 [10] [11] [12]。而且近年来因天然来源的抗氧化剂因毒副作用比合成氧化剂小而受到更多关注 [13] [14] [15]。为较好的保护和开发白毛乌蔹莓,充分挖掘其药用价值,本研究以白毛乌蔹莓乙醇浸膏为研究对象,分别采用石油醚,二氯甲烷,乙酸乙酯,正丁醇进行极性分段,并针对四种不同极性萃取物进行了DPPH自由基清除能力的抗氧化活性研究,为白毛乌蔹莓进一步的开发和利用提供实验和理论基础。
2. 仪器与材料
白毛乌蔹莓(采购于湖南怀化通道县,湖南中医药大学药学院王智鉴定为白毛乌蔹莓,收藏于湖南省侗药重点实验室);VC标准品、DPPH标准品(上海如吉生物科技发展有限公司);甲醇、乙酸乙酯、石油醚、正丁醇、二氯甲烷(分析纯,国药集团化学试剂有限公司),水为蒸馏水;紫外分光光度计(岛津UV1800)。
3. 实验方法
3.1. 白毛乌蔹莓不同萃取部位和供试样品的制备
白毛乌蔹莓干燥地上部分(1500 g),粉碎成粗粉,75%的乙醇渗漉提取。滤液减压浓缩(60℃),得干燥浸膏460 g。取235 g干燥浸膏分散于700 mL水中,依次用石油醚,二氯甲烷,乙酸乙酯,正丁醇萃取。各萃取液减压浓缩,干燥分别得:石油醚层浸膏(12.86 g),二氯甲烷层浸膏(12.04 g),乙酸乙酯层浸膏(4.57 g),正丁醇层浸膏(25.85 g)。分别精密称量各提取部位样品于容量瓶中,用甲醇溶解定容,制备成如下被试样品溶液:0.90 mg/mL正丁醇层样品溶液,0.45 mg/mL乙酸乙酯层样品溶液,0.20 mg/mL二氯甲烷层样品溶液,1.6 mg/mL石油醚层样品溶液。
3.2. DPPH自由基清除力的测定
3.2.1. 标准溶液的配制
VC溶液的配制:精密称量0.0025 g VC标准品于50 mL容量瓶中,加水定容,得浓度为5.0 μg/mL VC样品溶液。
DPPH自由基溶液的制备:称取DPPH 0.0202 g,用少量甲醇溶解后定容至50 mL,作为储备液。精密移取上述储备液5.0 mL至50 mL量瓶中,定容得浓度为40.4 μg/mL DPPH自由基溶液,备用。
3.2.2. 标准曲线的绘制
用移液管分别移取0.20、0.30、0.40、0.50、0.60 mL VC样品溶液于5 mL容量瓶中,加水补齐至1 mL后,用40.4 μg/mL DPPH溶液定容,摇匀,放置10 min后,用紫外分光光度计,于515 nm波长处测吸光度,得A1。
用移液管分别移取0.20、0.30、0.40、0.50、0.60 mL VC样品溶液于5 mL容量瓶中,加水补齐至1 mL后,用甲醇定容,摇匀,放置10 min后,用紫外分光光度计,于515 nm波长处测吸光度,得A2。
精密移取1 mL水于5 mL容量瓶中,用40.4 μg/mL DPPH溶液定容,摇匀,放置10 min后,用紫外
分光光度计,于515 nm波长处测其吸光度,得A0。DPPH自由基清除率(%) ,以
VC摩尔浓度为自变量、DPPH自由基清除率为因变量绘制标准曲线并计算回归方程。
3.2.3. 被试样品DPPH自由基清除率测定
1) 各萃取层反应时间的优化分别取0.20 mL上述各萃取层被试样品溶液于5 mL容量瓶中,加入4.0 mL DPPH溶液,甲醇定容。定容后开始测各层样品反应液的吸光度值,以10 min为间隔,测至反应溶液吸光度值不再剧烈变化(且其后一个小时内吸光度RSD值小于3.00%)。
2) 各溶剂层DPPH自由基清除率测定计算白毛乌蔹莓乙醇提取物各萃取层提取物DPPH自由基清除力的VC当量。由于各层样品清除自由基能力不同,故不同层的样品测浓度清除率曲线时,所用的浓度梯度各不相同,即样品取样量不同。
正丁醇层:取样量为0.20、0.40、0.60、0.80、1.00 mL。用1 mL移液管,分别移取0.20、0.40、0.60、0.80、1.00 mL样品溶液于5 mL容量瓶中,用甲醇补齐至1 mL后,用40.4 μg/mL DPPH溶液定容,摇匀,放置80 min后,用紫外分光光度计,于515 nm波长处测其吸光度,得A1。用1 mL移液管,分别移取0.20、0.40、0.60、0.80、1.00 mL样品溶液于5 mL容量瓶中,用用甲醇(AR)定容,摇匀,放置10 min后,用紫外分光光度计,于515 nm波长处测其吸光度,得A2。用1 mL移液管,精密移取1 mL甲醇于5 mL容量瓶中,用40.4 μg/mL DPPH溶液定容,摇匀,放置10 min后,用紫外分光光度计,于515 nm波长处测其吸光度,得A0。计算DPPH 自由基清除率。
乙酸乙酯层(取样量为0.20、0.30、0.40、0.50、0.60、1.00 mL),二氯甲烷层(取样量为0.30、0.40、0.50、0.60、0.70 mL),石油醚层(0.10、0.20、0.30、0.40、0.50 mL)抗氧化活性测定方法同正丁醇层。
3) 各萃取层标准曲线的绘制。以白毛乌蔹莓乙醇提取物各溶剂层提取物摩尔浓度为自变量,DPPH自由基清除率为因变量绘制标准曲线并计算回归方程。
4. 实验结果
4.1. VC抗氧化清除曲线的测定
结果见表1。以浓度为横坐标,清除率为纵坐标,VC清除率浓度曲线见图1。由上述所测数据可得VC的IC50 (即50%清除率时的浓度)为:0.32 μg/mL。
Table 1. VCclearance rate
表1. VC清除率
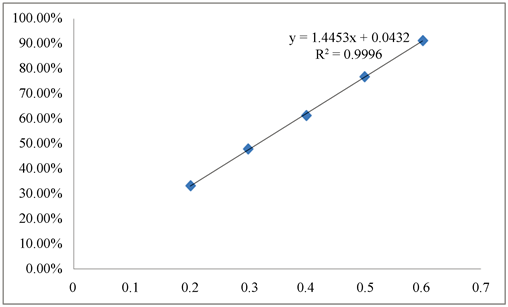
Figure 1. VC standard clearance/concentration curve
图1. VC清除率/浓度标准曲线图
4.2. DPPH法对不同萃取层样品抗氧化活性的测定
4.2.1. 各萃取层样品反应时间测定
结果表明,不同极性萃取部位的反应时间均不相同,正丁醇层样品反应进行到80 min后,样品溶液的吸光度值基本不变化,其后一个小时吸光度RSD值为2.70%,故确定正丁醇层反应时间为80 min。乙酸乙酯层样品反应进行到150 min后,样品溶液的吸光度值基本不变化,其后一个小时吸光度RSD值为2.97%,故确定乙酸乙酯层反应时间为150 min。二氯甲烷层样品和石油醚层样品分别反应到90 min和110 min后,样品溶液的吸光度值基本不变化,其后一个小时吸光度RSD值分别为1.72%与1.72%,故确定二氯甲烷层和石油醚层样品反应时间分别为90 min和110 min。
4.2.2. 各萃取层清除率曲线测定
各萃取层不同浓度下对DPPH自由基清除率结果见表2,根据表中结果分别计算正丁醇层、乙酸乙酯层、二氯甲烷层和石油醚层的回归方程及IC50值。
Table 2. Solvent layers clearance rate
表2. 各萃取层清除率
4.2.3. 各萃取层IC50
IC50是指清除率达到50%时样品的质量浓度,通过不同浓度样品的清除率可以绘制出清除率的标准曲线,求出回归方程,并计算得到IC50。正丁醇层回归方程为(见图2):Y = 3.7406x + 0.0718 (R2 = 0.9995),IC50值为0.11 mg/mL;乙酸乙酯层回归方程为(见图3):Y = 6.4906x + 0.1157 (R2 = 0.9998),IC50值为0.66 mg/mL;二氯甲烷层回归方程为(见图4):Y = 17.215x + 0.1805 (R2 = 0.9995),IC50值为0.02 mg/mL。石油醚层样品回归方程为(见图5) Y = 3.8516x + 0.098 (R2 = 0.9993),IC50值为0.10 mg/mL。
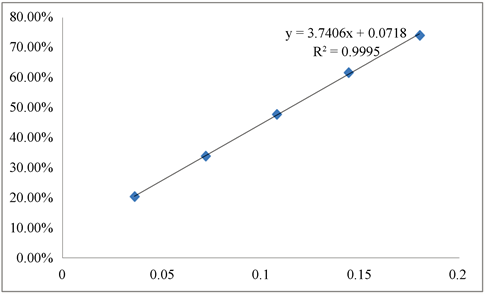
Figure 2. N-butanol solvent layer standard clearance/concentration curve
图2. 正丁醇层清除率/浓度曲线图
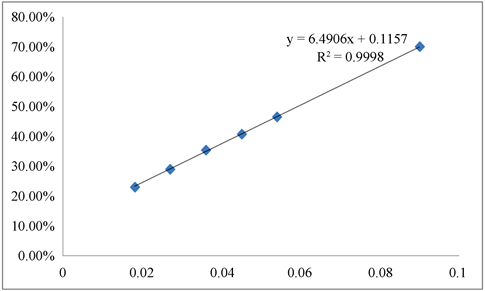
Figure 3. Ethyl acetate solvent layer standard clearance/concentration curve
图3. 乙酸乙酯层清除率/浓度曲线图
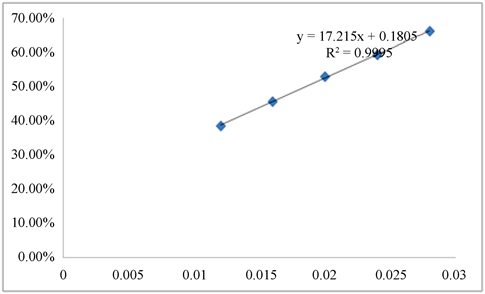
Figure 4. Dichloromethane solvent layer standard clearance/concentration curve
图4. 二氯甲烷层清除率/浓度曲线图

Figure 5. Petroleum ether solvent layer standard clearance/concentration curve
图5. 石油醚层清除率/浓度曲线图
4.2.4. 不同萃取部位的VC当量
过不同萃取部位的DPPH清除率(IC50)与VC的相对比,得到不同萃取部位的DPPH清除率的VC当量,可以比较直接的分析其抗氧化活性强弱。具体结果见表3。
Table 3. VC equivalent of DPPH clearance rates in different solvent layers
表3. 不同萃取层DPPH清除率的VC当量
实验结果表明,二氯甲烷层、石油醚层、正丁醇、乙酸乙酯层的VC当量分别是16.99、3.03、2.76、0.48。二氯甲烷萃取部位浸膏的抗氧化性最强,其次是石油醚层,正丁醇层,乙酸乙酯层。
5. 小结与讨论
体内过量的自由基是慢性病和健康衰老的根本原因,如动脉硬化、心脑血管疾病、糖尿病、风湿骨病、关节炎等,都被证实与自由基有关。侗族使用白乌蔹莓治疗关节炎具有确切的疗效。目前很多侗药的研究还处于起步阶段,其药效物质基础和作用机制尚不明确。本文针对白毛乌蔹莓的乙醇提取物,分离得到正丁醇、乙酸乙酯、二氯甲烷、石油醚四个萃取层,基于抗氧化活性导向,以DPPH自由基清除率为指标,测定了四个不同极性萃取部位的抗氧化活性。研究结果表明,二氯甲烷萃取部位浸膏的抗氧化性最强,其次是石油醚层,正丁醇层,乙酸乙酯层。其中二氯甲烷层、石油醚层和正丁醇层的VC当量分别是16.99、3.03、2.76,表明白毛乌蔹莓的二氯甲烷层、石油醚层和正丁醇层提取物具有较好的抗氧化活性,值得后期进一步深入研究,明确其抗氧化功效物质基础。在基础研究上结合治疗关节炎活性实验,为深入研究白毛乌蔹莓抗关节炎物质基础明和作用机制提供实验和理论基础。
基金项目
侗医药研究湖南省重点实验室(2015TP1020-02),侗医药研究湖南省重点实验室平台建设(2017CT5025)。大学生创新项目S202010541039,湖南省药学一流学科开放基金(2020YX04)。
文章引用
周 芳,段湘兰,彭伊玲,姚 旺,张 卓,易刚强,李 斌,彭彩云. 白毛乌蔹莓醇提物不同萃取部位抗氧化活性研究
Study on Antioxidant Activity of Different Solvent Extract of Cayratia albifolia C. L. Li[J]. 中医学, 2020, 09(06): 486-493. https://doi.org/10.12677/TCM.2020.96074
参考文献
- 1. 巩江, 张晶, 倪士峰. 国产乌蔹莓属植物药学研究[J]. 安徽农业科学, 2009, 37(7): 3031-3032.
- 2. 崔传文, 孙翠玲, 陈全成, 等. 乌蔹莓化学成分的初步探究[J]. 中国中药杂志, 2012, 37(19): 2906-2909.
- 3. 梁生林, 黄芳辉, 钟兴华, 等. 乌蔹莓抗炎镇痛有效部位的筛选[J]. 中草药, 2016, 47(4): 634-639.
- 4. 颜峰光, 钟兴华, 宓嘉琪, 等. 乌蔹莓水煎剂对小鼠镇痛作用初探[J]. 中国医药指南, 2013, 11(9): 457-458.
- 5. 黄思涵. 乌蔹莓不同溶剂提取物抗氧化活性研究[J]. 广东化工, 2018, 45(9): 31-32.
- 6. 王冶, 田兰, 田华咏, 主编. 中国侗医药史[M]. 北京: 中医古籍出版社, 2014: 105.
- 7. Kumar, D., Kumar, S., Gupta, J., et al. (2011) A Review on Chemical and Bi-ological Properties of Cayratia trifolia Linn. (Vitaceae). Pharmacognosy Reviews, 5, 184-189. https://doi.org/10.4103/0973-7847.91117
- 8. Ragasa, C., Buluran, A.I., Mandia, E., et al. (2014) Chemical Con-stituents of Cayratia trifolia. Der Pharma Chemica, 6, 418-422.
- 9. Mohammed, S.I., Salunkhe, N.S., Vishwakarma, K.S., et al. (2017) Experimental Validation of Antidiabetic Potential of Cayratia trifolia (L.) Domin: An Indigenous Medicinal Plant. Indian Journal of Clinical Biochemistry, 32, 153-162. https://doi.org/10.1007/s12291-016-0598-1
- 10. Bahorun, T., Soobrattee, M.M., Luximon-Ramma, M.V., et al. (2006) Free Radicals and Antioxidants in Cardiovascular Health and Disease. Internet Journal of Medical Update, 1, 24-40. https://doi.org/10.4314/ijmu.v1i2.39839
- 11. Pham-Huy, L.A., He, H. and Pham-Huy, C. (2008) Free Radicals, Antioxidants in Disease and Health. International Journal of Biomedical Science and Engineering, 4, 89-96.
- 12. Jahanban-Esfahlan, A. (2019) A Comparative Review on the Extraction, Antioxidant Content and Anti-oxidant Potential of Different Parts of Walnut (Juglans regia L.) Fruit and Tree. Molecules, 24, 2133. https://doi.org/10.3390/molecules24112133
- 13. 王峰, 麻旭州, 王道才, 等. 和厚朴酚体外抗氧化活性的研究[J]. 湖北民族大学(自然科学版), 2020, 38(2): 130-133, 170.
- 14. 罗廷顺, 石桂兰, 杨静, 等. 紫地榆多酚提取工艺优化及其体外抗氧化活性研究[J]. 时珍国医国药, 2019, 30(12): 2853-2856.
- 15. 杨嬪娟, 张希, 马雅鸽, 等. 发酵对黄精主要活性成分及其抗氧化活性和刺激性的影响[J]. 食品工艺科技, 2020, 41(2): 52-58.
NOTES
*并列第一作者。
#通讯作者。
